4.3.2共价键、分子间作用力+2024-2025学年高一上学期化学人教版(2019)必修第一册(含答案)
文档属性
| 名称 | 4.3.2共价键、分子间作用力+2024-2025学年高一上学期化学人教版(2019)必修第一册(含答案) |

|
|
| 格式 | DOCX | ||
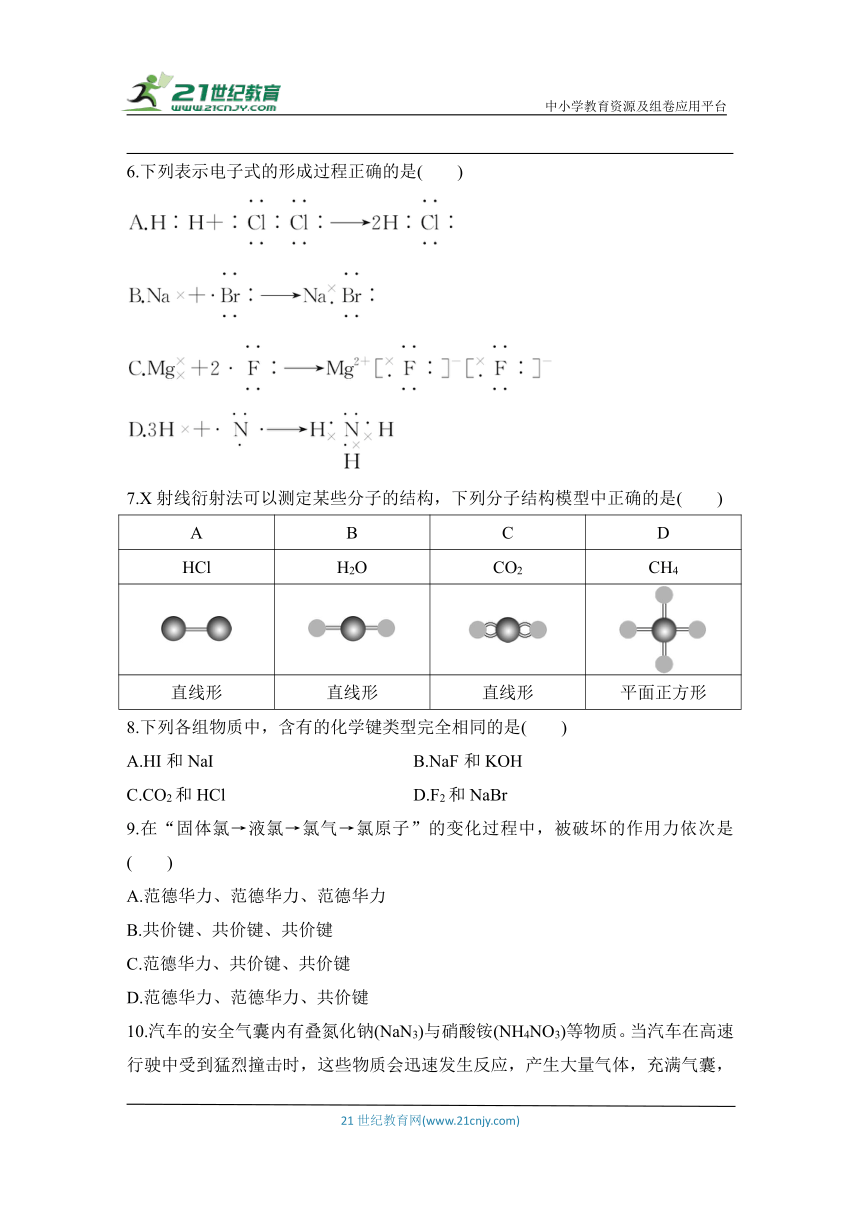
| 文件大小 | 146.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-23 16:41:50 | ||
图片预览



文档简介
4.3.2 共价键、分子间作用力
过关练
选择题只有1个选项符合题意
1.下列物质含有非极性共价键的是( )
A.NaOH B.Cl2
C.H2S D.KCl
2.下列各组物质中,都含有共价键,却又都不属于共价化合物的一组是( )
A.Na2O2 Na2O B.KClO NaOH
C.Br2 HBr D.HF H2O
3.下列有关化学键的叙述正确的是( )
A.离子化合物中一定含有离子键
B.单质分子中均存在化学键
C.由不同种非金属元素的原子形成的共价化合物一定只含极性键
D.只含共价键的物质一定是共价化合物
4.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
A.将CO2通入水中 B.烧碱溶于水
C.将HCl通入水中 D.过氧化钠溶于水
5.下列关于电子式的相关描述正确的是( )
A.CS2的电子式:
B.N2的电子式:N N
C.Na2O2的电子式:
D.用电子式表示H2S的形成过程:
6.下列表示电子式的形成过程正确的是( )
7.X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确的是( )
A B C D
HCl H2O CO2 CH4
直线形 直线形 直线形 平面正方形
8.下列各组物质中,含有的化学键类型完全相同的是( )
A.HI和NaI B.NaF和KOH
C.CO2和HCl D.F2和NaBr
9.在“固体氯→液氯→氯气→氯原子”的变化过程中,被破坏的作用力依次是( )
A.范德华力、范德华力、范德华力
B.共价键、共价键、共价键
C.范德华力、共价键、共价键
D.范德华力、范德华力、共价键
10.汽车的安全气囊内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生反应,产生大量气体,充满气囊,从而保护驾乘人员安全。
(1)下列判断正确的是________(填字母)。
A.道路起雾与H2O分子中化学键断裂相关
B.NH4NO3中只含有极性共价键
C.NaN3受到猛烈撞击与NH4NO3发生反应时化学键一定断裂
D.NaN3、NH4NO3均属于离子化合物
(2)叠氮化钠是一种无色晶体,广泛用于汽车安全气囊及化工合成等。常见的两种制备方法:2NaNH2+N2O===NaN3+NaOH+NH3;3NaNH2+NaNO3===NaN3+3NaOH+NH3↑。
①写出NaNH2的电子式:________。
②NaOH固体中含有的化学键类型有________。
B级 素养培优练
11.水煤气变换反应的过程如图所示。下列说法不正确的是( )
A.过程Ⅰ、Ⅱ中均有氧氢键断裂
B.该反应的化学方程式是CO+H2OCO2+H2
C.H2O和CO2分子中均含有共价键
D.该反应反应物中的化学键全部断裂形成原子,原子再重新结合生成生成物
12.“84”消毒液(有效成分是NaClO)使用方便的消毒剂,可以有效杀灭病毒。工业上,制备“84”消毒液的原理为NaCl+H2ONaClO+H2↑。下列说法不正确的是( )
A.NaClO的消毒原理是利用了其强氧化性
B.NaClO的电子式为Na+[︰︰︰]-
C.该反应每转移1 mol电子生成37.25 g的NaClO
D.上述反应过程中只有离子键、非极性共价键的断裂和形成
13.化合物M(结构式如图所示)可用于口腔清洁。已知W、X、Y、Z是原子序数依次增大的前20号主族元素,W与Z、X与Y分别同主族,Y、Z对应的简单离子核外电子排布相同。下列说法不正确的是( )
A.简单离子的半径:Y>Z>W
B.简单氢化物的沸点:X>Y
C.化合物M中X的化合价均为-2
D.ZW可与H2O反应生成W的单质
14.下面是同学们熟悉的物质:
①O2 ②干冰 ③NaBr ④H2SO4 ⑤Na2CO3
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2
⑩NaOH
(1)这些物质中,只含有共价键的是________;只含有离子键的是________;既含有共价键又含有离子键的是______________;不存在化学键的是____________;电解质有________;非电解质有________(填编号)。
(2)NaHSO4在熔融状态下电离,破坏的化学键是________,写出其电离方程式_________________________________________________________________
_________________________________________________________________。
(3)写出②与⑨发生反应的化学方程式:_________________________________
________________________________________________________________,
破坏的化学键是________。
(4)写出⑥的电子式:________;②与足量NaOH溶液反应的离子方程式是___________________________________________________________________
___________________________________________________________________。
(5)⑩的化合物类型是________化合物(填“共价”或“离子”),写出其电子式________。
15.一种常用融雪剂的主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是________,该物质中的化学键类型是________,电子式是________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻。
①D的离子结构示意图是________。
②D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到8e-稳定结构,化学键类型为________(填“离子键”“非极性共价键”或“极性共价键”)。
中小学教育资源及组卷应用平台
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物,不加热时生成________,其化学键类型为________;加热时生成________,其化学键类型为________。21世纪教育网(www.21cnjy.com)
参考答案
1.B [A项,NaOH中含有离子键和极性键,不符合题意;B项,Cl2只含有非极性键,符合题意;C项,H2S只含极性键,不符合题意;D项,KCl只含离子键,不符合题意。]
2.B [Na2O2、Na2O都属于离子化合物,但氧化钠只有离子键,A不符合题意;次氯酸钾和氢氧化钠均是离子化合物,均含有离子键和共价键,B符合题意;溴和溴化氢均只含有共价键,溴是单质,HBr是共价化合物,C不符合题意;HF和H2O均是只含有共价键的共价化合物,D不符合题意。]
3.A [A项,由离子键形成的化合物是离子化合物;B项,稀有气体单质分子(如氖)不存在化学键;C项,由不同种非金属元素的原子形成的共价化合物如H2O2含极性键和非极性键;D项,只含共价键的物质还可以是非金属单质,如氧气、金刚石等。]
4.D [既有离子键被破坏又有共价键被破坏,说明参与反应的物质中含有离子键和共价键。A项,二氧化碳溶于水,部分与水反应生成H2CO3,只有共价键被破坏和生成;B项,烧碱溶于水得到氢氧化钠溶液,氢氧化钠在水分子作用下电离出钠离子和氢氧根离子,只有离子键被破坏;C项,HCl通入水中得到盐酸,氯化氢在水分子作用下电离出氢离子和氯离子,只有共价键被破坏;D项,过氧化钠中含有离子键和共价键,与水反应生成氢氧化钠和氧气,既有离子键被破坏又有共价键被破坏。]
5.D [二硫化碳是共价化合物,C原子最外层4个电子,S原子最外层6个电子,所以二硫化碳的电子式为︰︰C︰︰,故A错误;氮气中N原子之间以三键结合,电子式为︰N N︰,故B错误;Na2O2是离子化合物,由Na+和构成,中O原子间共用一对电子,其电子式为Na+[︰︰︰]2-Na+,故C错误。]
6.D [A项,电子式的形成过程应用原子的最外层电子表示,故应为H×+·︰︰;B项,应为;C项,Mg原子的电子式电子应分布在Mg原子两侧,F-电子式不能并列书写,故应写为,D项正确。]
7.C [A项,HCl由2个原子构成,为直线型分子,但是原子大小不同,错误;B项,水是V形分子,错误;C项,CO2是直线形分子,正确;D项,CH4的空间构型为正四面体,错误。]
8.C [NaI是离子化合物,存在的化学键是离子键,HI是共价化合物,只存在共价键,化学键类型不相同,故A错误;NaF和KOH均是离子化合物,存在离子键,KOH中还存在共价键,化学键类型不全相同,故B错误;CO2和HCl都是共价化合物,存在的化学键都是极性共价键,故C正确;F2是共价化合物,存在的化学键是共价键,NaBr是离子化合物,只存在离子键,化学键类型不同,故D错误。]
9.D [固体氯→液氯→氯气属于物质的三态变化,属于物理变化,破坏了范德华力,氯气→氯原子破坏了共价键,所以在“固体氯→液氯→氯气→氯原子”的变化过程中,被破坏的作用力依次是范德华力、范德华力、共价键。]
10.(1) CD
(2)①Na+[H︰︰H]- ②离子键、极性共价键
解析 (1)道路起雾,空气中的水蒸气凝结为水分子,没有化学键的断裂,故A错误;NH4NO3中含有离子键和极性共价键,故B错误;NaN3受到猛烈撞击与NH4NO3发生化学反应,一定有化学键断裂和生成,故C正确;含离子键的一定为离子化合物,则NaN3、NH4NO3均属于离子化合物,故D正确。
(2)①NaNH2是由Na+和N构成的,其电子式为
Na+[H︰︰H]-。②NaOH固体中含有钠离子和氢氧根离子形成的离子键,还有氧原子和氢原子形成的极性共价键。
11.D [A项,由图知,过程Ⅰ、Ⅱ中均有氧氢键断裂;B项,由图知,反应物为CO、H2O,生成物为CO2和H2,则反应的化学方程式是CO+H2OCO2+H2;C项, H2O分子中为氢氧键、CO2分子中为碳氧双键,均为共价键;D项,由图知,CO分子内的化学键没有断裂形成原子。]
12.D [NaClO中Cl元素的化合价为+1价,具有强氧化性,可用于杀菌消毒,A正确;NaClO的电子式为Na+[︰︰︰]-,B正确;根据化学方程式可知,Cl的化合价从-1价升高为+1价,每转移2 mol电子生成74.5 g的NaClO,故该反应每转移1 mol电子生成37.25 g的NaClO,C正确;NaCl中钠离子和氯离子之间是离子键,水分子中含有极性共价键,NaClO中含有离子键和极性共价键,H2中存在非极性共价键,故上述反应过程中有离子键、极性共价键的断裂,有离子键、极性共价键、非极性共价键的形成,D错误。]
13.C [已知W、X、Y、Z是原子序数依次增大的前20号主族元素,由X可以形成2个共价键、Y形成6个共价键,X与Y同主族可知,X为O、Y为S;Y、Z对应的简单离子核外电子排布相同,Z可以形成带1个单位正电荷的阳离子,Z为第ⅠA族元素,为K;W与Z同主族,W为H。电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,简单离子的半径:Y>Z>W,A正确;水分子可以形成分子间氢键,导致水的沸点高于硫化氢,B正确;由图可知,化合物M中存在过氧根,故O的化合价存在-1价,C错误;KH为金属氢化物,可与水反应生成氢气,D正确。]
14.(1)①②④ ③ ⑤⑥⑦⑨⑩ ⑧ ③④⑤⑥⑦⑨⑩ ②
(2)离子键 NaHSO4(熔融)Na++HS
(3)2Na2O2+2CO22Na2CO3+O2 离子键和共价键
(4)[H︰︰H]+[︰︰]- CO2+2OH-C+H2O
(5)离子 Na+[︰︰H]-
解析 (1)各物质的化学键所属类别①O2中O原子之间只存在非极性共价键,属于单质;②干冰为二氧化碳,原子之间只存在共价键,属于非电解质;③NaBr中钠离子和溴离子之间只存在离子键,属于离子化合物,属于电解质;④H2SO4中S原子和O原子、O原子和H原子之间存在极性共价键,属于共价化合物,属于电解质;⑤Na2CO3中钠离子和碳酸根离子之间存在离子键、C原子和O原子之间存在极性共价键,属于离子化合物,属于电解质;⑥NH4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,属于离子化合物,属于电解质;⑦NaHSO4中钠离子和硫酸氢根离子之间存在离子键、S原子和O原子之间存在共价键,属于离子化合物,属于电解质;⑧Ne中不存在化学键,属于稀有气体;⑨Na2O2中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性共价键,属于离子化合物,属于电解质;⑩NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,属于离子化合物,属于电解质;综上所述,只含有共价键的是①②④;只含有离子键的是③;既含有共价键又含有离子键的是⑤⑥⑦⑨⑩;不存在化学键的是⑧;电解质有③④⑤⑥⑦⑨⑩;非电解质有②;(2)NaHSO4在熔融状态下电离成钠离子和硫酸氢根离子,破坏了离子键,其电离方程式NaHSO4(熔融)Na++HS;(3)二氧化碳和过氧化钠反应生成碳酸钠和氧气,化学方程式为2Na2O2+2CO22Na2CO3+O2;化学反应的实质是旧键断裂和新键生成,因此反应物中的离子键和共价键被破坏。(4)NH4Cl的电子式为[H︰︰H]+[︰︰]-。CO2与足量NaOH溶液反应生成碳酸钠和水,反应的离子方程式是CO2+2OH-C+H2O;(5) NaOH属于离子化合物,根据得失电子及8电子的稳定情况其电子式为Na+[︰︰H]-。
15.(1)CaCl2 离子键 [︰︰]-Ca2+[︰︰]-
(2)① ②极性共价键
(3)Na2O 离子键 Na2O2 离子键和非极性共价键
解析 (1)融雪剂XY2中阳离子和阴离子的电子层结构相同且1 mol XY2含有54 mol电子,则1 mol X2+和1 mol Y-中均含有18 mol电子,故X是Ca元素,Y是Cl元素,XY2是CaCl2。(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D是S元素,E是C元素。D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到8e-稳定结构,该化合物是CS2,含有极性共价键。(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,则W是O元素,Z是Na元素。Na和O2在不加热时生成Na2O,含有离子键;在加热时生成Na2O2,含有离子键和非极性共价键。
过关练
选择题只有1个选项符合题意
1.下列物质含有非极性共价键的是( )
A.NaOH B.Cl2
C.H2S D.KCl
2.下列各组物质中,都含有共价键,却又都不属于共价化合物的一组是( )
A.Na2O2 Na2O B.KClO NaOH
C.Br2 HBr D.HF H2O
3.下列有关化学键的叙述正确的是( )
A.离子化合物中一定含有离子键
B.单质分子中均存在化学键
C.由不同种非金属元素的原子形成的共价化合物一定只含极性键
D.只含共价键的物质一定是共价化合物
4.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
A.将CO2通入水中 B.烧碱溶于水
C.将HCl通入水中 D.过氧化钠溶于水
5.下列关于电子式的相关描述正确的是( )
A.CS2的电子式:
B.N2的电子式:N N
C.Na2O2的电子式:
D.用电子式表示H2S的形成过程:
6.下列表示电子式的形成过程正确的是( )
7.X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确的是( )
A B C D
HCl H2O CO2 CH4
直线形 直线形 直线形 平面正方形
8.下列各组物质中,含有的化学键类型完全相同的是( )
A.HI和NaI B.NaF和KOH
C.CO2和HCl D.F2和NaBr
9.在“固体氯→液氯→氯气→氯原子”的变化过程中,被破坏的作用力依次是( )
A.范德华力、范德华力、范德华力
B.共价键、共价键、共价键
C.范德华力、共价键、共价键
D.范德华力、范德华力、共价键
10.汽车的安全气囊内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生反应,产生大量气体,充满气囊,从而保护驾乘人员安全。
(1)下列判断正确的是________(填字母)。
A.道路起雾与H2O分子中化学键断裂相关
B.NH4NO3中只含有极性共价键
C.NaN3受到猛烈撞击与NH4NO3发生反应时化学键一定断裂
D.NaN3、NH4NO3均属于离子化合物
(2)叠氮化钠是一种无色晶体,广泛用于汽车安全气囊及化工合成等。常见的两种制备方法:2NaNH2+N2O===NaN3+NaOH+NH3;3NaNH2+NaNO3===NaN3+3NaOH+NH3↑。
①写出NaNH2的电子式:________。
②NaOH固体中含有的化学键类型有________。
B级 素养培优练
11.水煤气变换反应的过程如图所示。下列说法不正确的是( )
A.过程Ⅰ、Ⅱ中均有氧氢键断裂
B.该反应的化学方程式是CO+H2OCO2+H2
C.H2O和CO2分子中均含有共价键
D.该反应反应物中的化学键全部断裂形成原子,原子再重新结合生成生成物
12.“84”消毒液(有效成分是NaClO)使用方便的消毒剂,可以有效杀灭病毒。工业上,制备“84”消毒液的原理为NaCl+H2ONaClO+H2↑。下列说法不正确的是( )
A.NaClO的消毒原理是利用了其强氧化性
B.NaClO的电子式为Na+[︰︰︰]-
C.该反应每转移1 mol电子生成37.25 g的NaClO
D.上述反应过程中只有离子键、非极性共价键的断裂和形成
13.化合物M(结构式如图所示)可用于口腔清洁。已知W、X、Y、Z是原子序数依次增大的前20号主族元素,W与Z、X与Y分别同主族,Y、Z对应的简单离子核外电子排布相同。下列说法不正确的是( )
A.简单离子的半径:Y>Z>W
B.简单氢化物的沸点:X>Y
C.化合物M中X的化合价均为-2
D.ZW可与H2O反应生成W的单质
14.下面是同学们熟悉的物质:
①O2 ②干冰 ③NaBr ④H2SO4 ⑤Na2CO3
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2
⑩NaOH
(1)这些物质中,只含有共价键的是________;只含有离子键的是________;既含有共价键又含有离子键的是______________;不存在化学键的是____________;电解质有________;非电解质有________(填编号)。
(2)NaHSO4在熔融状态下电离,破坏的化学键是________,写出其电离方程式_________________________________________________________________
_________________________________________________________________。
(3)写出②与⑨发生反应的化学方程式:_________________________________
________________________________________________________________,
破坏的化学键是________。
(4)写出⑥的电子式:________;②与足量NaOH溶液反应的离子方程式是___________________________________________________________________
___________________________________________________________________。
(5)⑩的化合物类型是________化合物(填“共价”或“离子”),写出其电子式________。
15.一种常用融雪剂的主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是________,该物质中的化学键类型是________,电子式是________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻。
①D的离子结构示意图是________。
②D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到8e-稳定结构,化学键类型为________(填“离子键”“非极性共价键”或“极性共价键”)。
中小学教育资源及组卷应用平台
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物,不加热时生成________,其化学键类型为________;加热时生成________,其化学键类型为________。21世纪教育网(www.21cnjy.com)
参考答案
1.B [A项,NaOH中含有离子键和极性键,不符合题意;B项,Cl2只含有非极性键,符合题意;C项,H2S只含极性键,不符合题意;D项,KCl只含离子键,不符合题意。]
2.B [Na2O2、Na2O都属于离子化合物,但氧化钠只有离子键,A不符合题意;次氯酸钾和氢氧化钠均是离子化合物,均含有离子键和共价键,B符合题意;溴和溴化氢均只含有共价键,溴是单质,HBr是共价化合物,C不符合题意;HF和H2O均是只含有共价键的共价化合物,D不符合题意。]
3.A [A项,由离子键形成的化合物是离子化合物;B项,稀有气体单质分子(如氖)不存在化学键;C项,由不同种非金属元素的原子形成的共价化合物如H2O2含极性键和非极性键;D项,只含共价键的物质还可以是非金属单质,如氧气、金刚石等。]
4.D [既有离子键被破坏又有共价键被破坏,说明参与反应的物质中含有离子键和共价键。A项,二氧化碳溶于水,部分与水反应生成H2CO3,只有共价键被破坏和生成;B项,烧碱溶于水得到氢氧化钠溶液,氢氧化钠在水分子作用下电离出钠离子和氢氧根离子,只有离子键被破坏;C项,HCl通入水中得到盐酸,氯化氢在水分子作用下电离出氢离子和氯离子,只有共价键被破坏;D项,过氧化钠中含有离子键和共价键,与水反应生成氢氧化钠和氧气,既有离子键被破坏又有共价键被破坏。]
5.D [二硫化碳是共价化合物,C原子最外层4个电子,S原子最外层6个电子,所以二硫化碳的电子式为︰︰C︰︰,故A错误;氮气中N原子之间以三键结合,电子式为︰N N︰,故B错误;Na2O2是离子化合物,由Na+和构成,中O原子间共用一对电子,其电子式为Na+[︰︰︰]2-Na+,故C错误。]
6.D [A项,电子式的形成过程应用原子的最外层电子表示,故应为H×+·︰︰;B项,应为;C项,Mg原子的电子式电子应分布在Mg原子两侧,F-电子式不能并列书写,故应写为,D项正确。]
7.C [A项,HCl由2个原子构成,为直线型分子,但是原子大小不同,错误;B项,水是V形分子,错误;C项,CO2是直线形分子,正确;D项,CH4的空间构型为正四面体,错误。]
8.C [NaI是离子化合物,存在的化学键是离子键,HI是共价化合物,只存在共价键,化学键类型不相同,故A错误;NaF和KOH均是离子化合物,存在离子键,KOH中还存在共价键,化学键类型不全相同,故B错误;CO2和HCl都是共价化合物,存在的化学键都是极性共价键,故C正确;F2是共价化合物,存在的化学键是共价键,NaBr是离子化合物,只存在离子键,化学键类型不同,故D错误。]
9.D [固体氯→液氯→氯气属于物质的三态变化,属于物理变化,破坏了范德华力,氯气→氯原子破坏了共价键,所以在“固体氯→液氯→氯气→氯原子”的变化过程中,被破坏的作用力依次是范德华力、范德华力、共价键。]
10.(1) CD
(2)①Na+[H︰︰H]- ②离子键、极性共价键
解析 (1)道路起雾,空气中的水蒸气凝结为水分子,没有化学键的断裂,故A错误;NH4NO3中含有离子键和极性共价键,故B错误;NaN3受到猛烈撞击与NH4NO3发生化学反应,一定有化学键断裂和生成,故C正确;含离子键的一定为离子化合物,则NaN3、NH4NO3均属于离子化合物,故D正确。
(2)①NaNH2是由Na+和N构成的,其电子式为
Na+[H︰︰H]-。②NaOH固体中含有钠离子和氢氧根离子形成的离子键,还有氧原子和氢原子形成的极性共价键。
11.D [A项,由图知,过程Ⅰ、Ⅱ中均有氧氢键断裂;B项,由图知,反应物为CO、H2O,生成物为CO2和H2,则反应的化学方程式是CO+H2OCO2+H2;C项, H2O分子中为氢氧键、CO2分子中为碳氧双键,均为共价键;D项,由图知,CO分子内的化学键没有断裂形成原子。]
12.D [NaClO中Cl元素的化合价为+1价,具有强氧化性,可用于杀菌消毒,A正确;NaClO的电子式为Na+[︰︰︰]-,B正确;根据化学方程式可知,Cl的化合价从-1价升高为+1价,每转移2 mol电子生成74.5 g的NaClO,故该反应每转移1 mol电子生成37.25 g的NaClO,C正确;NaCl中钠离子和氯离子之间是离子键,水分子中含有极性共价键,NaClO中含有离子键和极性共价键,H2中存在非极性共价键,故上述反应过程中有离子键、极性共价键的断裂,有离子键、极性共价键、非极性共价键的形成,D错误。]
13.C [已知W、X、Y、Z是原子序数依次增大的前20号主族元素,由X可以形成2个共价键、Y形成6个共价键,X与Y同主族可知,X为O、Y为S;Y、Z对应的简单离子核外电子排布相同,Z可以形成带1个单位正电荷的阳离子,Z为第ⅠA族元素,为K;W与Z同主族,W为H。电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,简单离子的半径:Y>Z>W,A正确;水分子可以形成分子间氢键,导致水的沸点高于硫化氢,B正确;由图可知,化合物M中存在过氧根,故O的化合价存在-1价,C错误;KH为金属氢化物,可与水反应生成氢气,D正确。]
14.(1)①②④ ③ ⑤⑥⑦⑨⑩ ⑧ ③④⑤⑥⑦⑨⑩ ②
(2)离子键 NaHSO4(熔融)Na++HS
(3)2Na2O2+2CO22Na2CO3+O2 离子键和共价键
(4)[H︰︰H]+[︰︰]- CO2+2OH-C+H2O
(5)离子 Na+[︰︰H]-
解析 (1)各物质的化学键所属类别①O2中O原子之间只存在非极性共价键,属于单质;②干冰为二氧化碳,原子之间只存在共价键,属于非电解质;③NaBr中钠离子和溴离子之间只存在离子键,属于离子化合物,属于电解质;④H2SO4中S原子和O原子、O原子和H原子之间存在极性共价键,属于共价化合物,属于电解质;⑤Na2CO3中钠离子和碳酸根离子之间存在离子键、C原子和O原子之间存在极性共价键,属于离子化合物,属于电解质;⑥NH4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,属于离子化合物,属于电解质;⑦NaHSO4中钠离子和硫酸氢根离子之间存在离子键、S原子和O原子之间存在共价键,属于离子化合物,属于电解质;⑧Ne中不存在化学键,属于稀有气体;⑨Na2O2中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性共价键,属于离子化合物,属于电解质;⑩NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,属于离子化合物,属于电解质;综上所述,只含有共价键的是①②④;只含有离子键的是③;既含有共价键又含有离子键的是⑤⑥⑦⑨⑩;不存在化学键的是⑧;电解质有③④⑤⑥⑦⑨⑩;非电解质有②;(2)NaHSO4在熔融状态下电离成钠离子和硫酸氢根离子,破坏了离子键,其电离方程式NaHSO4(熔融)Na++HS;(3)二氧化碳和过氧化钠反应生成碳酸钠和氧气,化学方程式为2Na2O2+2CO22Na2CO3+O2;化学反应的实质是旧键断裂和新键生成,因此反应物中的离子键和共价键被破坏。(4)NH4Cl的电子式为[H︰︰H]+[︰︰]-。CO2与足量NaOH溶液反应生成碳酸钠和水,反应的离子方程式是CO2+2OH-C+H2O;(5) NaOH属于离子化合物,根据得失电子及8电子的稳定情况其电子式为Na+[︰︰H]-。
15.(1)CaCl2 离子键 [︰︰]-Ca2+[︰︰]-
(2)① ②极性共价键
(3)Na2O 离子键 Na2O2 离子键和非极性共价键
解析 (1)融雪剂XY2中阳离子和阴离子的电子层结构相同且1 mol XY2含有54 mol电子,则1 mol X2+和1 mol Y-中均含有18 mol电子,故X是Ca元素,Y是Cl元素,XY2是CaCl2。(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D是S元素,E是C元素。D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到8e-稳定结构,该化合物是CS2,含有极性共价键。(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,则W是O元素,Z是Na元素。Na和O2在不加热时生成Na2O,含有离子键;在加热时生成Na2O2,含有离子键和非极性共价键。
