河北省邢台市质检联盟2024-2025学年高三上学期第一次月考(10月)模拟练习化学试题(PDF版,含答案)
文档属性
| 名称 | 河北省邢台市质检联盟2024-2025学年高三上学期第一次月考(10月)模拟练习化学试题(PDF版,含答案) |  | |
| 格式 | |||
| 文件大小 | 684.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-23 20:06:31 | ||
图片预览

文档简介
河北省邢台市质检联盟 2024-2025 学年高三上学期第一次月考(10 月)模拟练习化学试题(自编供学生使用)
(考试时间:90 分钟 试卷总分:100 分)
一、单选题(本大题共 14 小题,共 42 分)
1.下列溶液中不.能.使酸性 KMnO4溶液褪色的是
A.CH3COOH B.CH2=CH2 C. D.甲苯
2.下列有关二氧化硫的说法正确的是
A.SO2属于电解质
B.SO2为非极性分子
C.SO2既有氧化性又有还原性
D.SO2易溶于水是因为与水能形成分子间氢键
3.下列化学用语表示正确的是
A.18O2-离子结构示意图:
B.SO2 的VSEPR 模型:
2
C.NaHCO3在水溶液中的电离方程式: NaHCO3 Na H CO3
D.反-2-丁烯的结构简式:
4.化学与生活密切相关。下列说法正确的是
A.SO2 用作葡萄酒中的抗氧化剂是因为其具有氧化性
B.pH 小于 7 的雨水称之为酸雨,酸雨对庄稼有危害
C.不含 C 的材料均可称之为无机非金属材料
D.用于信息技术和能源技术领域的单晶硅是半导体材料
5.如下图所示,2 个甲分子反应生成 1个丙分子和 3个乙分子,下列判断不正确的是
A.化学反应中分子的种类发生了改变
B.该反应属于复分解反应
C.摩尔质量关系为 2M(甲)=3M(乙)+M(丙)
D.根据阿伏加德罗定律可推知,1个乙分子中含有 2个 A原子
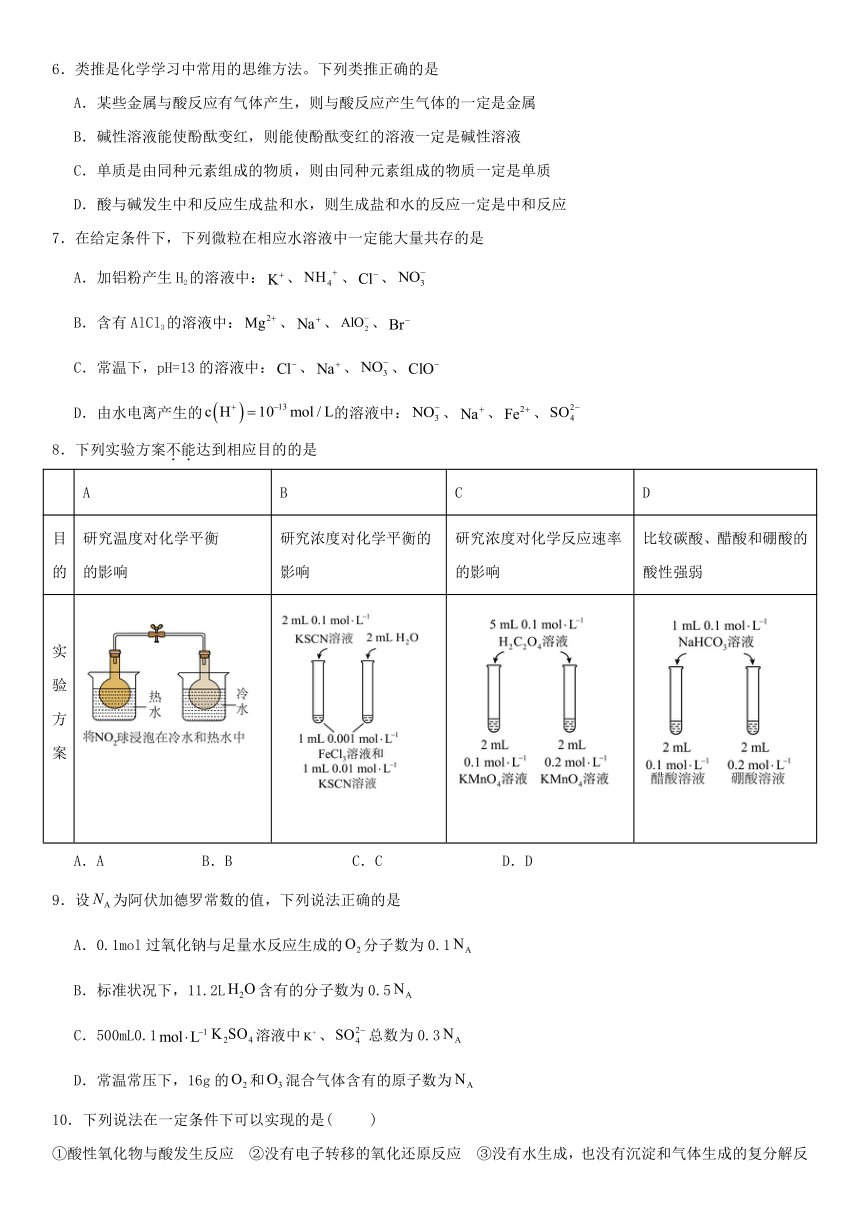
6.类推是化学学习中常用的思维方法。下列类推正确的是
A.某些金属与酸反应有气体产生,则与酸反应产生气体的一定是金属
B.碱性溶液能使酚酞变红,则能使酚酞变红的溶液一定是碱性溶液
C.单质是由同种元素组成的物质,则由同种元素组成的物质一定是单质
D.酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应
7.在给定条件下,下列微粒在相应水溶液中一定能大量共存的是
A.加铝粉产生 H2的溶液中:K 、NH Cl NO 4 、 、 3
B.含有 AlCl3的溶液中:Mg2 、 Na 、AlO2 、Br
C.常温下,pH=13 的溶液中:Cl 、 Na 、NO 3 、ClO
13
D.由水电离产生的 c H 10 mol / L的溶液中:NO3 、 Na 、Fe2 、SO2 4
8.下列实验方案不.能.达到相应目的的是
A B C D
目 研究温度对化学平衡 研究浓度对化学平衡的 研究浓度对化学反应速率 比较碳酸、醋酸和硼酸的
的 的影响 影响 的影响 酸性强弱
实
验
方
案
A.A B.B C.C D.D
9.设 NA 为阿伏加德罗常数的值,下列说法正确的是
A.0.1mol 过氧化钠与足量水反应生成的O2 分子数为 0.1NA
B.标准状况下,11.2LH2O含有的分子数为 0.5 NA
C.500mL0.1mol L 1 K SO K+ SO2 2 4 溶液中 、 4 总数为 0.3 NA
D.常温常压下,16g 的O2和O3 混合气体含有的原子数为 NA
10.下列说法在一定条件下可以实现的是( )
①酸性氧化物与酸发生反应 ②没有电子转移的氧化还原反应 ③没有水生成,也没有沉淀和气体生成的复分解反
应 ④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应
⑥通过单质化合形成 FeCl2
A.①③④⑤ B.②④⑤
C.①②③⑤⑥ D.③⑤⑥
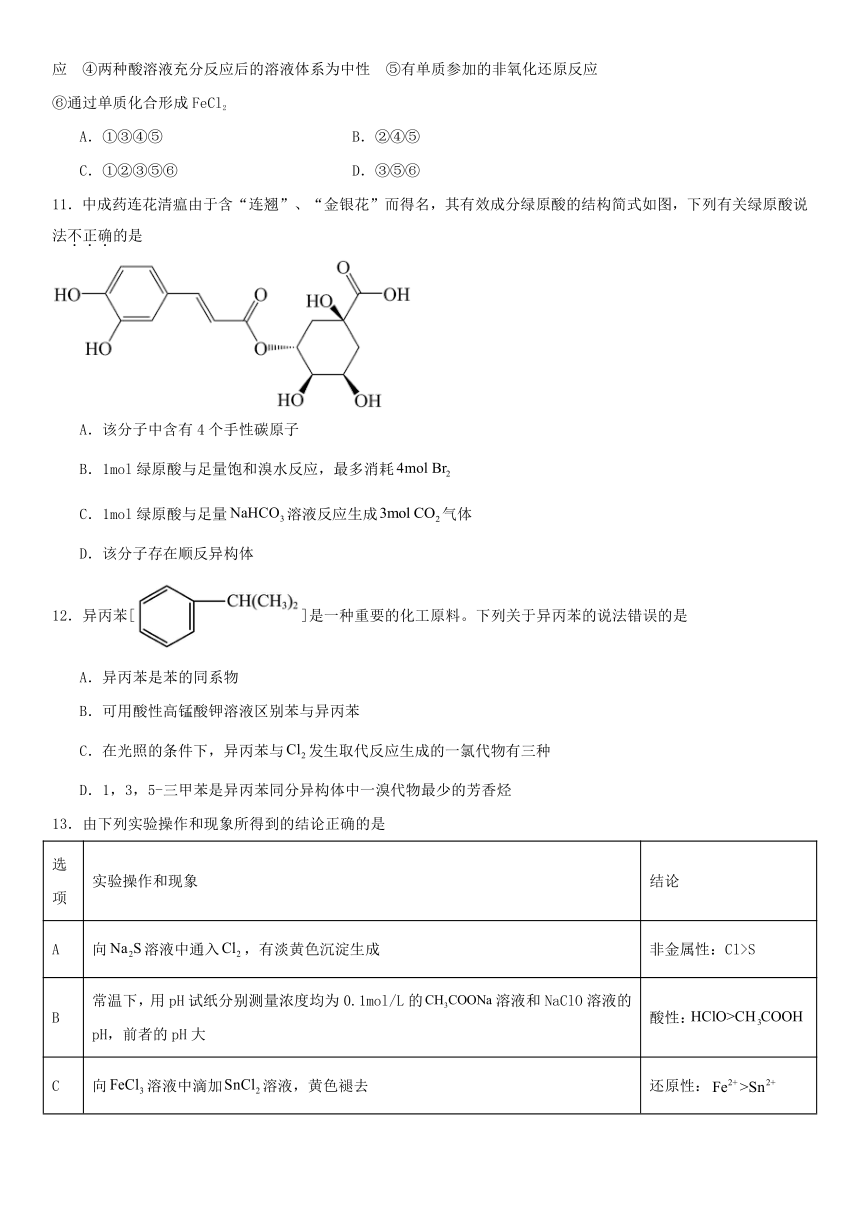
11.中成药连花清瘟由于含“连翘”、“金银花”而得名,其有效成分绿原酸的结构简式如图,下列有关绿原酸说
法不.正.确.的是
A.该分子中含有 4 个手性碳原子
B.1mol 绿原酸与足量饱和溴水反应,最多消耗 4mol Br2
C.1mol 绿原酸与足量 NaHCO3溶液反应生成3mol CO2气体
D.该分子存在顺反异构体
12.异丙苯[ ]是一种重要的化工原料。下列关于异丙苯的说法错误的是
A.异丙苯是苯的同系物
B.可用酸性高锰酸钾溶液区别苯与异丙苯
C.在光照的条件下,异丙苯与Cl2 发生取代反应生成的一氯代物有三种
D.1,3,5-三甲苯是异丙苯同分异构体中一溴代物最少的芳香烃
13.由下列实验操作和现象所得到的结论正确的是
选
实验操作和现象 结论
项
A 向 Na2S溶液中通入Cl2 ,有淡黄色沉淀生成 非金属性:Cl>S
常温下,用 pH 试纸分别测量浓度均为 0.1mol/L 的CH3COONa 溶液和 NaClO 溶液的
B 酸性:HClO>CH 3COOH
pH,前者的 pH 大
C 向 FeCl3 溶液中滴加SnCl2溶液,黄色褪去 还原性:Fe2+ >Sn2+
向10mL 0.1mol L-1NaOH -1溶液中先滴加1mL 0.1mol L MgCl 2 溶液,然后再滴加
D Ksp:Cu(OH)21mL0.1mol L-1 CuCl2 溶液,先产生白色沉淀,后产生蓝色沉淀
A.A B.B C.C D.D
14.钇钡铜复合氧化型超导材料 YBCO(YBa2Cu3Ox)的晶胞结构如图所示,下列说法错误的是
A.x=7 B.晶胞的体积为 3 a3×10-30cm3
C.该晶胞中 Cu 的配位数为 4 或 5 D.相邻 Y之间的最短距离为 3a pm
二、解答题(本大题共 4小题,共 58分)
15.某冶炼厂利用镉熔炼碱渣(约含80% NaOH 及Cd 、CdO、ZnO)和铜镉渣(含Zn 、Cu 、Fe 、Cd 等单质)联合
工艺制备黄钠铁钒[ NaFe3 SO4 2 (OH)6 ],并回收Cu 、Cd 等金属。
(1)滤渣Ⅰ主要含Cd 和CdO,请写出热水溶浸时发生反应的化学方程式: 。
(2)滤渣Ⅱ的主要成分是 。
(3)操作Ⅰ的作用是 。
(4)“沉矾”时应维持溶液 pH 约为 1.5,加入碳铵( NH4HCO3)主要利用其 。
A.具有还原性 B.水溶液呈酸性 C. 水溶液呈碱性 D.加热易分解性
(5)制得黄钠铁矾[ NaFe3 SO4 2 (OH)6 ]的离子方程式为 。
(6)将制镉后的电解废液通过改变电压和更换电极后进行二次电解,二次电解主要是为了回收电解液中的 ,
二次电解后溶液中的主要阳离子为 。
16.有 4 种化合物 W、X、Y、Z,它们的焰色试验都出现黄色,存在如下转化关系:
①W X+H2O+CO2↑
②Z+CO2→X+O2
③Z+H2O→Y+O2↑
④X+Ca(OH)2→Y+CaCO3
试回答下列问题:
(1)W、X 的化学式分别是:W 、X 。
(2)以上 4 个化学反应,属于氧化还原反应的是 (填反应序号),反应中氧化剂是 (写化学式),还原剂
是 (写化学式)。
(3)①如果反应④在溶液中进行,反应物之一为石灰乳,写出其离子方程式: 。
②充分加热 W 和 X 的混合物 10.0g 至质量不再变化,剩余固体质量为 8.45g,则混合物中 X 的质量分数为 。
17.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为 0;Q 与 X
同主族;Z、R 分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
I.(1)Y 在元素周期表中的位置为 。
(2)五种元素原子半径由大到小的顺序是(写元素符号) 。
(3)X、Z两元素能形成两种化合物的电子式分别为 和 。
Ⅱ.生活中 Q 的氯化物是重要的调味品。随着对饮食健康的重视,出现了各种特种类型。
(1)常说“饮食过咸会伤骨”,下列物质中可以作为补钙药品主要成分的是 (填标号)。
A.CaCO3 B.CaO C.Ca(OH)2 D.Ca
(2)调味品中 Q 的含量降低,替而代之氯化钾和硫酸镁,可防治高血压和心血管病,往其溶液中滴入氨水,发生
反应的离子方程式是 。
(3)调味品中也可加入硒元素,硒是人体微量元素中的“抗癌之王”,写出证明硒元素非金属性比硫元素弱的一
个实验事实: 。
(4)调味品中加入碘酸钾可防治碘缺乏症,其中的碘酸钾(KIO3)在酸性溶液中可氧化亚硫酸钠,生成物能使淀粉变
蓝,1mol KIO3被还原时,转移电子 mol,写出主要生成物的化学
式 。
18.G是合成某新型药物的中间体,下图是合成 G 的部分流程:
已知:
乙酸酐的结构简式为
请回答下列问题:
(1)G 中含氧官能团的名称是 、 。
(2)反应 A→B 的化学方程式为 。
(3)有机物 F 的结构简式为 。
(4)反应 ④、⑤的反应类型分别是 、 。
(5)写出满足下列条件的 C 的同分异构体的结构简式 。
Ⅰ.苯环上只有两种取代基
Ⅱ.分子中只有 4 种不同化学环境的氢原子
Ⅲ.能与 NaHCO3溶液反应生成 CO2
(6)以乙酸酐和 为原料,制备 的部分流程图如下。请结合相关信息和已学知识,将合
成路线补充完整(无机试剂任选)。
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 A C D D B B C C D A
题号 11 12 13 14
答案 C C A D
15. 2NaOH ZnO Na2 ZnO2 H2 O Cu 加入H2O2 ,将 Fe2 转化为 Fe3 C
Na 3Fe3 2SO2 4 6H2O NaFe
3 SO4 2 (OH)6 6H Zn H 、 NH 4
16.(1) NaHCO3 Na2CO3
(2) ②③ Na2O2 Na2O2
2 -
(3) Ca(OH)2+CO 3 =CaCO3↓+2OH 58%
2+
17. 第二周期第 IVA 族 Na>Al>C>O>H A Mg +2NH3·H2O
=Mg(OH)2↓+2NH
+
4 硒与氢气化合比硫更难(或硒酸酸性比硫酸弱,或硒化氢稳定性比硫化氢弱,或硫能置换出硒
等) 5 I2、Na2SO4 、K2SO4
18. 羧基 醚键
加
成反应 消去反应
(考试时间:90 分钟 试卷总分:100 分)
一、单选题(本大题共 14 小题,共 42 分)
1.下列溶液中不.能.使酸性 KMnO4溶液褪色的是
A.CH3COOH B.CH2=CH2 C. D.甲苯
2.下列有关二氧化硫的说法正确的是
A.SO2属于电解质
B.SO2为非极性分子
C.SO2既有氧化性又有还原性
D.SO2易溶于水是因为与水能形成分子间氢键
3.下列化学用语表示正确的是
A.18O2-离子结构示意图:
B.SO2 的VSEPR 模型:
2
C.NaHCO3在水溶液中的电离方程式: NaHCO3 Na H CO3
D.反-2-丁烯的结构简式:
4.化学与生活密切相关。下列说法正确的是
A.SO2 用作葡萄酒中的抗氧化剂是因为其具有氧化性
B.pH 小于 7 的雨水称之为酸雨,酸雨对庄稼有危害
C.不含 C 的材料均可称之为无机非金属材料
D.用于信息技术和能源技术领域的单晶硅是半导体材料
5.如下图所示,2 个甲分子反应生成 1个丙分子和 3个乙分子,下列判断不正确的是
A.化学反应中分子的种类发生了改变
B.该反应属于复分解反应
C.摩尔质量关系为 2M(甲)=3M(乙)+M(丙)
D.根据阿伏加德罗定律可推知,1个乙分子中含有 2个 A原子
6.类推是化学学习中常用的思维方法。下列类推正确的是
A.某些金属与酸反应有气体产生,则与酸反应产生气体的一定是金属
B.碱性溶液能使酚酞变红,则能使酚酞变红的溶液一定是碱性溶液
C.单质是由同种元素组成的物质,则由同种元素组成的物质一定是单质
D.酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应
7.在给定条件下,下列微粒在相应水溶液中一定能大量共存的是
A.加铝粉产生 H2的溶液中:K 、NH Cl NO 4 、 、 3
B.含有 AlCl3的溶液中:Mg2 、 Na 、AlO2 、Br
C.常温下,pH=13 的溶液中:Cl 、 Na 、NO 3 、ClO
13
D.由水电离产生的 c H 10 mol / L的溶液中:NO3 、 Na 、Fe2 、SO2 4
8.下列实验方案不.能.达到相应目的的是
A B C D
目 研究温度对化学平衡 研究浓度对化学平衡的 研究浓度对化学反应速率 比较碳酸、醋酸和硼酸的
的 的影响 影响 的影响 酸性强弱
实
验
方
案
A.A B.B C.C D.D
9.设 NA 为阿伏加德罗常数的值,下列说法正确的是
A.0.1mol 过氧化钠与足量水反应生成的O2 分子数为 0.1NA
B.标准状况下,11.2LH2O含有的分子数为 0.5 NA
C.500mL0.1mol L 1 K SO K+ SO2 2 4 溶液中 、 4 总数为 0.3 NA
D.常温常压下,16g 的O2和O3 混合气体含有的原子数为 NA
10.下列说法在一定条件下可以实现的是( )
①酸性氧化物与酸发生反应 ②没有电子转移的氧化还原反应 ③没有水生成,也没有沉淀和气体生成的复分解反
应 ④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应
⑥通过单质化合形成 FeCl2
A.①③④⑤ B.②④⑤
C.①②③⑤⑥ D.③⑤⑥
11.中成药连花清瘟由于含“连翘”、“金银花”而得名,其有效成分绿原酸的结构简式如图,下列有关绿原酸说
法不.正.确.的是
A.该分子中含有 4 个手性碳原子
B.1mol 绿原酸与足量饱和溴水反应,最多消耗 4mol Br2
C.1mol 绿原酸与足量 NaHCO3溶液反应生成3mol CO2气体
D.该分子存在顺反异构体
12.异丙苯[ ]是一种重要的化工原料。下列关于异丙苯的说法错误的是
A.异丙苯是苯的同系物
B.可用酸性高锰酸钾溶液区别苯与异丙苯
C.在光照的条件下,异丙苯与Cl2 发生取代反应生成的一氯代物有三种
D.1,3,5-三甲苯是异丙苯同分异构体中一溴代物最少的芳香烃
13.由下列实验操作和现象所得到的结论正确的是
选
实验操作和现象 结论
项
A 向 Na2S溶液中通入Cl2 ,有淡黄色沉淀生成 非金属性:Cl>S
常温下,用 pH 试纸分别测量浓度均为 0.1mol/L 的CH3COONa 溶液和 NaClO 溶液的
B 酸性:HClO>CH 3COOH
pH,前者的 pH 大
C 向 FeCl3 溶液中滴加SnCl2溶液,黄色褪去 还原性:Fe2+ >Sn2+
向10mL 0.1mol L-1NaOH -1溶液中先滴加1mL 0.1mol L MgCl 2 溶液,然后再滴加
D Ksp:Cu(OH)2
A.A B.B C.C D.D
14.钇钡铜复合氧化型超导材料 YBCO(YBa2Cu3Ox)的晶胞结构如图所示,下列说法错误的是
A.x=7 B.晶胞的体积为 3 a3×10-30cm3
C.该晶胞中 Cu 的配位数为 4 或 5 D.相邻 Y之间的最短距离为 3a pm
二、解答题(本大题共 4小题,共 58分)
15.某冶炼厂利用镉熔炼碱渣(约含80% NaOH 及Cd 、CdO、ZnO)和铜镉渣(含Zn 、Cu 、Fe 、Cd 等单质)联合
工艺制备黄钠铁钒[ NaFe3 SO4 2 (OH)6 ],并回收Cu 、Cd 等金属。
(1)滤渣Ⅰ主要含Cd 和CdO,请写出热水溶浸时发生反应的化学方程式: 。
(2)滤渣Ⅱ的主要成分是 。
(3)操作Ⅰ的作用是 。
(4)“沉矾”时应维持溶液 pH 约为 1.5,加入碳铵( NH4HCO3)主要利用其 。
A.具有还原性 B.水溶液呈酸性 C. 水溶液呈碱性 D.加热易分解性
(5)制得黄钠铁矾[ NaFe3 SO4 2 (OH)6 ]的离子方程式为 。
(6)将制镉后的电解废液通过改变电压和更换电极后进行二次电解,二次电解主要是为了回收电解液中的 ,
二次电解后溶液中的主要阳离子为 。
16.有 4 种化合物 W、X、Y、Z,它们的焰色试验都出现黄色,存在如下转化关系:
①W X+H2O+CO2↑
②Z+CO2→X+O2
③Z+H2O→Y+O2↑
④X+Ca(OH)2→Y+CaCO3
试回答下列问题:
(1)W、X 的化学式分别是:W 、X 。
(2)以上 4 个化学反应,属于氧化还原反应的是 (填反应序号),反应中氧化剂是 (写化学式),还原剂
是 (写化学式)。
(3)①如果反应④在溶液中进行,反应物之一为石灰乳,写出其离子方程式: 。
②充分加热 W 和 X 的混合物 10.0g 至质量不再变化,剩余固体质量为 8.45g,则混合物中 X 的质量分数为 。
17.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为 0;Q 与 X
同主族;Z、R 分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
I.(1)Y 在元素周期表中的位置为 。
(2)五种元素原子半径由大到小的顺序是(写元素符号) 。
(3)X、Z两元素能形成两种化合物的电子式分别为 和 。
Ⅱ.生活中 Q 的氯化物是重要的调味品。随着对饮食健康的重视,出现了各种特种类型。
(1)常说“饮食过咸会伤骨”,下列物质中可以作为补钙药品主要成分的是 (填标号)。
A.CaCO3 B.CaO C.Ca(OH)2 D.Ca
(2)调味品中 Q 的含量降低,替而代之氯化钾和硫酸镁,可防治高血压和心血管病,往其溶液中滴入氨水,发生
反应的离子方程式是 。
(3)调味品中也可加入硒元素,硒是人体微量元素中的“抗癌之王”,写出证明硒元素非金属性比硫元素弱的一
个实验事实: 。
(4)调味品中加入碘酸钾可防治碘缺乏症,其中的碘酸钾(KIO3)在酸性溶液中可氧化亚硫酸钠,生成物能使淀粉变
蓝,1mol KIO3被还原时,转移电子 mol,写出主要生成物的化学
式 。
18.G是合成某新型药物的中间体,下图是合成 G 的部分流程:
已知:
乙酸酐的结构简式为
请回答下列问题:
(1)G 中含氧官能团的名称是 、 。
(2)反应 A→B 的化学方程式为 。
(3)有机物 F 的结构简式为 。
(4)反应 ④、⑤的反应类型分别是 、 。
(5)写出满足下列条件的 C 的同分异构体的结构简式 。
Ⅰ.苯环上只有两种取代基
Ⅱ.分子中只有 4 种不同化学环境的氢原子
Ⅲ.能与 NaHCO3溶液反应生成 CO2
(6)以乙酸酐和 为原料,制备 的部分流程图如下。请结合相关信息和已学知识,将合
成路线补充完整(无机试剂任选)。
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 A C D D B B C C D A
题号 11 12 13 14
答案 C C A D
15. 2NaOH ZnO Na2 ZnO2 H2 O Cu 加入H2O2 ,将 Fe2 转化为 Fe3 C
Na 3Fe3 2SO2 4 6H2O NaFe
3 SO4 2 (OH)6 6H Zn H 、 NH 4
16.(1) NaHCO3 Na2CO3
(2) ②③ Na2O2 Na2O2
2 -
(3) Ca(OH)2+CO 3 =CaCO3↓+2OH 58%
2+
17. 第二周期第 IVA 族 Na>Al>C>O>H A Mg +2NH3·H2O
=Mg(OH)2↓+2NH
+
4 硒与氢气化合比硫更难(或硒酸酸性比硫酸弱,或硒化氢稳定性比硫化氢弱,或硫能置换出硒
等) 5 I2、Na2SO4 、K2SO4
18. 羧基 醚键
加
成反应 消去反应
同课章节目录
