安徽省六安第二中学2024-2025学年高三上学期10月第二次月考化学试题(PDF版,含答案)
文档属性
| 名称 | 安徽省六安第二中学2024-2025学年高三上学期10月第二次月考化学试题(PDF版,含答案) |  | |
| 格式 | |||
| 文件大小 | 546.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-23 20:08:03 | ||
图片预览


文档简介
六安二中 2025 届高三第二次月考
化学试卷
分值:100 分 时间:75 分钟
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 P:31 S:32 Fe:56
Cu:64
一.选择题(每小题 3 分,共 42 分)
1.从古至今,人类的生活、生产都离不开材料的应用。下列说法正确的是( )
A.歼-20上采用的氮化镓涂层,属于新型金属材料
B.人民币票面文字处采用了含 Fe3O4磁性油墨, Fe3O4常用作红色颜料
C.北斗卫星上使用的硅太阳能电池,利用SiO2 将太阳能转化为电能
D.神州十七号返回舱降落回收过程中使用了芳纶制作的降落伞,芳纶是有机高分子材料
2.纳米铜粉(平均粒径 30~80nm)可用于CO2和H2合成甲醇等反应过程的催化剂,以辉铜矿(主要成分
为Cu2S)为原料制备纳米铜粉的工艺流程如图所示:
已知:①浸取时,浸渣中含有硫单质;②还原时,生成的气体对环境没有污染。
下列说法错误的是( )
A.“浸取”时,发生反应的化学方程式为Cu2S 4FeCl3 2CuCl2 4FeCl2 S
B.“萃取”时,选择的萃取剂不溶于水,在该工艺中可循环使用
C.“还原”时,消耗N 2H 4和Cu
2
的物质的量之比为 1∶2
D.用激光笔照射纳米铜粉,可观察到丁达尔效应
3.下列用于解释事实的化学用语书写正确的是( )
A 3 .向AlCl3溶液中滴入过量氨水:Al 3NH3 H2O Al OH 3NH3 4
B .用氨水吸收烟气中少量的SO2 :NH3 H2O SO2 NH4 HSO3
C.向Mg OH 浊液中加入 FeCl 3 3溶液,生成红褐色沉淀:Fe 3OH Fe2 OH 3
D .电解熔融 NaCl的阴极反应: 2H2O 2e H2 2OH
4.设 NA 为阿伏加德罗常数的值,下列叙述正确的是( )
A.40g SiC晶体中含有的 Si―C的数目为 2NA
B.100g质量分数为 46%的C2H5OH的水溶液中含有的氧原子数目为 4NA
C.标准状况下,11.2LNH3 与 11.2L HF均含有5NA 个质子
D.1molC6H14 中含有的 键的数目为20NA
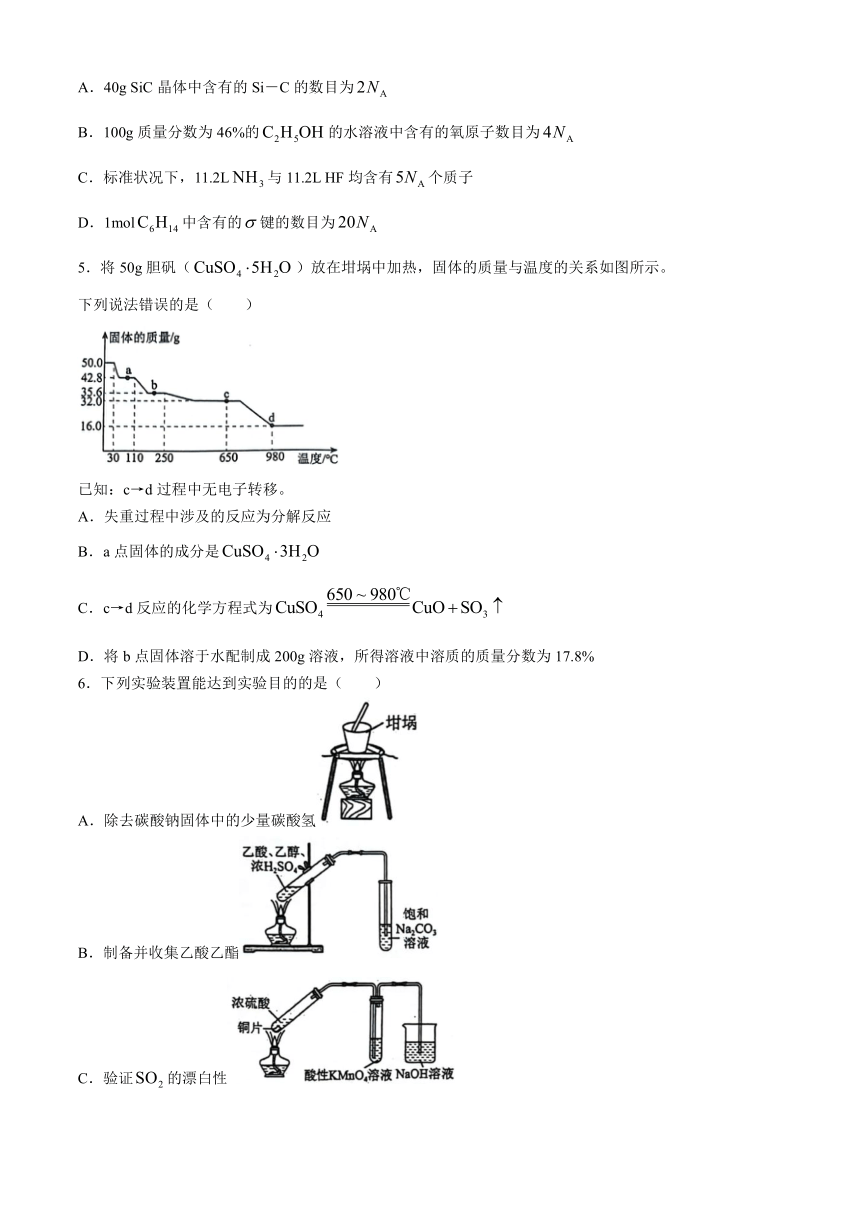
5.将 50g胆矾(CuSO4 5H2O )放在坩埚中加热,固体的质量与温度的关系如图所示。
下列说法错误的是( )
已知:c→d过程中无电子转移。
A.失重过程中涉及的反应为分解反应
B.a点固体的成分是CuSO4 3H2O
650 ~ 980℃
C.c→d反应的化学方程式为CuSO4 CuO SO3
D.将 b点固体溶于水配制成 200g溶液,所得溶液中溶质的质量分数为 17.8%
6.下列实验装置能达到实验目的的是( )
A.除去碳酸钠固体中的少量碳酸氢
B.制备并收集乙酸乙酯
C.验证SO2 的漂白性
D.制备并收集 NO
A.A B.B C.C D.D
7.下列玻璃仪器选择合理且能完成相应实验(夹持装置略去)的是( )
A.配制 500mL 40%的硫酸溶液:①④⑤⑨
B.分离四氯化碳和碘单质的混合物:③④⑥
C.测定CuSO4 5H2O 晶体中结晶水的含量:③⑤⑦⑧
D.用饱和碳酸钠溶液提纯乙酸乙酯(含少量乙酸):②⑤
8.油画创作需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪
色的主要原因是发生了以下两种化学反应。下列说法正确的是( )
A.As2O3 与水作用可生成对应的酸:H3AsO4
B.反应Ⅰ中元素 As和 s都被氧化
C.反应Ⅰ和Ⅱ中,氧化 1molAs2S3转移电子数之比为 3∶7
n O
D 2
.反应Ⅰ和Ⅱ中,参加反应的 :Ⅰ<Ⅱ
n H2O
阅读下列材料,完成下面小题。
资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
Ⅰ.CO2的捕集
方法 1:用Na2CO3溶液做吸收剂可“捕集”CO2。随着反应的进行;若吸收剂失活,可利用 NaOH溶液
使其再生。
方法 2:聚合离子液体是目前广泛研究的CO2吸附剂。实验得出聚合离子液体在不同温度、不同CO2流速
条件下,CO2吸附量变化如图所示:
Ⅱ.CO2合成乙酸:
中国科学家首次以CH3OH、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
9. NA 为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.100mL 0.5mol/L 的 NaOH溶液中含有0.05NA个 H原子
B.常温常压下,11.2LCO2中含有分子数小于0.5NA
C 14C18. O2分子中含有中子数为27NA
D.3.2gCH3OH中含有共价键个数为0.4NA
10.下列相关说法正确的是( )
A.NaOH、Na2CO3、CH3COOH均含有共价键和离子键
B.NaOH溶液使“Na2CO3吸收剂”再生的离子反应:OH
HCO H O CO2 3 2 3
C.低温高流速有利于聚合离子液体吸附CO2
D.CO2合成乙酸的总反应:CH3OH CO2 H
LiIRH
2 CH3COOH 2H2O
11.下列方案不.能.测出Na2CO3和NaHCO3的混合物中Na2CO3的质量分数的是( )
A.取 ag混合物充分加热,质量减少 bg
B.取 ag混合物与足量稀硫酸充分反应,得到 bgCO2
C.取 ag混合物与足量 NaOH溶液充分反应,得到 bg溶液
D.取 ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到 bg固体
12.下表中的各组物质之间通过一步反应就能实现如图所示转化的是( )
编号 a b c d
① Na2O Na2O2 Na NaOH
② Al Al2O3 NaAl OH Al OH4 3
③ FeCl2 FeCl3 Fe CuCl2
④ MgO MgCl2 Mg Mg OH 2
A.②④ B.①④ C.②③ D.③④
13.GaZrOx 双金属氧化物催化CO2加氢制甲醇的反应机理如图所示,活化位点为催化剂区域能吸附反应物
分子同催化剂反应的基团位置。下列说法不正确的是( )
A 催化剂.该过程的总反应可表示为CO2 3H2 CH3OH H2O
B.反应①②③④均有极性键的断裂与形成
C.CO2和H2的活化位点相同
D.氧空位浓度高,有利于增强CO2的吸附能力
14.NH3是重要的化工原料,可以按如下流程充分利用。已知:NaN3是离子化合物,各原子均满足 8电
子稳定结构。
下列说法正确的是( )
A .反应③实现了氮的固定 B.N3 的电子式为 ∶N ::N ::N :
C.反应②过程中,氮元素的杂化方式由 sp3变为 sp2 D .结合H 能力:N2H4 CH3NH2
二.填空题(共 58 分)
15.(每空 2分,共 14分)钠及其化合物在人类生产、生活中起着重要的作用。
请回答下列问题:
(1)工业上,将Na2CO3和Na2S以 1∶2的物质的量之比配成溶液,再通入SO2 可制取Na2S2O3,同时
放出CO2,写出该反应的化学方程式:______。
(2)我国化学家侯德榜发明了联合制碱法,为世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图
所示(部分物质已略去)。
①写出反应①的化学方程式:______。
②下列关于该流程的说法正确的是______(填标号)。
A.可循环使用的物质只有CO2
B.副产物NH4Cl可用作氮肥
C.优先通入CO2气体至饱和,后通入NH3 ,就会产生NaHCO3沉淀
(3)向 50mL的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 0.1mol/L 的稀盐
酸,产生气体的体积(标准状况)如图所示。
①通入二氧化碳后形成溶液的溶质成分是______(填化学式)。
②滴入 25mL稀盐酸过程中,溶液导电性______(填“增强”“减弱”或“不变”),试解释其原因:______。
③原 50mL氢氧化钠溶液的浓度为______。
16.(每空 2分,共 18分)某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入 10.00g 香菇样品和 400mL 水;锥形瓶中加入 125mL 水、1mL 淀粉溶液,并预加
0.30mL0.01000mol L 1的碘标准溶液,搅拌。
②以0.2L min 1流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定
消耗了 1.00mL碘标准溶液。
③做空白实验,消耗了 0.10mL碘标准溶液。
④用适量Na2SO3替代香菇样品,重复上述步骤,测得SO2 的平均回收率为 95%。
已知:Ka1 H3PO4 7.1 10 3,Ka1 H SO 22 3 1.3 10 。
回答下列问题:
(1)装置图中仪器 a、b的名称分别为______、______。
(2)三颈烧瓶适宜的规格为______(填标号)。
A.250mL B.500mL C.1000mL
(3)解释加入H3PO4 ,能够生成SO2 的原因:______
(4)滴定管在使用前需要______、洗涤、润洗;滴定终点时溶液的颜色为______;滴定反应的离子方程式
为______。
(5)若先加磷酸再通氮气,会使测定结果______(填“偏高”“偏低”或“无影响”)。
(6)该样品中亚硫酸盐含量为______mg kg 1(以SO2 计,结果保留三位有效数字)。
17.回答下列问题(除标注外,每空 2分,共 12分)。
(1)已知 CuO具有氧化性,与氨气加热反应的产物中含有两种单质。写出在加热条件下 CuO和NH3 反应
的化学方程式:______。
2 2 3 3 ( )在Mn 、Bi 、BiO3 、MnO4 、H 、H2O组成的一个氧化还原反应体系中,发生BiO3 Bi
的反应过程。将以上物质组成一个正确的离子方程式,并用单线桥标出其电子转移的方向和数目:______。
(离子方程式 2分,电子转移 2分,共 4分)
(3) Fe OH 与 NaOH和 NaClO 的混合溶液作用,是一种制备理想的绿色水处理剂(Na2FeO4 )的方3
法,写出该反应的化学方程式:______。
(4)KClO3可用于实验室制O2,若不加催化剂,400℃时KClO3分解只生成两种盐,其中一种是无氧酸
盐,另一种盐的阴阳离子个数比为 1∶1,写出该反应的化学方程式:______。
(5)某地污水中有机污染物的主要成分是三氯乙烯(C2HCl3 ),向该污水中加入KMnO4 (还原产物为
MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式:______。
18.(每空 2分,共 14分)黄铁矿高温煅烧除硫后的烧渣主要含有 Fe2O3、FeO、Al2O3、SiO2,某研究
小组尝试用烧渣制取绿矾( FeSO4 7H 2O ),流程图如下。
3 2
已知:Al 完全沉淀时的 pH小于 Fe 开始沉淀时的 pH。
回答下列问题:
(1)为提高烧渣的浸取速率,可采用的措施有______(填标号)。
a.升高温度 b.将烧渣粉碎 c.增大烧渣用量 d.适当增大硫酸浓度
e.增大反应容器气压
(2)滤渣Ⅰ的主要成分是______(填化学式)。
(3)试剂 X可以选用多种物质,若 X是一种非金属氧化物,写出还原过程中发生反应的离子方程式:______。
(4)滤渣Ⅱ的主要成分是______(填化学式)。
(5)过滤Ⅱ后的滤液为 FeSO4溶液,从 FeSO4溶液得到 FeSO4 7H 2O 的一系列操作中应将 FeSO4溶液
放置于______(填仪器名称)中加热。
(6)绿矾容易被氧化变质,写出实验室中检验绿矾是否被氧化变质的操作和现象:______。
(7)该研究小组取 14.00g烧渣进行实验,最后得到绿矾的质量为 25.02g,若从烧渣制取绿矾的流程中没有
使用含铁的试剂,则烧渣中 Fe 的质量百分数为______。(假设流程中的铁元素全部转化到绿矾中)
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D D A B D A D C B B
题号 11 12 13 14
答案 C D C B
15.(1)Na2CO3 2Na2S 4SO2 3Na2S2O3 CO2
(2)CO2 NH3 NaCl H2O NaHCO3 NH4Cl B
(3)NaOH、Na2CO3 减弱 发生中和反应,溶液中的离子总数不变,溶液体积增大,导致溶液的导电
性减弱 0.15mol/L
16.(1)球形冷凝管 酸式滴定管 (2)C
(3)加入H3PO4 后,溶液中存在化学平衡H2SO3 SO2 H2O ,SO2 的溶解度随着温度升高而减小,
SO2 逸出后,促进了化学平衡H2SO3 SO2 H2O 向右移动
(4 2 )检验其是否漏水 蓝色 I2 SO2 2H2O 2I 4H SO4 (5)偏低 (6)80.8
△
17.(1)3CuO 2NH3 3Cu N2 3H2O
(2)
(3)2Fe OH 4NaOH 3NaClO 2Na2FeO4 3NaCl 5H2O3
400℃
(4)4KClO3 KCl 3KClO4
(5)2KMnO4 C2HCl3 2MnO2 HCl 2KCl 2CO2
18 1 abd 2 SiO 3 2Fe3 SO 2H O 2Fe2 2 .( ) ( ) 2 ( ) 2 2 SO4 4H
(4)Al OH (5)蒸发皿3
(6)取少量固体于试管中,加入蒸馏水溶解,滴加 KSCN溶液,若溶液变红则已变质,若无明显现象,则
未变质
(7)36.00%
化学试卷
分值:100 分 时间:75 分钟
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 P:31 S:32 Fe:56
Cu:64
一.选择题(每小题 3 分,共 42 分)
1.从古至今,人类的生活、生产都离不开材料的应用。下列说法正确的是( )
A.歼-20上采用的氮化镓涂层,属于新型金属材料
B.人民币票面文字处采用了含 Fe3O4磁性油墨, Fe3O4常用作红色颜料
C.北斗卫星上使用的硅太阳能电池,利用SiO2 将太阳能转化为电能
D.神州十七号返回舱降落回收过程中使用了芳纶制作的降落伞,芳纶是有机高分子材料
2.纳米铜粉(平均粒径 30~80nm)可用于CO2和H2合成甲醇等反应过程的催化剂,以辉铜矿(主要成分
为Cu2S)为原料制备纳米铜粉的工艺流程如图所示:
已知:①浸取时,浸渣中含有硫单质;②还原时,生成的气体对环境没有污染。
下列说法错误的是( )
A.“浸取”时,发生反应的化学方程式为Cu2S 4FeCl3 2CuCl2 4FeCl2 S
B.“萃取”时,选择的萃取剂不溶于水,在该工艺中可循环使用
C.“还原”时,消耗N 2H 4和Cu
2
的物质的量之比为 1∶2
D.用激光笔照射纳米铜粉,可观察到丁达尔效应
3.下列用于解释事实的化学用语书写正确的是( )
A 3 .向AlCl3溶液中滴入过量氨水:Al 3NH3 H2O Al OH 3NH3 4
B .用氨水吸收烟气中少量的SO2 :NH3 H2O SO2 NH4 HSO3
C.向Mg OH 浊液中加入 FeCl 3 3溶液,生成红褐色沉淀:Fe 3OH Fe2 OH 3
D .电解熔融 NaCl的阴极反应: 2H2O 2e H2 2OH
4.设 NA 为阿伏加德罗常数的值,下列叙述正确的是( )
A.40g SiC晶体中含有的 Si―C的数目为 2NA
B.100g质量分数为 46%的C2H5OH的水溶液中含有的氧原子数目为 4NA
C.标准状况下,11.2LNH3 与 11.2L HF均含有5NA 个质子
D.1molC6H14 中含有的 键的数目为20NA
5.将 50g胆矾(CuSO4 5H2O )放在坩埚中加热,固体的质量与温度的关系如图所示。
下列说法错误的是( )
已知:c→d过程中无电子转移。
A.失重过程中涉及的反应为分解反应
B.a点固体的成分是CuSO4 3H2O
650 ~ 980℃
C.c→d反应的化学方程式为CuSO4 CuO SO3
D.将 b点固体溶于水配制成 200g溶液,所得溶液中溶质的质量分数为 17.8%
6.下列实验装置能达到实验目的的是( )
A.除去碳酸钠固体中的少量碳酸氢
B.制备并收集乙酸乙酯
C.验证SO2 的漂白性
D.制备并收集 NO
A.A B.B C.C D.D
7.下列玻璃仪器选择合理且能完成相应实验(夹持装置略去)的是( )
A.配制 500mL 40%的硫酸溶液:①④⑤⑨
B.分离四氯化碳和碘单质的混合物:③④⑥
C.测定CuSO4 5H2O 晶体中结晶水的含量:③⑤⑦⑧
D.用饱和碳酸钠溶液提纯乙酸乙酯(含少量乙酸):②⑤
8.油画创作需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪
色的主要原因是发生了以下两种化学反应。下列说法正确的是( )
A.As2O3 与水作用可生成对应的酸:H3AsO4
B.反应Ⅰ中元素 As和 s都被氧化
C.反应Ⅰ和Ⅱ中,氧化 1molAs2S3转移电子数之比为 3∶7
n O
D 2
.反应Ⅰ和Ⅱ中,参加反应的 :Ⅰ<Ⅱ
n H2O
阅读下列材料,完成下面小题。
资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
Ⅰ.CO2的捕集
方法 1:用Na2CO3溶液做吸收剂可“捕集”CO2。随着反应的进行;若吸收剂失活,可利用 NaOH溶液
使其再生。
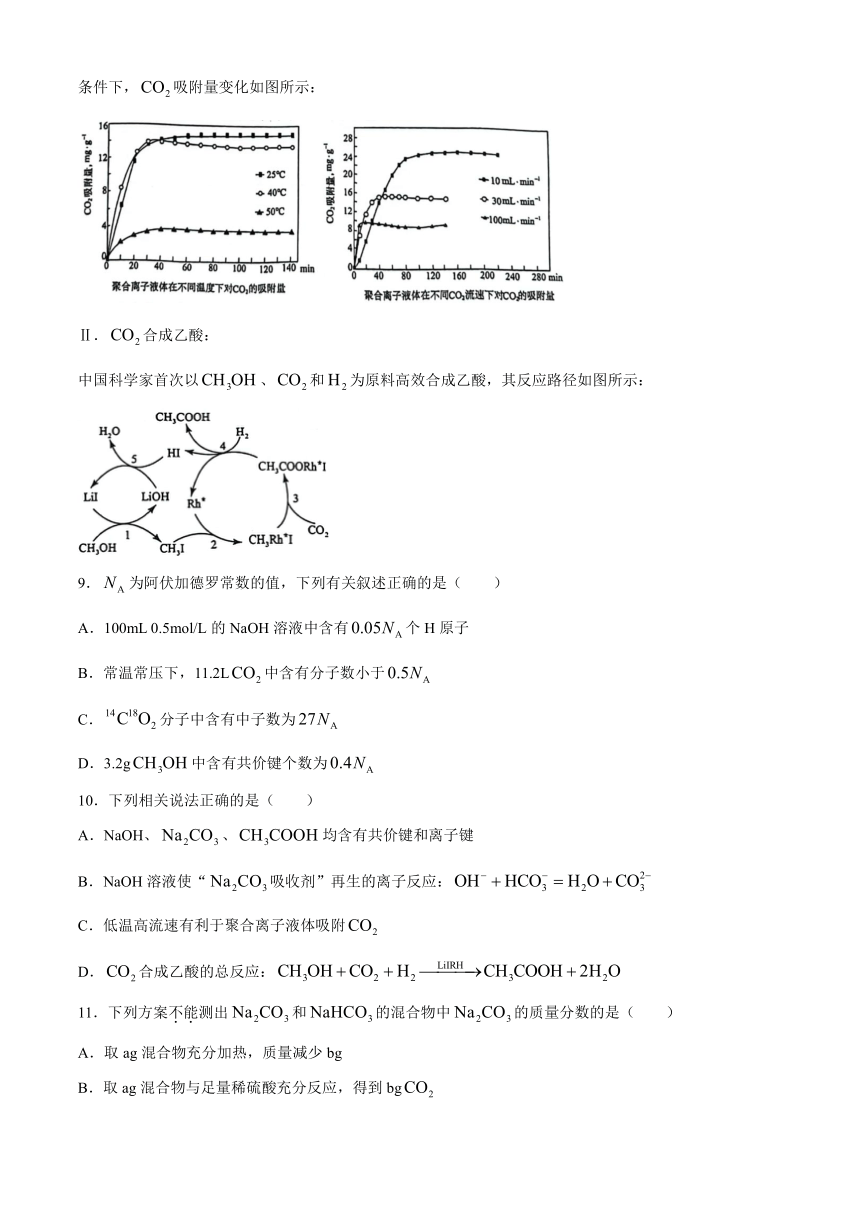
方法 2:聚合离子液体是目前广泛研究的CO2吸附剂。实验得出聚合离子液体在不同温度、不同CO2流速
条件下,CO2吸附量变化如图所示:
Ⅱ.CO2合成乙酸:
中国科学家首次以CH3OH、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
9. NA 为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.100mL 0.5mol/L 的 NaOH溶液中含有0.05NA个 H原子
B.常温常压下,11.2LCO2中含有分子数小于0.5NA
C 14C18. O2分子中含有中子数为27NA
D.3.2gCH3OH中含有共价键个数为0.4NA
10.下列相关说法正确的是( )
A.NaOH、Na2CO3、CH3COOH均含有共价键和离子键
B.NaOH溶液使“Na2CO3吸收剂”再生的离子反应:OH
HCO H O CO2 3 2 3
C.低温高流速有利于聚合离子液体吸附CO2
D.CO2合成乙酸的总反应:CH3OH CO2 H
LiIRH
2 CH3COOH 2H2O
11.下列方案不.能.测出Na2CO3和NaHCO3的混合物中Na2CO3的质量分数的是( )
A.取 ag混合物充分加热,质量减少 bg
B.取 ag混合物与足量稀硫酸充分反应,得到 bgCO2
C.取 ag混合物与足量 NaOH溶液充分反应,得到 bg溶液
D.取 ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到 bg固体
12.下表中的各组物质之间通过一步反应就能实现如图所示转化的是( )
编号 a b c d
① Na2O Na2O2 Na NaOH
② Al Al2O3 NaAl OH Al OH4 3
③ FeCl2 FeCl3 Fe CuCl2
④ MgO MgCl2 Mg Mg OH 2
A.②④ B.①④ C.②③ D.③④
13.GaZrOx 双金属氧化物催化CO2加氢制甲醇的反应机理如图所示,活化位点为催化剂区域能吸附反应物
分子同催化剂反应的基团位置。下列说法不正确的是( )
A 催化剂.该过程的总反应可表示为CO2 3H2 CH3OH H2O
B.反应①②③④均有极性键的断裂与形成
C.CO2和H2的活化位点相同
D.氧空位浓度高,有利于增强CO2的吸附能力
14.NH3是重要的化工原料,可以按如下流程充分利用。已知:NaN3是离子化合物,各原子均满足 8电
子稳定结构。
下列说法正确的是( )
A .反应③实现了氮的固定 B.N3 的电子式为 ∶N ::N ::N :
C.反应②过程中,氮元素的杂化方式由 sp3变为 sp2 D .结合H 能力:N2H4 CH3NH2
二.填空题(共 58 分)
15.(每空 2分,共 14分)钠及其化合物在人类生产、生活中起着重要的作用。
请回答下列问题:
(1)工业上,将Na2CO3和Na2S以 1∶2的物质的量之比配成溶液,再通入SO2 可制取Na2S2O3,同时
放出CO2,写出该反应的化学方程式:______。
(2)我国化学家侯德榜发明了联合制碱法,为世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图
所示(部分物质已略去)。
①写出反应①的化学方程式:______。
②下列关于该流程的说法正确的是______(填标号)。
A.可循环使用的物质只有CO2
B.副产物NH4Cl可用作氮肥
C.优先通入CO2气体至饱和,后通入NH3 ,就会产生NaHCO3沉淀
(3)向 50mL的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 0.1mol/L 的稀盐
酸,产生气体的体积(标准状况)如图所示。
①通入二氧化碳后形成溶液的溶质成分是______(填化学式)。
②滴入 25mL稀盐酸过程中,溶液导电性______(填“增强”“减弱”或“不变”),试解释其原因:______。
③原 50mL氢氧化钠溶液的浓度为______。
16.(每空 2分,共 18分)某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入 10.00g 香菇样品和 400mL 水;锥形瓶中加入 125mL 水、1mL 淀粉溶液,并预加
0.30mL0.01000mol L 1的碘标准溶液,搅拌。
②以0.2L min 1流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定
消耗了 1.00mL碘标准溶液。
③做空白实验,消耗了 0.10mL碘标准溶液。
④用适量Na2SO3替代香菇样品,重复上述步骤,测得SO2 的平均回收率为 95%。
已知:Ka1 H3PO4 7.1 10 3,Ka1 H SO 22 3 1.3 10 。
回答下列问题:
(1)装置图中仪器 a、b的名称分别为______、______。
(2)三颈烧瓶适宜的规格为______(填标号)。
A.250mL B.500mL C.1000mL
(3)解释加入H3PO4 ,能够生成SO2 的原因:______
(4)滴定管在使用前需要______、洗涤、润洗;滴定终点时溶液的颜色为______;滴定反应的离子方程式
为______。
(5)若先加磷酸再通氮气,会使测定结果______(填“偏高”“偏低”或“无影响”)。
(6)该样品中亚硫酸盐含量为______mg kg 1(以SO2 计,结果保留三位有效数字)。
17.回答下列问题(除标注外,每空 2分,共 12分)。
(1)已知 CuO具有氧化性,与氨气加热反应的产物中含有两种单质。写出在加热条件下 CuO和NH3 反应
的化学方程式:______。
2 2 3 3 ( )在Mn 、Bi 、BiO3 、MnO4 、H 、H2O组成的一个氧化还原反应体系中,发生BiO3 Bi
的反应过程。将以上物质组成一个正确的离子方程式,并用单线桥标出其电子转移的方向和数目:______。
(离子方程式 2分,电子转移 2分,共 4分)
(3) Fe OH 与 NaOH和 NaClO 的混合溶液作用,是一种制备理想的绿色水处理剂(Na2FeO4 )的方3
法,写出该反应的化学方程式:______。
(4)KClO3可用于实验室制O2,若不加催化剂,400℃时KClO3分解只生成两种盐,其中一种是无氧酸
盐,另一种盐的阴阳离子个数比为 1∶1,写出该反应的化学方程式:______。
(5)某地污水中有机污染物的主要成分是三氯乙烯(C2HCl3 ),向该污水中加入KMnO4 (还原产物为
MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式:______。
18.(每空 2分,共 14分)黄铁矿高温煅烧除硫后的烧渣主要含有 Fe2O3、FeO、Al2O3、SiO2,某研究
小组尝试用烧渣制取绿矾( FeSO4 7H 2O ),流程图如下。
3 2
已知:Al 完全沉淀时的 pH小于 Fe 开始沉淀时的 pH。
回答下列问题:
(1)为提高烧渣的浸取速率,可采用的措施有______(填标号)。
a.升高温度 b.将烧渣粉碎 c.增大烧渣用量 d.适当增大硫酸浓度
e.增大反应容器气压
(2)滤渣Ⅰ的主要成分是______(填化学式)。
(3)试剂 X可以选用多种物质,若 X是一种非金属氧化物,写出还原过程中发生反应的离子方程式:______。
(4)滤渣Ⅱ的主要成分是______(填化学式)。
(5)过滤Ⅱ后的滤液为 FeSO4溶液,从 FeSO4溶液得到 FeSO4 7H 2O 的一系列操作中应将 FeSO4溶液
放置于______(填仪器名称)中加热。
(6)绿矾容易被氧化变质,写出实验室中检验绿矾是否被氧化变质的操作和现象:______。
(7)该研究小组取 14.00g烧渣进行实验,最后得到绿矾的质量为 25.02g,若从烧渣制取绿矾的流程中没有
使用含铁的试剂,则烧渣中 Fe 的质量百分数为______。(假设流程中的铁元素全部转化到绿矾中)
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D D A B D A D C B B
题号 11 12 13 14
答案 C D C B
15.(1)Na2CO3 2Na2S 4SO2 3Na2S2O3 CO2
(2)CO2 NH3 NaCl H2O NaHCO3 NH4Cl B
(3)NaOH、Na2CO3 减弱 发生中和反应,溶液中的离子总数不变,溶液体积增大,导致溶液的导电
性减弱 0.15mol/L
16.(1)球形冷凝管 酸式滴定管 (2)C
(3)加入H3PO4 后,溶液中存在化学平衡H2SO3 SO2 H2O ,SO2 的溶解度随着温度升高而减小,
SO2 逸出后,促进了化学平衡H2SO3 SO2 H2O 向右移动
(4 2 )检验其是否漏水 蓝色 I2 SO2 2H2O 2I 4H SO4 (5)偏低 (6)80.8
△
17.(1)3CuO 2NH3 3Cu N2 3H2O
(2)
(3)2Fe OH 4NaOH 3NaClO 2Na2FeO4 3NaCl 5H2O3
400℃
(4)4KClO3 KCl 3KClO4
(5)2KMnO4 C2HCl3 2MnO2 HCl 2KCl 2CO2
18 1 abd 2 SiO 3 2Fe3 SO 2H O 2Fe2 2 .( ) ( ) 2 ( ) 2 2 SO4 4H
(4)Al OH (5)蒸发皿3
(6)取少量固体于试管中,加入蒸馏水溶解,滴加 KSCN溶液,若溶液变红则已变质,若无明显现象,则
未变质
(7)36.00%
同课章节目录
