苏教版高中化学选修三专题3 晶体结构与性质复习课件(共30张PPT)
文档属性
| 名称 | 苏教版高中化学选修三专题3 晶体结构与性质复习课件(共30张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-03-01 00:00:00 | ||
图片预览








文档简介
课件30张PPT。2018/11/22晶体结构与性质
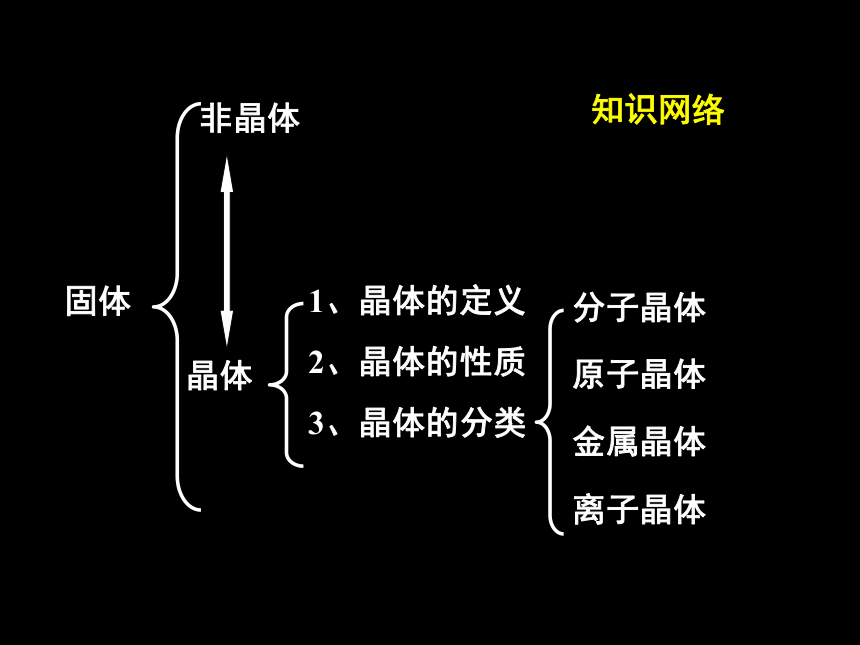
复习知识网络固体非晶体晶体1、晶体的定义2、晶体的性质3、晶体的分类分子晶体原子晶体金属晶体离子晶体2018/11/22一、晶体与非晶体1.晶体与非晶体的区别2018/11/222.晶体形成的途径熔融态物质凝固.
气态物质冷却不经液态直接凝固(凝华).
溶质从溶液中析出.3.晶体的特性有规则的几何外形
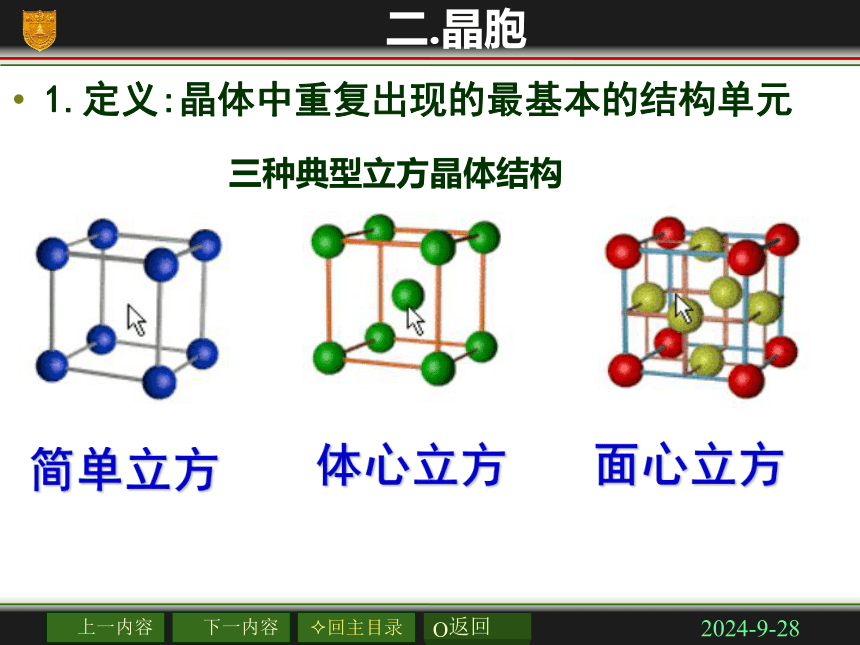
有固定的熔沸点(合金除外)2018/11/22二.晶胞1.定义:晶体中重复出现的最基本的结构单元
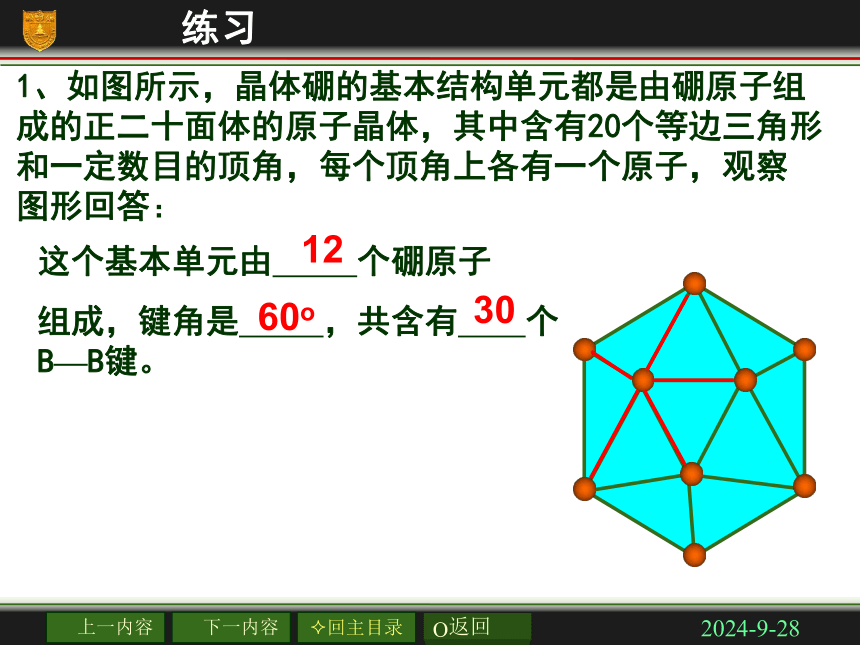
三种典型立方晶体结构2018/11/22立方晶胞体心:1面心:1/2棱边:1/4顶点:1/82、立方晶体中晶胞对质点的占有率2018/11/221、如图所示,晶体硼的基本结构单元都是由硼原子组
成的正二十面体的原子晶体,其中含有20个等边三角形
和一定数目的顶角,每个顶角上各有一个原子,观察
图形回答:这个基本单元由 个硼原子
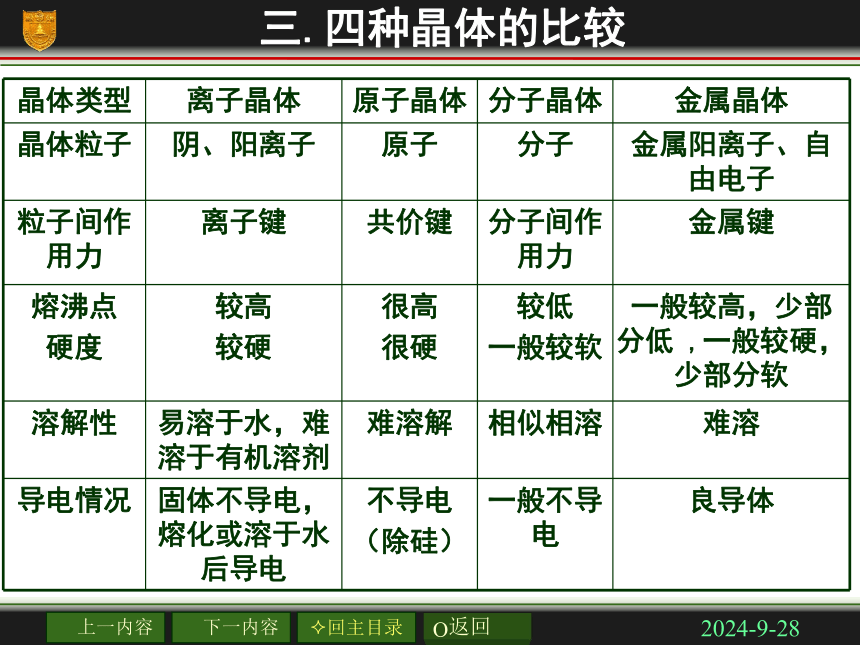
组成,键角是 ,共含有 个B—B键。1260o30练习2018/11/222、最近发现一种有钛原子和碳原子构成的气态团簇分子,结构如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为______ Ti14C13练习2018/11/22三.四种晶体的比较2018/11/222018/11/22晶体熔沸点高低的判断 ⑴不同晶体类型的熔沸点比较 一般:原子晶体>离子晶体>分子晶体(有例外) ⑵同种晶体类型物质的熔沸点比较 ①离子晶体: 阴、阳离子电荷数越大,半径越小熔沸点越高 ②原子晶体: 原子半径越小→键长越短→键能越大熔沸点越高 ③分子晶体: 相对分子质量越大,分子的极性越大熔沸点越高 组成和结构相似的分子晶体 ④金属晶体: 金属阳离子电荷数越高,半径越小熔沸点越高 2018/11/223、将下列各组物质按熔沸点由高到低的顺序排列:
1、CaCl2、H2O 、KCl 、晶体硅
2、SiC 、晶体硅 、金刚石
3、CH4 、CCl4 、CBr4、CF4
4、CaCl2 、NH4Cl 、KCl 、NaCl
5、Na 、Al 、Ar 、Hg
6、NH3 、Hg 、Br2 、金刚石
7、 H2O 、I2 、H2S练习1、 晶体硅> CaCl2 >KCl >H2O2、 金刚石 > SiC> 晶体硅 3、 CBr4 > CCl4 > CF4 > CH4 4、 CaCl2 > NaCl > KCl > NH4Cl 5、 Al> Na > Hg > Ar 6、 金刚石> Hg > Br2 > NH3 7、 I2 > H2O > H2S 2018/11/22四、分子晶体2018/11/22 4、白磷的键角为多少?Wg白磷中磷磷单键的数目为多少?60° (W/124) ×6 ×NA PPPP练习2018/11/22五、原子晶体5、甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知:甲、乙、丙为双原子分子或负二价双原子离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式为: 。
(2)乙在高温时是一种还原剂,请用化学反应方程式表示它在工业上的一种重要的用途: 。
(3)在一定条件下,甲与O2反应的化学方程式是: 。
(4)丁的元素符号是 ,它的原子结构示意图为 。
(5)丁的氧化物的晶体结构与 的晶体结构相似2018/11/22六、金属晶体原子在二维平面上的两种放置方式-非密置层和密置层非密置层
配位数为4密置层
配位数为62018/11/22三维堆积——四种方式金属晶体的原子堆积模型简单立方堆积钾型(体心立方)由非密置层一层一层堆积而成2018/11/22A
B
AC
B
A镁型铜型金属晶体的两种最密堆积方式金属晶体的原子堆积模型2018/11/22金属晶体的四种堆积模型对比2018/11/22七.离子晶体NaCl和CsCl的晶胞2018/11/22 NaCl晶体每个Na+同时吸引6个Cl-,每个Cl-同时吸引6个Na+每个Cl―(Na+)同时吸引12个Cl―(Na+)2018/11/22 在氯化铯晶体中,每个Cl-(或Cs+)周围与之最接近且距离相等的Cs+(或Cl-)共有 ;这几个Cs+(或Cl-)在空间构成的几何构型为 ;在每个Cs+周围距离相等且最近的Cs+共有 ;这几个Cs+(或Cl-)在空间构成的几何构型为 ;CsCl晶体8个立方体6 个正八面体2018/11/22(1)几何因素--正负离子的半径比(r+/r- )(2)电荷因素----正负离子的电荷比(3)键性因素----离子键的纯粹程度1.离子晶体中离子的配位数的决定因素2018/11/222.晶格能1.晶格能:拆开1mol离子晶体使之成为气态阳离子和气态负离子形成所吸收的能量.2.影响晶格能的因素:
(1)与正负离子电荷成正比
(2)与核间距成反比(与半径成反比)
3.晶格能与离子晶体的物理性质:
晶格能越大,离子晶体越稳定,熔沸点越高、硬度越大.2018/11/22 晶体中微粒的排列、个数的计算 在氯化钠晶体中,每个Na+周围与之最接近且距离相等的Cl-共有 个;这几个Cl-在空间构成的几何构型为 。6正八面体2018/11/22八、混合型晶体2018/11/22达标潜能练习1、下列不存在化学键的晶体是:
A.硝酸钾 B.干冰 C.石墨 D.固体氩
2、常温常压下的分子晶体是:
A.碘 B.水 C. 硫酸铵 D.干冰
3、同组物质中化学键类型相同、晶体类型也相
同的是:
A、I2 Ar N2 Si B、金刚石 O2 F2
C、Ba(OH)2 K2O CaCl2
D、HCHO CO2 C2H5OH2018/11/224、下列有关共价化合物的说:①具有较低的熔沸点
②不是电解质③固态时是分子晶体④都由分子构成
⑤液态时不导电,其中一定正确的说法是:
A.①③④ B.②⑤ C.⑤ D.全部正确
5、关于晶体的下列说法正确的是:
A、在晶体中只要有阴离子就一定有阳离子
B、在晶体中只要有阳离子就一定有阴离子
C、 原子晶体的熔点一定比金属晶体的高
D、分子晶体的熔点一定比金属晶体的低达标潜能练习2018/11/22达标潜能练习6、晶体中一个微粒周围有6个微粒,这种晶体是:A.金刚石 B.石墨 C.干冰 D.氯化钠
7、许多事实都证明氯化铝是分子晶体.请你设
计一个实验证实这一结论.实验方案为:
______________________________________
复习知识网络固体非晶体晶体1、晶体的定义2、晶体的性质3、晶体的分类分子晶体原子晶体金属晶体离子晶体2018/11/22一、晶体与非晶体1.晶体与非晶体的区别2018/11/222.晶体形成的途径熔融态物质凝固.
气态物质冷却不经液态直接凝固(凝华).
溶质从溶液中析出.3.晶体的特性有规则的几何外形
有固定的熔沸点(合金除外)2018/11/22二.晶胞1.定义:晶体中重复出现的最基本的结构单元
三种典型立方晶体结构2018/11/22立方晶胞体心:1面心:1/2棱边:1/4顶点:1/82、立方晶体中晶胞对质点的占有率2018/11/221、如图所示,晶体硼的基本结构单元都是由硼原子组
成的正二十面体的原子晶体,其中含有20个等边三角形
和一定数目的顶角,每个顶角上各有一个原子,观察
图形回答:这个基本单元由 个硼原子
组成,键角是 ,共含有 个B—B键。1260o30练习2018/11/222、最近发现一种有钛原子和碳原子构成的气态团簇分子,结构如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为______ Ti14C13练习2018/11/22三.四种晶体的比较2018/11/222018/11/22晶体熔沸点高低的判断 ⑴不同晶体类型的熔沸点比较 一般:原子晶体>离子晶体>分子晶体(有例外) ⑵同种晶体类型物质的熔沸点比较 ①离子晶体: 阴、阳离子电荷数越大,半径越小熔沸点越高 ②原子晶体: 原子半径越小→键长越短→键能越大熔沸点越高 ③分子晶体: 相对分子质量越大,分子的极性越大熔沸点越高 组成和结构相似的分子晶体 ④金属晶体: 金属阳离子电荷数越高,半径越小熔沸点越高 2018/11/223、将下列各组物质按熔沸点由高到低的顺序排列:
1、CaCl2、H2O 、KCl 、晶体硅
2、SiC 、晶体硅 、金刚石
3、CH4 、CCl4 、CBr4、CF4
4、CaCl2 、NH4Cl 、KCl 、NaCl
5、Na 、Al 、Ar 、Hg
6、NH3 、Hg 、Br2 、金刚石
7、 H2O 、I2 、H2S练习1、 晶体硅> CaCl2 >KCl >H2O2、 金刚石 > SiC> 晶体硅 3、 CBr4 > CCl4 > CF4 > CH4 4、 CaCl2 > NaCl > KCl > NH4Cl 5、 Al> Na > Hg > Ar 6、 金刚石> Hg > Br2 > NH3 7、 I2 > H2O > H2S 2018/11/22四、分子晶体2018/11/22 4、白磷的键角为多少?Wg白磷中磷磷单键的数目为多少?60° (W/124) ×6 ×NA PPPP练习2018/11/22五、原子晶体5、甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知:甲、乙、丙为双原子分子或负二价双原子离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式为: 。
(2)乙在高温时是一种还原剂,请用化学反应方程式表示它在工业上的一种重要的用途: 。
(3)在一定条件下,甲与O2反应的化学方程式是: 。
(4)丁的元素符号是 ,它的原子结构示意图为 。
(5)丁的氧化物的晶体结构与 的晶体结构相似2018/11/22六、金属晶体原子在二维平面上的两种放置方式-非密置层和密置层非密置层
配位数为4密置层
配位数为62018/11/22三维堆积——四种方式金属晶体的原子堆积模型简单立方堆积钾型(体心立方)由非密置层一层一层堆积而成2018/11/22A
B
AC
B
A镁型铜型金属晶体的两种最密堆积方式金属晶体的原子堆积模型2018/11/22金属晶体的四种堆积模型对比2018/11/22七.离子晶体NaCl和CsCl的晶胞2018/11/22 NaCl晶体每个Na+同时吸引6个Cl-,每个Cl-同时吸引6个Na+每个Cl―(Na+)同时吸引12个Cl―(Na+)2018/11/22 在氯化铯晶体中,每个Cl-(或Cs+)周围与之最接近且距离相等的Cs+(或Cl-)共有 ;这几个Cs+(或Cl-)在空间构成的几何构型为 ;在每个Cs+周围距离相等且最近的Cs+共有 ;这几个Cs+(或Cl-)在空间构成的几何构型为 ;CsCl晶体8个立方体6 个正八面体2018/11/22(1)几何因素--正负离子的半径比(r+/r- )(2)电荷因素----正负离子的电荷比(3)键性因素----离子键的纯粹程度1.离子晶体中离子的配位数的决定因素2018/11/222.晶格能1.晶格能:拆开1mol离子晶体使之成为气态阳离子和气态负离子形成所吸收的能量.2.影响晶格能的因素:
(1)与正负离子电荷成正比
(2)与核间距成反比(与半径成反比)
3.晶格能与离子晶体的物理性质:
晶格能越大,离子晶体越稳定,熔沸点越高、硬度越大.2018/11/22 晶体中微粒的排列、个数的计算 在氯化钠晶体中,每个Na+周围与之最接近且距离相等的Cl-共有 个;这几个Cl-在空间构成的几何构型为 。6正八面体2018/11/22八、混合型晶体2018/11/22达标潜能练习1、下列不存在化学键的晶体是:
A.硝酸钾 B.干冰 C.石墨 D.固体氩
2、常温常压下的分子晶体是:
A.碘 B.水 C. 硫酸铵 D.干冰
3、同组物质中化学键类型相同、晶体类型也相
同的是:
A、I2 Ar N2 Si B、金刚石 O2 F2
C、Ba(OH)2 K2O CaCl2
D、HCHO CO2 C2H5OH2018/11/224、下列有关共价化合物的说:①具有较低的熔沸点
②不是电解质③固态时是分子晶体④都由分子构成
⑤液态时不导电,其中一定正确的说法是:
A.①③④ B.②⑤ C.⑤ D.全部正确
5、关于晶体的下列说法正确的是:
A、在晶体中只要有阴离子就一定有阳离子
B、在晶体中只要有阳离子就一定有阴离子
C、 原子晶体的熔点一定比金属晶体的高
D、分子晶体的熔点一定比金属晶体的低达标潜能练习2018/11/22达标潜能练习6、晶体中一个微粒周围有6个微粒,这种晶体是:A.金刚石 B.石墨 C.干冰 D.氯化钠
7、许多事实都证明氯化铝是分子晶体.请你设
计一个实验证实这一结论.实验方案为:
______________________________________
