江苏省淮安中学苏教版高中化学必修二专题一 微观结构与物质的多样性总复习课件(共53张PPT)
文档属性
| 名称 | 江苏省淮安中学苏教版高中化学必修二专题一 微观结构与物质的多样性总复习课件(共53张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 784.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-03-01 21:28:34 | ||
图片预览





文档简介
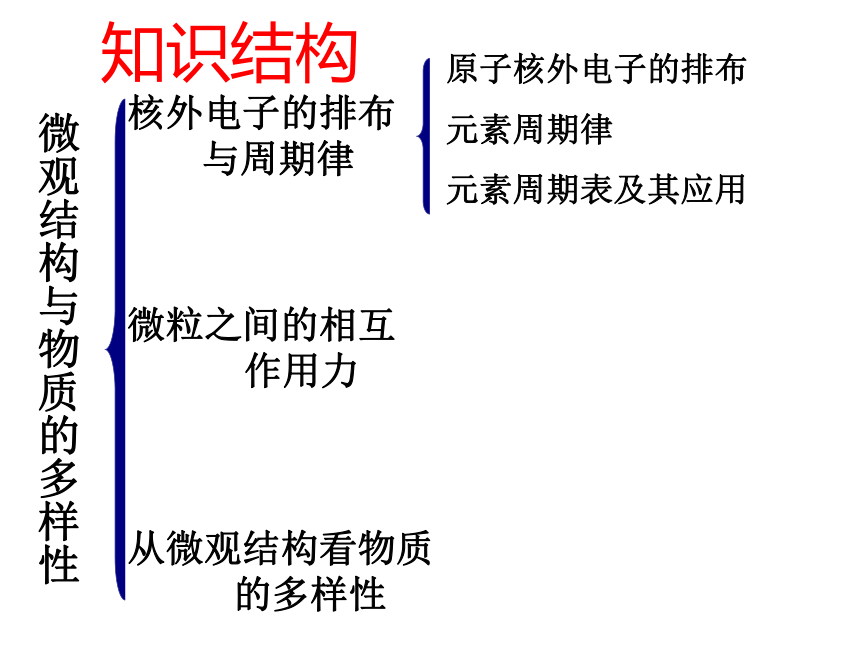
课件53张PPT。专题1.微观结构与物质的多样性复习课化学必修2知识结构微观结构与物质的多样性核外电子的排布
与周期律
微粒之间的相互
作用力
从微观结构看物质
的多样性原子核外电子的排布
元素周期律
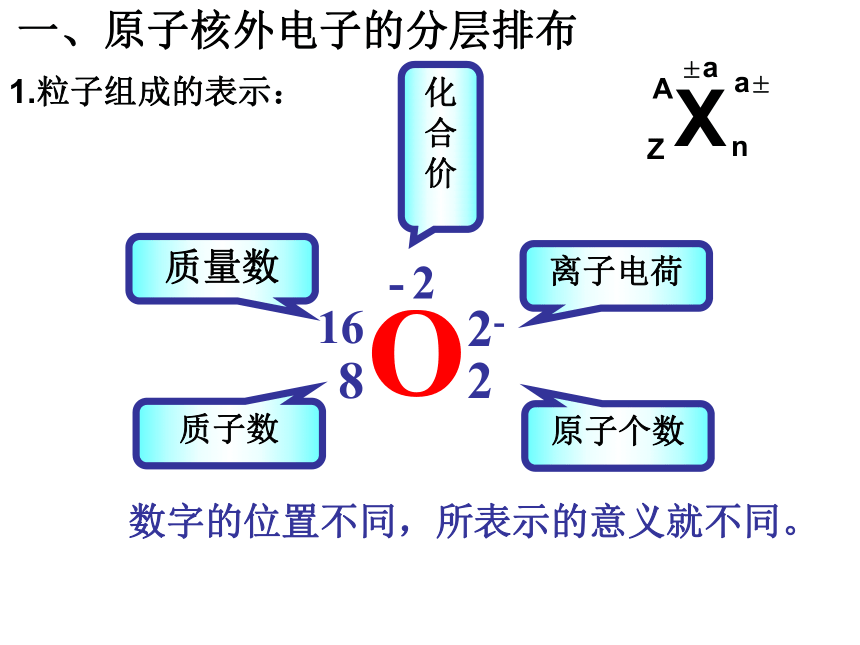
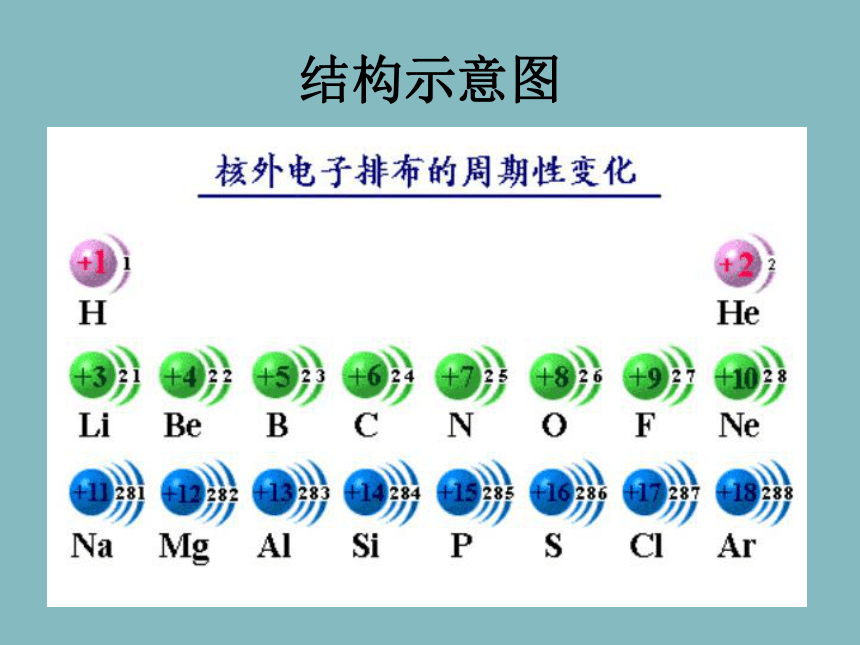
元素周期表及其应用O81622-- 2离子电荷原子个数质量数质子数化合价 数字的位置不同,所表示的意义就不同。1.粒子组成的表示:一、原子核外电子的分层排布 AXn±aZa±例4 136C— NMR(核磁共振)可以用于含碳化合物的结构分析,136C表示的碳原子( )
A.核外有13个电子,其中6个能参与成键
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
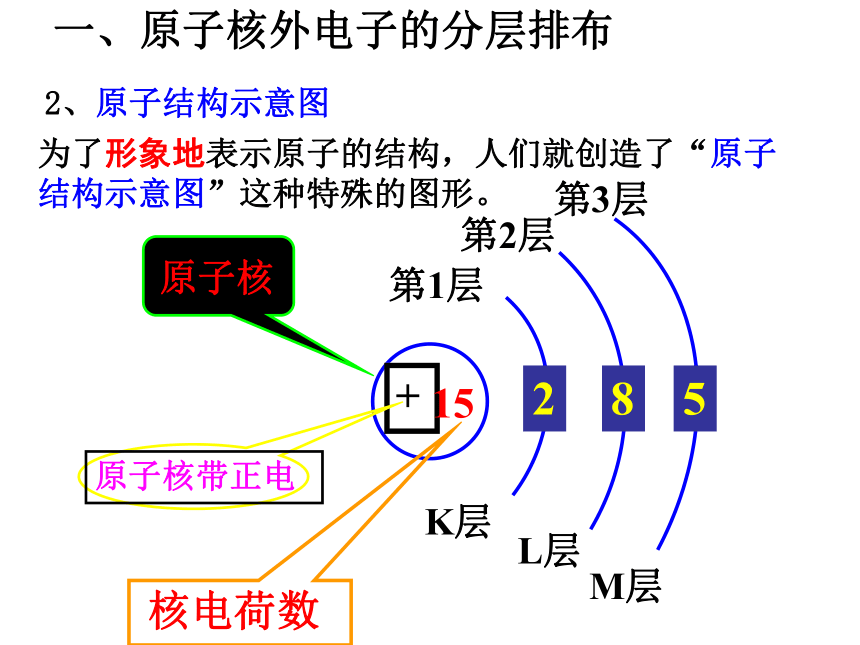
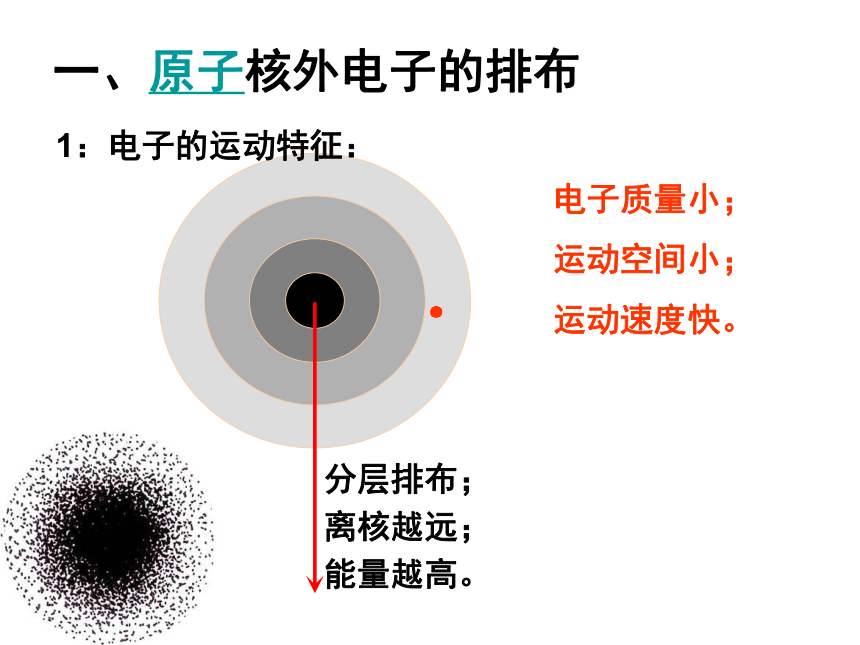
D一、原子核外电子的分层排布 2、原子结构示意图为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。+15第1层第2层第3层K层L层M层285结构示意图一、原子核外电子的排布1:电子的运动特征:电子质量小;
运动空间小;
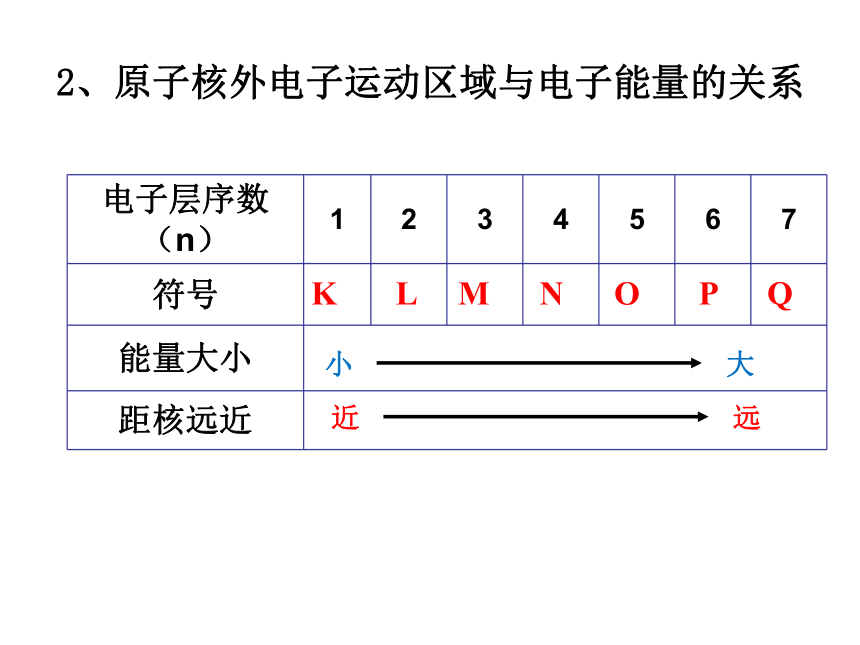
运动速度快。能量越高。离核越远;分层排布;K L M N O P Q 2、原子核外电子运动区域与电子能量的关系 3:原子核外电子排布规律分析P3表1-1,各稀有气体元素原子的最外层最多能容纳的电子数是多少?次外层呢?(1)各电子层最多容纳的电子数为2n2个。
(2)最外层电子数不超过8个(K层为最外
层不超过2个),次外层不超过18个(3)核外电子优先占有能量较低的轨道,
只有当能量较低的轨道排满后,再
排能量比较高的轨道。一最低、一最多、两不超课堂练习11.下列原子结构示意图中,正确的是:2.某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为:
A.14 B.15 C.16 D.17
3.下列叙述正确的是:
A.电子在原子核外作高速圆周运动
B. 次外层电子数一定是2或8
C.最外层只有一个电子的原子不一定是碱金属元素的原子BAC 元素的性质随着原子序数的递增
而呈现周期性的变化规律。 元素周期律是元素原子的核外电子排布随着元素
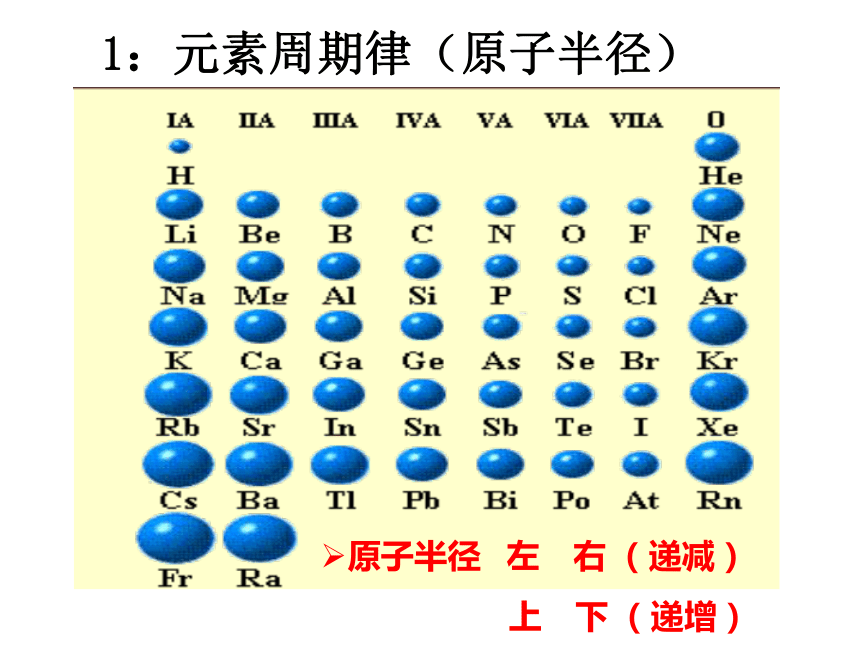
核电荷数的递增而呈现周期性的变化的必然结果。元素周期律——二:元 素 周 期 律19世纪中叶门捷列夫发现了元素周期律1:元素周期律(原子半径)原子半径 左 右( 递减 )
上 下( 递增 ) 微粒半径比较 1. 原子半径与离子半径关系: 原子半径<相应的阴离子半径 原子 半径>相应的阳离子半径 2.比较微粒大小的依据(三看) 一看电子层数:电子层数越多半径越大 如: Na>Na+ 二看核电荷数:电子层数相同,核电荷数越大半径越小 如: S2- > Cl- > Ar > K+ > Ca2+; 三看核外电子数:电子层和核电荷数都相同时,核外电 子数越多,半径越大。 如: Cl->Cl; Fe2+>Fe3+ 2:元素周期律(元素主要化合价)主要化合价 最高正价+1 +7(递增)(O、F,稀有气体除外)
最低负价-4 -1 (递增)(金属元素除外)最高正化合价+∣最低负化合价︱=8
最高正化合价=最外层电子数 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强,原子半径逐渐减小 金属性逐渐增强对应的碱碱性越强
原子半径逐渐增大
金属性逐渐增强 非金属性逐渐增强元素非金属性强弱的判断依据:单质从水(或酸)置换出氢越容易元素金属性强弱的判断依据:单质与氢气形成气态氢化物越容易,气态氢化物越稳定最高价氧化物水化物---碱的碱性越强最高价氧化物水化物---酸的酸性越强元素的金属性越强元素的非金属性越强课本P51.根据原子序数11~17的元素,用化学用语填写下列空白:
⑴与水反应最剧烈的元素的元素名称是 ,最高价氧化物的水化物碱性最强的碱是 ,原子半径最大的是 ,最活泼的非金属是 。
⑵金属性最强的元素是 ,非金属性最强的元素是 ,最稳定的气态氢化物是 ,16号元素氢化物的化学式为 。钠NaNaOHClNaClHClH2S3.某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为( )
A H2XO3 B HXO3 C H3XO4 D H2XO42.元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为
A.XY2 B.X2Y3 C.X3Y2 D.XY2BD4.A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。已知A的原子序数大于B的原子序数。则A、B、C三种离子半径大小的顺序是 ( ) A. B>A>C B. C>A>B
C.A>B>C D.C>B>A5.下列各组顺序的排列不正确的是 ( ) ( )
A.原子半径:Na<Mg<Cl
B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H2SiO3<H2CO3<H3PO4
D. 碱性强弱:Be(OH)2 < LiOH < KOH
AA核电核数越大半径越小副族B族:过渡金属 (第3、4、5、6、7
11、12列)16个族
元素周期表结构
短周期(第一、二、三周期)
(元素有2、8、8种) 长周期(第四、五、六周期)
(元素有18、18、32种)主族A族(第1、2、13、14、15、16、17列)不完全周期(第七周期)
(元素有26种多)三:元素周期表的结构7个周期零族(稀有气体)(第18列)
第VIII族(第8、9、10列)ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 课本P7元素性质的递变规律同周期(左→右)项 目核电荷数同主族(上→下)电子层数原子半径化 合 价 相 同 逐渐减小 最高正价:+1 →+7 逐渐增大 负化合价:- 4 → -1 增 大 增 多 逐渐增大 最高正价=族序数 负化合价= -(8-族序数) 逐渐减弱 逐渐增强 逐渐减弱 逐渐增强 金属性非金属性 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强③元素化学性质的递变规律逐渐↓逐渐↑ 最高正化合价=主族序数
最低负化合价=主族序数-8金属性逐渐↓
非金属性逐渐↑金属性逐渐↑
非金属性逐渐↓碱性逐渐↓
酸性逐渐↑碱性逐渐↑
酸性逐渐↓稳定性逐渐↑稳定性逐渐↓同周期元素的最高价氧化物对应水化物酸碱性同主族元素最高价氧化物对应水化物的酸碱性酸 性 增 强碱 性 增 强元素周期律及元素周期表的应用 ⑴ 根据位置,推测结构,预测性质 ⑵ 研究合成有特定性质的新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找半导体材料、催化剂、耐高温耐腐蚀材料。课本P9元素“位”、“构”、“性”三者关系结构金属原子半径大、最外层电子数少 易失电子 金属性强
非金属原子半径小、最外层电子数接近8 易得电子 非金属性强
最外层4个电子 不易得失电子 易形成共价化合物完成下表:33213第2周期36172第3周期第3周期ⅡA族ⅦA族 ⅥA族2.元素在周期表中的位置取决于( )
A.元素的原子半径 B.元素的化合价
C.元素原子的电子层数 D.元素原子的最外层电子数3.右图是周期表中的一部份都属于主族元素,位置如图所示,下列叙述不正确的是( )A.最高价氧化物对应的水化物的酸性A < C < B
B.原子半径A > B > C
C.三种元素非金属性最强的为B
D.金属性B < C < A4.某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于( )
A.第二周期 B.第三周期
C.ⅣA族 D.ⅥA族CDBAC5.下列各组元素按最高正化合价递增排列的是 A.Na 、F、N B.Li、C、B C.Be、Na、Mg D.Al、C、ND最外层电子数
第二单元. 微粒之间的相互作用力共 价 键离 子 键 成 键微 粒成键元素电子式 原 子阴、阳离子原子间共用电子对阴、阳离子间静电作用活泼金属元素/铵根离子与活泼非金属元素/非金属离子团成键本质相同或不同的非金属元素(通常)例如:例如:在元素符号周围用小黑点(或×)来表示元素的最外层电子,这种式子叫电子式。
例如:离子化合物的电子式1 ﹑阴离子和复杂阳离子要标明最外层电子,并要用[]括起来,在右上角要注明负电荷数,阳离子只要在右上角要注明正电荷数
2 ﹑相同的离子要对称分布,不要合并
3 ﹑化学式中有三个或三个以上的阴﹑阳离子要尽量对称排列共价分子的电子式写法:1、共价分子的电子式不标电荷。
2、原子最外层电子达到稳定结构。
3、明确标出所有原子的最外层电子。
如:HCl分子共价分子的结构式:
原子间用一条短线表示一对共用电子对所得到的式子称为结构式。
如:HCl分子H—Cl课本P14碳原子之间可以形成碳碳单键,碳碳双键,碳碳三键。碳原子之间不仅可以通过共价键彼此结合形成碳链,也可以连接形成碳环。碳原子可以稳定地形成四个共价键碳原子的共价键特点课本P14-151.指出下列化合物所含化学键类型:NaBr、MgO、H2S、NaOH、SO2 、H2
属于离子化合物的有: 属属于共价化合物的有: .
判断对错:
1、含有共价键的化合物一定是共价化合物。
2、共价化合物只含共价键。
3、含有离子键的化合物一定是离子化合物。
4、离子化合物可以含共价键。
5、只含有共价键的物质一定是共价化合物。
6、氦气是共价化合物。 错(NaOH)错(H2)对错对对(NaOH)NaBr、NaOH、 MgOH2S 、SO22.下列说法正确的是:( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低 DNa2O2是_____(“离子”或“共价”)化合物,其电子式为______。H2O2是_____(“离子”或“共价”)化合物,其电子式为______。离子共价4.下列电子式中错误的是( )
A、 Na+ B、
C、 D、 C3.写出下列粒子的电子式,并写出共价分子的结构式:
Ca2+ NH3
MgO NaOH HCl
5.下列性质可以证明化合物内一定存在离子键的是
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态下能导电 6.下列说法正确的是
A.离子化合物中可能含共价键 B.共价化合物中可能含离子键
C.离子化合物中只含离子键 D.离子化合物一定含金属元素DA7.下列各组物质中,都属共价化合物的是( )
(A)H2S和Na2O2 (B)Na2SO4和HClO
(C)NH3和H2O (D)H2O2和CaF2C存在:________概念:分子间存在的将分子聚集在一起
的作用力称为分子间作用力,
又称为范德华力。大小:________________意义:______________________________分子间比化学键弱得多影响物质的熔沸点和溶解性等物理性质特点:三、分子间作用力课本P15化学键与分子间作用力的比较原子间
离子间
强烈化学性质分子间较弱物理性质不同晶体的结构与性质:阴,阳离子原子分子低金刚石,晶体硅,二氧化硅共价键分子间作用力离子键高较高绝大多数非金属单质,非金属氧化物,含氧酸,气态氢化物,大部分有机物大部分盐,强碱,活泼金属氧化物课本P221.下列变化中,不需要破坏化学键的是( )
A、氯化氢溶于水
B、加热氯酸钾使其分解
C、碘升华
D、氯化钠溶于水C2.下列元素的原子在形成不同物质时,既能形成离子键,又能形成共价键的是 ( )
A、K B、Ca
C、Cl D、NeC3.共价键、离子键、分子间作用力都是粒子间的作用力,含有以上两种作用力的晶体是 ( )
A、H2O B、CCl4
C、NaCl D、NaOHABD4.、将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用①共价键 ②离子键 ③分子间作用力,正确的顺序是
A、①②②③ B、②①②③
C、②③②① D、①①②③5.. 下列各组物质的晶体中,化学键类型和晶体类型都相同的是
SO2和SiO2 B. NaCl和HCl
C. CO2和H2O D. CCl4和CaCl26.. 实现下列变化时,需克服相同类型作用力的是
A. 二氧化硅和干冰的熔化 B. 液溴和氯化铵气化
C. 食盐和冰的熔化 D. 纯碱和烧碱的熔化BCD7.氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时所克服的微粒见的作用力与氮化硼熔化所克服的微粒见的作用力都相同的是
A.氯化钠和金刚石 B.晶体硅和二氧化硅
C.冰和干冰 D.二氧化硫和二氧化硅B知识结构微观结构与物质的多样性核外电子的排布
与周期律
微粒之间的相互
作用力
从微观结构看物质
的多样性原子核外电子的排布
元素周期律
元素周期表及其应用离子键
共价键
分子间作用力同素异形现象
同分异构现象
不同类型的晶体原子通常为非金属通常在非金属元素
的原子间,如NH3、
H2SO4、HNO3、H2O 相邻的原子间强烈的相互作用把分子聚集在一起的作用力分子内原子间分子之间较 强与化学键相比弱的多主要影响化学性质主要影响物理性质(如熔沸点)化学键与分子间作用力的比较天然最硬物质最软矿物之一很高很高导电不导电装饰品
切割玻璃、大理石
钻探机钻头铅笔芯 H.B
电极、坩埚臭氧与氧气的性质对比无色无味气体特殊臭味淡蓝色气体不易溶于水比O2易溶于水强氧化性、不稳定性、漂白、杀菌消毒呼吸、燃烧等脱色剂、消毒剂主要是由于氧原子的个数和氧原子排列方式的不同引起的
阴阳离子
原子分子金属阳离子
和自由电子离子键共价键分子间
作用力金属键较硬很硬较小较高高较低一般较大部分小
与周期律
微粒之间的相互
作用力
从微观结构看物质
的多样性原子核外电子的排布
元素周期律
元素周期表及其应用O81622-- 2离子电荷原子个数质量数质子数化合价 数字的位置不同,所表示的意义就不同。1.粒子组成的表示:一、原子核外电子的分层排布 AXn±aZa±例4 136C— NMR(核磁共振)可以用于含碳化合物的结构分析,136C表示的碳原子( )
A.核外有13个电子,其中6个能参与成键
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
D一、原子核外电子的分层排布 2、原子结构示意图为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。+15第1层第2层第3层K层L层M层285结构示意图一、原子核外电子的排布1:电子的运动特征:电子质量小;
运动空间小;
运动速度快。能量越高。离核越远;分层排布;K L M N O P Q 2、原子核外电子运动区域与电子能量的关系 3:原子核外电子排布规律分析P3表1-1,各稀有气体元素原子的最外层最多能容纳的电子数是多少?次外层呢?(1)各电子层最多容纳的电子数为2n2个。
(2)最外层电子数不超过8个(K层为最外
层不超过2个),次外层不超过18个(3)核外电子优先占有能量较低的轨道,
只有当能量较低的轨道排满后,再
排能量比较高的轨道。一最低、一最多、两不超课堂练习11.下列原子结构示意图中,正确的是:2.某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为:
A.14 B.15 C.16 D.17
3.下列叙述正确的是:
A.电子在原子核外作高速圆周运动
B. 次外层电子数一定是2或8
C.最外层只有一个电子的原子不一定是碱金属元素的原子BAC 元素的性质随着原子序数的递增
而呈现周期性的变化规律。 元素周期律是元素原子的核外电子排布随着元素
核电荷数的递增而呈现周期性的变化的必然结果。元素周期律——二:元 素 周 期 律19世纪中叶门捷列夫发现了元素周期律1:元素周期律(原子半径)原子半径 左 右( 递减 )
上 下( 递增 ) 微粒半径比较 1. 原子半径与离子半径关系: 原子半径<相应的阴离子半径 原子 半径>相应的阳离子半径 2.比较微粒大小的依据(三看) 一看电子层数:电子层数越多半径越大 如: Na>Na+ 二看核电荷数:电子层数相同,核电荷数越大半径越小 如: S2- > Cl- > Ar > K+ > Ca2+; 三看核外电子数:电子层和核电荷数都相同时,核外电 子数越多,半径越大。 如: Cl->Cl; Fe2+>Fe3+ 2:元素周期律(元素主要化合价)主要化合价 最高正价+1 +7(递增)(O、F,稀有气体除外)
最低负价-4 -1 (递增)(金属元素除外)最高正化合价+∣最低负化合价︱=8
最高正化合价=最外层电子数 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强,原子半径逐渐减小 金属性逐渐增强对应的碱碱性越强
原子半径逐渐增大
金属性逐渐增强 非金属性逐渐增强元素非金属性强弱的判断依据:单质从水(或酸)置换出氢越容易元素金属性强弱的判断依据:单质与氢气形成气态氢化物越容易,气态氢化物越稳定最高价氧化物水化物---碱的碱性越强最高价氧化物水化物---酸的酸性越强元素的金属性越强元素的非金属性越强课本P51.根据原子序数11~17的元素,用化学用语填写下列空白:
⑴与水反应最剧烈的元素的元素名称是 ,最高价氧化物的水化物碱性最强的碱是 ,原子半径最大的是 ,最活泼的非金属是 。
⑵金属性最强的元素是 ,非金属性最强的元素是 ,最稳定的气态氢化物是 ,16号元素氢化物的化学式为 。钠NaNaOHClNaClHClH2S3.某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为( )
A H2XO3 B HXO3 C H3XO4 D H2XO42.元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为
A.XY2 B.X2Y3 C.X3Y2 D.XY2BD4.A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。已知A的原子序数大于B的原子序数。则A、B、C三种离子半径大小的顺序是 ( ) A. B>A>C B. C>A>B
C.A>B>C D.C>B>A5.下列各组顺序的排列不正确的是 ( ) ( )
A.原子半径:Na<Mg<Cl
B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H2SiO3<H2CO3<H3PO4
D. 碱性强弱:Be(OH)2 < LiOH < KOH
AA核电核数越大半径越小副族B族:过渡金属 (第3、4、5、6、7
11、12列)16个族
元素周期表结构
短周期(第一、二、三周期)
(元素有2、8、8种) 长周期(第四、五、六周期)
(元素有18、18、32种)主族A族(第1、2、13、14、15、16、17列)不完全周期(第七周期)
(元素有26种多)三:元素周期表的结构7个周期零族(稀有气体)(第18列)
第VIII族(第8、9、10列)ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 课本P7元素性质的递变规律同周期(左→右)项 目核电荷数同主族(上→下)电子层数原子半径化 合 价 相 同 逐渐减小 最高正价:+1 →+7 逐渐增大 负化合价:- 4 → -1 增 大 增 多 逐渐增大 最高正价=族序数 负化合价= -(8-族序数) 逐渐减弱 逐渐增强 逐渐减弱 逐渐增强 金属性非金属性 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强③元素化学性质的递变规律逐渐↓逐渐↑ 最高正化合价=主族序数
最低负化合价=主族序数-8金属性逐渐↓
非金属性逐渐↑金属性逐渐↑
非金属性逐渐↓碱性逐渐↓
酸性逐渐↑碱性逐渐↑
酸性逐渐↓稳定性逐渐↑稳定性逐渐↓同周期元素的最高价氧化物对应水化物酸碱性同主族元素最高价氧化物对应水化物的酸碱性酸 性 增 强碱 性 增 强元素周期律及元素周期表的应用 ⑴ 根据位置,推测结构,预测性质 ⑵ 研究合成有特定性质的新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找半导体材料、催化剂、耐高温耐腐蚀材料。课本P9元素“位”、“构”、“性”三者关系结构金属原子半径大、最外层电子数少 易失电子 金属性强
非金属原子半径小、最外层电子数接近8 易得电子 非金属性强
最外层4个电子 不易得失电子 易形成共价化合物完成下表:33213第2周期36172第3周期第3周期ⅡA族ⅦA族 ⅥA族2.元素在周期表中的位置取决于( )
A.元素的原子半径 B.元素的化合价
C.元素原子的电子层数 D.元素原子的最外层电子数3.右图是周期表中的一部份都属于主族元素,位置如图所示,下列叙述不正确的是( )A.最高价氧化物对应的水化物的酸性A < C < B
B.原子半径A > B > C
C.三种元素非金属性最强的为B
D.金属性B < C < A4.某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于( )
A.第二周期 B.第三周期
C.ⅣA族 D.ⅥA族CDBAC5.下列各组元素按最高正化合价递增排列的是 A.Na 、F、N B.Li、C、B C.Be、Na、Mg D.Al、C、ND最外层电子数
第二单元. 微粒之间的相互作用力共 价 键离 子 键 成 键微 粒成键元素电子式 原 子阴、阳离子原子间共用电子对阴、阳离子间静电作用活泼金属元素/铵根离子与活泼非金属元素/非金属离子团成键本质相同或不同的非金属元素(通常)例如:例如:在元素符号周围用小黑点(或×)来表示元素的最外层电子,这种式子叫电子式。
例如:离子化合物的电子式1 ﹑阴离子和复杂阳离子要标明最外层电子,并要用[]括起来,在右上角要注明负电荷数,阳离子只要在右上角要注明正电荷数
2 ﹑相同的离子要对称分布,不要合并
3 ﹑化学式中有三个或三个以上的阴﹑阳离子要尽量对称排列共价分子的电子式写法:1、共价分子的电子式不标电荷。
2、原子最外层电子达到稳定结构。
3、明确标出所有原子的最外层电子。
如:HCl分子共价分子的结构式:
原子间用一条短线表示一对共用电子对所得到的式子称为结构式。
如:HCl分子H—Cl课本P14碳原子之间可以形成碳碳单键,碳碳双键,碳碳三键。碳原子之间不仅可以通过共价键彼此结合形成碳链,也可以连接形成碳环。碳原子可以稳定地形成四个共价键碳原子的共价键特点课本P14-151.指出下列化合物所含化学键类型:NaBr、MgO、H2S、NaOH、SO2 、H2
属于离子化合物的有: 属属于共价化合物的有: .
判断对错:
1、含有共价键的化合物一定是共价化合物。
2、共价化合物只含共价键。
3、含有离子键的化合物一定是离子化合物。
4、离子化合物可以含共价键。
5、只含有共价键的物质一定是共价化合物。
6、氦气是共价化合物。 错(NaOH)错(H2)对错对对(NaOH)NaBr、NaOH、 MgOH2S 、SO22.下列说法正确的是:( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低 DNa2O2是_____(“离子”或“共价”)化合物,其电子式为______。H2O2是_____(“离子”或“共价”)化合物,其电子式为______。离子共价4.下列电子式中错误的是( )
A、 Na+ B、
C、 D、 C3.写出下列粒子的电子式,并写出共价分子的结构式:
Ca2+ NH3
MgO NaOH HCl
5.下列性质可以证明化合物内一定存在离子键的是
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态下能导电 6.下列说法正确的是
A.离子化合物中可能含共价键 B.共价化合物中可能含离子键
C.离子化合物中只含离子键 D.离子化合物一定含金属元素DA7.下列各组物质中,都属共价化合物的是( )
(A)H2S和Na2O2 (B)Na2SO4和HClO
(C)NH3和H2O (D)H2O2和CaF2C存在:________概念:分子间存在的将分子聚集在一起
的作用力称为分子间作用力,
又称为范德华力。大小:________________意义:______________________________分子间比化学键弱得多影响物质的熔沸点和溶解性等物理性质特点:三、分子间作用力课本P15化学键与分子间作用力的比较原子间
离子间
强烈化学性质分子间较弱物理性质不同晶体的结构与性质:阴,阳离子原子分子低金刚石,晶体硅,二氧化硅共价键分子间作用力离子键高较高绝大多数非金属单质,非金属氧化物,含氧酸,气态氢化物,大部分有机物大部分盐,强碱,活泼金属氧化物课本P221.下列变化中,不需要破坏化学键的是( )
A、氯化氢溶于水
B、加热氯酸钾使其分解
C、碘升华
D、氯化钠溶于水C2.下列元素的原子在形成不同物质时,既能形成离子键,又能形成共价键的是 ( )
A、K B、Ca
C、Cl D、NeC3.共价键、离子键、分子间作用力都是粒子间的作用力,含有以上两种作用力的晶体是 ( )
A、H2O B、CCl4
C、NaCl D、NaOHABD4.、将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用①共价键 ②离子键 ③分子间作用力,正确的顺序是
A、①②②③ B、②①②③
C、②③②① D、①①②③5.. 下列各组物质的晶体中,化学键类型和晶体类型都相同的是
SO2和SiO2 B. NaCl和HCl
C. CO2和H2O D. CCl4和CaCl26.. 实现下列变化时,需克服相同类型作用力的是
A. 二氧化硅和干冰的熔化 B. 液溴和氯化铵气化
C. 食盐和冰的熔化 D. 纯碱和烧碱的熔化BCD7.氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时所克服的微粒见的作用力与氮化硼熔化所克服的微粒见的作用力都相同的是
A.氯化钠和金刚石 B.晶体硅和二氧化硅
C.冰和干冰 D.二氧化硫和二氧化硅B知识结构微观结构与物质的多样性核外电子的排布
与周期律
微粒之间的相互
作用力
从微观结构看物质
的多样性原子核外电子的排布
元素周期律
元素周期表及其应用离子键
共价键
分子间作用力同素异形现象
同分异构现象
不同类型的晶体原子通常为非金属通常在非金属元素
的原子间,如NH3、
H2SO4、HNO3、H2O 相邻的原子间强烈的相互作用把分子聚集在一起的作用力分子内原子间分子之间较 强与化学键相比弱的多主要影响化学性质主要影响物理性质(如熔沸点)化学键与分子间作用力的比较天然最硬物质最软矿物之一很高很高导电不导电装饰品
切割玻璃、大理石
钻探机钻头铅笔芯 H.B
电极、坩埚臭氧与氧气的性质对比无色无味气体特殊臭味淡蓝色气体不易溶于水比O2易溶于水强氧化性、不稳定性、漂白、杀菌消毒呼吸、燃烧等脱色剂、消毒剂主要是由于氧原子的个数和氧原子排列方式的不同引起的
阴阳离子
原子分子金属阳离子
和自由电子离子键共价键分子间
作用力金属键较硬很硬较小较高高较低一般较大部分小
