江苏省淮安中学苏教版高中化学必修一 专题1化学家眼中的物质世界专题优化总结课件(共33张PPT)
文档属性
| 名称 | 江苏省淮安中学苏教版高中化学必修一 专题1化学家眼中的物质世界专题优化总结课件(共33张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 371.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-03-01 00:00:00 | ||
图片预览







文档简介
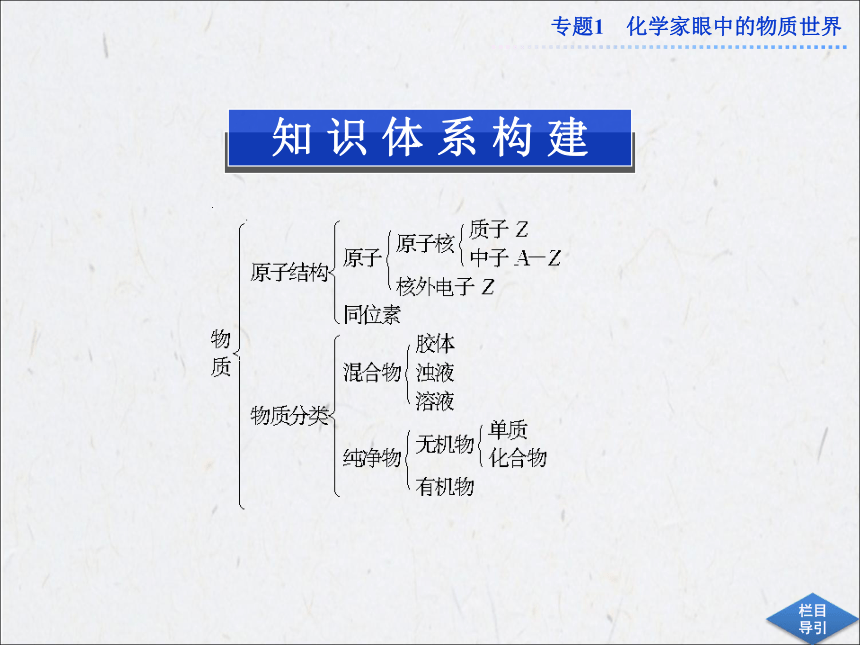
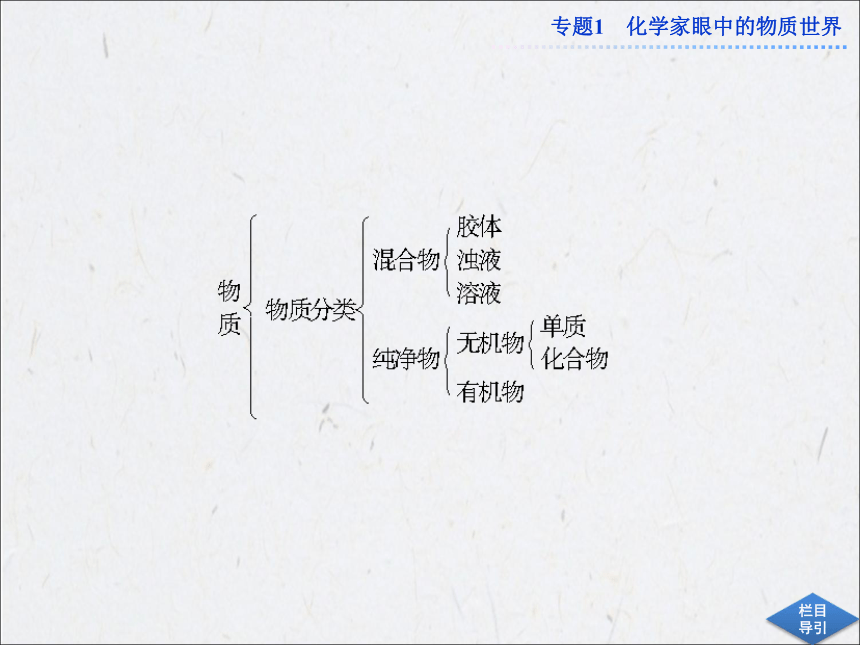
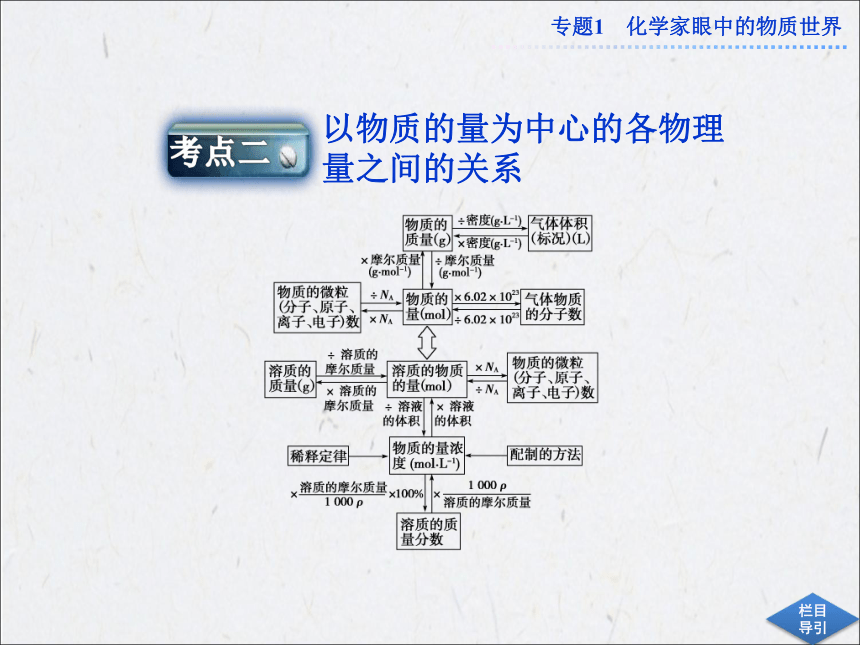
课件33张PPT。专题优化总结专题1 化学家眼中的物质世界物质的分类方法依据很多,按不同的分类方法对同一物质进行分类,得出的类别名称不同。
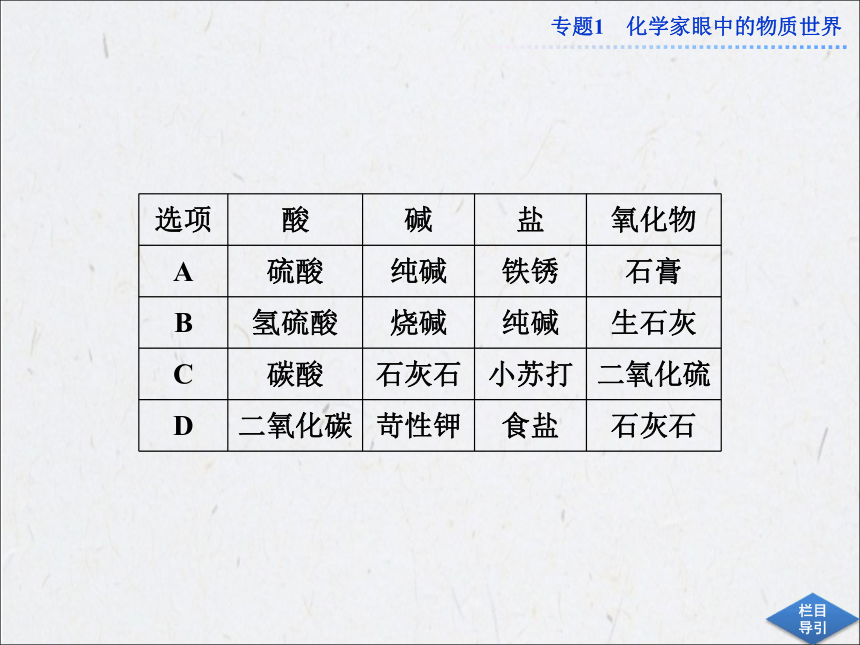
下列各组物质分类正确的是( )
【解析】 本题需要熟悉一些常见化合物的俗名。纯碱是Na2CO3,属于盐类;石膏是CaSO4,属于盐类;铁锈是Fe2O3,属于氧化物,A项错误;生石灰是CaO,属于氧化物,B项正确;石灰石是CaCO3,属于盐类,C项错误;二氧化碳属于氧化物,石灰石是CaCO3,属于盐,D项错误。
【答案】 B
设NA为阿伏加德罗常数,下列叙述正确的是( )
A.64 g二氧化硫含有原子数为3NA
B.1 L 1 mol·L-1的氯化钠溶液中,所含离子数为NA
C.标准状况下,11.2 L水所含分子数为0.5NA
D.常温常压下,0.1NA个H2O分子的质量为18 g
【答案】 A巩固练习
1.标准状况下350 L的氨气溶解在1 L的水
中,这种氨水的物质的量浓度为________。(氨水密度为0.924 g·cm-3)
解析:本题综合考查物质的量、气体摩尔体积和物质的量浓度。熟练掌握有关计算是十分必要的。
根据物质的量浓度求算公式列式如下:
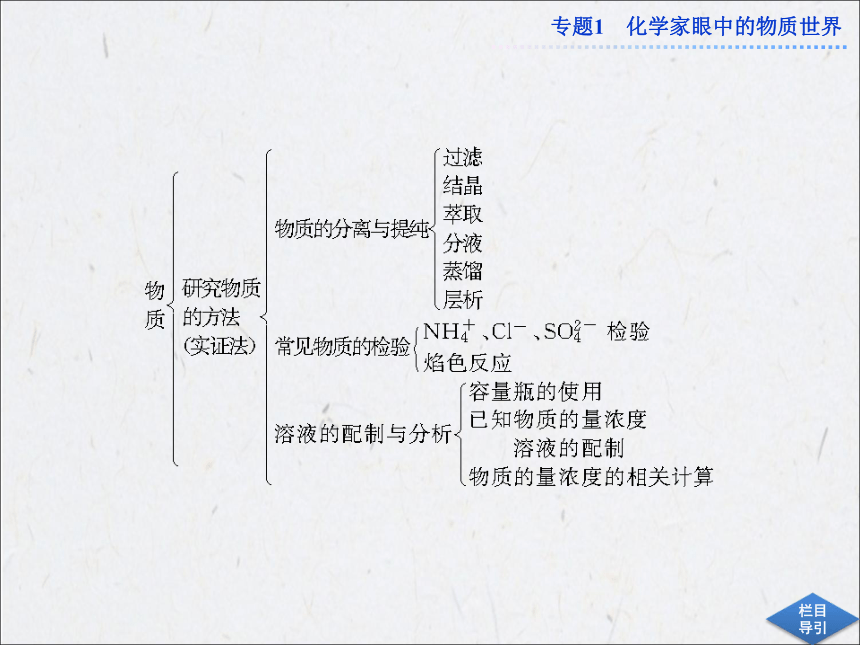
答案:11.4 mol·L-11.化学实验的基本知识包括仪器的使用、基本操作以及观察、分析、描述实验现象的能力,是化学实验题中的必考内容。题型以选择题、填空题为主,既有常规仪器的规格和使用方法的考查,又有对正误操作的辨析及具体实验操作方法的叙述等。
2.物质的检验、分离和提纯一直是高考的
热点,有如下考查方式:①常见离子的检验方法;②选择适当试剂及分离方法,除去指定杂质;③除杂时试剂的加入顺序;④过
滤、蒸发、分液的操作;⑤综合实验。
(3)对下列各组物质可按照溶解、过滤、蒸发的实验操作顺序将它们分离的是________(填序号)。
①NaNO3和NaCl;②CaCl2和CaCO3;③MnO2和KCl; ④BaSO4和AgCl。
【解析】 (1)NaNO3和KNO3都溶于水,但溶解度不同,可用结晶法来提纯。④中两者都难溶,故①④均不能用指定的方法分离。②中CaCl2易溶而CaCO3难溶,③中MnO2难溶而KCl易溶,故②③可用指定方法分离。
【答案】 (1)溶解 过滤 (2)BaCl2[或
Ba(OH)2]、K2CO3、HCl (3)②③
巩固练习
3.下列有关实验的叙述,正确的是( )
A.用量筒量取5.0 mL 1.00 mol·L-1盐酸于50 mL容量瓶中,加水稀释至刻度可配制0.100 mol·L-1盐酸
B.用10 mL的量筒准确量取9.50 mL水
C.向碘水中加入CCl4,振荡静置后分层, CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
D.稀释浓硫酸时将水倒入浓硫酸中进行搅拌
解析:选C。配制溶液要先在烧杯中将盐酸稀释并冷却至室温再转移到容量瓶中,A项不正确;量筒只是一种粗量仪器,10 mL的量筒仅能精确到0.1 mL,故要量取9.50 mL水需精确度更高的仪器,B项不正确;浓硫酸稀释时,应将浓硫酸沿烧杯内壁倒入盛有水的烧杯中,并用玻璃棒不断搅拌,D项不正确。
4.现有A、B、C、D、E、F六瓶无色溶液,分别为酚酞、NaOH溶液、(NH4)2SO4溶液、BaCl2溶液、Na2SO4溶液和盐酸中的一种。进行有关实验后得到如下现象:
①A、B两溶液混合后溶液呈红色
②取A溶液分别加入C、D、E、F中并加热,发现没有任何现象产生
回答下列问题:
(1)根据上述实验,你能得出什么结论?____________________________________。
(2)在不添加任何其他试剂的情况下,其他物质能否一一区分开?_________________。
若能,请你写出实验方法、现象和相应的结论;若不能,以下不必回答。
①________________;
②________________;
③________________;
④________________。(不必填满)
解析:根据①A、B两溶液混合后溶液呈红
色,说明A、B一定是酚酞、NaOH溶液之一;根据②取A溶液分别加入C、D、E、F中并加热,发现没有任何现象产生,说明A为酚酞,因为若A为NaOH溶液,则一定会与其中的(NH4)2SO4反应并产生具有刺激性气味的气体,故B为NaOH溶液。
答案:(1)A为酚酞,B为NaOH溶液
(2)能 ①将B溶液依次加入另外四种溶液中
并加热,有刺激性气味气体产生的为
(NH4)2SO4溶液
②将(NH4)2SO4溶液依次加入另外三种溶液
中,有白色沉淀产生的是BaCl2溶液
③将BaCl2溶液依次加入另外两种溶液中,有白色沉淀产生的是Na2SO4溶液,没有明显现象的是盐酸
1.原子核外电子排布规律
2.原子结构中各微粒数之间的关系
3.核素、同位素、元素的区别与联系
有A、B、C、D、E五种元素,它们原子的核电荷数依次增加且均小于18;A原子核内仅有1个质子;B原子的电子总数与D原子的最外层电子数相等; A原子与B原子的最外层电子数和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍;E元素的最外层电子数是其电子层数的三分之一。
(1)试推断它们各是什么元素,写出它们的元素符号:A__________、B__________、C_________、D_________、E__________。
(2)写出A分别与B、C、D形成化合物的化学式:________、________、________。
(3)B的原子结构示意图为________,D的离子结构示意图为________。
(4)B和D形成的化合物甲能与A、D、E形成的化合物乙反应,则甲与过量的乙溶液反应的化学方程式为_______________________.【解析】 A原子核内仅有1个质子,为H;D原子有两个电子层,内层电子数为2,由其最外层电子数为6知为O;E元素的最外层电子数是其电子层数的三分之一,只能是三个电子层,最外层有1个电子,为Na;B原子的电子总数与D原子的最外层电子数相等,即6个,故B为C;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等,即C为N。
(4)B和D形成CO和CO2两种气体,A、D、E形成的化合物乙为NaOH,能与NaOH溶液反应的是CO2,即甲为CO2,甲与过量的乙溶液反应的化学方程式为CO2+2NaOH===
Na2CO3+H2O。
【答案】 (1)H C N O Na
(2)CH4 NH3 H2O (3)
(4)CO2+2NaOH===Na2CO3+H2O
下列各组物质分类正确的是( )
【解析】 本题需要熟悉一些常见化合物的俗名。纯碱是Na2CO3,属于盐类;石膏是CaSO4,属于盐类;铁锈是Fe2O3,属于氧化物,A项错误;生石灰是CaO,属于氧化物,B项正确;石灰石是CaCO3,属于盐类,C项错误;二氧化碳属于氧化物,石灰石是CaCO3,属于盐,D项错误。
【答案】 B
设NA为阿伏加德罗常数,下列叙述正确的是( )
A.64 g二氧化硫含有原子数为3NA
B.1 L 1 mol·L-1的氯化钠溶液中,所含离子数为NA
C.标准状况下,11.2 L水所含分子数为0.5NA
D.常温常压下,0.1NA个H2O分子的质量为18 g
【答案】 A巩固练习
1.标准状况下350 L的氨气溶解在1 L的水
中,这种氨水的物质的量浓度为________。(氨水密度为0.924 g·cm-3)
解析:本题综合考查物质的量、气体摩尔体积和物质的量浓度。熟练掌握有关计算是十分必要的。
根据物质的量浓度求算公式列式如下:
答案:11.4 mol·L-11.化学实验的基本知识包括仪器的使用、基本操作以及观察、分析、描述实验现象的能力,是化学实验题中的必考内容。题型以选择题、填空题为主,既有常规仪器的规格和使用方法的考查,又有对正误操作的辨析及具体实验操作方法的叙述等。
2.物质的检验、分离和提纯一直是高考的
热点,有如下考查方式:①常见离子的检验方法;②选择适当试剂及分离方法,除去指定杂质;③除杂时试剂的加入顺序;④过
滤、蒸发、分液的操作;⑤综合实验。
(3)对下列各组物质可按照溶解、过滤、蒸发的实验操作顺序将它们分离的是________(填序号)。
①NaNO3和NaCl;②CaCl2和CaCO3;③MnO2和KCl; ④BaSO4和AgCl。
【解析】 (1)NaNO3和KNO3都溶于水,但溶解度不同,可用结晶法来提纯。④中两者都难溶,故①④均不能用指定的方法分离。②中CaCl2易溶而CaCO3难溶,③中MnO2难溶而KCl易溶,故②③可用指定方法分离。
【答案】 (1)溶解 过滤 (2)BaCl2[或
Ba(OH)2]、K2CO3、HCl (3)②③
巩固练习
3.下列有关实验的叙述,正确的是( )
A.用量筒量取5.0 mL 1.00 mol·L-1盐酸于50 mL容量瓶中,加水稀释至刻度可配制0.100 mol·L-1盐酸
B.用10 mL的量筒准确量取9.50 mL水
C.向碘水中加入CCl4,振荡静置后分层, CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
D.稀释浓硫酸时将水倒入浓硫酸中进行搅拌
解析:选C。配制溶液要先在烧杯中将盐酸稀释并冷却至室温再转移到容量瓶中,A项不正确;量筒只是一种粗量仪器,10 mL的量筒仅能精确到0.1 mL,故要量取9.50 mL水需精确度更高的仪器,B项不正确;浓硫酸稀释时,应将浓硫酸沿烧杯内壁倒入盛有水的烧杯中,并用玻璃棒不断搅拌,D项不正确。
4.现有A、B、C、D、E、F六瓶无色溶液,分别为酚酞、NaOH溶液、(NH4)2SO4溶液、BaCl2溶液、Na2SO4溶液和盐酸中的一种。进行有关实验后得到如下现象:
①A、B两溶液混合后溶液呈红色
②取A溶液分别加入C、D、E、F中并加热,发现没有任何现象产生
回答下列问题:
(1)根据上述实验,你能得出什么结论?____________________________________。
(2)在不添加任何其他试剂的情况下,其他物质能否一一区分开?_________________。
若能,请你写出实验方法、现象和相应的结论;若不能,以下不必回答。
①________________;
②________________;
③________________;
④________________。(不必填满)
解析:根据①A、B两溶液混合后溶液呈红
色,说明A、B一定是酚酞、NaOH溶液之一;根据②取A溶液分别加入C、D、E、F中并加热,发现没有任何现象产生,说明A为酚酞,因为若A为NaOH溶液,则一定会与其中的(NH4)2SO4反应并产生具有刺激性气味的气体,故B为NaOH溶液。
答案:(1)A为酚酞,B为NaOH溶液
(2)能 ①将B溶液依次加入另外四种溶液中
并加热,有刺激性气味气体产生的为
(NH4)2SO4溶液
②将(NH4)2SO4溶液依次加入另外三种溶液
中,有白色沉淀产生的是BaCl2溶液
③将BaCl2溶液依次加入另外两种溶液中,有白色沉淀产生的是Na2SO4溶液,没有明显现象的是盐酸
1.原子核外电子排布规律
2.原子结构中各微粒数之间的关系
3.核素、同位素、元素的区别与联系
有A、B、C、D、E五种元素,它们原子的核电荷数依次增加且均小于18;A原子核内仅有1个质子;B原子的电子总数与D原子的最外层电子数相等; A原子与B原子的最外层电子数和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍;E元素的最外层电子数是其电子层数的三分之一。
(1)试推断它们各是什么元素,写出它们的元素符号:A__________、B__________、C_________、D_________、E__________。
(2)写出A分别与B、C、D形成化合物的化学式:________、________、________。
(3)B的原子结构示意图为________,D的离子结构示意图为________。
(4)B和D形成的化合物甲能与A、D、E形成的化合物乙反应,则甲与过量的乙溶液反应的化学方程式为_______________________.【解析】 A原子核内仅有1个质子,为H;D原子有两个电子层,内层电子数为2,由其最外层电子数为6知为O;E元素的最外层电子数是其电子层数的三分之一,只能是三个电子层,最外层有1个电子,为Na;B原子的电子总数与D原子的最外层电子数相等,即6个,故B为C;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等,即C为N。
(4)B和D形成CO和CO2两种气体,A、D、E形成的化合物乙为NaOH,能与NaOH溶液反应的是CO2,即甲为CO2,甲与过量的乙溶液反应的化学方程式为CO2+2NaOH===
Na2CO3+H2O。
【答案】 (1)H C N O Na
(2)CH4 NH3 H2O (3)
(4)CO2+2NaOH===Na2CO3+H2O
