沪教版(全国)九年级上化学 第3章 物质构成的奥秘单元检测卷(含答案)
文档属性
| 名称 | 沪教版(全国)九年级上化学 第3章 物质构成的奥秘单元检测卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 322.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-24 09:26:29 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
沪教版化学第3章 物质构成的奥秘单元检测卷
一、选择题(共10题;共20分)
1.小科通过微信公众号“胜哥课程”知道了平时所见的物质由三类微粒构成。下列物质中,既含有分子又含有离子的是( )
A.过氧化氢溶液 B.氯化钠
C.硫酸铜溶液 D.铁
2.(学习方法)逻辑推理是一种重要的化学思维方法。下列推理正确的是( )
A.分子都是由原子构成的,所以分子一定都比原子大
B.催化剂在化学反应前后质量不变,则化学反应前后质量不变的物质一定是催化剂
C.分子可以构成物质,但物质不一定都是分子构成
D.离子是带电荷的粒子,所以带电荷的粒子一定是离子
3.下列微粒中,核外电子数大于核电荷数的是( )
A. B. C. D.
4.门捷列夫说:“没有观察就没有接踵而来的前进。”下列实验现象描述正确的是( )
A.打开浓盐酸的试剂瓶塞,瓶口产生大量白烟
B.向氢氧化钠溶液中滴入几滴石 溶液,溶液变红
C.铁丝在氧气中燃烧,火星四射,生成四氧化三铁
D.硬铝片和铝片互相刻划,铝片上留下的划痕比硬铝片的深
5.均衡膳食有利于维持人体中各元素的平衡。因摄入量不足易导致骨质疏松的元素是( )
A.铁 B.硒 C.锌 D.钙
6.(化学用语)小华通过微信公众号“胜哥课程”学会了一些化学用语。下列表示两个分子的是( )
A.2O B.2O2 C.SO2 D.O2-
7.(现代科技)中国志愿者王跃参加了人类首次模拟火星载人航天飞行试验,有探测资料表明,火星上存在丰富的镁资源。在元素周期表中,镁元素的某些信息如图所示,下列说法不正确的是( )
A.镁元素原子的核外电子数为12 B.镁元素原子的核电荷数为12
C.镁元素属于非金属元素 D.镁元素的相对原子质量24.31
8.在化学王国里,数字被赋予了丰富的内涵。下列化学用语中数字“2”说法正确的是( )
①2H+②2NH3③H2SO4④Cu+2O⑤Ca2+⑥2NO3⑦H2O2
A.表示离子个数的是⑤⑥ B.表示离子所带电荷数的是④⑤
C.表示分子中原子个数的是③⑦ D.表示分子个数的是①②
9. 2023年10月26日,神舟十七号载人飞船发射取得圆满成功。高氯酸钾( KClO4)可用于制备火箭燃料。在KClO4中,氯元素的化合价为( )
A.+1 B.+3 C.+5 D.+7
10.(传统文化)在“探索千年古窑、了解现代科技”研学活动中,同学们了解到吉州窑黑釉木叶纹盏是汉族名瓷,烧制胚体的主要成分是 NaAlSi2O6。其中硅元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
二、非选择题(共9题;共80分)
11.(12分)(2024九上·南康月考)根据所学知识,完成下列问题:
原子名称 质子数 核外电子数 中子数 相对原子质量
氢 1 1 0 1
碳-12 6 6 6 12
氧 8 8 8 16
钠 11 X 12 23
镁 Y 12 12 Z
(1)(6分)上表中X的值为 ;Y的值为 ;Z的值为 ;
(2)已知碳-12原子的实际质量为1.993×10-26 kg,则表中镁原子的实际质量为 。(写出计算过程)
(3)等质量的铁和钠相比较, (选填“铁”或“钠”)所含原子数目更多。(温馨提示:铁的相对原子质量是56,钠的相对原子质量是23)
(4)从表格中可以找到以下规律,下列概括正确的是_________(填序号,双选)。
A.不同种原子,质子数不同 B.所有的原子中都含有中子
C.在原子中,质子数=核外电子数 D.相对原子质量≈质子数+电子数
12.(10分)(2024九上·大冶月考)O2是人类生存必需的物质,认识和获取O2具有重要意义。
(1)工业生产的O2可加压贮存在蓝色钢瓶中,在此过程中发生的变化是 (填字母)。
a.O2分子质量变小 b.O2分子间间隔减小 c.O2分子转变为其他分子
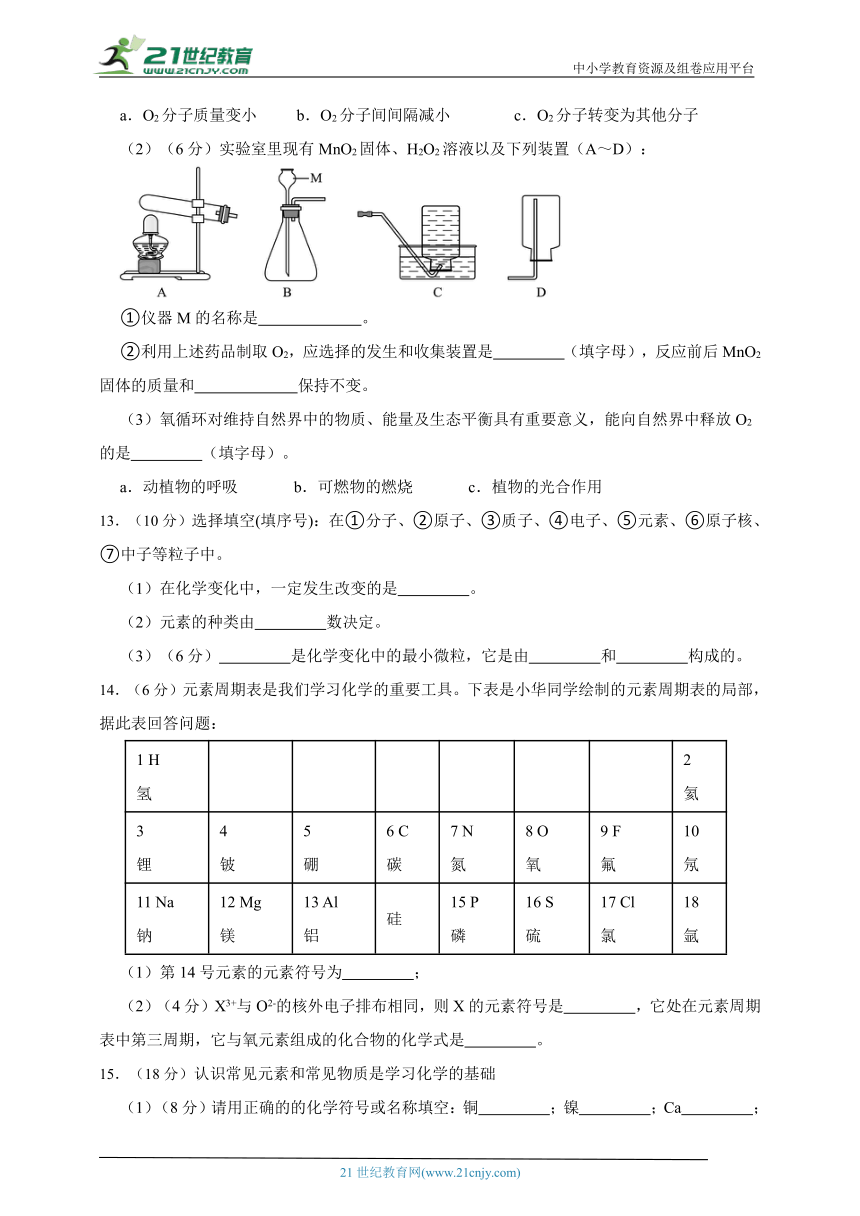
(2)(6分)实验室里现有MnO2固体、H2O2溶液以及下列装置(A~D):
①仪器M的名称是 。
②利用上述药品制取O2,应选择的发生和收集装置是 (填字母),反应前后MnO2固体的质量和 保持不变。
(3)氧循环对维持自然界中的物质、能量及生态平衡具有重要意义,能向自然界中释放O2的是 (填字母)。
a.动植物的呼吸 b.可燃物的燃烧 c.植物的光合作用
13.(10分)选择填空(填序号):在①分子、②原子、③质子、④电子、⑤元素、⑥原子核、⑦中子等粒子中。
(1)在化学变化中,一定发生改变的是 。
(2)元素的种类由 数决定。
(3)(6分) 是化学变化中的最小微粒,它是由 和 构成的。
14.(6分)元素周期表是我们学习化学的重要工具。下表是小华同学绘制的元素周期表的局部,据此表回答问题:
1 H 氢 2 氦
3 锂 4 铍 5 硼 6 C 碳 7 N 氮 8 O 氧 9 F 氟 10 氖
11 Na 钠 12 Mg 镁 13 Al 铝 硅 15 P 磷 16 S 硫 17 Cl 氯 18 氩
(1)第14号元素的元素符号为 ;
(2)(4分)X3+与O2-的核外电子排布相同,则X的元素符号是 ,它处在元素周期表中第三周期,它与氧元素组成的化合物的化学式是 。
15.(18分)认识常见元素和常见物质是学习化学的基础
(1)(8分)请用正确的的化学符号或名称填空:铜 ;镍 ;Ca ;Na ;
(2)(8分)写出下列物质的化学符号:二氧化锰 ;四氧化三铁 ;五氧化二磷 ;水 。
(3)下列物质中,属于纯净物的有 (填序号)
①可乐饮料;②冰水混合物;③矿泉水;④液氧,⑤二氧化硫;⑥液态空气;⑦高锰酸钾;⑧3%的过氧化氢溶液。
16.(8分)小华通过微信公众号“胜哥课程”知道了化学用语是国际通用的化学语言。试用化学用语填空。
(1)3个磷原子 ;
(2)氩气 ;
(3)过氧化氢 ;
(4)标出氧化铝中氧元素的化合价 。
17.(4分)写出下列微粒的化学符号:
(1)2个铝原子 ; (2)3个氧分子 。
18.(6分)天宫课堂中,航天员王亚平用视频展示了在无容器材料实验柜中进行的“锆金属熔化与凝固”实验。已知锆元素的核电荷数为40,1个锆原子的质量为1.51×10-25kg,1个碳12原子的质量为1.993×10-26kg。求:
(1)锆的相对原子质量(写出计算过程,结果保留整数)。
(2)(4分)锆原子核内的中子数为 ,核外电子数为 。
19.(6分)蛋白质由甘氨酸()等多种氨基酸构成。计算:
(1)甘氨酸由 种元素组成(写数值);
(2)一个甘氨酸分子中含有 个原子;
(3)75g甘氨酸中含有氮元素的质量为 g。
答案解析部分
1.【答案】C
【知识点】物质的微粒性
【解析】【解答】A、过氧化氢溶液中含有过氧化氢分子和水分子,该物质只含分子,故不符合题意;
B、氯化钠是由钠离子和氯离子构成的,该物质只含离子,不符合题意;
C、硫酸铜溶液中含有铜离子、硫酸根离子和水分子,该物质既含有分子,又含有离子,符合题意;
D、铁是由铁原子构成的,该物质只含有原子,不符合题意。
故答案为:C.
【分析】根据物质由分子、原子、离子构成来解答。
2.【答案】C
【知识点】催化剂的特点与催化作用;分子和原子的区别和联系;原子和离子的相互转化
【解析】【解答】A、分子和原子的大小没有可比性,分子不一定比原子大,例如1个氢分子的质量比1个氧原子的质量小,故该说法错误,不符合题意;
B、催化剂在化学反应前后质量和化学性质均不变,则化学反应前后质量不变的不一定是催化剂,该说法错误,不符合题意;
C、分子可以构成物质,但物质不一定都是分子构成,如铁是由铁原子构成的,该说法正确,符合题意;
D、离子是带电的粒子,但带电的粒子不一定是离子,如质子、电子,该说法错误,不符合题意。
故答案为:C.
【分析】A、根据物质由分子、原子、离子构成来解答;
B、根据催化剂的概念是在化学反应中改变其他物质的反应速度,而本身的质量和化学性质不变来解答;
C、根据物质由分子、原子、离子构成来解答;
D、根据带电的微粒有质子、电子、原子核、离子来解答。
3.【答案】B
【知识点】原子的定义与构成;原子和离子的相互转化
【解析】【解答】解:在原子中质子数等于电子数;原子得到电子带负电就是阴离子,故电子数大于质子数就是阴离子;原子失去最外层电子带正电就是阳离子,故电子数小于质子数就是阳离子。而题意是电子数大于质子数(原子核电荷数)就是阴离子,故符合题意的是B,不符合题意的是ACD。
故答案为:B.
【分析】根据在原子中质子数等于电子数,电子数大于质子数是阴离子,电子数小于质子数是阳离子来解答。
4.【答案】D
【知识点】反应现象和本质的联系
【解析】【解答】A、 打开浓盐酸的试剂瓶塞,挥发性出的氯化氢与水蒸气结合成盐酸液滴,会在瓶口产生大量白雾 ,不符合题意;
B、 向氢氧化钠溶液中滴入几滴石蕊溶液,溶液变蓝 ,不符合题意;
C、 铁丝在氧气中燃烧,生成四氧化三铁是结论, 不是现象 ,不符合题意;
D、 硬铝为合金,硬度大于纯铝,硬铝片和铝片互相刻划,铝片上留下的划痕比硬铝片的深 ,符合题意;
故选D。
【分析】A、根据浓盐酸的挥发性分析;
B、根据碱性溶液使石蕊变蓝分析;
C、根据生成物名称描述是结论分析;
D、根据合金硬度大于纯金属分析。
5.【答案】D
【知识点】人体的元素组成与元素对人体健康的重要作用
【解析】【解答】元素在人体中的作用是钙增强骨质密度,青少年缺钙会发育不良,导致骨质疏松;缺铁会贫血,缺锌会厌食,硒元素是抗癌元素,增强体质。
故答案为:D.
【分析】根据钙元素在人体中的作用是加强骨质密度,缺钙会导致骨质疏松来解答。
6.【答案】B
【知识点】元素的符号及其意义
【解析】【解答】A、2O表示2个氧原子,故不符合题意;
B、2O2表示2个氧分子,符合题意;
C、SO2 表示二氧化硫这种物质,1个二氧化硫分子,故不符合题意;
D、O2-表示氧离子,2表示一个氧离子带2个单位的负电荷,故不符合题意。
故答案为:B.
【分析】根据元素符号周围数字是含义来解答。
7.【答案】C
【知识点】元素的简单分类;元素周期表的特点及其应用
【解析】【解答】A、 镁元素原子的核外电子数=质子数=原子序数=12 ,不符合题意;
B、 镁元素原子的核电荷数=原子序数=12 ,不符合题意;
C、 镁元素属于金属元素 ,符合题意;
D、 镁元素的相对原子质量24.31 ,不符合题意;
故选C。
【分析】A、根据原子中电子数=质子数=原子序数分析;
B、根据原子的核电荷数=原子序数分析;
C、根据名称带“钅”的为金属元素分析;
D、根据元素周期表小格信息中最下面数字为相对原子质量分析。
8.【答案】C
【知识点】化学式的书写及意义;化合价与离子表示方法上的异同点
【解析】【解答】A. 元素符号右上角的数字表示离子所带电荷数,离子符号前的数字表示离子所带电荷数,则①⑥中的“2”表示离子个数,故错误;
B. 元素符号右上角的数字表示离子所带电荷数,则⑤中的“2”表示离子所带电荷数,故错误;
C. 元素符号右小角的数字表示分子中原子个数,则③⑦中的“2”表示分子中原子个数,故正确;
D. 化学式前的数字表示分子个数,则②中的“2”表示分子个数,故错误;
故答案为:C。
【分析】A、元素符号右上角的数字表示离子所带电荷数,离子符号前的数字表示离子所带电荷数。
B、元素符号右上角的数字表示离子所带电荷数。
C、元素符号右下角的数字表示1个分子中原子个数。
D、化学式前的数字表示分子个数。
9.【答案】D
【知识点】化合价规律和原则
【解析】【解答】 KClO4中钾元素化合价为+1,氧元素为-2,设氯元素的化合价为x,则(+1)+x+(-2)×4=0,x=+7。
故选D。
【分析】根据化合物中元素化合价代数和为0分析。
10.【答案】D
【知识点】有关元素化合价的计算
【解析】【解答】 NaAlSi2O6 中钠元素为+1价,铝元素为+3价,氧元素为-2价,设硅元素化合价为x,则(+1)+(+3)+2x+(-2)×6=0,x=+4。
故选D。
【分析】根据化合物中元素化合价代数和为0分析。
11.【答案】(1)11;12;24
(2)解:设表中镁原子的实际质量为x,由表中镁的数据可知:镁的相对原子质量≈质子数+中子数=核外电子数+中子数=12+12=24,则x=3.986×10-26kg答:表中镁原子的实际质量为3.986×10-26kg。
(3)钠
(4)A;C
【知识点】原子的定义与构成;原子的有关数量计算;相对原子质量和相对分子质量
【解析】【解答】(1)在原子中,质子数=核外电子数,钠原子的质子数为11,则钠原子的核外电子数X=11;镁原子的核外电子数为12,则镁原子的质子数Y=12;
在原子中,相对原子质量=中子数+质子数,镁原子的质子数为12,中子数为12,则镁原子的相对原子质量Z=12+12=24;
(2)解:根据原子的相对质量是以碳原子的质量的为标准量来比较得出,故镁原子的相对质量=,而原子的相对质量=质子数+中子数,故镁的原子量为,那么镁原子的实际质量=。
(3)等质量的金属,所含原子个数最多,即原子质量最小;由原子的相对原子质量与其实际质量是成正比的关系,相对原子质量最小的即是原子个数最多的金属,铁的相对原子质量是56,钠的相对原子质量是23,故等质量的铁和钠相比较,钠所含原子数目更多;
(4)A、从表格数据可知,不同种原子,质子数不同,该说法正确,符合题意;
B、从表格数据可知,并不是所有的原子中都含有中子,例如氢原子中不含有中子,该说法错误,不符合题意;
C、从表格数据可知,在原子中,质子数=核外电子数,该说法正确,符合题意;
D、从表格数据可知, 相对原子质量≈质子数+中子数,该说法错误,不符合题意。
故答案为:AC.
【分析】(1)根据在原子中质子数等于核外电子数,相对原子质量=中子数+质子数来解答;
(2)根据原子的相对质量是以碳原子的质量的为标准量比较得出来解答;
(3)根据原子的相对质量乘以原子个数就是元素的质量来解答;
(4 )根据质子数决定元素、原子种类,在原子中质子数等于电子数,原子的相对质量=质子数+中子数,氢原子没有中子来解答。
(1)在原子中,质子数=核外电子数,钠原子的质子数为11,则钠原子的核外电子数X=11;镁原子的核外电子数为12,则镁原子的质子数Y=12;
在原子中,相对原子质量近似等于中子数+质子数,镁原子的质子数为12,中子数为12,则镁原子的相对原子质量Z=12+12=24;
(2)见答案;
(3)等质量的金属,所含原子个数最多,即原子质量最小;由原子的相对原子质量与其实际质量是成正比的关系,相对原子质量最小的即是原子个数最多的金属,铁的相对原子质量是56,钠的相对原子质量是23,故等质量的铁和钠相比较,钠所含原子数目更多;
(4)A、从表格数据可知,不同种原子,质子数不同,故A说法正确;
B、从表格数据可知,并不是所有的原子中都含有中子,例如氢原子中不含有中子,故B说法错误;
C、从表格数据可知,在原子中,质子数=核外电子数,故C说法正确;
D、从表格数据可知, 相对原子质量≈质子数+中子数,故D说法错误;
故选:AC。
12.【答案】(1)b
(2)长颈漏斗;BC;化学性质
(3)c
【知识点】实验室常见的仪器及使用;氧气的实验室制法;自然界中的物质循环;分子的定义与分子的特性
【解析】【解得】(1)工业生产的O2可加压贮存在蓝色钢瓶中,在此过程中没有新物质生成,发生的属于物理变化,因此分子的种类没有发生改变,发生改变的是氧分子间的间隔,加压时,氧分子间的间隔变小了;故答案为:b.
(2)①仪器M的名称是长颈漏斗。
②用过氧化氢溶液与二氧化锰制氧气属于固液常温型,发生装置选择B;氧气的密度比空气大,可采用向上排空气法来收集,氧气不易溶于水,可采用排水法来收集,故选装置C;二氧化锰是反应的催化剂,因此该反应前后MnO2质量和化学性质保持不变。
(3)a.动植物的呼吸需要消耗氧气,不合题意;
b.可燃物的燃烧需要消耗氧气,不合题意;
c.植物的光合作用会释放出氧气,符合题意;
故答案为:c.
【分析】(1)根据没有新物质生成的变化是物理变化,分子间的间隔发生变化来解答;
(2)根据实验室常见仪器,反应物的状态和反应条件来选择发生装置,气体的密度和溶解性来选择收集装置;催化剂是改变其它物质的反应速度,本身的质量和化学性质不变来解答;
(3)根据氧气在自然界的循环是通过植物光合作用实现来解答。
(1)工业生产的O2可加压贮存在蓝色钢瓶中,在此过程中没有新物质生成,发生的属于物理变化,因此分子的种类没有发生改变,发生改变的是氧分子间的间隔,加压时,氧分子间的间隔变小了;故答案为:b;
(2)①据图可知,仪器M的名称是长颈漏斗;
②用过氧化氢溶液与二氧化锰制氧气属于固液常温型,发生装置选择B;氧气的密度比空气大,可采用向上排空气法来收集,氧气不易溶于水,可采用排水法来收集,故选装置C;二氧化锰是反应的催化剂,因此该反应前后MnO2质量和化学性质保持不变;
(3)a.动植物的呼吸需要消耗氧气,不合题意;
b.可燃物的燃烧需要消耗氧气,不合题意;
c.植物的光合作用会释放出氧气,符合题意;
故答案为:c。
13.【答案】(1)①
(2)③
(3)②;⑥;④
【知识点】分子和原子的区别和联系;元素的概念
【解析】【解答】(1)化学变化的实质是分子先分裂成原子,原子再重新组合成新的分子,原子是化学变化中的最小粒子,故在化学变化中,一定发生改变的是分子;
(2)元素是具有相同质子数的某一类原子的统称,故元素的种类由质子数决定;
(3)原子是化学变化中的最小粒子,原子由原子核和核外电子构成。
【分析】根据元素的概念是质子数相同的一类原子的总称;在化学变化中,分子分解成原子,原子重新结合成新的分子来解答。
(1)化学变化的实质是分子先分裂成原子,原子再重新组合成新的分子,原子是化学变化中的最小粒子,故在化学变化中,一定发生改变的是分子;
(2)元素是具有相同质子数的某一类原子的统称,故元素的种类由质子数决定;
(3)原子是化学变化中的最小粒子,原子由原子核和核外电子构成。
14.【答案】(1)Si
(2)Al;Al2O3
【知识点】元素周期表的特点及其应用
【解析】【解答】(1)第14号元素的元素符号为 Si 。
(2)X3+与O2-的核外电子排布相同,那么氧离子的电子数是10,2个电子层,而X3+的电子数是10,则X的质子数是,故该元素符号是 Al ,它处在元素周期表中第三周期,它与氧元素组成的化合物是氧化铝,化学式为: Al2O3 。
【分析】根据质子数决定元素种类,阳离子的电子数=质子数-所带电荷数,阴离子的电子数=质子数+离子所带电荷数;在化合物中各元素的化合价的代数和为0来解答。
15.【答案】(1)Cu;Ni;钙;钠
(2)MnO2;Fe3O4;P2O5;H2O
(3)②④⑤⑦
【知识点】元素的符号及其意义;化学式的书写及意义;纯净物和混合物
【解析】【解答】(1)书写元素符号第一个字母大写,第二个字母小写,铜的元素符号为:Cu;镍的元素符号为:Ni;Ca是钙的元素符号,名称为:钙;Na是钠的元素符号,名称为:钠。
(2)根据二氧化锰的读法可知二氧化锰的化学式为:MnO2;根据四氧化三铁的读法可知四氧化三铁的化学式为:Fe3O4;据五氧化二磷的读法可知五氧化二磷的化学式为:P2O5;水是由氢氧元素组成的,氢元素化合价为+1价,氧元素化合价为-2价,根据正价在左负价在右,正负化合价代数和为零,化合价数值约到最简交叉写在元素右下角,水的化学式为:H2O。
(3)①可乐饮料中含有水、二氧化碳等多种物质,属于混合物;
②冰是水的固态形式,冰水混合物中只含有水一种物质,属于纯净物;
③矿泉水含有水和矿物质,属于混合物;
④液氧是氧气的液态形式,是由一种物质组成的,属于纯净物;
⑤二氧化硫是由一种物质组成的,属于纯净物;
⑥液态空气中含有液氮、液氧等多种物质,属于混合物;
⑦高锰酸钾是由一种物质组成的,属于纯净物;
⑧3%的过氧化氢溶液含有过氧化氢和水,属于混合物。
属于纯净物的有:②④⑤⑦。
【分析】(1)根据书写元素符号第一个字母大写,第二个字母小写分析。
(2)根据物质化学式的书写,正价在左负价在右,正负化合价代数和为零,化合价数值约到最简交叉写在元素右下角分析。
(3)由单一物质组成的物质称为纯净物。
混合物是由两种及两种以上纯物质(元素或化合物)没有经化学变化而组成的物质。
(1)书写元素符号第一个字母大写,第二个字母小写,铜的元素符号为:Cu;镍的元素符号为:Ni;Ca是钙的元素符号,名称为:钙;Na是钠的元素符号,名称为:钠;
(2)根据二氧化锰的读法可知二氧化锰的化学式为:MnO2;根据四氧化三铁的读法可知四氧化三铁的化学式为:Fe3O4;据五氧化二磷的读法可知五氧化二磷的化学式为:P2O5;水是由氢氧元素组成的,氢元素化合价为+1价,氧元素化合价为-2价,根据正价在左负价在右,正负化合价代数和为零,化合价数值约到最简交叉写在元素右下角,水的化学式为:H2O;
(3)①可乐饮料中含有水、二氧化碳等多种物质,属于混合物;②冰是水的固态形式,冰水混合物中只含有水一种物质,属于纯净物;③矿泉水含有水和矿物质,属于混合物;④液氧是氧气的液态形式,是由一种物质组成的,属于纯净物;⑤二氧化硫是由一种物质组成的,属于纯净物;⑥液态空气中含有液氮、液氧等多种物质,属于混合物;⑦高锰酸钾是由一种物质组成的,属于纯净物;⑧3%的过氧化氢溶液含有过氧化氢和水,属于混合物。
属于纯净物的有:②④⑤⑦。
16.【答案】(1)3P
(2)Ar
(3)H2O2
(4)
【知识点】元素的符号及其意义;化学式的书写及意义;常见元素与原子团的化合价
【解析】【解答】(1)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,3个磷原子表示为3P。
(2)稀有气体的化学式用元素符号表示,氩气属于稀有气体,其化学式为Ar。
(3)过氧化氢由过氧化氢分子构成,一个过氧化氢分子由两个氢原子、两个氧原子构成,过氧化氢的化学式为H2O2。
(4)化合价标在元素符号的正上方,正负号在前,价数在后。氧化铝中氧元素的化合价表示为。
【分析】根据化学符号的意义分析,元素符号表示元素和一个原子,表示多个原子元素符号前加相应数字;化学式表示一种物质和一个分子,表示多个分子,化学式前加相应系数;离子符号是在元素符号或原子团符号右上角标上所带电荷数,数字在前,正负号在后,表示多个离子,在符号前加相应数字;元素化合价标在元素符号的正上方,正负号在前,数字在后。
(1)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,3个磷原子表示为3P。
(2)稀有气体的化学式用元素符号表示,氩气属于稀有气体,其化学式为Ar。
(3)过氧化氢由过氧化氢分子构成,一个过氧化氢分子由两个氢原子、两个氧原子构成,过氧化氢的化学式为H2O2。
(4)化合价标在元素符号的正上方,正负号在前,价数在后。氧化铝中氧元素的化合价表示为。
17.【答案】(1)
(2)
【知识点】化学符号及其周围数字的意义
【解析】【解答】(1)元素符号前方的数字表示原子个数,故2个铝原子表示为:2Al;
(2)数字在分子符号前表示分子个数,3个氧分子表示为:3O2。
【分析】根据符号前面的数字表示微粒个数来解答。
(1)数字在元素符号前表示原子个数,2个铝原子表示为:2Al;
(2)数字在分子符号前表示分子个数,3个氧分子表示为:3O2。
18.【答案】(1)解:锆的相对原子质量为:。
(2)51;40
【知识点】原子的有关数量计算;相对原子质量和相对分子质量
【解析】【解得】(1)解: 锆的相对原子质量为: 。
(2)在原子中核电荷数=质子数=核外电子数。锆原子核外电子数为40;根据相对原子质量≈质子数+中子数,锆原子核内的中子数为:91-40=51。
【分析】(1)根据原子的相对质量就是以碳原子的质量的12分之一为标准量来比较来解答;
(2)根据在原子中,质子数等于电子数等于原子核电荷数;原子的相对质量=质子数+中子数来解答。
(1)见答案。
(2)原子中,核电荷数=质子数=核外电子数,锆原子核外电子数为40;根据相对原子质量≈质子数+中子数,锆原子核内的中子数为:91-40=51。故填:51;40。
19.【答案】(1)4
(2)10
(3)14
【知识点】化学式的相关计算
【解析】【解答】(1) 甘氨酸由碳、氢、氧、氮4种元素组成。
(2) 一个甘氨酸分子中含有 10个原子。
(3) 75g甘氨酸中含有氮元素的质量为.
【分析】(1)根据化学式确定物质的元素组成分析;
(2)根据化学式右下角数字为一个分子中原子个数分析;
(3)根据元素质量为物质质量×元素质量分数分析。
试题分析部分
1、试卷总体分布分析
总分:100分
分值分布 客观题(占比) 20.0(20.0%)
主观题(占比) 80.0(80.0%)
题量分布 客观题(占比) 10(52.6%)
主观题(占比) 9(47.4%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
选择题 10(52.6%) 20.0(20.0%)
非选择题 9(47.4%) 80.0(80.0%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (63.2%)
2 容易 (36.8%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 物质的微粒性 2.0(2.0%) 1
2 化合价规律和原则 2.0(2.0%) 9
3 人体的元素组成与元素对人体健康的重要作用 2.0(2.0%) 5
4 反应现象和本质的联系 2.0(2.0%) 4
5 分子的定义与分子的特性 10.0(10.0%) 12
6 原子的定义与构成 14.0(14.0%) 3,11
7 相对原子质量和相对分子质量 18.0(18.0%) 11,18
8 化学式的书写及意义 28.0(28.0%) 8,15,16
9 元素的概念 10.0(10.0%) 13
10 有关元素化合价的计算 2.0(2.0%) 10
11 元素的简单分类 2.0(2.0%) 7
12 元素周期表的特点及其应用 8.0(8.0%) 7,14
13 氧气的实验室制法 10.0(10.0%) 12
14 原子和离子的相互转化 4.0(4.0%) 2,3
15 自然界中的物质循环 10.0(10.0%) 12
16 化学式的相关计算 6.0(6.0%) 19
17 纯净物和混合物 18.0(18.0%) 15
18 分子和原子的区别和联系 12.0(12.0%) 2,13
19 元素的符号及其意义 28.0(28.0%) 6,15,16
20 常见元素与原子团的化合价 8.0(8.0%) 16
21 化合价与离子表示方法上的异同点 2.0(2.0%) 8
22 实验室常见的仪器及使用 10.0(10.0%) 12
23 催化剂的特点与催化作用 2.0(2.0%) 2
24 原子的有关数量计算 18.0(18.0%) 11,18
25 化学符号及其周围数字的意义 4.0(4.0%) 17
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
沪教版化学第3章 物质构成的奥秘单元检测卷
一、选择题(共10题;共20分)
1.小科通过微信公众号“胜哥课程”知道了平时所见的物质由三类微粒构成。下列物质中,既含有分子又含有离子的是( )
A.过氧化氢溶液 B.氯化钠
C.硫酸铜溶液 D.铁
2.(学习方法)逻辑推理是一种重要的化学思维方法。下列推理正确的是( )
A.分子都是由原子构成的,所以分子一定都比原子大
B.催化剂在化学反应前后质量不变,则化学反应前后质量不变的物质一定是催化剂
C.分子可以构成物质,但物质不一定都是分子构成
D.离子是带电荷的粒子,所以带电荷的粒子一定是离子
3.下列微粒中,核外电子数大于核电荷数的是( )
A. B. C. D.
4.门捷列夫说:“没有观察就没有接踵而来的前进。”下列实验现象描述正确的是( )
A.打开浓盐酸的试剂瓶塞,瓶口产生大量白烟
B.向氢氧化钠溶液中滴入几滴石 溶液,溶液变红
C.铁丝在氧气中燃烧,火星四射,生成四氧化三铁
D.硬铝片和铝片互相刻划,铝片上留下的划痕比硬铝片的深
5.均衡膳食有利于维持人体中各元素的平衡。因摄入量不足易导致骨质疏松的元素是( )
A.铁 B.硒 C.锌 D.钙
6.(化学用语)小华通过微信公众号“胜哥课程”学会了一些化学用语。下列表示两个分子的是( )
A.2O B.2O2 C.SO2 D.O2-
7.(现代科技)中国志愿者王跃参加了人类首次模拟火星载人航天飞行试验,有探测资料表明,火星上存在丰富的镁资源。在元素周期表中,镁元素的某些信息如图所示,下列说法不正确的是( )
A.镁元素原子的核外电子数为12 B.镁元素原子的核电荷数为12
C.镁元素属于非金属元素 D.镁元素的相对原子质量24.31
8.在化学王国里,数字被赋予了丰富的内涵。下列化学用语中数字“2”说法正确的是( )
①2H+②2NH3③H2SO4④Cu+2O⑤Ca2+⑥2NO3⑦H2O2
A.表示离子个数的是⑤⑥ B.表示离子所带电荷数的是④⑤
C.表示分子中原子个数的是③⑦ D.表示分子个数的是①②
9. 2023年10月26日,神舟十七号载人飞船发射取得圆满成功。高氯酸钾( KClO4)可用于制备火箭燃料。在KClO4中,氯元素的化合价为( )
A.+1 B.+3 C.+5 D.+7
10.(传统文化)在“探索千年古窑、了解现代科技”研学活动中,同学们了解到吉州窑黑釉木叶纹盏是汉族名瓷,烧制胚体的主要成分是 NaAlSi2O6。其中硅元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
二、非选择题(共9题;共80分)
11.(12分)(2024九上·南康月考)根据所学知识,完成下列问题:
原子名称 质子数 核外电子数 中子数 相对原子质量
氢 1 1 0 1
碳-12 6 6 6 12
氧 8 8 8 16
钠 11 X 12 23
镁 Y 12 12 Z
(1)(6分)上表中X的值为 ;Y的值为 ;Z的值为 ;
(2)已知碳-12原子的实际质量为1.993×10-26 kg,则表中镁原子的实际质量为 。(写出计算过程)
(3)等质量的铁和钠相比较, (选填“铁”或“钠”)所含原子数目更多。(温馨提示:铁的相对原子质量是56,钠的相对原子质量是23)
(4)从表格中可以找到以下规律,下列概括正确的是_________(填序号,双选)。
A.不同种原子,质子数不同 B.所有的原子中都含有中子
C.在原子中,质子数=核外电子数 D.相对原子质量≈质子数+电子数
12.(10分)(2024九上·大冶月考)O2是人类生存必需的物质,认识和获取O2具有重要意义。
(1)工业生产的O2可加压贮存在蓝色钢瓶中,在此过程中发生的变化是 (填字母)。
a.O2分子质量变小 b.O2分子间间隔减小 c.O2分子转变为其他分子
(2)(6分)实验室里现有MnO2固体、H2O2溶液以及下列装置(A~D):
①仪器M的名称是 。
②利用上述药品制取O2,应选择的发生和收集装置是 (填字母),反应前后MnO2固体的质量和 保持不变。
(3)氧循环对维持自然界中的物质、能量及生态平衡具有重要意义,能向自然界中释放O2的是 (填字母)。
a.动植物的呼吸 b.可燃物的燃烧 c.植物的光合作用
13.(10分)选择填空(填序号):在①分子、②原子、③质子、④电子、⑤元素、⑥原子核、⑦中子等粒子中。
(1)在化学变化中,一定发生改变的是 。
(2)元素的种类由 数决定。
(3)(6分) 是化学变化中的最小微粒,它是由 和 构成的。
14.(6分)元素周期表是我们学习化学的重要工具。下表是小华同学绘制的元素周期表的局部,据此表回答问题:
1 H 氢 2 氦
3 锂 4 铍 5 硼 6 C 碳 7 N 氮 8 O 氧 9 F 氟 10 氖
11 Na 钠 12 Mg 镁 13 Al 铝 硅 15 P 磷 16 S 硫 17 Cl 氯 18 氩
(1)第14号元素的元素符号为 ;
(2)(4分)X3+与O2-的核外电子排布相同,则X的元素符号是 ,它处在元素周期表中第三周期,它与氧元素组成的化合物的化学式是 。
15.(18分)认识常见元素和常见物质是学习化学的基础
(1)(8分)请用正确的的化学符号或名称填空:铜 ;镍 ;Ca ;Na ;
(2)(8分)写出下列物质的化学符号:二氧化锰 ;四氧化三铁 ;五氧化二磷 ;水 。
(3)下列物质中,属于纯净物的有 (填序号)
①可乐饮料;②冰水混合物;③矿泉水;④液氧,⑤二氧化硫;⑥液态空气;⑦高锰酸钾;⑧3%的过氧化氢溶液。
16.(8分)小华通过微信公众号“胜哥课程”知道了化学用语是国际通用的化学语言。试用化学用语填空。
(1)3个磷原子 ;
(2)氩气 ;
(3)过氧化氢 ;
(4)标出氧化铝中氧元素的化合价 。
17.(4分)写出下列微粒的化学符号:
(1)2个铝原子 ; (2)3个氧分子 。
18.(6分)天宫课堂中,航天员王亚平用视频展示了在无容器材料实验柜中进行的“锆金属熔化与凝固”实验。已知锆元素的核电荷数为40,1个锆原子的质量为1.51×10-25kg,1个碳12原子的质量为1.993×10-26kg。求:
(1)锆的相对原子质量(写出计算过程,结果保留整数)。
(2)(4分)锆原子核内的中子数为 ,核外电子数为 。
19.(6分)蛋白质由甘氨酸()等多种氨基酸构成。计算:
(1)甘氨酸由 种元素组成(写数值);
(2)一个甘氨酸分子中含有 个原子;
(3)75g甘氨酸中含有氮元素的质量为 g。
答案解析部分
1.【答案】C
【知识点】物质的微粒性
【解析】【解答】A、过氧化氢溶液中含有过氧化氢分子和水分子,该物质只含分子,故不符合题意;
B、氯化钠是由钠离子和氯离子构成的,该物质只含离子,不符合题意;
C、硫酸铜溶液中含有铜离子、硫酸根离子和水分子,该物质既含有分子,又含有离子,符合题意;
D、铁是由铁原子构成的,该物质只含有原子,不符合题意。
故答案为:C.
【分析】根据物质由分子、原子、离子构成来解答。
2.【答案】C
【知识点】催化剂的特点与催化作用;分子和原子的区别和联系;原子和离子的相互转化
【解析】【解答】A、分子和原子的大小没有可比性,分子不一定比原子大,例如1个氢分子的质量比1个氧原子的质量小,故该说法错误,不符合题意;
B、催化剂在化学反应前后质量和化学性质均不变,则化学反应前后质量不变的不一定是催化剂,该说法错误,不符合题意;
C、分子可以构成物质,但物质不一定都是分子构成,如铁是由铁原子构成的,该说法正确,符合题意;
D、离子是带电的粒子,但带电的粒子不一定是离子,如质子、电子,该说法错误,不符合题意。
故答案为:C.
【分析】A、根据物质由分子、原子、离子构成来解答;
B、根据催化剂的概念是在化学反应中改变其他物质的反应速度,而本身的质量和化学性质不变来解答;
C、根据物质由分子、原子、离子构成来解答;
D、根据带电的微粒有质子、电子、原子核、离子来解答。
3.【答案】B
【知识点】原子的定义与构成;原子和离子的相互转化
【解析】【解答】解:在原子中质子数等于电子数;原子得到电子带负电就是阴离子,故电子数大于质子数就是阴离子;原子失去最外层电子带正电就是阳离子,故电子数小于质子数就是阳离子。而题意是电子数大于质子数(原子核电荷数)就是阴离子,故符合题意的是B,不符合题意的是ACD。
故答案为:B.
【分析】根据在原子中质子数等于电子数,电子数大于质子数是阴离子,电子数小于质子数是阳离子来解答。
4.【答案】D
【知识点】反应现象和本质的联系
【解析】【解答】A、 打开浓盐酸的试剂瓶塞,挥发性出的氯化氢与水蒸气结合成盐酸液滴,会在瓶口产生大量白雾 ,不符合题意;
B、 向氢氧化钠溶液中滴入几滴石蕊溶液,溶液变蓝 ,不符合题意;
C、 铁丝在氧气中燃烧,生成四氧化三铁是结论, 不是现象 ,不符合题意;
D、 硬铝为合金,硬度大于纯铝,硬铝片和铝片互相刻划,铝片上留下的划痕比硬铝片的深 ,符合题意;
故选D。
【分析】A、根据浓盐酸的挥发性分析;
B、根据碱性溶液使石蕊变蓝分析;
C、根据生成物名称描述是结论分析;
D、根据合金硬度大于纯金属分析。
5.【答案】D
【知识点】人体的元素组成与元素对人体健康的重要作用
【解析】【解答】元素在人体中的作用是钙增强骨质密度,青少年缺钙会发育不良,导致骨质疏松;缺铁会贫血,缺锌会厌食,硒元素是抗癌元素,增强体质。
故答案为:D.
【分析】根据钙元素在人体中的作用是加强骨质密度,缺钙会导致骨质疏松来解答。
6.【答案】B
【知识点】元素的符号及其意义
【解析】【解答】A、2O表示2个氧原子,故不符合题意;
B、2O2表示2个氧分子,符合题意;
C、SO2 表示二氧化硫这种物质,1个二氧化硫分子,故不符合题意;
D、O2-表示氧离子,2表示一个氧离子带2个单位的负电荷,故不符合题意。
故答案为:B.
【分析】根据元素符号周围数字是含义来解答。
7.【答案】C
【知识点】元素的简单分类;元素周期表的特点及其应用
【解析】【解答】A、 镁元素原子的核外电子数=质子数=原子序数=12 ,不符合题意;
B、 镁元素原子的核电荷数=原子序数=12 ,不符合题意;
C、 镁元素属于金属元素 ,符合题意;
D、 镁元素的相对原子质量24.31 ,不符合题意;
故选C。
【分析】A、根据原子中电子数=质子数=原子序数分析;
B、根据原子的核电荷数=原子序数分析;
C、根据名称带“钅”的为金属元素分析;
D、根据元素周期表小格信息中最下面数字为相对原子质量分析。
8.【答案】C
【知识点】化学式的书写及意义;化合价与离子表示方法上的异同点
【解析】【解答】A. 元素符号右上角的数字表示离子所带电荷数,离子符号前的数字表示离子所带电荷数,则①⑥中的“2”表示离子个数,故错误;
B. 元素符号右上角的数字表示离子所带电荷数,则⑤中的“2”表示离子所带电荷数,故错误;
C. 元素符号右小角的数字表示分子中原子个数,则③⑦中的“2”表示分子中原子个数,故正确;
D. 化学式前的数字表示分子个数,则②中的“2”表示分子个数,故错误;
故答案为:C。
【分析】A、元素符号右上角的数字表示离子所带电荷数,离子符号前的数字表示离子所带电荷数。
B、元素符号右上角的数字表示离子所带电荷数。
C、元素符号右下角的数字表示1个分子中原子个数。
D、化学式前的数字表示分子个数。
9.【答案】D
【知识点】化合价规律和原则
【解析】【解答】 KClO4中钾元素化合价为+1,氧元素为-2,设氯元素的化合价为x,则(+1)+x+(-2)×4=0,x=+7。
故选D。
【分析】根据化合物中元素化合价代数和为0分析。
10.【答案】D
【知识点】有关元素化合价的计算
【解析】【解答】 NaAlSi2O6 中钠元素为+1价,铝元素为+3价,氧元素为-2价,设硅元素化合价为x,则(+1)+(+3)+2x+(-2)×6=0,x=+4。
故选D。
【分析】根据化合物中元素化合价代数和为0分析。
11.【答案】(1)11;12;24
(2)解:设表中镁原子的实际质量为x,由表中镁的数据可知:镁的相对原子质量≈质子数+中子数=核外电子数+中子数=12+12=24,则x=3.986×10-26kg答:表中镁原子的实际质量为3.986×10-26kg。
(3)钠
(4)A;C
【知识点】原子的定义与构成;原子的有关数量计算;相对原子质量和相对分子质量
【解析】【解答】(1)在原子中,质子数=核外电子数,钠原子的质子数为11,则钠原子的核外电子数X=11;镁原子的核外电子数为12,则镁原子的质子数Y=12;
在原子中,相对原子质量=中子数+质子数,镁原子的质子数为12,中子数为12,则镁原子的相对原子质量Z=12+12=24;
(2)解:根据原子的相对质量是以碳原子的质量的为标准量来比较得出,故镁原子的相对质量=,而原子的相对质量=质子数+中子数,故镁的原子量为,那么镁原子的实际质量=。
(3)等质量的金属,所含原子个数最多,即原子质量最小;由原子的相对原子质量与其实际质量是成正比的关系,相对原子质量最小的即是原子个数最多的金属,铁的相对原子质量是56,钠的相对原子质量是23,故等质量的铁和钠相比较,钠所含原子数目更多;
(4)A、从表格数据可知,不同种原子,质子数不同,该说法正确,符合题意;
B、从表格数据可知,并不是所有的原子中都含有中子,例如氢原子中不含有中子,该说法错误,不符合题意;
C、从表格数据可知,在原子中,质子数=核外电子数,该说法正确,符合题意;
D、从表格数据可知, 相对原子质量≈质子数+中子数,该说法错误,不符合题意。
故答案为:AC.
【分析】(1)根据在原子中质子数等于核外电子数,相对原子质量=中子数+质子数来解答;
(2)根据原子的相对质量是以碳原子的质量的为标准量比较得出来解答;
(3)根据原子的相对质量乘以原子个数就是元素的质量来解答;
(4 )根据质子数决定元素、原子种类,在原子中质子数等于电子数,原子的相对质量=质子数+中子数,氢原子没有中子来解答。
(1)在原子中,质子数=核外电子数,钠原子的质子数为11,则钠原子的核外电子数X=11;镁原子的核外电子数为12,则镁原子的质子数Y=12;
在原子中,相对原子质量近似等于中子数+质子数,镁原子的质子数为12,中子数为12,则镁原子的相对原子质量Z=12+12=24;
(2)见答案;
(3)等质量的金属,所含原子个数最多,即原子质量最小;由原子的相对原子质量与其实际质量是成正比的关系,相对原子质量最小的即是原子个数最多的金属,铁的相对原子质量是56,钠的相对原子质量是23,故等质量的铁和钠相比较,钠所含原子数目更多;
(4)A、从表格数据可知,不同种原子,质子数不同,故A说法正确;
B、从表格数据可知,并不是所有的原子中都含有中子,例如氢原子中不含有中子,故B说法错误;
C、从表格数据可知,在原子中,质子数=核外电子数,故C说法正确;
D、从表格数据可知, 相对原子质量≈质子数+中子数,故D说法错误;
故选:AC。
12.【答案】(1)b
(2)长颈漏斗;BC;化学性质
(3)c
【知识点】实验室常见的仪器及使用;氧气的实验室制法;自然界中的物质循环;分子的定义与分子的特性
【解析】【解得】(1)工业生产的O2可加压贮存在蓝色钢瓶中,在此过程中没有新物质生成,发生的属于物理变化,因此分子的种类没有发生改变,发生改变的是氧分子间的间隔,加压时,氧分子间的间隔变小了;故答案为:b.
(2)①仪器M的名称是长颈漏斗。
②用过氧化氢溶液与二氧化锰制氧气属于固液常温型,发生装置选择B;氧气的密度比空气大,可采用向上排空气法来收集,氧气不易溶于水,可采用排水法来收集,故选装置C;二氧化锰是反应的催化剂,因此该反应前后MnO2质量和化学性质保持不变。
(3)a.动植物的呼吸需要消耗氧气,不合题意;
b.可燃物的燃烧需要消耗氧气,不合题意;
c.植物的光合作用会释放出氧气,符合题意;
故答案为:c.
【分析】(1)根据没有新物质生成的变化是物理变化,分子间的间隔发生变化来解答;
(2)根据实验室常见仪器,反应物的状态和反应条件来选择发生装置,气体的密度和溶解性来选择收集装置;催化剂是改变其它物质的反应速度,本身的质量和化学性质不变来解答;
(3)根据氧气在自然界的循环是通过植物光合作用实现来解答。
(1)工业生产的O2可加压贮存在蓝色钢瓶中,在此过程中没有新物质生成,发生的属于物理变化,因此分子的种类没有发生改变,发生改变的是氧分子间的间隔,加压时,氧分子间的间隔变小了;故答案为:b;
(2)①据图可知,仪器M的名称是长颈漏斗;
②用过氧化氢溶液与二氧化锰制氧气属于固液常温型,发生装置选择B;氧气的密度比空气大,可采用向上排空气法来收集,氧气不易溶于水,可采用排水法来收集,故选装置C;二氧化锰是反应的催化剂,因此该反应前后MnO2质量和化学性质保持不变;
(3)a.动植物的呼吸需要消耗氧气,不合题意;
b.可燃物的燃烧需要消耗氧气,不合题意;
c.植物的光合作用会释放出氧气,符合题意;
故答案为:c。
13.【答案】(1)①
(2)③
(3)②;⑥;④
【知识点】分子和原子的区别和联系;元素的概念
【解析】【解答】(1)化学变化的实质是分子先分裂成原子,原子再重新组合成新的分子,原子是化学变化中的最小粒子,故在化学变化中,一定发生改变的是分子;
(2)元素是具有相同质子数的某一类原子的统称,故元素的种类由质子数决定;
(3)原子是化学变化中的最小粒子,原子由原子核和核外电子构成。
【分析】根据元素的概念是质子数相同的一类原子的总称;在化学变化中,分子分解成原子,原子重新结合成新的分子来解答。
(1)化学变化的实质是分子先分裂成原子,原子再重新组合成新的分子,原子是化学变化中的最小粒子,故在化学变化中,一定发生改变的是分子;
(2)元素是具有相同质子数的某一类原子的统称,故元素的种类由质子数决定;
(3)原子是化学变化中的最小粒子,原子由原子核和核外电子构成。
14.【答案】(1)Si
(2)Al;Al2O3
【知识点】元素周期表的特点及其应用
【解析】【解答】(1)第14号元素的元素符号为 Si 。
(2)X3+与O2-的核外电子排布相同,那么氧离子的电子数是10,2个电子层,而X3+的电子数是10,则X的质子数是,故该元素符号是 Al ,它处在元素周期表中第三周期,它与氧元素组成的化合物是氧化铝,化学式为: Al2O3 。
【分析】根据质子数决定元素种类,阳离子的电子数=质子数-所带电荷数,阴离子的电子数=质子数+离子所带电荷数;在化合物中各元素的化合价的代数和为0来解答。
15.【答案】(1)Cu;Ni;钙;钠
(2)MnO2;Fe3O4;P2O5;H2O
(3)②④⑤⑦
【知识点】元素的符号及其意义;化学式的书写及意义;纯净物和混合物
【解析】【解答】(1)书写元素符号第一个字母大写,第二个字母小写,铜的元素符号为:Cu;镍的元素符号为:Ni;Ca是钙的元素符号,名称为:钙;Na是钠的元素符号,名称为:钠。
(2)根据二氧化锰的读法可知二氧化锰的化学式为:MnO2;根据四氧化三铁的读法可知四氧化三铁的化学式为:Fe3O4;据五氧化二磷的读法可知五氧化二磷的化学式为:P2O5;水是由氢氧元素组成的,氢元素化合价为+1价,氧元素化合价为-2价,根据正价在左负价在右,正负化合价代数和为零,化合价数值约到最简交叉写在元素右下角,水的化学式为:H2O。
(3)①可乐饮料中含有水、二氧化碳等多种物质,属于混合物;
②冰是水的固态形式,冰水混合物中只含有水一种物质,属于纯净物;
③矿泉水含有水和矿物质,属于混合物;
④液氧是氧气的液态形式,是由一种物质组成的,属于纯净物;
⑤二氧化硫是由一种物质组成的,属于纯净物;
⑥液态空气中含有液氮、液氧等多种物质,属于混合物;
⑦高锰酸钾是由一种物质组成的,属于纯净物;
⑧3%的过氧化氢溶液含有过氧化氢和水,属于混合物。
属于纯净物的有:②④⑤⑦。
【分析】(1)根据书写元素符号第一个字母大写,第二个字母小写分析。
(2)根据物质化学式的书写,正价在左负价在右,正负化合价代数和为零,化合价数值约到最简交叉写在元素右下角分析。
(3)由单一物质组成的物质称为纯净物。
混合物是由两种及两种以上纯物质(元素或化合物)没有经化学变化而组成的物质。
(1)书写元素符号第一个字母大写,第二个字母小写,铜的元素符号为:Cu;镍的元素符号为:Ni;Ca是钙的元素符号,名称为:钙;Na是钠的元素符号,名称为:钠;
(2)根据二氧化锰的读法可知二氧化锰的化学式为:MnO2;根据四氧化三铁的读法可知四氧化三铁的化学式为:Fe3O4;据五氧化二磷的读法可知五氧化二磷的化学式为:P2O5;水是由氢氧元素组成的,氢元素化合价为+1价,氧元素化合价为-2价,根据正价在左负价在右,正负化合价代数和为零,化合价数值约到最简交叉写在元素右下角,水的化学式为:H2O;
(3)①可乐饮料中含有水、二氧化碳等多种物质,属于混合物;②冰是水的固态形式,冰水混合物中只含有水一种物质,属于纯净物;③矿泉水含有水和矿物质,属于混合物;④液氧是氧气的液态形式,是由一种物质组成的,属于纯净物;⑤二氧化硫是由一种物质组成的,属于纯净物;⑥液态空气中含有液氮、液氧等多种物质,属于混合物;⑦高锰酸钾是由一种物质组成的,属于纯净物;⑧3%的过氧化氢溶液含有过氧化氢和水,属于混合物。
属于纯净物的有:②④⑤⑦。
16.【答案】(1)3P
(2)Ar
(3)H2O2
(4)
【知识点】元素的符号及其意义;化学式的书写及意义;常见元素与原子团的化合价
【解析】【解答】(1)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,3个磷原子表示为3P。
(2)稀有气体的化学式用元素符号表示,氩气属于稀有气体,其化学式为Ar。
(3)过氧化氢由过氧化氢分子构成,一个过氧化氢分子由两个氢原子、两个氧原子构成,过氧化氢的化学式为H2O2。
(4)化合价标在元素符号的正上方,正负号在前,价数在后。氧化铝中氧元素的化合价表示为。
【分析】根据化学符号的意义分析,元素符号表示元素和一个原子,表示多个原子元素符号前加相应数字;化学式表示一种物质和一个分子,表示多个分子,化学式前加相应系数;离子符号是在元素符号或原子团符号右上角标上所带电荷数,数字在前,正负号在后,表示多个离子,在符号前加相应数字;元素化合价标在元素符号的正上方,正负号在前,数字在后。
(1)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,3个磷原子表示为3P。
(2)稀有气体的化学式用元素符号表示,氩气属于稀有气体,其化学式为Ar。
(3)过氧化氢由过氧化氢分子构成,一个过氧化氢分子由两个氢原子、两个氧原子构成,过氧化氢的化学式为H2O2。
(4)化合价标在元素符号的正上方,正负号在前,价数在后。氧化铝中氧元素的化合价表示为。
17.【答案】(1)
(2)
【知识点】化学符号及其周围数字的意义
【解析】【解答】(1)元素符号前方的数字表示原子个数,故2个铝原子表示为:2Al;
(2)数字在分子符号前表示分子个数,3个氧分子表示为:3O2。
【分析】根据符号前面的数字表示微粒个数来解答。
(1)数字在元素符号前表示原子个数,2个铝原子表示为:2Al;
(2)数字在分子符号前表示分子个数,3个氧分子表示为:3O2。
18.【答案】(1)解:锆的相对原子质量为:。
(2)51;40
【知识点】原子的有关数量计算;相对原子质量和相对分子质量
【解析】【解得】(1)解: 锆的相对原子质量为: 。
(2)在原子中核电荷数=质子数=核外电子数。锆原子核外电子数为40;根据相对原子质量≈质子数+中子数,锆原子核内的中子数为:91-40=51。
【分析】(1)根据原子的相对质量就是以碳原子的质量的12分之一为标准量来比较来解答;
(2)根据在原子中,质子数等于电子数等于原子核电荷数;原子的相对质量=质子数+中子数来解答。
(1)见答案。
(2)原子中,核电荷数=质子数=核外电子数,锆原子核外电子数为40;根据相对原子质量≈质子数+中子数,锆原子核内的中子数为:91-40=51。故填:51;40。
19.【答案】(1)4
(2)10
(3)14
【知识点】化学式的相关计算
【解析】【解答】(1) 甘氨酸由碳、氢、氧、氮4种元素组成。
(2) 一个甘氨酸分子中含有 10个原子。
(3) 75g甘氨酸中含有氮元素的质量为.
【分析】(1)根据化学式确定物质的元素组成分析;
(2)根据化学式右下角数字为一个分子中原子个数分析;
(3)根据元素质量为物质质量×元素质量分数分析。
试题分析部分
1、试卷总体分布分析
总分:100分
分值分布 客观题(占比) 20.0(20.0%)
主观题(占比) 80.0(80.0%)
题量分布 客观题(占比) 10(52.6%)
主观题(占比) 9(47.4%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
选择题 10(52.6%) 20.0(20.0%)
非选择题 9(47.4%) 80.0(80.0%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (63.2%)
2 容易 (36.8%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 物质的微粒性 2.0(2.0%) 1
2 化合价规律和原则 2.0(2.0%) 9
3 人体的元素组成与元素对人体健康的重要作用 2.0(2.0%) 5
4 反应现象和本质的联系 2.0(2.0%) 4
5 分子的定义与分子的特性 10.0(10.0%) 12
6 原子的定义与构成 14.0(14.0%) 3,11
7 相对原子质量和相对分子质量 18.0(18.0%) 11,18
8 化学式的书写及意义 28.0(28.0%) 8,15,16
9 元素的概念 10.0(10.0%) 13
10 有关元素化合价的计算 2.0(2.0%) 10
11 元素的简单分类 2.0(2.0%) 7
12 元素周期表的特点及其应用 8.0(8.0%) 7,14
13 氧气的实验室制法 10.0(10.0%) 12
14 原子和离子的相互转化 4.0(4.0%) 2,3
15 自然界中的物质循环 10.0(10.0%) 12
16 化学式的相关计算 6.0(6.0%) 19
17 纯净物和混合物 18.0(18.0%) 15
18 分子和原子的区别和联系 12.0(12.0%) 2,13
19 元素的符号及其意义 28.0(28.0%) 6,15,16
20 常见元素与原子团的化合价 8.0(8.0%) 16
21 化合价与离子表示方法上的异同点 2.0(2.0%) 8
22 实验室常见的仪器及使用 10.0(10.0%) 12
23 催化剂的特点与催化作用 2.0(2.0%) 2
24 原子的有关数量计算 18.0(18.0%) 11,18
25 化学符号及其周围数字的意义 4.0(4.0%) 17
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
