北京理工大学附属中学2024-2025学年高二上学期10月月考化学试题(含答案)
文档属性
| 名称 | 北京理工大学附属中学2024-2025学年高二上学期10月月考化学试题(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-24 17:33:10 | ||
图片预览

文档简介
2024.10高二第一学期十月阶段练习-化学
原子量:H 1 C 12 O 16 Na 23 P 31 S 32 Cl 35.5 Ba 137
一、选择题(每题只有一个选项符合题意,1-20题每题3分,21-25题每题2分,共70分)
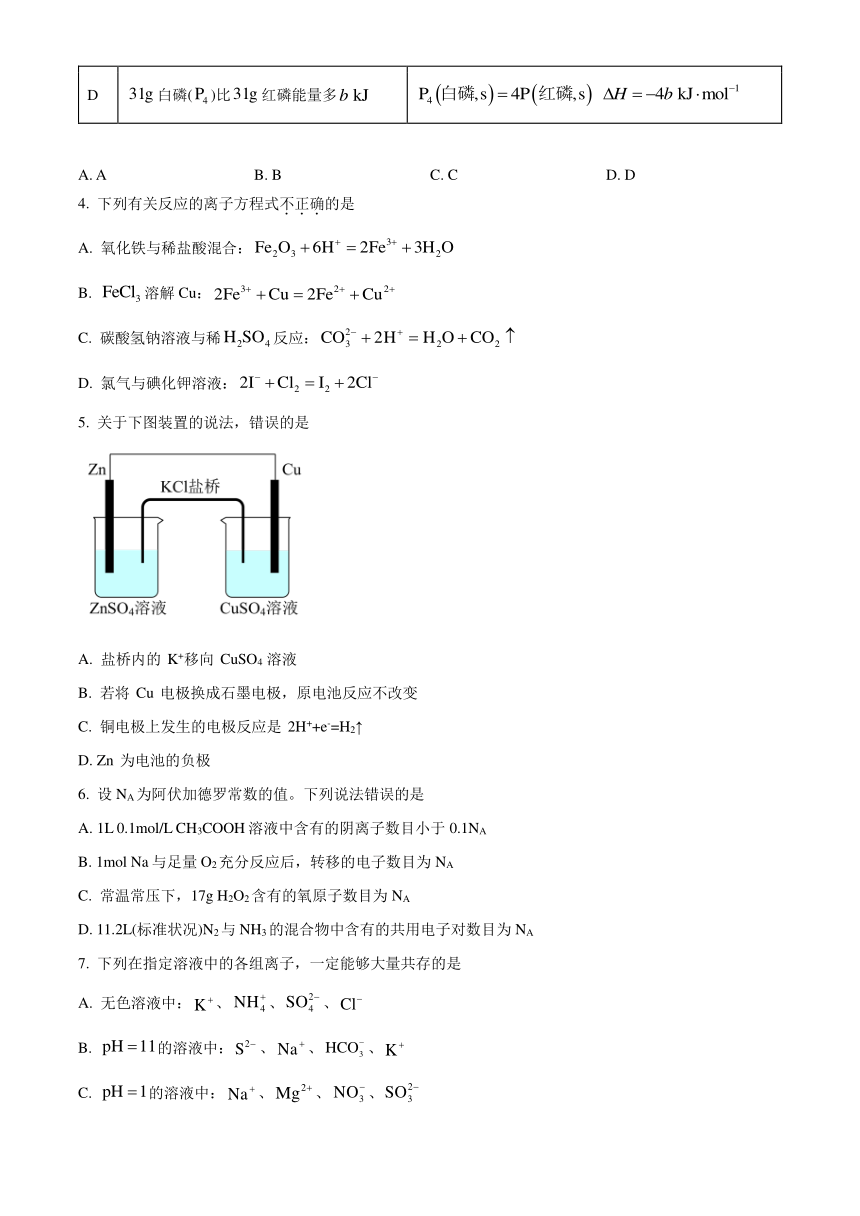
1. 关于中国传统文化中的“文房四宝”,下列叙述中不正确的是( )
A. 可用灼烧法鉴别毛笔笔头是否含蛋白质
B. 用墨写字利用了常温下碳的稳定性
C. 纸的主要成分纤维素属于合成高分子化合物
D. 用工具打磨石材制砚台的过程是物理变化
2. 用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )
A. AgNO3 CuCl2 Cu(NO3)2 B. KCl Na2SO4 CuSO4
C CaCl2 KOH NaNO3 D. HCl HNO3 K2SO4
3. 下列热化学方程式正确的是
选项 已知条件 热化学方程式
A 的燃烧热为
B 、完全反应,放出热量
C
D 白磷()比红磷能量多
A. A B. B C. C D. D
4. 下列有关反应的离子方程式不正确的是
A. 氧化铁与稀盐酸混合:
B. 溶解Cu:
C. 碳酸氢钠溶液与稀反应:
D. 氯气与碘化钾溶液:
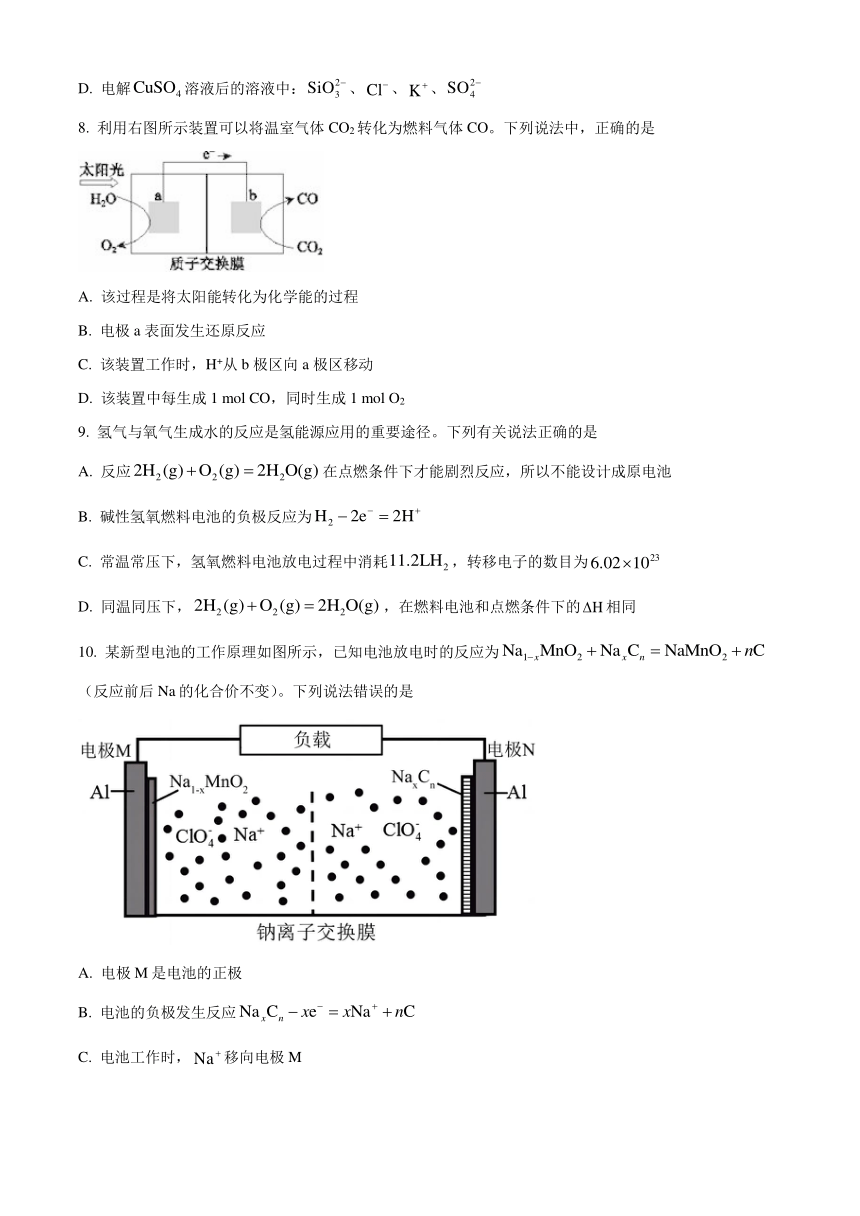
5. 关于下图装置的说法,错误的是
A. 盐桥内的 K+移向 CuSO4 溶液
B. 若将 Cu 电极换成石墨电极,原电池反应不改变
C. 铜电极上发生的电极反应是 2H++e-=H2↑
D. Zn 为电池的负极
6. 设NA为阿伏加德罗常数的值。下列说法错误的是
A. 1L 0.1mol/L CH3COOH溶液中含有的阴离子数目小于0.1NA
B. 1mol Na与足量O2充分反应后,转移的电子数目为NA
C. 常温常压下,17g H2O2含有的氧原子数目为NA
D. 11.2L(标准状况)N2与NH3的混合物中含有的共用电子对数目为NA
7. 下列在指定溶液中的各组离子,一定能够大量共存的是
A. 无色溶液中:、、、
B. 的溶液中:、、、
C. 的溶液中:、、、
D. 电解溶液后的溶液中:、、、
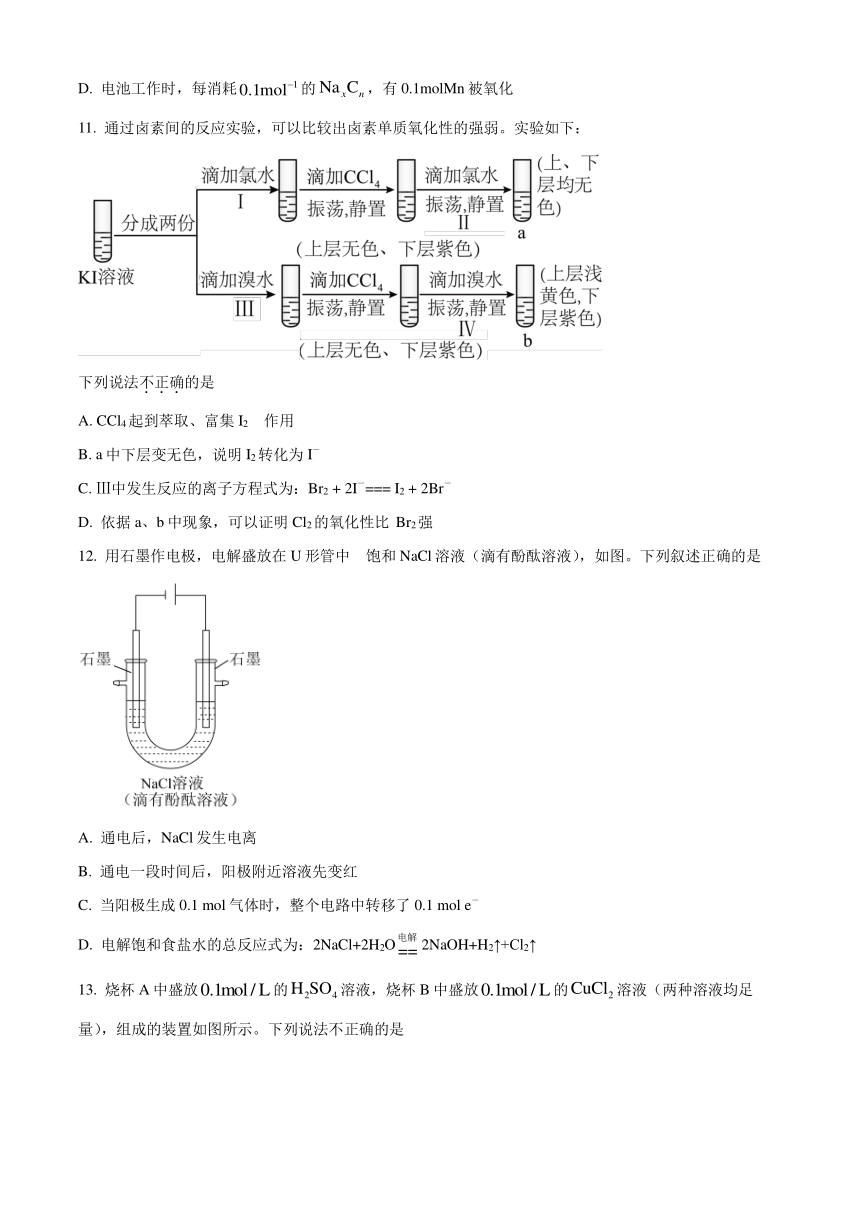
8. 利用右图所示装置可以将温室气体CO2转化为燃料气体CO。下列说法中,正确的是
A. 该过程是将太阳能转化为化学能的过程
B. 电极a表面发生还原反应
C. 该装置工作时,H+从b极区向a极区移动
D. 该装置中每生成1 mol CO,同时生成1 mol O2
9. 氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 反应在点燃条件下才能剧烈反应,所以不能设计成原电池
B. 碱性氢氧燃料电池的负极反应为
C. 常温常压下,氢氧燃料电池放电过程中消耗,转移电子的数目为
D. 同温同压下,,在燃料电池和点燃条件下的相同
10. 某新型电池的工作原理如图所示,已知电池放电时的反应为(反应前后Na的化合价不变)。下列说法错误的是
A. 电极M是电池的正极
B. 电池的负极发生反应
C. 电池工作时,移向电极M
D. 电池工作时,每消耗的,有0.1molMn被氧化
11. 通过卤素间的反应实验,可以比较出卤素单质氧化性的强弱。实验如下:
下列说法不正确的是
A. CCl4起到萃取、富集I2作用
B. a中下层变无色,说明I2转化为I-
C. Ⅲ中发生反应的离子方程式为:Br2 + 2I-=== I2 + 2Br-
D. 依据a、b中现象,可以证明Cl2的氧化性比 Br2强
12. 用石墨作电极,电解盛放在U形管中饱和NaCl溶液(滴有酚酞溶液),如图。下列叙述正确的是
A. 通电后,NaCl发生电离
B. 通电一段时间后,阳极附近溶液先变红
C. 当阳极生成0.1 mol气体时,整个电路中转移了0.1 mol e-
D. 电解饱和食盐水的总反应式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑
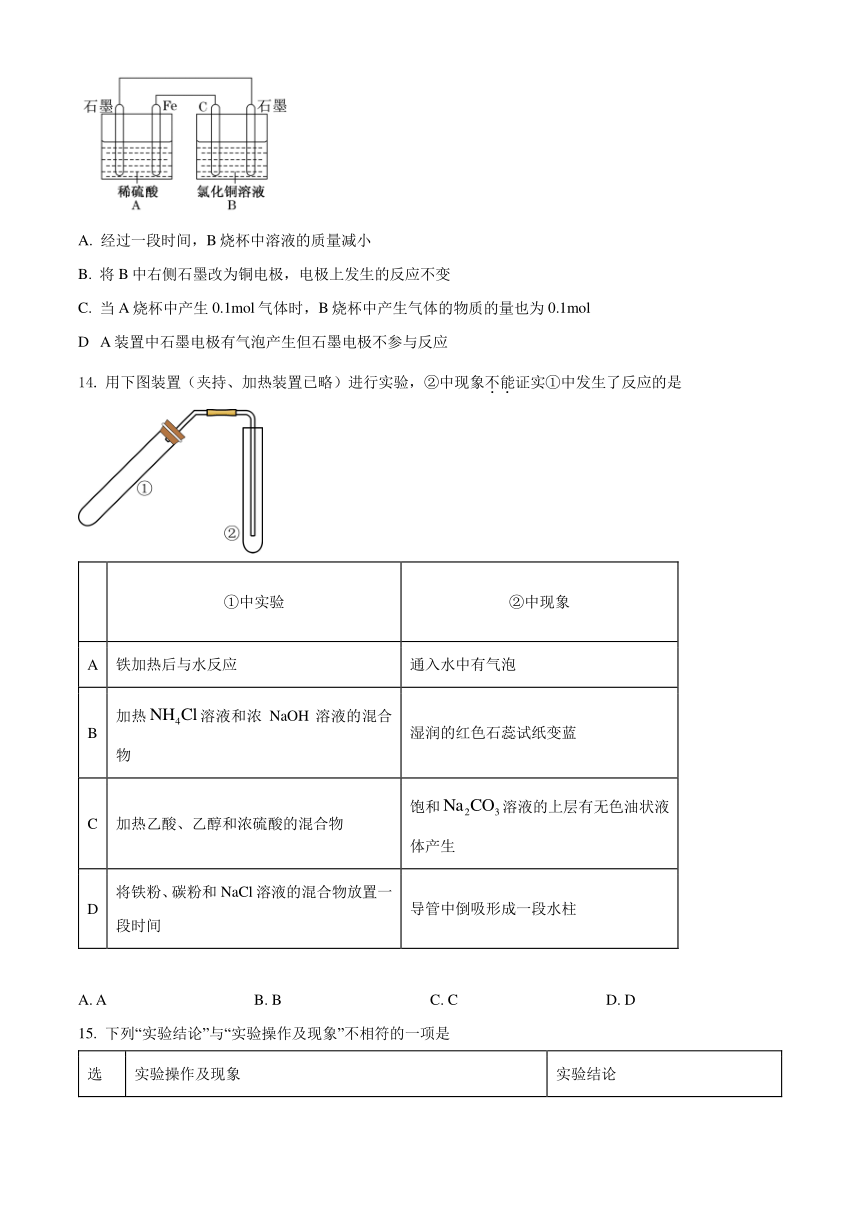
13. 烧杯A中盛放的溶液,烧杯B中盛放的溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是
A. 经过一段时间,B烧杯中溶液的质量减小
B. 将B中右侧石墨改为铜电极,电极上发生的反应不变
C. 当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
D A装置中石墨电极有气泡产生但石墨电极不参与反应
用下图装置(夹持、加热装置已略)进行实验,②中现象不能证实①中发生了反应的是
①中实验 ②中现象
A 铁加热后与水反应 通入水中有气泡
B 加热溶液和浓NaOH溶液的混合物 湿润的红色石蕊试纸变蓝
C 加热乙酸、乙醇和浓硫酸的混合物 饱和溶液的上层有无色油状液体产生
D 将铁粉、碳粉和NaCl溶液的混合物放置一段时间 导管中倒吸形成一段水柱
A. A B. B C. C D. D
15. 下列“实验结论”与“实验操作及现象”不相符的一项是
选项 实验操作及现象 实验结论
A 向某溶液中加入溶液,生成白色沉淀 该溶液中一定含有
B 将银白色的金属钠放置在空气中,钠表面很快变暗 金属钠具有还原性
C 向某溶液中加入溶液,生成白色沉淀 该溶液中可能含有
D 用玻璃棒蘸取氯水滴到蓝色石蕊试纸上,试纸先变红,随后褪色 氯水中含有酸性物质、漂白性物质
A. A B. B C. C D. D
16. 取和的混合溶液,加入过量溶液后得到29.02g白色沉淀,用过量稀硝酸处理产生气体2.24L(标准状况)。下列说法不正确的是
A. 混合溶液中的物质的量浓度0.1mol/L
B. 混合溶液中的物质的量浓度0.4mol/L
C. 29.02g白色沉淀用过量稀硝酸处理,沉淀质量减少19.7g
D. 处理沉淀消耗的硝酸的溶质的物质的量0.2mol
17. 工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
18. 执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法错误的是
A. 电解质溶液中的移向a电极
B. 该装置工作时b电极附近pH值减少
C. 呼出气体中酒精含量越高,产生的电流越大
D. a极上的电极反应式为
19. 用Na2FeO4 溶液氧化废水中的还原性污染物 M,为研究降解效果。设计如下对比实验探究温度、浓度、pH 对降解速率和效果的影响,实验测得 M 的浓度与时间关系如图所示,下列说法错误的是
实验编号 温度℃ pH
① 25 1
② 45 1
③ 25 7
④ 25 1
A. 实验①在 15min 内 M 的降解速率为 1.33×10-5mol/(L·min)
B. 实验①②说明升高温度,M 降解速率增大
C. 实验①③证明 pH 越高,越不利于 M 的降解
D. 实验②④说明 M 的浓度越小,降解的速率越慢
20. 二氧化碳的资源化利用是目前研究的热点问题之一,西北工业大学团队研究锂-二氧化碳二次电池,取得了重大科研成果。该电池放电时的总反应为:3CO2+4Li=2Li2CO3+C,下列说法正确的是
A. 该电池隔膜两侧的电解液a、b均可选用水性电解液
B. 放电时,电子从锂电极流出,最终通过电解质溶液流回锂电极,构成闭合回路
C. 放电时,若消耗3 mol CO2时,转移4 mol电子
D. 充电时,锂电极与外接电源的正极相连
二、填空题(共30分)
21. 某兴趣小组同学利用氧化还原反应设计了如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为,盐桥中装有饱和溶液。回答下列问题:
(1)发生氧化反应的烧杯是______(填“甲”或“乙”)。
(2)工作时,盐桥中的移向______(“甲”或“乙”)烧杯。
(3)甲烧杯中发生的电极反应为______。
22. 二甲醚被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
②
③
(1)则反应______。
(2)以下说法能说明反应达到平衡状态的有______。
A.和的浓度之比为3:1
B.单位时间内断裂3个同时断裂1个
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(3)如图所示装置,装置A是二甲醚燃料电池,已知该装置工作时电子从b极流出,a极流入。
①A池中a电极为电池的______极(填“正或负”),电极反应式为______。
②当装置A中消耗0.25mol二甲醚时,此时转移的电子的物质的量为______;装置A中溶液的pH会______(填写“增大”“减小”或“不变”)。
23. 以黄铜矿(主要成分二硫化亚铁铜)为原料,用溶液作浸取剂提取铜,总反应的离子方程式是。
(1)该反应中,体现______性。
(2)上述总反应的原理如图所示。负极的电极反应式是______。
(3)一定温度下,控制浸取剂,取三份相同质量黄铜矿粉末分别进行如下实验:
实验 操作 2小时后浸出率
Ⅰ 加入足量溶液 78.2
Ⅱ 加入足量溶液,通入空气 90.8
Ⅲ 加入足量溶液,再加入少量溶液 98.0
由实验Ⅲ推测,在浸取过程中作催化剂,催化原理是:ⅰ.,ⅱ.。
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量溶液,充分混合后静置。取上层清液,加入稀盐酸,观察到溶液中______,证明发生反应ⅰ。
b.取少量粉末,加入______溶液,充分混合后静置取上层清液,加入稀盐酸,有白色沉淀,证明发生反应ⅱ。
(4)用实验Ⅱ的浸取液电解提取铜的原理如图所示:
①电解初期,阴极没有铜析出。用电极反应式解释原因是______。
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是______。
参考答案
1. C
2. B
3. D
4. C
5. C
6. D
7. A
8. A
9. D
10. D
11. B
12. D
13. B
14. A
15. A
16. A
17. C
18. B
19. D
20. C
21. (1)乙 (2)乙
(3)+8H++5e-=Mn2++4H2O
22. (1) 246.1
(2)BDE
(3)①. 正 ②. O2+4e-+2H2O=4OH- ③. 3mol ④. 减小
23. (1)氧化
(2)CuFeS2-4e-=Fe2++2S+Cu2+
(3)①. 无明显现象 ②. Fe2(SO4)3
(4)①. Fe3++e-=Fe2+ ②. Fe2+在阳极失电子生成Fe3+,通过阴离子交换膜进入阳极室,Fe2(SO4)3溶液再生
原子量:H 1 C 12 O 16 Na 23 P 31 S 32 Cl 35.5 Ba 137
一、选择题(每题只有一个选项符合题意,1-20题每题3分,21-25题每题2分,共70分)
1. 关于中国传统文化中的“文房四宝”,下列叙述中不正确的是( )
A. 可用灼烧法鉴别毛笔笔头是否含蛋白质
B. 用墨写字利用了常温下碳的稳定性
C. 纸的主要成分纤维素属于合成高分子化合物
D. 用工具打磨石材制砚台的过程是物理变化
2. 用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )
A. AgNO3 CuCl2 Cu(NO3)2 B. KCl Na2SO4 CuSO4
C CaCl2 KOH NaNO3 D. HCl HNO3 K2SO4
3. 下列热化学方程式正确的是
选项 已知条件 热化学方程式
A 的燃烧热为
B 、完全反应,放出热量
C
D 白磷()比红磷能量多
A. A B. B C. C D. D
4. 下列有关反应的离子方程式不正确的是
A. 氧化铁与稀盐酸混合:
B. 溶解Cu:
C. 碳酸氢钠溶液与稀反应:
D. 氯气与碘化钾溶液:
5. 关于下图装置的说法,错误的是
A. 盐桥内的 K+移向 CuSO4 溶液
B. 若将 Cu 电极换成石墨电极,原电池反应不改变
C. 铜电极上发生的电极反应是 2H++e-=H2↑
D. Zn 为电池的负极
6. 设NA为阿伏加德罗常数的值。下列说法错误的是
A. 1L 0.1mol/L CH3COOH溶液中含有的阴离子数目小于0.1NA
B. 1mol Na与足量O2充分反应后,转移的电子数目为NA
C. 常温常压下,17g H2O2含有的氧原子数目为NA
D. 11.2L(标准状况)N2与NH3的混合物中含有的共用电子对数目为NA
7. 下列在指定溶液中的各组离子,一定能够大量共存的是
A. 无色溶液中:、、、
B. 的溶液中:、、、
C. 的溶液中:、、、
D. 电解溶液后的溶液中:、、、
8. 利用右图所示装置可以将温室气体CO2转化为燃料气体CO。下列说法中,正确的是
A. 该过程是将太阳能转化为化学能的过程
B. 电极a表面发生还原反应
C. 该装置工作时,H+从b极区向a极区移动
D. 该装置中每生成1 mol CO,同时生成1 mol O2
9. 氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 反应在点燃条件下才能剧烈反应,所以不能设计成原电池
B. 碱性氢氧燃料电池的负极反应为
C. 常温常压下,氢氧燃料电池放电过程中消耗,转移电子的数目为
D. 同温同压下,,在燃料电池和点燃条件下的相同
10. 某新型电池的工作原理如图所示,已知电池放电时的反应为(反应前后Na的化合价不变)。下列说法错误的是
A. 电极M是电池的正极
B. 电池的负极发生反应
C. 电池工作时,移向电极M
D. 电池工作时,每消耗的,有0.1molMn被氧化
11. 通过卤素间的反应实验,可以比较出卤素单质氧化性的强弱。实验如下:
下列说法不正确的是
A. CCl4起到萃取、富集I2作用
B. a中下层变无色,说明I2转化为I-
C. Ⅲ中发生反应的离子方程式为:Br2 + 2I-=== I2 + 2Br-
D. 依据a、b中现象,可以证明Cl2的氧化性比 Br2强
12. 用石墨作电极,电解盛放在U形管中饱和NaCl溶液(滴有酚酞溶液),如图。下列叙述正确的是
A. 通电后,NaCl发生电离
B. 通电一段时间后,阳极附近溶液先变红
C. 当阳极生成0.1 mol气体时,整个电路中转移了0.1 mol e-
D. 电解饱和食盐水的总反应式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑
13. 烧杯A中盛放的溶液,烧杯B中盛放的溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是
A. 经过一段时间,B烧杯中溶液的质量减小
B. 将B中右侧石墨改为铜电极,电极上发生的反应不变
C. 当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
D A装置中石墨电极有气泡产生但石墨电极不参与反应
用下图装置(夹持、加热装置已略)进行实验,②中现象不能证实①中发生了反应的是
①中实验 ②中现象
A 铁加热后与水反应 通入水中有气泡
B 加热溶液和浓NaOH溶液的混合物 湿润的红色石蕊试纸变蓝
C 加热乙酸、乙醇和浓硫酸的混合物 饱和溶液的上层有无色油状液体产生
D 将铁粉、碳粉和NaCl溶液的混合物放置一段时间 导管中倒吸形成一段水柱
A. A B. B C. C D. D
15. 下列“实验结论”与“实验操作及现象”不相符的一项是
选项 实验操作及现象 实验结论
A 向某溶液中加入溶液,生成白色沉淀 该溶液中一定含有
B 将银白色的金属钠放置在空气中,钠表面很快变暗 金属钠具有还原性
C 向某溶液中加入溶液,生成白色沉淀 该溶液中可能含有
D 用玻璃棒蘸取氯水滴到蓝色石蕊试纸上,试纸先变红,随后褪色 氯水中含有酸性物质、漂白性物质
A. A B. B C. C D. D
16. 取和的混合溶液,加入过量溶液后得到29.02g白色沉淀,用过量稀硝酸处理产生气体2.24L(标准状况)。下列说法不正确的是
A. 混合溶液中的物质的量浓度0.1mol/L
B. 混合溶液中的物质的量浓度0.4mol/L
C. 29.02g白色沉淀用过量稀硝酸处理,沉淀质量减少19.7g
D. 处理沉淀消耗的硝酸的溶质的物质的量0.2mol
17. 工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
18. 执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法错误的是
A. 电解质溶液中的移向a电极
B. 该装置工作时b电极附近pH值减少
C. 呼出气体中酒精含量越高,产生的电流越大
D. a极上的电极反应式为
19. 用Na2FeO4 溶液氧化废水中的还原性污染物 M,为研究降解效果。设计如下对比实验探究温度、浓度、pH 对降解速率和效果的影响,实验测得 M 的浓度与时间关系如图所示,下列说法错误的是
实验编号 温度℃ pH
① 25 1
② 45 1
③ 25 7
④ 25 1
A. 实验①在 15min 内 M 的降解速率为 1.33×10-5mol/(L·min)
B. 实验①②说明升高温度,M 降解速率增大
C. 实验①③证明 pH 越高,越不利于 M 的降解
D. 实验②④说明 M 的浓度越小,降解的速率越慢
20. 二氧化碳的资源化利用是目前研究的热点问题之一,西北工业大学团队研究锂-二氧化碳二次电池,取得了重大科研成果。该电池放电时的总反应为:3CO2+4Li=2Li2CO3+C,下列说法正确的是
A. 该电池隔膜两侧的电解液a、b均可选用水性电解液
B. 放电时,电子从锂电极流出,最终通过电解质溶液流回锂电极,构成闭合回路
C. 放电时,若消耗3 mol CO2时,转移4 mol电子
D. 充电时,锂电极与外接电源的正极相连
二、填空题(共30分)
21. 某兴趣小组同学利用氧化还原反应设计了如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为,盐桥中装有饱和溶液。回答下列问题:
(1)发生氧化反应的烧杯是______(填“甲”或“乙”)。
(2)工作时,盐桥中的移向______(“甲”或“乙”)烧杯。
(3)甲烧杯中发生的电极反应为______。
22. 二甲醚被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
②
③
(1)则反应______。
(2)以下说法能说明反应达到平衡状态的有______。
A.和的浓度之比为3:1
B.单位时间内断裂3个同时断裂1个
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(3)如图所示装置,装置A是二甲醚燃料电池,已知该装置工作时电子从b极流出,a极流入。
①A池中a电极为电池的______极(填“正或负”),电极反应式为______。
②当装置A中消耗0.25mol二甲醚时,此时转移的电子的物质的量为______;装置A中溶液的pH会______(填写“增大”“减小”或“不变”)。
23. 以黄铜矿(主要成分二硫化亚铁铜)为原料,用溶液作浸取剂提取铜,总反应的离子方程式是。
(1)该反应中,体现______性。
(2)上述总反应的原理如图所示。负极的电极反应式是______。
(3)一定温度下,控制浸取剂,取三份相同质量黄铜矿粉末分别进行如下实验:
实验 操作 2小时后浸出率
Ⅰ 加入足量溶液 78.2
Ⅱ 加入足量溶液,通入空气 90.8
Ⅲ 加入足量溶液,再加入少量溶液 98.0
由实验Ⅲ推测,在浸取过程中作催化剂,催化原理是:ⅰ.,ⅱ.。
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量溶液,充分混合后静置。取上层清液,加入稀盐酸,观察到溶液中______,证明发生反应ⅰ。
b.取少量粉末,加入______溶液,充分混合后静置取上层清液,加入稀盐酸,有白色沉淀,证明发生反应ⅱ。
(4)用实验Ⅱ的浸取液电解提取铜的原理如图所示:
①电解初期,阴极没有铜析出。用电极反应式解释原因是______。
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是______。
参考答案
1. C
2. B
3. D
4. C
5. C
6. D
7. A
8. A
9. D
10. D
11. B
12. D
13. B
14. A
15. A
16. A
17. C
18. B
19. D
20. C
21. (1)乙 (2)乙
(3)+8H++5e-=Mn2++4H2O
22. (1) 246.1
(2)BDE
(3)①. 正 ②. O2+4e-+2H2O=4OH- ③. 3mol ④. 减小
23. (1)氧化
(2)CuFeS2-4e-=Fe2++2S+Cu2+
(3)①. 无明显现象 ②. Fe2(SO4)3
(4)①. Fe3++e-=Fe2+ ②. Fe2+在阳极失电子生成Fe3+,通过阴离子交换膜进入阳极室,Fe2(SO4)3溶液再生
同课章节目录
