2.1 化学反应进行的方向 课件 (共16张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 2.1 化学反应进行的方向 课件 (共16张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-24 21:06:45 | ||
图片预览





文档简介
(共16张PPT)
化学反应的方向
1.了解焓变、熵变与反应方向的关系;
2.能综合运用焓变与熵变判断反应进行的方向。
生活中的自发过程
体系趋向于从高能量状态转换为低能量状态
体系趋向于从有序状态转换为无序状态
①NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l),ΔH< 0,
常温下能自发进行。
②2Na(s)+2H2O(l)=2NaOH(aq)+H2(g),ΔH<0,
常温下能自发进行。
③2N2O5(g)=4NO2(g)+O2(g),ΔH>0,
该反应在常温下能自发进行。
④CaCO3(s)=CaO(s)+CO2(g),ΔH>0,
该反应在常温下不能自发进行,但在较高温度下能自发进行。
观察以下反应,总结焓变ΔH与反应方向的关系
一、 反应焓变与反应方向的关系
反应焓变是与反应能否自发进行有关的一个因素,但不是唯一因素。
多数放热反应能自发进行(ΔH < 0)
少数吸热反应也能自发进行(ΔH > 0)
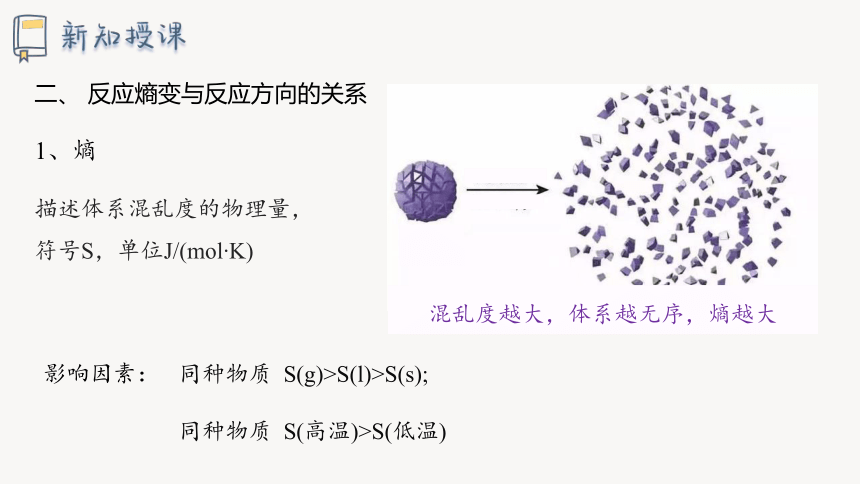
1、熵
影响因素:
同种物质 S(g)>S(l)>S(s);
混乱度越大,体系越无序,熵越大
同种物质 S(高温)>S(低温)
描述体系混乱度的物理量,
符号S,单位J/(mol K)
二、 反应熵变与反应方向的关系
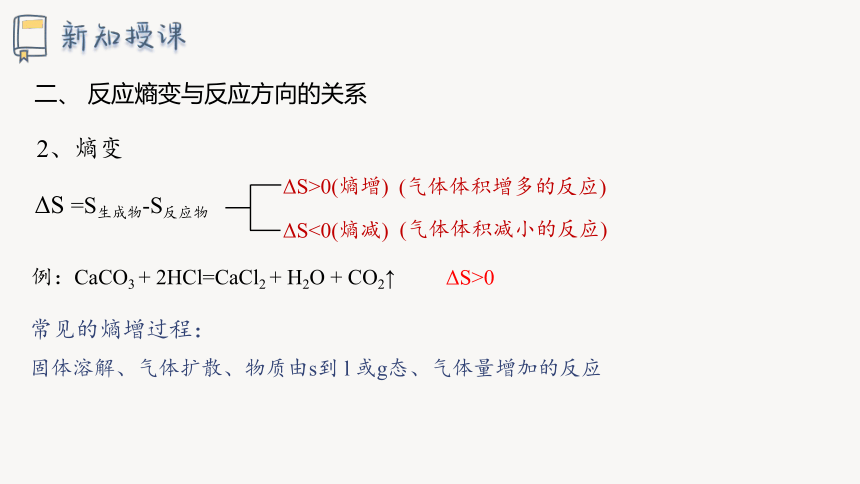
2、熵变
ΔS =S生成物-S反应物
(气体体积增多的反应)
(气体体积减小的反应)
ΔS>0(熵增)
ΔS<0(熵减)
常见的熵增过程:
固体溶解、气体扩散、物质由s到 l 或g态、气体量增加的反应
例:CaCO3 + 2HCl=CaCl2 + H2O + CO2↑
ΔS>0
二、 反应熵变与反应方向的关系
①2Na(s)+2H2O(l)=2NaOH(aq)+H2(g),ΔS>0,
常温下能自发进行。
②2N2O5(g)=4NO2(g)+O2(g),ΔS>0,
该反应在常温下能自发进行。
③2H2O2(aq)=2H2O(l)+O2(g),ΔS>0,
该反应在常温下能自发进行。
④Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l) ,ΔS<0,
该反应在常温下能自发进行。
观察以下反应,总结熵变ΔS与反应方向的关系
一般熵增反应有利于反应自发进行;
少数熵减反应在一定条件下也能自发进行。
熵变是反应能否自发进行有关的一个因素,但不是唯一因素。
二、 反应熵变与反应方向的关系
在温度、压强一定 ,自发反应总是向ΔH-TΔS<0的方向进行,直至达到平衡状态。
ΔH-TΔS > 0 反应不能自发进行
三、焓变与熵变对反应方向的共同影响
1、反应方向的判据
ΔH-TΔS < 0 反应能自发进行
ΔH-TΔS = 0 反应达到平衡状态
ΔG =ΔH-TΔS
焓变(ΔH) 熵变(ΔS) 反应在某状况下能否自发进行
复合判据ΔH-TΔS
2、温度与反应方向的关系
能自发进行
不能自发进行
取决于温度,低温自发
取决于温度,高温自发
反应的自发性只能判断反应的方向性,反应能否实现还要看具体条件
<0 >0
>0 <0
<0 <0
>0 >0
1、下列反应中,一定不能自发进行的是( )
A.2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78.03 kJ·mol-1 ΔS=1 110 J·mol-1·K-1
B.CO(g)=C(s,石墨)+ O2(g) ΔH=110.5 kJ·mol-1 ΔS=-89.36 J·mol-1·K-1
C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1 ΔS=280.1 J·mol-1·K-1
D.NH4HCO3(s)+CH3COOH(aq)=CO2(g)+ CH3COONH4(aq)+H2O(l) ΔH=37.301 kJ·mol-1 ΔS=184.05 J·mol-1·K-1
B
2、已知吸热反应:2CO(g)=2C(s)+O2(g) ,设ΔH和ΔS不随温度而变,下列说法中正确的是( )
A.低温下能自发进行
B.高温下能自发进行
C.任何温度下都能自发进行
D.任何温度下都不能自发进行
D
3、下列对熵变的判断中不正确的是( )
A.少量的食盐溶于水中:ΔS>0
B.炭和氧气反应生成CO(g):ΔS>0
C.气态水变成液态水:ΔS>0
D.CaCO3(s)受热分解为CaO(s)和CO2(g):ΔS>0
D
4、25 ℃和1.01×105 Pa时,2N2O5(g)=4NO2(g)+O2(g) ΔH=56.7 kJ/mol
能自发进行,其原因是( )
A.该反应是吸热反应 B.该反应是放热反应
C.该反应是熵减小的反应 D.熵增效应大于能量效应
D
化学反应的方向
1.了解焓变、熵变与反应方向的关系;
2.能综合运用焓变与熵变判断反应进行的方向。
生活中的自发过程
体系趋向于从高能量状态转换为低能量状态
体系趋向于从有序状态转换为无序状态
①NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l),ΔH< 0,
常温下能自发进行。
②2Na(s)+2H2O(l)=2NaOH(aq)+H2(g),ΔH<0,
常温下能自发进行。
③2N2O5(g)=4NO2(g)+O2(g),ΔH>0,
该反应在常温下能自发进行。
④CaCO3(s)=CaO(s)+CO2(g),ΔH>0,
该反应在常温下不能自发进行,但在较高温度下能自发进行。
观察以下反应,总结焓变ΔH与反应方向的关系
一、 反应焓变与反应方向的关系
反应焓变是与反应能否自发进行有关的一个因素,但不是唯一因素。
多数放热反应能自发进行(ΔH < 0)
少数吸热反应也能自发进行(ΔH > 0)
1、熵
影响因素:
同种物质 S(g)>S(l)>S(s);
混乱度越大,体系越无序,熵越大
同种物质 S(高温)>S(低温)
描述体系混乱度的物理量,
符号S,单位J/(mol K)
二、 反应熵变与反应方向的关系
2、熵变
ΔS =S生成物-S反应物
(气体体积增多的反应)
(气体体积减小的反应)
ΔS>0(熵增)
ΔS<0(熵减)
常见的熵增过程:
固体溶解、气体扩散、物质由s到 l 或g态、气体量增加的反应
例:CaCO3 + 2HCl=CaCl2 + H2O + CO2↑
ΔS>0
二、 反应熵变与反应方向的关系
①2Na(s)+2H2O(l)=2NaOH(aq)+H2(g),ΔS>0,
常温下能自发进行。
②2N2O5(g)=4NO2(g)+O2(g),ΔS>0,
该反应在常温下能自发进行。
③2H2O2(aq)=2H2O(l)+O2(g),ΔS>0,
该反应在常温下能自发进行。
④Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l) ,ΔS<0,
该反应在常温下能自发进行。
观察以下反应,总结熵变ΔS与反应方向的关系
一般熵增反应有利于反应自发进行;
少数熵减反应在一定条件下也能自发进行。
熵变是反应能否自发进行有关的一个因素,但不是唯一因素。
二、 反应熵变与反应方向的关系
在温度、压强一定 ,自发反应总是向ΔH-TΔS<0的方向进行,直至达到平衡状态。
ΔH-TΔS > 0 反应不能自发进行
三、焓变与熵变对反应方向的共同影响
1、反应方向的判据
ΔH-TΔS < 0 反应能自发进行
ΔH-TΔS = 0 反应达到平衡状态
ΔG =ΔH-TΔS
焓变(ΔH) 熵变(ΔS) 反应在某状况下能否自发进行
复合判据ΔH-TΔS
2、温度与反应方向的关系
能自发进行
不能自发进行
取决于温度,低温自发
取决于温度,高温自发
反应的自发性只能判断反应的方向性,反应能否实现还要看具体条件
<0 >0
>0 <0
<0 <0
>0 >0
1、下列反应中,一定不能自发进行的是( )
A.2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78.03 kJ·mol-1 ΔS=1 110 J·mol-1·K-1
B.CO(g)=C(s,石墨)+ O2(g) ΔH=110.5 kJ·mol-1 ΔS=-89.36 J·mol-1·K-1
C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1 ΔS=280.1 J·mol-1·K-1
D.NH4HCO3(s)+CH3COOH(aq)=CO2(g)+ CH3COONH4(aq)+H2O(l) ΔH=37.301 kJ·mol-1 ΔS=184.05 J·mol-1·K-1
B
2、已知吸热反应:2CO(g)=2C(s)+O2(g) ,设ΔH和ΔS不随温度而变,下列说法中正确的是( )
A.低温下能自发进行
B.高温下能自发进行
C.任何温度下都能自发进行
D.任何温度下都不能自发进行
D
3、下列对熵变的判断中不正确的是( )
A.少量的食盐溶于水中:ΔS>0
B.炭和氧气反应生成CO(g):ΔS>0
C.气态水变成液态水:ΔS>0
D.CaCO3(s)受热分解为CaO(s)和CO2(g):ΔS>0
D
4、25 ℃和1.01×105 Pa时,2N2O5(g)=4NO2(g)+O2(g) ΔH=56.7 kJ/mol
能自发进行,其原因是( )
A.该反应是吸热反应 B.该反应是放热反应
C.该反应是熵减小的反应 D.熵增效应大于能量效应
D
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
