2.2 课时1 化学平衡常数 课件 (共15张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 2.2 课时1 化学平衡常数 课件 (共15张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-24 21:08:03 | ||
图片预览






文档简介
(共15张PPT)
化学平衡常数
1.认识化学平衡常数是表征反应限度的物理量,知道化学平衡常数的含义,能书写平衡常数表达式,能进行平衡常数的简单计算;
2.能利用平衡常数和浓度商的关系判断化学反应是否达到平衡及平衡移动的方向。
化学平衡状态的概念:如果外界条件(______、______、______等)不发生改变,当_______反应进行到一定程度时,__________与__________相等,反应物的________与生成物的_______不再改变,达到一种表面静止的状态,称为“化学平衡状态”,简称化学平衡。化学平衡研究的对象是___________。
压强
温度
浓度
正反应速率
可逆
逆反应速率
浓度
浓度
可逆反应
在工业生产和实验室中,人们会遇到各种各样的可逆反应,如合成氨的反应:
N2(g)+3H2(g) 2NH3(g)
高温、高压
催化剂
该反应在一定条件下不可能进行完全,即存在一定的限度,而反应限度的大小对于生产和生活实际有着直接的影响。
如何定量地描述化学反应的限度呢?
研究表明,可逆反应在适当条件下进行一段时间后一定会达到化学平衡状态。此时,平衡混合物的组成不再随时间的延续而变化,反应达到一定的限度。在研究了大量实验的基础上,人们发现可以用化学平衡常数来定量描述化学反应的限度。
那么什么是化学平衡常数?该如何表示?如何计算?怎么用它来比较反应的限度大小呢?
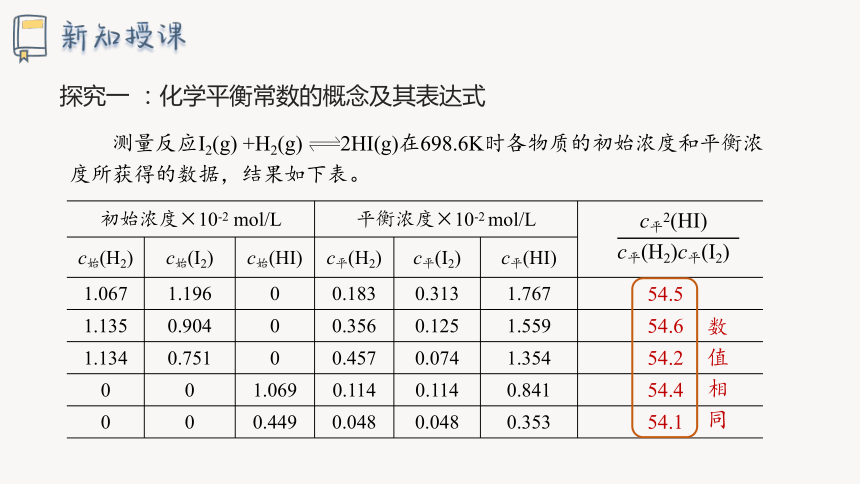
探究一 :化学平衡常数的概念及其表达式
测量反应I2(g) +H2(g) 2HI(g)在698.6K时各物质的初始浓度和平衡浓度所获得的数据,结果如下表。
初始浓度×10-2 mol/L 平衡浓度×10-2 mol/L
c始(H2) c始(I2) c始(HI) c平(H2) c平(I2) c平(HI)
1.067 1.196 0 0.183 0.313 1.767
1.135 0.904 0 0.356 0.125 1.559
1.134 0.751 0 0.457 0.074 1.354
0 0 1.069 0.114 0.114 0.841
0 0 0.449 0.048 0.048 0.353
c平2(HI)
c平(H2)c平(I2)
54.5
54.6
54.2
54.1
54.4
数值相同
(1)相同温度,达到化学平衡状态时 的数值相同吗?
c平2(HI)
c平(H2)c平(I2)
相同,是个常数。
(2)这个常数与反应的起始浓度大小有关吗?
无关。
(3)这个常数与正向建立还是逆向建立平衡有关系吗?
无关。即与平衡建立的过程无关。
化学平衡常数
一定温度下,当一个可逆反应达到平衡状态时,生成物浓度以化学计量数为指数的幂的乘积与反应物浓度以化学计量数为指数的幂的乘积的比值是一个常数。这个常数就是该反应的化学平衡常数(简称平衡常数,用K表示)。
对于: a A(g)+b B(g) c C(g)+d D(g)
c平(A) c平(B)
K=
c
c平(C) c平(D)
d
a
b
注意:对于有纯固体或纯液体参与的反应,纯固体或纯液体不列入平衡常数的表达式中。
写出下表中各反应的平衡常数表达式和单位。
反应 K 单位
① 1/2N2(g)+3/2H2 (g) NH3(g) (mol·L-1)-1
② N2(g)+3H2 (g) 2NH3 (g) (mol·L-1)-2
③ 2NH3(g) N2(g)+3H2 (g) (mol·L-1)2
c平(NH3)
c平(N2)1/2c平(H2)3/2
c平(NH3)2
c平(N2)c平(H2)3
c平(N2)c平(H2)3
c平(NH3)2
对于一个反应,其平衡常数的表达式是唯一的吗?平衡常数的表达式与哪些因素有关?
不唯一。化学平衡常数的表达式取决于化学方程式的系数,对于确定反应还与温度有关。
对于一可逆反应,其正反应和逆反应的K有什么关系?
互为倒数,单位不同。
如果浓度的单位是mol L-1,将浓度单位代入化学平衡常数表达式,可得到K的单位。由上述结果分析K的单位与反应的化学方程式存在什么关系?
K的单位与化学方程式的书写方式相对应。
反应 K 单位
NH3 H2O(aq) NH4+(aq)+OH—(aq)
FeO(s)+CO(g) Fe(s)+CO2(g)
AgCI(s) Ag+(aq)+CI—(aq)
写出下表中各反应的平衡常数表达式和单位。
c平(NH4+)c平(OH-)
c平(NH3 H2O)
c平(CO2)
c平(CO)
c平(Ag+)c平(Cl-)
mol·L-1
1
(mol·L-1)2
探究二:化学平衡常数意义及应用
使用平衡常数应注意的问题:
(1)化学平衡常数只受温度影响,与反应物或生成物的浓度变化无关。
C(s)+H2O(g)??CO(g)+H2(g)
FeO(s)+CO(g)??Fe(s)+CO2(g)
(2)在平衡常数表达式中,水(液态)的浓度、固体物质的浓度不写。
反映了化学反应可能进行的程度,平衡常数的数值越大,说明反应进行得越完全。
K>105或106时 ,反应进行的较完全;
K<10-5或10-6时,反应很难正向进行。
如何判断某温度下可逆反应是否达到平衡状态?
对于可逆反应aA(g)+bB(g) cC(g)+dD(g)
达到平衡状态时, K=
任意状态时:
浓度商Q =
cc(C)·cd(D)
ca(A)·cb(B)
在某温度下,用浓度商Q与K比较大小来判断是否达到平衡
Q = K 反应状态 。
Q < K 反应状态 。
Q > K 反应状态 。
平衡状态
反应正向进行
反应逆向进行
化学平衡常数
1.认识化学平衡常数是表征反应限度的物理量,知道化学平衡常数的含义,能书写平衡常数表达式,能进行平衡常数的简单计算;
2.能利用平衡常数和浓度商的关系判断化学反应是否达到平衡及平衡移动的方向。
化学平衡状态的概念:如果外界条件(______、______、______等)不发生改变,当_______反应进行到一定程度时,__________与__________相等,反应物的________与生成物的_______不再改变,达到一种表面静止的状态,称为“化学平衡状态”,简称化学平衡。化学平衡研究的对象是___________。
压强
温度
浓度
正反应速率
可逆
逆反应速率
浓度
浓度
可逆反应
在工业生产和实验室中,人们会遇到各种各样的可逆反应,如合成氨的反应:
N2(g)+3H2(g) 2NH3(g)
高温、高压
催化剂
该反应在一定条件下不可能进行完全,即存在一定的限度,而反应限度的大小对于生产和生活实际有着直接的影响。
如何定量地描述化学反应的限度呢?
研究表明,可逆反应在适当条件下进行一段时间后一定会达到化学平衡状态。此时,平衡混合物的组成不再随时间的延续而变化,反应达到一定的限度。在研究了大量实验的基础上,人们发现可以用化学平衡常数来定量描述化学反应的限度。
那么什么是化学平衡常数?该如何表示?如何计算?怎么用它来比较反应的限度大小呢?
探究一 :化学平衡常数的概念及其表达式
测量反应I2(g) +H2(g) 2HI(g)在698.6K时各物质的初始浓度和平衡浓度所获得的数据,结果如下表。
初始浓度×10-2 mol/L 平衡浓度×10-2 mol/L
c始(H2) c始(I2) c始(HI) c平(H2) c平(I2) c平(HI)
1.067 1.196 0 0.183 0.313 1.767
1.135 0.904 0 0.356 0.125 1.559
1.134 0.751 0 0.457 0.074 1.354
0 0 1.069 0.114 0.114 0.841
0 0 0.449 0.048 0.048 0.353
c平2(HI)
c平(H2)c平(I2)
54.5
54.6
54.2
54.1
54.4
数值相同
(1)相同温度,达到化学平衡状态时 的数值相同吗?
c平2(HI)
c平(H2)c平(I2)
相同,是个常数。
(2)这个常数与反应的起始浓度大小有关吗?
无关。
(3)这个常数与正向建立还是逆向建立平衡有关系吗?
无关。即与平衡建立的过程无关。
化学平衡常数
一定温度下,当一个可逆反应达到平衡状态时,生成物浓度以化学计量数为指数的幂的乘积与反应物浓度以化学计量数为指数的幂的乘积的比值是一个常数。这个常数就是该反应的化学平衡常数(简称平衡常数,用K表示)。
对于: a A(g)+b B(g) c C(g)+d D(g)
c平(A) c平(B)
K=
c
c平(C) c平(D)
d
a
b
注意:对于有纯固体或纯液体参与的反应,纯固体或纯液体不列入平衡常数的表达式中。
写出下表中各反应的平衡常数表达式和单位。
反应 K 单位
① 1/2N2(g)+3/2H2 (g) NH3(g) (mol·L-1)-1
② N2(g)+3H2 (g) 2NH3 (g) (mol·L-1)-2
③ 2NH3(g) N2(g)+3H2 (g) (mol·L-1)2
c平(NH3)
c平(N2)1/2c平(H2)3/2
c平(NH3)2
c平(N2)c平(H2)3
c平(N2)c平(H2)3
c平(NH3)2
对于一个反应,其平衡常数的表达式是唯一的吗?平衡常数的表达式与哪些因素有关?
不唯一。化学平衡常数的表达式取决于化学方程式的系数,对于确定反应还与温度有关。
对于一可逆反应,其正反应和逆反应的K有什么关系?
互为倒数,单位不同。
如果浓度的单位是mol L-1,将浓度单位代入化学平衡常数表达式,可得到K的单位。由上述结果分析K的单位与反应的化学方程式存在什么关系?
K的单位与化学方程式的书写方式相对应。
反应 K 单位
NH3 H2O(aq) NH4+(aq)+OH—(aq)
FeO(s)+CO(g) Fe(s)+CO2(g)
AgCI(s) Ag+(aq)+CI—(aq)
写出下表中各反应的平衡常数表达式和单位。
c平(NH4+)c平(OH-)
c平(NH3 H2O)
c平(CO2)
c平(CO)
c平(Ag+)c平(Cl-)
mol·L-1
1
(mol·L-1)2
探究二:化学平衡常数意义及应用
使用平衡常数应注意的问题:
(1)化学平衡常数只受温度影响,与反应物或生成物的浓度变化无关。
C(s)+H2O(g)??CO(g)+H2(g)
FeO(s)+CO(g)??Fe(s)+CO2(g)
(2)在平衡常数表达式中,水(液态)的浓度、固体物质的浓度不写。
反映了化学反应可能进行的程度,平衡常数的数值越大,说明反应进行得越完全。
K>105或106时 ,反应进行的较完全;
K<10-5或10-6时,反应很难正向进行。
如何判断某温度下可逆反应是否达到平衡状态?
对于可逆反应aA(g)+bB(g) cC(g)+dD(g)
达到平衡状态时, K=
任意状态时:
浓度商Q =
cc(C)·cd(D)
ca(A)·cb(B)
在某温度下,用浓度商Q与K比较大小来判断是否达到平衡
Q = K 反应状态 。
Q < K 反应状态 。
Q > K 反应状态 。
平衡状态
反应正向进行
反应逆向进行
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
