2.2 课时4 压强对化学平衡的影响 平衡移动原理 课件 (共19张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 2.2 课时4 压强对化学平衡的影响 平衡移动原理 课件 (共19张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 34.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-24 23:52:45 | ||
图片预览






文档简介
(共19张PPT)
压强对化学平衡的影响
平衡移动原理
1.了解压强对化学平衡的影响,并能判断平衡移动的方向。
2.掌握勒夏特列原理的概念。
如果改变压强(容积),以下反应各物质的浓度会如何变化? 气体颜色如何变化?
红棕色
无色
2NO2(g) N2O4(g)
一、压强对化学平衡的影响
在其他条件不变的情况下,压强对化学平衡的影响规律
增大压强
Q=K
平衡不移动
Q>K
平衡逆向(气体分子总数减小)移动
Q<K
平衡正向(气体分子总数减小)移动
Δvg=0
Δvg>0
Δvg<0
Δvg=(化学方程式中气态反应产物化学式前系数之和)-(化学方程式中气态反应物化学式前系数之和)。
在其他条件不变的情况下,压强对化学平衡的影响规律
减小压强
Δvg=0
Δvg>0
Δvg<0
Q=K
平衡不移动
Q<K
平衡正向(气体分子总数增大)移动
Q>K
平衡逆向(气体分子总数增大)移动
Δvg=(化学方程式中气态反应产物化学式前系数之和)-(化学方程式中气态反应物化学式前系数之和)。
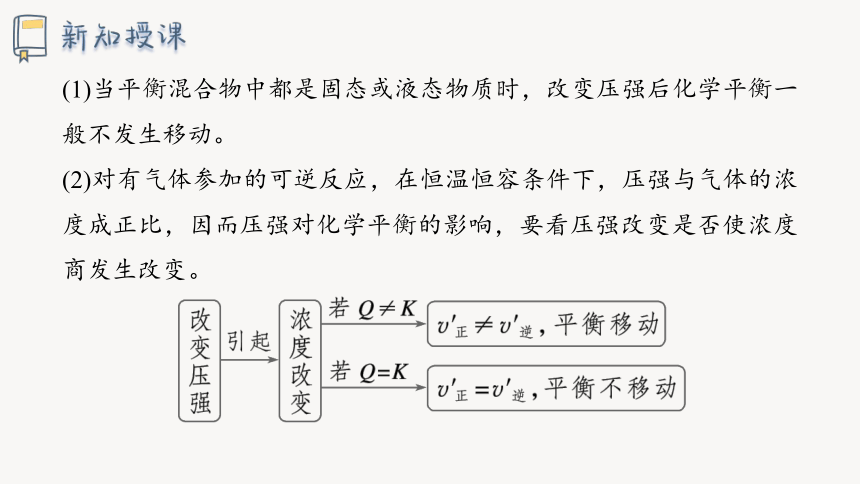
(1)当平衡混合物中都是固态或液态物质时,改变压强后化学平衡一般不发生移动。
(2)对有气体参加的可逆反应,在恒温恒容条件下,压强与气体的浓度成正比,因而压强对化学平衡的影响,要看压强改变是否使浓度商发生改变。
在密闭容器中发生反应N2(g)+3H2(g) 2NH3(g),达到平衡状态。
(1)保持温度、容积不变,再充入少量He。容器内压强增大平衡是否移动,阐述判断的理由。
不移动。因为容器容积不变,则各物质的浓度未发生变化,Q=K,则平衡不移动。
保持温度、容器压强不变,再充入少量He。容器的容积如何变化?平衡移动方向如何?简述判断的方法。
容积增大,平衡逆向移动。扩大容器的容积,相当于减小压强,平衡向气体体积增大的方向移动,该反应逆向移动。或从Q变化分析,此时Q>K。
充入“惰性”气体对化学平衡的影响
小结:外因对化学平衡的影响
条件的改变(其他条件不变) 化学平衡的移动
浓度 增大反应物浓度或减小反应产物浓度
减小反应物浓度或增大反应产物浓度
压强(对有气体参加的反应) 反应前后气体分子数改变 增大压强
减小压强
反应前后气体分子数不变 改变压强
向正反应方向移动
向逆反应方向移动
向气体分子数目减小的方向移动
向气体分子数目增大的方向移动
平衡不移动
条件的改变(其他条件不变) 化学平衡的移动
温度 升高温度
降低温度
催化剂 使用催化剂
向吸热反应方向移动
向放热反应方向移动
平衡不移动
如果改变一个条件,平衡就向着能够减弱这种改变的方向移动
二、勒·夏特列原理
如果改变平衡体系的一个条件(如温度、浓度或压强),平衡将向减弱这个改变的方向移动。
适用范围:
已达到平衡的反应体系
勒 夏特列
对原理中“减弱这个改变”的理解
“减弱”不等于“消除”,更不是“扭转”
缩小体积增大压强,混合气体颜色先加深,后变浅,达到新的平衡后混合体系颜色比原平衡时颜色深。
2NO2(g)(红棕色) N2O4(g)(无色)
1.常温下,一定体积的密闭容器中,充入NO2和N2O4的混合气体,反应2NO2(g)(红棕色) N2O4(g)(无色)达到平衡。
(1)若将容器的体积缩小为原来的一半,平衡向_______方向移动,平衡后气体的颜色与原来相比_____(填“加深”“变浅”或“不变”)。
(2)从K与Q的视角论证平衡正向移动的原因:_____________________
_______________________________________________________________________________________________。
正反应
加深
2.下列事实中,不能用勒·夏特列原理解释的是____(填字母)。
A.溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对2H2O2 2H2O+O2的反应,使用MnO2可加快制备O2的反应速率
C.反应:CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0,升高温度,平衡
向逆反应方向移动
D.合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,为使氨的产率提
高,理论上应采取低温高压的措施
E.H2(g)+I2(g) 2HI(g),缩小体积加压颜色加深
BE
3.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g),平衡时测得C的浓度为0.50 mol·L-1。保持温度不变,将容器的容积压缩到原来的一半,再达到平衡时,测得C的浓度变为0.90 mol·L-1。
(1)压缩容积时,平衡是否发生移动?移动的方向如何?
发生移动,平衡逆向移动
(2)C的体积分数_____(填“增大”“减小”或“不变”)。
(3)x+y z(填“>”“<”或“=”)。
减小
<
4.在一定温度下,反应mA(g)+nB(g) pC(g)+qD(g)达到平衡,完成下列填空:
(1)若m+n>p+q,缩小容器的容积,增大压强[课下研究m+n①化学平衡向 方向移动,平衡后c平(A) (填“增大”“减小”或“不变”,下同),c平(D) ,B的转化率 。
正反应
增大
增大
增大
②在图中补全,t1时,增大压强后的v-t图像。
(2)若m+n=p+q,扩大容器的容积,
①Q K,化学平衡 移动,c平(A) ,c平(D) ,B的转化率 。
②在图中补全,t1时,减小压强后的v-t图像。
=
不
减小
减小
不变
压强对化学平衡的影响
平衡移动原理
1.了解压强对化学平衡的影响,并能判断平衡移动的方向。
2.掌握勒夏特列原理的概念。
如果改变压强(容积),以下反应各物质的浓度会如何变化? 气体颜色如何变化?
红棕色
无色
2NO2(g) N2O4(g)
一、压强对化学平衡的影响
在其他条件不变的情况下,压强对化学平衡的影响规律
增大压强
Q=K
平衡不移动
Q>K
平衡逆向(气体分子总数减小)移动
Q<K
平衡正向(气体分子总数减小)移动
Δvg=0
Δvg>0
Δvg<0
Δvg=(化学方程式中气态反应产物化学式前系数之和)-(化学方程式中气态反应物化学式前系数之和)。
在其他条件不变的情况下,压强对化学平衡的影响规律
减小压强
Δvg=0
Δvg>0
Δvg<0
Q=K
平衡不移动
Q<K
平衡正向(气体分子总数增大)移动
Q>K
平衡逆向(气体分子总数增大)移动
Δvg=(化学方程式中气态反应产物化学式前系数之和)-(化学方程式中气态反应物化学式前系数之和)。
(1)当平衡混合物中都是固态或液态物质时,改变压强后化学平衡一般不发生移动。
(2)对有气体参加的可逆反应,在恒温恒容条件下,压强与气体的浓度成正比,因而压强对化学平衡的影响,要看压强改变是否使浓度商发生改变。
在密闭容器中发生反应N2(g)+3H2(g) 2NH3(g),达到平衡状态。
(1)保持温度、容积不变,再充入少量He。容器内压强增大平衡是否移动,阐述判断的理由。
不移动。因为容器容积不变,则各物质的浓度未发生变化,Q=K,则平衡不移动。
保持温度、容器压强不变,再充入少量He。容器的容积如何变化?平衡移动方向如何?简述判断的方法。
容积增大,平衡逆向移动。扩大容器的容积,相当于减小压强,平衡向气体体积增大的方向移动,该反应逆向移动。或从Q变化分析,此时Q>K。
充入“惰性”气体对化学平衡的影响
小结:外因对化学平衡的影响
条件的改变(其他条件不变) 化学平衡的移动
浓度 增大反应物浓度或减小反应产物浓度
减小反应物浓度或增大反应产物浓度
压强(对有气体参加的反应) 反应前后气体分子数改变 增大压强
减小压强
反应前后气体分子数不变 改变压强
向正反应方向移动
向逆反应方向移动
向气体分子数目减小的方向移动
向气体分子数目增大的方向移动
平衡不移动
条件的改变(其他条件不变) 化学平衡的移动
温度 升高温度
降低温度
催化剂 使用催化剂
向吸热反应方向移动
向放热反应方向移动
平衡不移动
如果改变一个条件,平衡就向着能够减弱这种改变的方向移动
二、勒·夏特列原理
如果改变平衡体系的一个条件(如温度、浓度或压强),平衡将向减弱这个改变的方向移动。
适用范围:
已达到平衡的反应体系
勒 夏特列
对原理中“减弱这个改变”的理解
“减弱”不等于“消除”,更不是“扭转”
缩小体积增大压强,混合气体颜色先加深,后变浅,达到新的平衡后混合体系颜色比原平衡时颜色深。
2NO2(g)(红棕色) N2O4(g)(无色)
1.常温下,一定体积的密闭容器中,充入NO2和N2O4的混合气体,反应2NO2(g)(红棕色) N2O4(g)(无色)达到平衡。
(1)若将容器的体积缩小为原来的一半,平衡向_______方向移动,平衡后气体的颜色与原来相比_____(填“加深”“变浅”或“不变”)。
(2)从K与Q的视角论证平衡正向移动的原因:_____________________
_______________________________________________________________________________________________。
正反应
加深
2.下列事实中,不能用勒·夏特列原理解释的是____(填字母)。
A.溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对2H2O2 2H2O+O2的反应,使用MnO2可加快制备O2的反应速率
C.反应:CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0,升高温度,平衡
向逆反应方向移动
D.合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,为使氨的产率提
高,理论上应采取低温高压的措施
E.H2(g)+I2(g) 2HI(g),缩小体积加压颜色加深
BE
3.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g),平衡时测得C的浓度为0.50 mol·L-1。保持温度不变,将容器的容积压缩到原来的一半,再达到平衡时,测得C的浓度变为0.90 mol·L-1。
(1)压缩容积时,平衡是否发生移动?移动的方向如何?
发生移动,平衡逆向移动
(2)C的体积分数_____(填“增大”“减小”或“不变”)。
(3)x+y z(填“>”“<”或“=”)。
减小
<
4.在一定温度下,反应mA(g)+nB(g) pC(g)+qD(g)达到平衡,完成下列填空:
(1)若m+n>p+q,缩小容器的容积,增大压强[课下研究m+n
正反应
增大
增大
增大
②在图中补全,t1时,增大压强后的v-t图像。
(2)若m+n=p+q,扩大容器的容积,
①Q K,化学平衡 移动,c平(A) ,c平(D) ,B的转化率 。
②在图中补全,t1时,减小压强后的v-t图像。
=
不
减小
减小
不变
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
