科粤版化学九年级上 第二单元 空气、物质的构成与组成单元检测卷(含答案)
文档属性
| 名称 | 科粤版化学九年级上 第二单元 空气、物质的构成与组成单元检测卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 454.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-25 11:58:54 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
科粤版化学第二单元 空气、物质的构成与组成单元检测卷
一、选择题(共10题;共20分)
1.如图所示,利用过量红磷进行空气中氧气含量的测定,下列图像能正确反映对应变化关系的是( )
A. B.
C. D.
2.(走进生活)新春佳节的热闹气氛离不开多彩绚烂的霓虹灯装饰,下列气体可用于霓虹灯制作的是( )
A.氧气 B.二氧化碳 C.稀有气体 D.氮气
3.下列各组物质中,前者属于混合物,后者属于纯净物的是
A.雪碧饮料 铁丝 B.冰水混合物 澄清石灰水
C.海水 净化后的空气 D.五氧化二磷 稀有气体
4.(环保理念)人类的下列行为不会污染空气的是
A.打开教室门窗通风 B.环卫工人露天焚烧垃圾
C.在公共场所吸烟 D.在室外燃放烟花爆竹
5.小华通过微信公众号“胜哥课程”知道了我们平时所见的物质一般由三种微粒构成。下列物质由原子构成的是
A.金刚石 B.氯化钠 C.氢气 D.水
6.下列对宏观事实的微观解释错误的是
选项 宏观事实 微观解释
A 温度升高,水银柱上升 汞原子体积变大
B 墙内开花墙外香 分子在不断地运动
C 稀有气体用作保护气 稀有气体的原子最外层达到稳定结构
D 燃烧的木条在氧气中燃烧更旺,在二氧化碳中熄灭 分子不同,化学性质不同
A.A B.B C.C D.D
7.下列四种原子的结构示意图中,最容易形成阳离子的是
A. B. C. D.
8.下列关于分子和原子的说法,错误的是( )
A.同种原子可以构成不同种分子
B.分子可再分,原子不能再分
C.原子的质量主要集中在原子核上
D.纯净物不一定由同种分子构成
9.下列生活中常见物质的成分只含金属元素的是
A.小苏打: B.纯金:Au
C.酒精: D.木炭:C
10.化学观念可以让我们更全面的认识物质。以下说法正确的是( )
A.能量观:化学反应中不通过燃烧也能获得热量
B.微粒观:氧气和氯化钠都是由分子构成
C.结构观:石墨转化成金刚石改变了碳原子的排列方式,是物理变化
D.元素观:乙醇的化学式为C2H6O,它由3个元素组成
二、非选择题(共9题;共80分)
11.(10分)(1)(4分)下列物质:①氮气②空气③二氧化碳④矿泉水⑤高锰酸钾⑥二氧化锰⑦食盐⑧牛奶,其中属于纯净物的有 (均填序号),属于混合物的有 。
(2)(6分)下列5种微粒子,易失电子形成阳离子的是 (填序号,下同),易得电子形成阴离子的是 ,已达稳定结构的是 。
12.(8分)如图所示,在试管中的滤纸条上A、B、C三处各滴加一滴无色酚酞溶液,再在试管口放一团棉花。
(1)(2分)吸取浓氨水,滴在棉花上的仪器名称是 。
(2)(6分)实验中,可以观察到A、B、C三处的酚酞溶液变色的顺序是 (用字母填空),该实验说明分子具有的性质是 ,同时还可说明 具有挥发性。
13.(12分)如图是质子数为1~18号元素所在元素周期表中的相关信息,请利用图表中的信息回答相关问题:
(1)(6分)地壳中含量最多的金属元素的原子序数为 ,该原子在化学反应中容易 (填“失去”或“得到”)电子,其离子符号为 。
(2)(2分)表中不同种元素最本质的区别是 (填序号)。
A.相对原子质量不同 B.质子数不同 C.中子数不同
(3)(2分)元素周期表中每一个横行叫作一个周期,通过分析,同一周期元素之间的排列有一定的规律,如: (填序号)。
A.同周期元素,从左到右,各元素原子的电子层数相同
B.同周期元素,从左到右,各元素原子的原子序数依次增加
C.同周期元素,从左到右,各元素原子的最外层电子数相同
D.同周期元素,从左到右,各元素原子最外层电子数依次递增
(4)(2分)元素周期表中每一个纵列叫作一个族,一般具有相似的化学性质,则下列各组元素具有相似化学性质的是 (填序号)。
A.Na和Cl B.O和S C.B和S D.F和Cl
14.(10分)下图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图。
(1)(2分)氟元素的相对原子质量为 。
(2)(2分)X= 。
(3)(2分)写出C粒子的符号 。
(4)(2分)A、B、C、D中属于同种元素的粒子是 (填序号,下同);
(5)(2分)A粒子和B、C、D三种粒子中的 的化学性质相似。
15.(8分)对比分析①水 ②澄清石灰水 ③过氧化氢 ④氧气 ⑤空气,用序号回答下列问题。
(1)(2分)属于混合物的有 ;
(2)(2分)含有氧分子的有 ;
(3)(2分)属于氧化物的是 ;
(4)(2分)组成物质的元素相同,而化学性质不同的两种物质是 。
16.(6分)下列物质:①冰水共存物 ②洁净的空气 ③硫粉 ④高锰酸钾 ⑤液氮 ⑥自来水 ⑦四氧化三铁 ⑧稀有气体 ⑨氯化钾。请用序号填空。
(1)(2分)属于混合物的有: ;
(2)(2分)属于氧化物的有: ;
(3)(2分)属于单质的是: 。
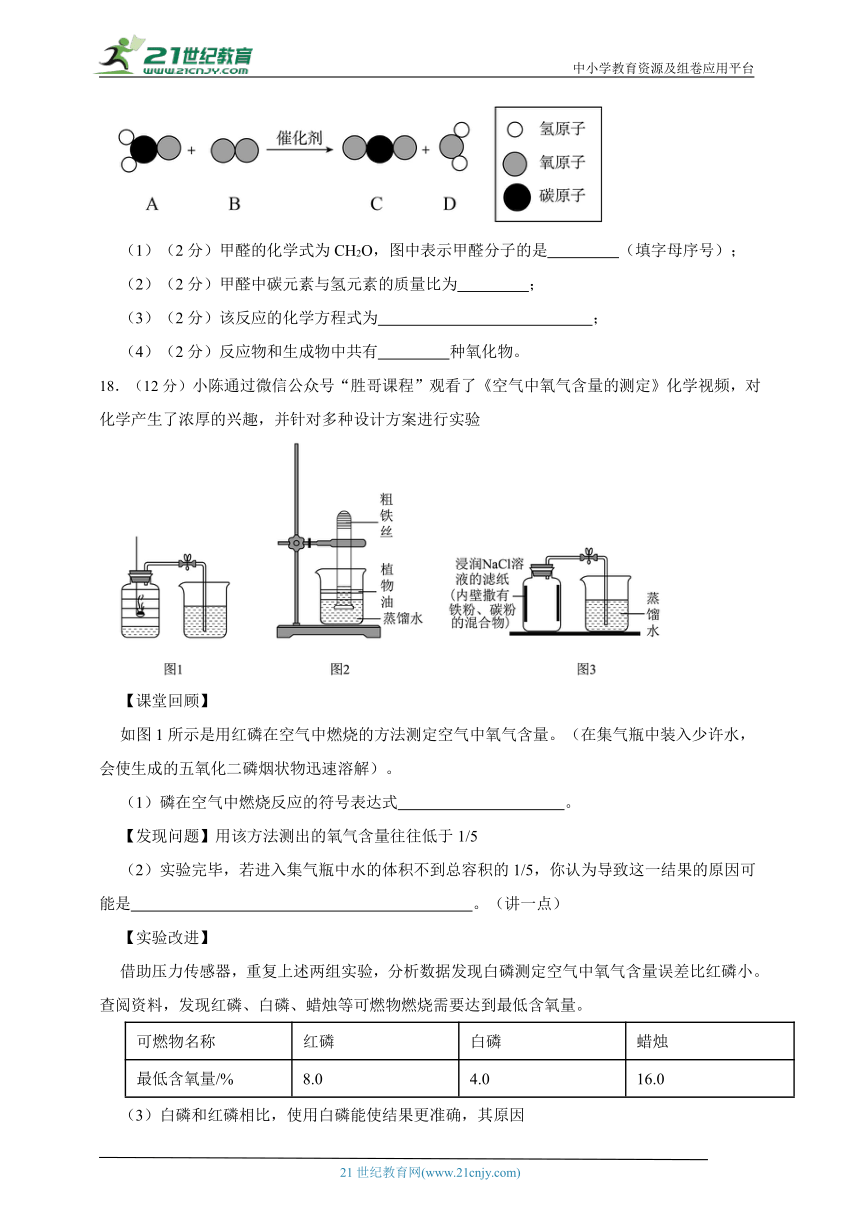
17.(8分)(环保理念)利用化学方法可消除家居装修过程中产生的甲醛,其反应的微观示意图如下。回答下列问题:
(1)(2分)甲醛的化学式为CH2O,图中表示甲醛分子的是 (填字母序号);
(2)(2分)甲醛中碳元素与氢元素的质量比为 ;
(3)(2分)该反应的化学方程式为 ;
(4)(2分)反应物和生成物中共有 种氧化物。
18.(12分)小陈通过微信公众号“胜哥课程”观看了《空气中氧气含量的测定》化学视频,对化学产生了浓厚的兴趣,并针对多种设计方案进行实验
【课堂回顾】
如图1所示是用红磷在空气中燃烧的方法测定空气中氧气含量。(在集气瓶中装入少许水,会使生成的五氧化二磷烟状物迅速溶解)。
(1)磷在空气中燃烧反应的符号表达式 。
【发现问题】用该方法测出的氧气含量往往低于1/5
(2)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是 。(讲一点)
【实验改进】
借助压力传感器,重复上述两组实验,分析数据发现白磷测定空气中氧气含量误差比红磷小。查阅资料,发现红磷、白磷、蜡烛等可燃物燃烧需要达到最低含氧量。
可燃物名称 红磷 白磷 蜡烛
最低含氧量/% 8.0 4.0 16.0
(3)白磷和红磷相比,使用白磷能使结果更准确,其原因是 ;
(4)小陈根据铁生锈的原理(铁在常温下可以和氧气、水生成铁锈)来测定空气中氧气的含量,装置如图2将足量粗铁丝置于试管底部,并倒扣在装有水的烧杯中,一段时间后你将看到的现象是 ,通过7天后测得的数据计算出空气中氧气的含量为19.13%。
(5)小陈利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图3)。8分钟后测得的数据如下表,计算出空气中氧气含量为 (结果保留1位小数)。
实验前集气瓶内空气的体积 实验前烧杯内蒸馏水的体积 实验后烧杯内剩余蒸馏水的体积
120mL 90.0mL 65.8mL
(6)通过上述实验探究,下列四组实验中选择 (填字母)进行实验,可较为快速地完成实验并减小实验误差。
a.红磷 b.白磷 c.粗铁丝 d.铁粉、炭粉、氯化钠、蒸馏水
19.(6分)科学上规定以C-12原子质量的作为标准,用其他原子的实际质量跟它相比所得到的比值就是该原子的相对原子质量。C-12原子的质量为1.993×10-26kg,铬原子的质量为8.636×10-26kg。已知铬原子核内中子数比质子数多4。
(1)(2分)铬的相对原子质量为 。(保留一位小数)。
(2)(4分)铬原子核内质子数为 ,中子数为 。
答案解析部分
1.【答案】C
【知识点】空气的组成;测定空气中的氧气含量
【解析】【解答】A、该实验中红磷为反应物,其质量随反应的发生而减小,实验时取用过量红磷,最终红磷应有剩余,则反应结束时红磷保持一定质量不变,不符合题意;
B、磷燃烧时放热,放热造成装置内压强增大值大于消耗氧气压强减小值,温度恢复后,由温度变化引起的压强变化再恢复,但最终因氧气的消耗,压强涉于原始值,不符合题意;
C、红磷燃烧消耗氧气,不消耗氮气,集气瓶内氮气的质量不变,符合题意;
D、该实验开始前集气瓶内有一部分水,打开弹簧夹前,水的中保持不变,打开弹簧夹后,烧杯中的水进入集气瓶,水的体积增加,至一定体积后保持不变,不符合题意;
故答案为:C
【分析】根据红磷燃烧测定氧气含量时,装置内压强的变化、红磷用量、瓶内水的体积变化及空气中未反应的其它气体的质量不变分析。
2.【答案】C
【知识点】氮气及稀有气体的用途
【解析】【解答】稀有气体在通电下会发出有颜色的光,稀有气体可用于霓虹灯制作,
故答案为:C。
【分析】 根据稀有气体的用途分析。
3.【答案】A
【知识点】纯净物和混合物
【解析】【解答】A、雪碧饮料是由水、碳酸等混合而成,属于混合物;铁丝是由同种物质组成,属于纯净物,A符合题意;
B、冰是固态的水,冰水混合物是由水一种物质组成,属于纯净物;澄清石灰水是由氢氧化钙和水混合而成,属于混合物,B不符合题意;
C、海水是由水、氯化钠等混合而成,属于混合物;净化后的空气是由氮气、氧气等混合而成,属于混合物,C不符合题意;
D、五氧化二磷由同种物质组成,属于纯净物,稀有气体由氖气、氦气等混合而成,属于混合物,D不符合题意。
故答案选:A。
【分析】根据一种物质组成的是纯净物,多种物质混合而成的是混合物分析。
4.【答案】A
【知识点】空气的污染与防治
【解析】【解答】A、打开教室门窗通风,不会产生污染物,不会污染空气,符合题意;
B、露天焚烧垃圾会产生可吸入颗粒物、一氧化碳等空气污染物,会污染空气,不符合题意;
C、“烟气”中含有多种有害物质如可吸入颗粒物、一氧化碳等,会污染空气,不符合题意;
D、燃放烟花爆竹会产生二氧化硫等空气污染物,会污染空气,不符合题意;
故答案为:A。
【分析】 空气污染物主要包括可吸入颗粒物、二氧化硫、氮氧化物、一氧化碳等。
5.【答案】A
【知识点】物质的微粒性
【解析】【解答】A、金刚石属于固态非金属单质,是由碳原子直接构成的,符合题意;
B、氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的,不符合题意;
C、氢气属于气态非金属单质,氢气是由氢分子构成的,不符合题意;
D、铜属于固态金属单质,铜是由铜原子构成的,不符合题意。
故答案为:A.
【分析】根据物质由分子、原子、离子构成来解答。
6.【答案】A
【知识点】分子和原子的区别和联系;原子结构示意图与离子结构示意图;分子的定义与分子的特性
【解析】【解答】A、温度升高,水银柱上升,是因为汞原子间的间隔增大,汞原子体积不变,故A答案错误;
B、墙内开花墙外香,是因为分子在不断地运动,向四周扩散,使人们闻到香味,故B答案正确;
C、稀有气体的原子最外层达到稳定结构,化学性质不活泼,可用作保护气,故C答案正确;
D、燃烧的木条在氧气中燃烧更旺,在二氧化碳中熄灭,氧气是由氧分子构成的,二氧化碳是由二氧化碳分子构成的,分子不同,化学性质不同,故D答案正确;
故答案选:A。
【分析】A、根据温度升高,汞原子间的间隔变大分析;
B、根据分子在不断地运动分析;
C、根据稀有气体的原子最外层达到稳定结构,化学性质不活泼分析;
D、根据不同物质的分子化学性质不同分析。
7.【答案】C
【知识点】原子和离子的相互转化;原子结构示意图与离子结构示意图
【解析】【解答】在原子中质子数等于电子数。在原子核外电子的排布中,最外层电子小于4个时,易失去电子形成阳离子,当最外层电子大于4时,易得到电子形成阴离子,当最外层电子数为4时,得电子的能力与失电子的能力相当,可能形成阳离子,也可能形成阴离子。
A、在氟原子结构图中,最外层有7个电子,易得电子形成阴离子,不符合题意;
B、氖原子结构图中,最外层有8个电子,属于稳定结构,所以不易离子,不符合题意;
C、钠原子结构图中,最外层是1个电子,化学反应中易失去最外层1个电子,形成带一个单位正电荷的阳离子,符合题意;
D、硅原子结构图中,最外层有4个电子,得电子的能力与失电子的能力相当,相比较而言,比最外层电子数是1的原子更难失掉电子,不符合题意。
故答案为:C.
【分析】在原子结构示意图中,当最外层电子小于4个时,易失去电子形成阳离子,当最外层电子大于4时,易得到电子形成阴离子,当最外层电子数为4时,得电子的能力与失电子的能力相当,可能形成阳离子,也可能形成阴离子来解答。
8.【答案】B
【知识点】原子的定义与构成;分子的定义与分子的特性;化学反应的实质
【解析】【解答】A、同种原子可以构成不同的分子,如水分子和过氧化氢分子。A答案正确;
B、在化学变化中,分子可分,原子不能再分。B答案错误;
C、电子的质量非常小,可以忽略不计,原子的质量主要集中在原子核上。C答案正确;
D、物质是由分子,原子,离子构成的,纯净物不一定由同种分子构成,如氯化钠。D答案正确;
故答案为:B。
【分析】A、根据同种原子可以构成不同的分子分析;
B、根据在化学变化中,分子可分,原子不能再分分析;
C、根据原子的质量主要集中在原子核上分析;
D、根据物质是由分子,原子,离子构成的分析。
9.【答案】B
【知识点】元素的简单分类;物质的元素组成
【解析】【解答】A、小苏打中碳、氢、氧元素属于非金属元素,钠元素属于金属元素,不符合题意;
B、纯金只含有金属元素金元素,符合题意;
C、酒精中碳、氢、氧都是非金属元素,不符合题意;
D、木炭只含非金属元素碳元素,不符合题意;
故答案为:B。
【分析】根据金属元素除金、汞外,一般名称带“钅”,结合所给各物质化学式确定元素组成及种类分析。
10.【答案】A
【知识点】物质的微粒性;元素的概念;物质的元素组成
【解析】【解答】A、氧化钙与水反应生成氧化钙,反应过程中放出热量,该反应不是燃烧,则化学反应中不通过燃烧也能获得热量,故选项A说法正确。
B、氧气是由氧分子构成,氯化钠是由钠离子与氯离子构成,故选项B说法错误。
C、金刚石与石墨不是同种物质,则石墨转化为金刚石的变化有新物质生成,发生的属于化学变化,故选项C说法错误。
D、乙醇的化学式为 C2H6O ,它是由3种元素组成,元素是个宏观概念,只讲种类、不讲个数,故选项D说法错误。
故答案为:A
【分析】A、根据化学反应中的能量变化来分析。
B、根据构成物质的基本粒子来分析。
C、根据是否生成新物质来分析。
D、根据元素的规定来分析。
11.【答案】(1)①③⑤⑥;②④⑦⑧
(2)AE;D;BC
【知识点】核外电子在化学反应中的作用;原子结构示意图与离子结构示意图;纯净物和混合物
【解析】【解答】(1)①氮气是气体单质,属于纯净物;②空气中含有氮气、氧气等,属于混合物;③二氧化碳是由一种物质组成的,属于纯净物;④矿泉水中含有水、矿物质,属于混合物;③高锰酸钾是由一种物质组成的,属于纯净物;⑥二氧化锰是由一种物质组成的,属于纯净物;⑦食盐中含有氯化钠、碘酸钾,属于混合物;⑧牛奶含有水、蛋白质等,属于混合物。
其中属于纯净物的有①③⑤⑥,属于混合物的有②④⑦⑧。
(2)A粒子核外有三个电子层,最外层电子数为1,容易失去1个电子形成阳离子;B粒子核外有两个电子层,最外层电子数为8,已达到稳定结构;C粒子核外有两个电子层,最外层电子数为8,已达到稳定结构;D粒子核外有三个电子层,最外层电子数为7,容易得到1个电子形成阴离子;E粒子核外有三个电子层,最外层电子数为2,容易失去2个电子形成阳离子。
则易失电子形成阳离子的是AE,易得电子形成阴离子的是D,已达稳定结构的是BC。
【分析】(1)根据纯净物由一种物质组成,混合物由多种物质组成,结合常见物质的组成分析;
(2)根据粒子的最外层电子数小于4时易失电子,大于4时易得电子,等于8(只有一层时为2)时达到稳定结构分析。
12.【答案】(1)胶头滴管
(2)C、B、A;分子在不断运动;浓氨水
【知识点】实验室常见的仪器及使用;分子的定义与分子的特性
【解析】【解答】(1)胶头滴管用于吸取和滴加少量液体,这里需要少量的浓氨水,故吸取浓氨水,滴在棉花上的仪器名称是:胶头滴管。
(2)1:实验中,可以观察到A、B、C三处的酚酞溶液变色的顺序是:C、B、A:。
2:浓氨水和酚酞溶液未直接接触,一段时间后,酚酞溶液变红,说明分子在不断运动,当氨分子运动到酚酞溶液处时,氨气溶于水形成氨水,氨水显碱性,能使无色酚酞试液变红,因为距离棉花的距离由近到远为C、B、A,所以这三处酚酞溶液变色的顺序是C、B、A。
3:滴加了浓氨水的棉花没有变色,滴加了酚酞溶液的滤纸变红,说明酚酞溶液没有挥发而浓氨水具有挥发性。
【分析】根据浓氨水易挥发而酚酞不易挥发入手。
13.【答案】(1)13;失去;
(2)B
(3)A;B;D
(4)B;D
【知识点】原子结构示意图与离子结构示意图;元素的概念;元素周期表的特点及其应用
【解析】【解答】(1)地壳中含量最多的金属元素是铝元素,如表可知,其周期表标签左上角数字即原子序数为13,核外电子排布是2、8、3,最外层电子数是3,小于4,化学反应时易失去三个电子形成带三个单位正电荷的阳离子,由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,故表示为:
(2)元素是具有相同核电荷数即质子数的一类原子的总称,不同种元素最本质的区别是质子数不同,故选:B;
(3)根据元素周期表可知:
A、同周期元素,从左到右,各元素原子的电子层数相同,选项正确;
B、同周期元素,从左到右,各元素原子的原子序数依次增加,选项正确;
C、同周期元素,从左到右,各元素原子的最外层电子数依此增加,选项错误;
D、同周期元素,从左到右,各元素原子最外层电子数依次递增,选项正确;
故选:ABD;
(4)元素具有相似化学性质的是原子最外层电子数相等的原子,根据元素周期表可知原子最外层电子数相等的元素在同一纵行,如表,氧元素和硫元素属于同一族,氟元素和氯元素属于同一族,它们的化学性质相似,故选:BD。
【分析】(1)根据地壳中含量最多的金属元素是铝元素,单元格左上角的数字表示原子序数分析;
(2)根据不同种元素最本质的区别是质子数不同分析;
(3)根据元素周期表的规律分析;
(4)根据元素的化学性质由原子最外层电子数决定分析。
(1)地壳中含量最多的金属元素是铝元素,如表可知,其周期表标签左上角数字即原子序数为13,核外电子排布是2、8、3,最外层电子数是3,小于4,化学反应时易失去三个电子形成带三个单位正电荷的阳离子,由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,故表示为:
(2)元素是具有相同核电荷数即质子数的一类原子的总称,不同种元素最本质的区别是质子数不同,故选:B;
(3)根据元素周期表可知:
A、同周期元素,从左到右,各元素原子的电子层数相同,选项正确;
B、同周期元素,从左到右,各元素原子的原子序数依次增加,选项正确;
C、同周期元素,从左到右,各元素原子的最外层电子数依此增加,选项错误;
D、同周期元素,从左到右,各元素原子最外层电子数依次递增,选项正确;
故选:ABD;
(4)元素具有相似化学性质的是原子最外层电子数相等的原子,根据元素周期表可知原子最外层电子数相等的元素在同一纵行,如表,氧元素和硫元素属于同一族,氟元素和氯元素属于同一族,它们的化学性质相似,故选:BD。
14.【答案】(1)19.00
(2)8
(3)Cl-
(4)BC
(5)B
【知识点】原子结构示意图与离子结构示意图;元素的概念;元素的符号及其意义;元素周期表的特点及其应用
【解析】【解答】(1)根据图示可知,元素名称下面的数字表示相对原子质量,氟元素的相对原子质量为19.00;
(2)原子中,原子中核电荷数=核外电子数,即18=2+8+X,X=8;
(3)C中核电荷数小于核外电子数,表示阴离子,二者数值相差1,即带有1个单位负电荷的离子,所以C粒子的化学符号Cl-;
(4)同种元素的质子数相同,则A、B、C、D结构示意图中,属于同种元素的粒子是BC;
(5)A粒子的最外层有7个电子,B粒子的最外层有7个电子,因此A的化学性质与B粒子的化学性质相似;故答案为:B。
【分析】(1)根据元素名称下面的数字表示相对原子质量分析;
(2)根据原子中核电荷数=核外电子数分析;
(3)根据阴离子中核电荷数小于核外电子数分析;
(4)根据元素的种类由质子数决定分析;
(5)根据原子的最外层电子数决定化学性质分析。
(1)根据图示可知,元素名称下面的数字表示相对原子质量,氟元素的相对原子质量为19.00;
(2)原子中,原子中核电荷数=核外电子数,即18=2+8+X,X=8;
(3)C中核电荷数小于核外电子数,表示阴离子,二者数值相差1,即带有1个单位负电荷的离子,所以C粒子的化学符号Cl-;
(4)同种元素的质子数相同,则A、B、C、D结构示意图中,属于同种元素的粒子是BC;
(5)A粒子的最外层有7个电子,B粒子的最外层有7个电子,因此A的化学性质与B粒子的化学性质相似;故答案为:B。
15.【答案】(1)②⑤
(2)④⑤
(3)①③
(4)①③
【知识点】物质的元素组成;纯净物和混合物;从组成上识别氧化物
【解析】【解答】解:水是由氢氧元素组成的纯净物,故属于氧化物;澄清石灰水是氢氧化钙和水形成的混合物;过氧化氢是由氢氧元素组成的纯净物,属于氧化物;氧气是由氧元素组成的单质;空气是由氧气、氮气、稀有气体形成的混合物。
故答案为:(1) 属于混合物的有 ②⑤ ;
(2) 含有氧分子的物质一定是有氧气为 ④⑤ ;
(3) 属于氧化物的是 ①③ ;
(4) 组成物质的元素相同,而化学性质不同的两种物质是 ①③ 。
【分析】(1)根据混合物的概念是由多种物质混合而成来解答;
(2)根据氧气由氧分子构成,含有氧气的物质来解答;
(3)根据氧化物的概念是由两种元素组成,其中一种是氧元素的化合物来解答;
(4)根据过氧化氢和水都是由氧元素和氢元素组成来解答。
16.【答案】(1)②⑥⑧
(2)①⑦
(3)③⑤
【知识点】单质和化合物;纯净物和混合物;从组成上识别氧化物
【解析】【解答】(1)洁净的空气中含有氮气、氧气等物质,属于混合物;自来水中含有水和一些溶于水的物质,属于混合物;稀有气体包括氦气、氖气、氩气等,故稀有气体属于混合物,故答案为:②⑥⑧;
(2)由两种元素组成的化合物中,其中一种元素是氧元素的叫作氧化物,上述物质中,只有冰水共存物(H2O)、四氧化三铁(Fe3O4)是由两种元素组成的的化合物,且其中一种元素是氧元素,所以属于氧化物,故答案为:①⑦;
(3)由同种元素组成的纯净物叫作单质,上述物质中只有硫粉(S)和液氮(N2)是由一种元素组成的纯净物,所以属于单质。故答案为:③⑤。
【分析】(1)根据混合物的定义分析回答;
(2)根据氧化物的定义分析回答;
(3)根据单质的定义分析回答。
(1)洁净的空气中含有氮气、氧气等物质,属于混合物;自来水中含有水和一些溶于水的物质,属于混合物;稀有气体包括氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)和氡(Rn),稀有气体属于混合物。故填:②⑥⑧。
(2)冰水共存物、四氧化三铁都是由氧元素和另外一种元素组成的化合物,属于氧化物。故填:①⑦。
(3)硫粉、液氮都是由一种元素组成的纯净物,属于单质。故填:③⑤。
17.【答案】(1)A
(2)6:1
(3)
(4)3
【知识点】化学方程式的书写与配平;化学式的相关计算;微粒观点及模型图的应用;从组成上识别氧化物
18.【答案】P+O2P2O5;红磷不足或没有冷却到室温读数或装置漏气;白磷燃烧需要达到最低含氧量更低,可以将氧气消耗的更完全;铁丝表面有红色物质生成,试管内液面上升;20.2%;bd
【知识点】测定空气中的氧气含量
【解析】【解答】(1)红磷燃烧生成五氧化二磷,反应的符号表达式:P+O2P2O5;
(2)若进入集气瓶中水的体积不到总容积的,是由于反应结束后集气瓶内的气压偏大,可能是氧气没有完全消耗或温度偏高或有空气进入,具体的原因可能是红磷不足或没有冷却到室温读数或装置漏气等;
(3)根据表格中数据可知,白磷和红磷相比,使用白磷能使结果更准确,其原因白磷燃烧需要达到最低含氧量更低,可以将氧气消耗的更完全;
(4)铁在潮湿空气易与水和氧气反应生成铁锈,试管内的气压下降,装置如图2将足量粗铁丝置于试管底部,并倒扣在装有水的烧杯中,一段时间后你将看到的现象是铁丝表面有红色物质生成,试管内液面上升;
(5)小陈利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图3)。实验前集气瓶内空气为120mL,烧杯内蒸馏水为90.0mL,实验后烧杯内剩余蒸馏水65.8mL,消耗的氧气体积=90.0mL-65.8mL=24.2mL,空气中氧气含量=;
(6)通过上述实验探究,白磷和铁粉、炭粉、氯化钠、蒸馏水进行实验,可较为快速地完成实验并减小实验误差,红磷和粗铁丝都有较大误差。故填:bd。
【分析】(1)根据磷燃烧生成五氧化二磷分析;
(2)根据药品不足、装置漏气或打开止水夹过早等会使结果偏小分析;
(3)根据白磷消耗氧气更彻底分析;
(4)根据铁生锈是与氧气和水共同作用分收入
(5)根据烧杯内减少水的体积即为氧气体积,由此计算空气中氧气含量分析;
(6)根据实验探究确定能快速且彻底消耗氧气的药品分析。
19.【答案】(1)52.0
(2)24;28
【知识点】原子的有关数量计算
【解析】【解答】(1)国际上一致采用相对原子质量,即以一种碳原子质量的1/12为标准,其他原子的质量与它相比较得到的比值,作为这种原子的相对原子质量,铬的相对原子质量为;
(2)相对原子质量等于质子数加中子数,铬原子核内质子数为,x=24,中子数为 24+4=28.
【分析】(1)根据国际上一致采用相对原子质量,即以一种碳原子质量的1/12为标准,其他原子的质量与它相比较得到的比值,作为这种原子的相对原子质量分析;
(2)根据相对原子质量等于质子数加中子数分析。
试题分析部分
1、试卷总体分布分析
总分:100分
分值分布 客观题(占比) 20.0(20.0%)
主观题(占比) 80.0(80.0%)
题量分布 客观题(占比) 10(52.6%)
主观题(占比) 9(47.4%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
选择题 10(52.6%) 20.0(20.0%)
非选择题 9(47.4%) 80.0(80.0%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (73.7%)
2 容易 (21.1%)
3 困难 (5.3%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 单质和化合物 6.0(6.0%) 16
2 物质的微粒性 4.0(4.0%) 5,10
3 分子的定义与分子的特性 12.0(12.0%) 6,8,12
4 化学方程式的书写与配平 8.0(8.0%) 17
5 原子的定义与构成 2.0(2.0%) 8
6 化学反应的实质 2.0(2.0%) 8
7 元素的概念 24.0(24.0%) 10,13,14
8 元素的简单分类 2.0(2.0%) 9
9 元素周期表的特点及其应用 22.0(22.0%) 13,14
10 物质的元素组成 12.0(12.0%) 9,10,15
11 微粒观点及模型图的应用 8.0(8.0%) 17
12 原子和离子的相互转化 2.0(2.0%) 7
13 从组成上识别氧化物 22.0(22.0%) 15,16,17
14 化学式的相关计算 8.0(8.0%) 17
15 纯净物和混合物 26.0(26.0%) 3,11,15,16
16 空气的污染与防治 2.0(2.0%) 4
17 分子和原子的区别和联系 2.0(2.0%) 6
18 元素的符号及其意义 10.0(10.0%) 14
19 核外电子在化学反应中的作用 10.0(10.0%) 11
20 原子结构示意图与离子结构示意图 36.0(36.0%) 6,7,11,13,14
21 空气的组成 2.0(2.0%) 1
22 氮气及稀有气体的用途 2.0(2.0%) 2
23 实验室常见的仪器及使用 8.0(8.0%) 12
24 测定空气中的氧气含量 14.0(14.0%) 1,18
25 原子的有关数量计算 6.0(6.0%) 19
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
科粤版化学第二单元 空气、物质的构成与组成单元检测卷
一、选择题(共10题;共20分)
1.如图所示,利用过量红磷进行空气中氧气含量的测定,下列图像能正确反映对应变化关系的是( )
A. B.
C. D.
2.(走进生活)新春佳节的热闹气氛离不开多彩绚烂的霓虹灯装饰,下列气体可用于霓虹灯制作的是( )
A.氧气 B.二氧化碳 C.稀有气体 D.氮气
3.下列各组物质中,前者属于混合物,后者属于纯净物的是
A.雪碧饮料 铁丝 B.冰水混合物 澄清石灰水
C.海水 净化后的空气 D.五氧化二磷 稀有气体
4.(环保理念)人类的下列行为不会污染空气的是
A.打开教室门窗通风 B.环卫工人露天焚烧垃圾
C.在公共场所吸烟 D.在室外燃放烟花爆竹
5.小华通过微信公众号“胜哥课程”知道了我们平时所见的物质一般由三种微粒构成。下列物质由原子构成的是
A.金刚石 B.氯化钠 C.氢气 D.水
6.下列对宏观事实的微观解释错误的是
选项 宏观事实 微观解释
A 温度升高,水银柱上升 汞原子体积变大
B 墙内开花墙外香 分子在不断地运动
C 稀有气体用作保护气 稀有气体的原子最外层达到稳定结构
D 燃烧的木条在氧气中燃烧更旺,在二氧化碳中熄灭 分子不同,化学性质不同
A.A B.B C.C D.D
7.下列四种原子的结构示意图中,最容易形成阳离子的是
A. B. C. D.
8.下列关于分子和原子的说法,错误的是( )
A.同种原子可以构成不同种分子
B.分子可再分,原子不能再分
C.原子的质量主要集中在原子核上
D.纯净物不一定由同种分子构成
9.下列生活中常见物质的成分只含金属元素的是
A.小苏打: B.纯金:Au
C.酒精: D.木炭:C
10.化学观念可以让我们更全面的认识物质。以下说法正确的是( )
A.能量观:化学反应中不通过燃烧也能获得热量
B.微粒观:氧气和氯化钠都是由分子构成
C.结构观:石墨转化成金刚石改变了碳原子的排列方式,是物理变化
D.元素观:乙醇的化学式为C2H6O,它由3个元素组成
二、非选择题(共9题;共80分)
11.(10分)(1)(4分)下列物质:①氮气②空气③二氧化碳④矿泉水⑤高锰酸钾⑥二氧化锰⑦食盐⑧牛奶,其中属于纯净物的有 (均填序号),属于混合物的有 。
(2)(6分)下列5种微粒子,易失电子形成阳离子的是 (填序号,下同),易得电子形成阴离子的是 ,已达稳定结构的是 。
12.(8分)如图所示,在试管中的滤纸条上A、B、C三处各滴加一滴无色酚酞溶液,再在试管口放一团棉花。
(1)(2分)吸取浓氨水,滴在棉花上的仪器名称是 。
(2)(6分)实验中,可以观察到A、B、C三处的酚酞溶液变色的顺序是 (用字母填空),该实验说明分子具有的性质是 ,同时还可说明 具有挥发性。
13.(12分)如图是质子数为1~18号元素所在元素周期表中的相关信息,请利用图表中的信息回答相关问题:
(1)(6分)地壳中含量最多的金属元素的原子序数为 ,该原子在化学反应中容易 (填“失去”或“得到”)电子,其离子符号为 。
(2)(2分)表中不同种元素最本质的区别是 (填序号)。
A.相对原子质量不同 B.质子数不同 C.中子数不同
(3)(2分)元素周期表中每一个横行叫作一个周期,通过分析,同一周期元素之间的排列有一定的规律,如: (填序号)。
A.同周期元素,从左到右,各元素原子的电子层数相同
B.同周期元素,从左到右,各元素原子的原子序数依次增加
C.同周期元素,从左到右,各元素原子的最外层电子数相同
D.同周期元素,从左到右,各元素原子最外层电子数依次递增
(4)(2分)元素周期表中每一个纵列叫作一个族,一般具有相似的化学性质,则下列各组元素具有相似化学性质的是 (填序号)。
A.Na和Cl B.O和S C.B和S D.F和Cl
14.(10分)下图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图。
(1)(2分)氟元素的相对原子质量为 。
(2)(2分)X= 。
(3)(2分)写出C粒子的符号 。
(4)(2分)A、B、C、D中属于同种元素的粒子是 (填序号,下同);
(5)(2分)A粒子和B、C、D三种粒子中的 的化学性质相似。
15.(8分)对比分析①水 ②澄清石灰水 ③过氧化氢 ④氧气 ⑤空气,用序号回答下列问题。
(1)(2分)属于混合物的有 ;
(2)(2分)含有氧分子的有 ;
(3)(2分)属于氧化物的是 ;
(4)(2分)组成物质的元素相同,而化学性质不同的两种物质是 。
16.(6分)下列物质:①冰水共存物 ②洁净的空气 ③硫粉 ④高锰酸钾 ⑤液氮 ⑥自来水 ⑦四氧化三铁 ⑧稀有气体 ⑨氯化钾。请用序号填空。
(1)(2分)属于混合物的有: ;
(2)(2分)属于氧化物的有: ;
(3)(2分)属于单质的是: 。
17.(8分)(环保理念)利用化学方法可消除家居装修过程中产生的甲醛,其反应的微观示意图如下。回答下列问题:
(1)(2分)甲醛的化学式为CH2O,图中表示甲醛分子的是 (填字母序号);
(2)(2分)甲醛中碳元素与氢元素的质量比为 ;
(3)(2分)该反应的化学方程式为 ;
(4)(2分)反应物和生成物中共有 种氧化物。
18.(12分)小陈通过微信公众号“胜哥课程”观看了《空气中氧气含量的测定》化学视频,对化学产生了浓厚的兴趣,并针对多种设计方案进行实验
【课堂回顾】
如图1所示是用红磷在空气中燃烧的方法测定空气中氧气含量。(在集气瓶中装入少许水,会使生成的五氧化二磷烟状物迅速溶解)。
(1)磷在空气中燃烧反应的符号表达式 。
【发现问题】用该方法测出的氧气含量往往低于1/5
(2)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是 。(讲一点)
【实验改进】
借助压力传感器,重复上述两组实验,分析数据发现白磷测定空气中氧气含量误差比红磷小。查阅资料,发现红磷、白磷、蜡烛等可燃物燃烧需要达到最低含氧量。
可燃物名称 红磷 白磷 蜡烛
最低含氧量/% 8.0 4.0 16.0
(3)白磷和红磷相比,使用白磷能使结果更准确,其原因是 ;
(4)小陈根据铁生锈的原理(铁在常温下可以和氧气、水生成铁锈)来测定空气中氧气的含量,装置如图2将足量粗铁丝置于试管底部,并倒扣在装有水的烧杯中,一段时间后你将看到的现象是 ,通过7天后测得的数据计算出空气中氧气的含量为19.13%。
(5)小陈利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图3)。8分钟后测得的数据如下表,计算出空气中氧气含量为 (结果保留1位小数)。
实验前集气瓶内空气的体积 实验前烧杯内蒸馏水的体积 实验后烧杯内剩余蒸馏水的体积
120mL 90.0mL 65.8mL
(6)通过上述实验探究,下列四组实验中选择 (填字母)进行实验,可较为快速地完成实验并减小实验误差。
a.红磷 b.白磷 c.粗铁丝 d.铁粉、炭粉、氯化钠、蒸馏水
19.(6分)科学上规定以C-12原子质量的作为标准,用其他原子的实际质量跟它相比所得到的比值就是该原子的相对原子质量。C-12原子的质量为1.993×10-26kg,铬原子的质量为8.636×10-26kg。已知铬原子核内中子数比质子数多4。
(1)(2分)铬的相对原子质量为 。(保留一位小数)。
(2)(4分)铬原子核内质子数为 ,中子数为 。
答案解析部分
1.【答案】C
【知识点】空气的组成;测定空气中的氧气含量
【解析】【解答】A、该实验中红磷为反应物,其质量随反应的发生而减小,实验时取用过量红磷,最终红磷应有剩余,则反应结束时红磷保持一定质量不变,不符合题意;
B、磷燃烧时放热,放热造成装置内压强增大值大于消耗氧气压强减小值,温度恢复后,由温度变化引起的压强变化再恢复,但最终因氧气的消耗,压强涉于原始值,不符合题意;
C、红磷燃烧消耗氧气,不消耗氮气,集气瓶内氮气的质量不变,符合题意;
D、该实验开始前集气瓶内有一部分水,打开弹簧夹前,水的中保持不变,打开弹簧夹后,烧杯中的水进入集气瓶,水的体积增加,至一定体积后保持不变,不符合题意;
故答案为:C
【分析】根据红磷燃烧测定氧气含量时,装置内压强的变化、红磷用量、瓶内水的体积变化及空气中未反应的其它气体的质量不变分析。
2.【答案】C
【知识点】氮气及稀有气体的用途
【解析】【解答】稀有气体在通电下会发出有颜色的光,稀有气体可用于霓虹灯制作,
故答案为:C。
【分析】 根据稀有气体的用途分析。
3.【答案】A
【知识点】纯净物和混合物
【解析】【解答】A、雪碧饮料是由水、碳酸等混合而成,属于混合物;铁丝是由同种物质组成,属于纯净物,A符合题意;
B、冰是固态的水,冰水混合物是由水一种物质组成,属于纯净物;澄清石灰水是由氢氧化钙和水混合而成,属于混合物,B不符合题意;
C、海水是由水、氯化钠等混合而成,属于混合物;净化后的空气是由氮气、氧气等混合而成,属于混合物,C不符合题意;
D、五氧化二磷由同种物质组成,属于纯净物,稀有气体由氖气、氦气等混合而成,属于混合物,D不符合题意。
故答案选:A。
【分析】根据一种物质组成的是纯净物,多种物质混合而成的是混合物分析。
4.【答案】A
【知识点】空气的污染与防治
【解析】【解答】A、打开教室门窗通风,不会产生污染物,不会污染空气,符合题意;
B、露天焚烧垃圾会产生可吸入颗粒物、一氧化碳等空气污染物,会污染空气,不符合题意;
C、“烟气”中含有多种有害物质如可吸入颗粒物、一氧化碳等,会污染空气,不符合题意;
D、燃放烟花爆竹会产生二氧化硫等空气污染物,会污染空气,不符合题意;
故答案为:A。
【分析】 空气污染物主要包括可吸入颗粒物、二氧化硫、氮氧化物、一氧化碳等。
5.【答案】A
【知识点】物质的微粒性
【解析】【解答】A、金刚石属于固态非金属单质,是由碳原子直接构成的,符合题意;
B、氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的,不符合题意;
C、氢气属于气态非金属单质,氢气是由氢分子构成的,不符合题意;
D、铜属于固态金属单质,铜是由铜原子构成的,不符合题意。
故答案为:A.
【分析】根据物质由分子、原子、离子构成来解答。
6.【答案】A
【知识点】分子和原子的区别和联系;原子结构示意图与离子结构示意图;分子的定义与分子的特性
【解析】【解答】A、温度升高,水银柱上升,是因为汞原子间的间隔增大,汞原子体积不变,故A答案错误;
B、墙内开花墙外香,是因为分子在不断地运动,向四周扩散,使人们闻到香味,故B答案正确;
C、稀有气体的原子最外层达到稳定结构,化学性质不活泼,可用作保护气,故C答案正确;
D、燃烧的木条在氧气中燃烧更旺,在二氧化碳中熄灭,氧气是由氧分子构成的,二氧化碳是由二氧化碳分子构成的,分子不同,化学性质不同,故D答案正确;
故答案选:A。
【分析】A、根据温度升高,汞原子间的间隔变大分析;
B、根据分子在不断地运动分析;
C、根据稀有气体的原子最外层达到稳定结构,化学性质不活泼分析;
D、根据不同物质的分子化学性质不同分析。
7.【答案】C
【知识点】原子和离子的相互转化;原子结构示意图与离子结构示意图
【解析】【解答】在原子中质子数等于电子数。在原子核外电子的排布中,最外层电子小于4个时,易失去电子形成阳离子,当最外层电子大于4时,易得到电子形成阴离子,当最外层电子数为4时,得电子的能力与失电子的能力相当,可能形成阳离子,也可能形成阴离子。
A、在氟原子结构图中,最外层有7个电子,易得电子形成阴离子,不符合题意;
B、氖原子结构图中,最外层有8个电子,属于稳定结构,所以不易离子,不符合题意;
C、钠原子结构图中,最外层是1个电子,化学反应中易失去最外层1个电子,形成带一个单位正电荷的阳离子,符合题意;
D、硅原子结构图中,最外层有4个电子,得电子的能力与失电子的能力相当,相比较而言,比最外层电子数是1的原子更难失掉电子,不符合题意。
故答案为:C.
【分析】在原子结构示意图中,当最外层电子小于4个时,易失去电子形成阳离子,当最外层电子大于4时,易得到电子形成阴离子,当最外层电子数为4时,得电子的能力与失电子的能力相当,可能形成阳离子,也可能形成阴离子来解答。
8.【答案】B
【知识点】原子的定义与构成;分子的定义与分子的特性;化学反应的实质
【解析】【解答】A、同种原子可以构成不同的分子,如水分子和过氧化氢分子。A答案正确;
B、在化学变化中,分子可分,原子不能再分。B答案错误;
C、电子的质量非常小,可以忽略不计,原子的质量主要集中在原子核上。C答案正确;
D、物质是由分子,原子,离子构成的,纯净物不一定由同种分子构成,如氯化钠。D答案正确;
故答案为:B。
【分析】A、根据同种原子可以构成不同的分子分析;
B、根据在化学变化中,分子可分,原子不能再分分析;
C、根据原子的质量主要集中在原子核上分析;
D、根据物质是由分子,原子,离子构成的分析。
9.【答案】B
【知识点】元素的简单分类;物质的元素组成
【解析】【解答】A、小苏打中碳、氢、氧元素属于非金属元素,钠元素属于金属元素,不符合题意;
B、纯金只含有金属元素金元素,符合题意;
C、酒精中碳、氢、氧都是非金属元素,不符合题意;
D、木炭只含非金属元素碳元素,不符合题意;
故答案为:B。
【分析】根据金属元素除金、汞外,一般名称带“钅”,结合所给各物质化学式确定元素组成及种类分析。
10.【答案】A
【知识点】物质的微粒性;元素的概念;物质的元素组成
【解析】【解答】A、氧化钙与水反应生成氧化钙,反应过程中放出热量,该反应不是燃烧,则化学反应中不通过燃烧也能获得热量,故选项A说法正确。
B、氧气是由氧分子构成,氯化钠是由钠离子与氯离子构成,故选项B说法错误。
C、金刚石与石墨不是同种物质,则石墨转化为金刚石的变化有新物质生成,发生的属于化学变化,故选项C说法错误。
D、乙醇的化学式为 C2H6O ,它是由3种元素组成,元素是个宏观概念,只讲种类、不讲个数,故选项D说法错误。
故答案为:A
【分析】A、根据化学反应中的能量变化来分析。
B、根据构成物质的基本粒子来分析。
C、根据是否生成新物质来分析。
D、根据元素的规定来分析。
11.【答案】(1)①③⑤⑥;②④⑦⑧
(2)AE;D;BC
【知识点】核外电子在化学反应中的作用;原子结构示意图与离子结构示意图;纯净物和混合物
【解析】【解答】(1)①氮气是气体单质,属于纯净物;②空气中含有氮气、氧气等,属于混合物;③二氧化碳是由一种物质组成的,属于纯净物;④矿泉水中含有水、矿物质,属于混合物;③高锰酸钾是由一种物质组成的,属于纯净物;⑥二氧化锰是由一种物质组成的,属于纯净物;⑦食盐中含有氯化钠、碘酸钾,属于混合物;⑧牛奶含有水、蛋白质等,属于混合物。
其中属于纯净物的有①③⑤⑥,属于混合物的有②④⑦⑧。
(2)A粒子核外有三个电子层,最外层电子数为1,容易失去1个电子形成阳离子;B粒子核外有两个电子层,最外层电子数为8,已达到稳定结构;C粒子核外有两个电子层,最外层电子数为8,已达到稳定结构;D粒子核外有三个电子层,最外层电子数为7,容易得到1个电子形成阴离子;E粒子核外有三个电子层,最外层电子数为2,容易失去2个电子形成阳离子。
则易失电子形成阳离子的是AE,易得电子形成阴离子的是D,已达稳定结构的是BC。
【分析】(1)根据纯净物由一种物质组成,混合物由多种物质组成,结合常见物质的组成分析;
(2)根据粒子的最外层电子数小于4时易失电子,大于4时易得电子,等于8(只有一层时为2)时达到稳定结构分析。
12.【答案】(1)胶头滴管
(2)C、B、A;分子在不断运动;浓氨水
【知识点】实验室常见的仪器及使用;分子的定义与分子的特性
【解析】【解答】(1)胶头滴管用于吸取和滴加少量液体,这里需要少量的浓氨水,故吸取浓氨水,滴在棉花上的仪器名称是:胶头滴管。
(2)1:实验中,可以观察到A、B、C三处的酚酞溶液变色的顺序是:C、B、A:。
2:浓氨水和酚酞溶液未直接接触,一段时间后,酚酞溶液变红,说明分子在不断运动,当氨分子运动到酚酞溶液处时,氨气溶于水形成氨水,氨水显碱性,能使无色酚酞试液变红,因为距离棉花的距离由近到远为C、B、A,所以这三处酚酞溶液变色的顺序是C、B、A。
3:滴加了浓氨水的棉花没有变色,滴加了酚酞溶液的滤纸变红,说明酚酞溶液没有挥发而浓氨水具有挥发性。
【分析】根据浓氨水易挥发而酚酞不易挥发入手。
13.【答案】(1)13;失去;
(2)B
(3)A;B;D
(4)B;D
【知识点】原子结构示意图与离子结构示意图;元素的概念;元素周期表的特点及其应用
【解析】【解答】(1)地壳中含量最多的金属元素是铝元素,如表可知,其周期表标签左上角数字即原子序数为13,核外电子排布是2、8、3,最外层电子数是3,小于4,化学反应时易失去三个电子形成带三个单位正电荷的阳离子,由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,故表示为:
(2)元素是具有相同核电荷数即质子数的一类原子的总称,不同种元素最本质的区别是质子数不同,故选:B;
(3)根据元素周期表可知:
A、同周期元素,从左到右,各元素原子的电子层数相同,选项正确;
B、同周期元素,从左到右,各元素原子的原子序数依次增加,选项正确;
C、同周期元素,从左到右,各元素原子的最外层电子数依此增加,选项错误;
D、同周期元素,从左到右,各元素原子最外层电子数依次递增,选项正确;
故选:ABD;
(4)元素具有相似化学性质的是原子最外层电子数相等的原子,根据元素周期表可知原子最外层电子数相等的元素在同一纵行,如表,氧元素和硫元素属于同一族,氟元素和氯元素属于同一族,它们的化学性质相似,故选:BD。
【分析】(1)根据地壳中含量最多的金属元素是铝元素,单元格左上角的数字表示原子序数分析;
(2)根据不同种元素最本质的区别是质子数不同分析;
(3)根据元素周期表的规律分析;
(4)根据元素的化学性质由原子最外层电子数决定分析。
(1)地壳中含量最多的金属元素是铝元素,如表可知,其周期表标签左上角数字即原子序数为13,核外电子排布是2、8、3,最外层电子数是3,小于4,化学反应时易失去三个电子形成带三个单位正电荷的阳离子,由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,故表示为:
(2)元素是具有相同核电荷数即质子数的一类原子的总称,不同种元素最本质的区别是质子数不同,故选:B;
(3)根据元素周期表可知:
A、同周期元素,从左到右,各元素原子的电子层数相同,选项正确;
B、同周期元素,从左到右,各元素原子的原子序数依次增加,选项正确;
C、同周期元素,从左到右,各元素原子的最外层电子数依此增加,选项错误;
D、同周期元素,从左到右,各元素原子最外层电子数依次递增,选项正确;
故选:ABD;
(4)元素具有相似化学性质的是原子最外层电子数相等的原子,根据元素周期表可知原子最外层电子数相等的元素在同一纵行,如表,氧元素和硫元素属于同一族,氟元素和氯元素属于同一族,它们的化学性质相似,故选:BD。
14.【答案】(1)19.00
(2)8
(3)Cl-
(4)BC
(5)B
【知识点】原子结构示意图与离子结构示意图;元素的概念;元素的符号及其意义;元素周期表的特点及其应用
【解析】【解答】(1)根据图示可知,元素名称下面的数字表示相对原子质量,氟元素的相对原子质量为19.00;
(2)原子中,原子中核电荷数=核外电子数,即18=2+8+X,X=8;
(3)C中核电荷数小于核外电子数,表示阴离子,二者数值相差1,即带有1个单位负电荷的离子,所以C粒子的化学符号Cl-;
(4)同种元素的质子数相同,则A、B、C、D结构示意图中,属于同种元素的粒子是BC;
(5)A粒子的最外层有7个电子,B粒子的最外层有7个电子,因此A的化学性质与B粒子的化学性质相似;故答案为:B。
【分析】(1)根据元素名称下面的数字表示相对原子质量分析;
(2)根据原子中核电荷数=核外电子数分析;
(3)根据阴离子中核电荷数小于核外电子数分析;
(4)根据元素的种类由质子数决定分析;
(5)根据原子的最外层电子数决定化学性质分析。
(1)根据图示可知,元素名称下面的数字表示相对原子质量,氟元素的相对原子质量为19.00;
(2)原子中,原子中核电荷数=核外电子数,即18=2+8+X,X=8;
(3)C中核电荷数小于核外电子数,表示阴离子,二者数值相差1,即带有1个单位负电荷的离子,所以C粒子的化学符号Cl-;
(4)同种元素的质子数相同,则A、B、C、D结构示意图中,属于同种元素的粒子是BC;
(5)A粒子的最外层有7个电子,B粒子的最外层有7个电子,因此A的化学性质与B粒子的化学性质相似;故答案为:B。
15.【答案】(1)②⑤
(2)④⑤
(3)①③
(4)①③
【知识点】物质的元素组成;纯净物和混合物;从组成上识别氧化物
【解析】【解答】解:水是由氢氧元素组成的纯净物,故属于氧化物;澄清石灰水是氢氧化钙和水形成的混合物;过氧化氢是由氢氧元素组成的纯净物,属于氧化物;氧气是由氧元素组成的单质;空气是由氧气、氮气、稀有气体形成的混合物。
故答案为:(1) 属于混合物的有 ②⑤ ;
(2) 含有氧分子的物质一定是有氧气为 ④⑤ ;
(3) 属于氧化物的是 ①③ ;
(4) 组成物质的元素相同,而化学性质不同的两种物质是 ①③ 。
【分析】(1)根据混合物的概念是由多种物质混合而成来解答;
(2)根据氧气由氧分子构成,含有氧气的物质来解答;
(3)根据氧化物的概念是由两种元素组成,其中一种是氧元素的化合物来解答;
(4)根据过氧化氢和水都是由氧元素和氢元素组成来解答。
16.【答案】(1)②⑥⑧
(2)①⑦
(3)③⑤
【知识点】单质和化合物;纯净物和混合物;从组成上识别氧化物
【解析】【解答】(1)洁净的空气中含有氮气、氧气等物质,属于混合物;自来水中含有水和一些溶于水的物质,属于混合物;稀有气体包括氦气、氖气、氩气等,故稀有气体属于混合物,故答案为:②⑥⑧;
(2)由两种元素组成的化合物中,其中一种元素是氧元素的叫作氧化物,上述物质中,只有冰水共存物(H2O)、四氧化三铁(Fe3O4)是由两种元素组成的的化合物,且其中一种元素是氧元素,所以属于氧化物,故答案为:①⑦;
(3)由同种元素组成的纯净物叫作单质,上述物质中只有硫粉(S)和液氮(N2)是由一种元素组成的纯净物,所以属于单质。故答案为:③⑤。
【分析】(1)根据混合物的定义分析回答;
(2)根据氧化物的定义分析回答;
(3)根据单质的定义分析回答。
(1)洁净的空气中含有氮气、氧气等物质,属于混合物;自来水中含有水和一些溶于水的物质,属于混合物;稀有气体包括氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)和氡(Rn),稀有气体属于混合物。故填:②⑥⑧。
(2)冰水共存物、四氧化三铁都是由氧元素和另外一种元素组成的化合物,属于氧化物。故填:①⑦。
(3)硫粉、液氮都是由一种元素组成的纯净物,属于单质。故填:③⑤。
17.【答案】(1)A
(2)6:1
(3)
(4)3
【知识点】化学方程式的书写与配平;化学式的相关计算;微粒观点及模型图的应用;从组成上识别氧化物
18.【答案】P+O2P2O5;红磷不足或没有冷却到室温读数或装置漏气;白磷燃烧需要达到最低含氧量更低,可以将氧气消耗的更完全;铁丝表面有红色物质生成,试管内液面上升;20.2%;bd
【知识点】测定空气中的氧气含量
【解析】【解答】(1)红磷燃烧生成五氧化二磷,反应的符号表达式:P+O2P2O5;
(2)若进入集气瓶中水的体积不到总容积的,是由于反应结束后集气瓶内的气压偏大,可能是氧气没有完全消耗或温度偏高或有空气进入,具体的原因可能是红磷不足或没有冷却到室温读数或装置漏气等;
(3)根据表格中数据可知,白磷和红磷相比,使用白磷能使结果更准确,其原因白磷燃烧需要达到最低含氧量更低,可以将氧气消耗的更完全;
(4)铁在潮湿空气易与水和氧气反应生成铁锈,试管内的气压下降,装置如图2将足量粗铁丝置于试管底部,并倒扣在装有水的烧杯中,一段时间后你将看到的现象是铁丝表面有红色物质生成,试管内液面上升;
(5)小陈利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图3)。实验前集气瓶内空气为120mL,烧杯内蒸馏水为90.0mL,实验后烧杯内剩余蒸馏水65.8mL,消耗的氧气体积=90.0mL-65.8mL=24.2mL,空气中氧气含量=;
(6)通过上述实验探究,白磷和铁粉、炭粉、氯化钠、蒸馏水进行实验,可较为快速地完成实验并减小实验误差,红磷和粗铁丝都有较大误差。故填:bd。
【分析】(1)根据磷燃烧生成五氧化二磷分析;
(2)根据药品不足、装置漏气或打开止水夹过早等会使结果偏小分析;
(3)根据白磷消耗氧气更彻底分析;
(4)根据铁生锈是与氧气和水共同作用分收入
(5)根据烧杯内减少水的体积即为氧气体积,由此计算空气中氧气含量分析;
(6)根据实验探究确定能快速且彻底消耗氧气的药品分析。
19.【答案】(1)52.0
(2)24;28
【知识点】原子的有关数量计算
【解析】【解答】(1)国际上一致采用相对原子质量,即以一种碳原子质量的1/12为标准,其他原子的质量与它相比较得到的比值,作为这种原子的相对原子质量,铬的相对原子质量为;
(2)相对原子质量等于质子数加中子数,铬原子核内质子数为,x=24,中子数为 24+4=28.
【分析】(1)根据国际上一致采用相对原子质量,即以一种碳原子质量的1/12为标准,其他原子的质量与它相比较得到的比值,作为这种原子的相对原子质量分析;
(2)根据相对原子质量等于质子数加中子数分析。
试题分析部分
1、试卷总体分布分析
总分:100分
分值分布 客观题(占比) 20.0(20.0%)
主观题(占比) 80.0(80.0%)
题量分布 客观题(占比) 10(52.6%)
主观题(占比) 9(47.4%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
选择题 10(52.6%) 20.0(20.0%)
非选择题 9(47.4%) 80.0(80.0%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (73.7%)
2 容易 (21.1%)
3 困难 (5.3%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 单质和化合物 6.0(6.0%) 16
2 物质的微粒性 4.0(4.0%) 5,10
3 分子的定义与分子的特性 12.0(12.0%) 6,8,12
4 化学方程式的书写与配平 8.0(8.0%) 17
5 原子的定义与构成 2.0(2.0%) 8
6 化学反应的实质 2.0(2.0%) 8
7 元素的概念 24.0(24.0%) 10,13,14
8 元素的简单分类 2.0(2.0%) 9
9 元素周期表的特点及其应用 22.0(22.0%) 13,14
10 物质的元素组成 12.0(12.0%) 9,10,15
11 微粒观点及模型图的应用 8.0(8.0%) 17
12 原子和离子的相互转化 2.0(2.0%) 7
13 从组成上识别氧化物 22.0(22.0%) 15,16,17
14 化学式的相关计算 8.0(8.0%) 17
15 纯净物和混合物 26.0(26.0%) 3,11,15,16
16 空气的污染与防治 2.0(2.0%) 4
17 分子和原子的区别和联系 2.0(2.0%) 6
18 元素的符号及其意义 10.0(10.0%) 14
19 核外电子在化学反应中的作用 10.0(10.0%) 11
20 原子结构示意图与离子结构示意图 36.0(36.0%) 6,7,11,13,14
21 空气的组成 2.0(2.0%) 1
22 氮气及稀有气体的用途 2.0(2.0%) 2
23 实验室常见的仪器及使用 8.0(8.0%) 12
24 测定空气中的氧气含量 14.0(14.0%) 1,18
25 原子的有关数量计算 6.0(6.0%) 19
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
