黑龙江省哈尔滨市第九中学2024-2025学年高二上学期10月月考化学试题 (含答案)
文档属性
| 名称 | 黑龙江省哈尔滨市第九中学2024-2025学年高二上学期10月月考化学试题 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-25 12:21:45 | ||
图片预览




文档简介
哈尔滨市第九中学2024—2025学年度上学期
十月月考高二化学考试试卷
(考试时间:75分钟 满分:100分)
第I卷(共45分)
一、选择题(本题共15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1. 下列事实能用勒夏特列原理解释的是
A. 可用排饱和食盐水法收集 B. 将猪肉放入冰箱中冷藏
C. 平衡混合气体加压后颜色变深 D. 溶液中加少量固体,促进分解
2. 反应 ,其反应速率方程为。下列措施能同时提高平衡转化率和反应速率的是
A. 升高温度 B. 使用催化剂 C. 减小的浓度 D. 增大容器体积
3. 向恒容密闭容器中充入一定体积的,发生反应后达到平衡。若保持温度不变,再充入相同体积的,达到新平衡后,与原平衡相比,下列值增大的是
A. B. 的转化率 C. 的体积分数 D.
4. 氨对发展农业有着重要意义,也是重要的化工原料。合成氨的生产流程示意如下。
下列说法不正确的是
A. 原料气须经过净化处理,以防止催化剂中毒和安全事故发生
B. 合成氨一般选择400~500℃进行,主要是让铁触媒的活性最大,平衡转化率高
C. 热交换的目的是预热原料气,同时对合成的氨气进行降温利于液化分离
D. 新型锰系催化剂将合成氨的温度、压强分别降到了350℃、1MPa,显著降低合成氨的能耗
5. 下列说法正确的是
A. C(石墨,s)=C(金刚石,s)ΔH=+1.9kJ·mol-1,则:由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
B. 已知C2H5OH(1)的燃烧热是1366.8kJ·mol-1,则C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)反应的ΔH=-1366.8kJ·mol-1
C. 一定条件下2SO2(g)+O2(g) 2SO3(g) ΔH1,2SO2(g)+O2(g) 2SO3(l) ΔH2,则ΔH1>ΔH2
D. 在一定温度和压强下,将0.5molN2和1.5molH2充分反应生成NH3(g),放出热量19.3kJ,则其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6kJ·mol-1
6. 将1molN2O5充入10L恒容密闭容器中,在一定温度下发生下列反应:①2N2O5(g)2N2O4(g)+O2(g) K1;②N2O4(g)2NO2(g) K2(K1、K2为反应平衡常数)。10min末,该反应达到平衡,此时c(O2)=0.02mol L-1,c(NO2)=0.06mol L-1,下列说法正确的是
A. N2O5的物质的量分数为20%
B. 若反应N2O5(g)2NO2(g)+O2(g) K3,则K3=
C. v(O2)=0.02mol L-1 min-1
D K1 K2=2×10-4
7. 在密闭容器中进行反应:X(g)+3Y(g)2Z(g),有关下列图像的说法错误的是
A. 依据图a可判断逆反应ΔH>0
B. 在图b中,虚线可表示使用了催化剂
C. 图c可表示增大压强对正逆化学反应速率变化
D. 由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的<0
8. 工业上合成甲醇的反应:CO(g)+2H2(g)CH3OH(g) =-90.8kJ·mol-1.恒温恒容,按不同方式投入反应物,3个密闭容器体积相等,测得反应达到平衡时的有关数据如下,下列说法错误的是
容器 甲 乙 丙
反应物投入量 1molCO 、2molH2 1mol CH3OH 2molCO、4molH2
H2的浓度(mol/L) c1 c2 c3
反应的能量变化 放出Q1 kJ 吸收Q2 kJ 放出Q3 kJ
CH3OH体积分数 φ1 φ2 φ3
反应物转化率 α 1 α 2 α 3
A. 2c1>c3 B. Q1+Q2=90.8 C. α2+α3>100% D. φ2>φ3
9. 乙醇是重要有机化工原料,可由乙烯气相直接水合法制取,已知等物质的量的和的混合气体在一定的条件下反应:,乙烯的平衡转化率与温度、压强的关系如图。下列说法不正确的是
A. 压强由小到大顺序为
B. 当温度从升高到时,增大的倍数大于
C. A点混合气体中的体积分数为
D. 若保持其他条件不变,将容器改为恒压密闭容器,则的平衡转化率将增大
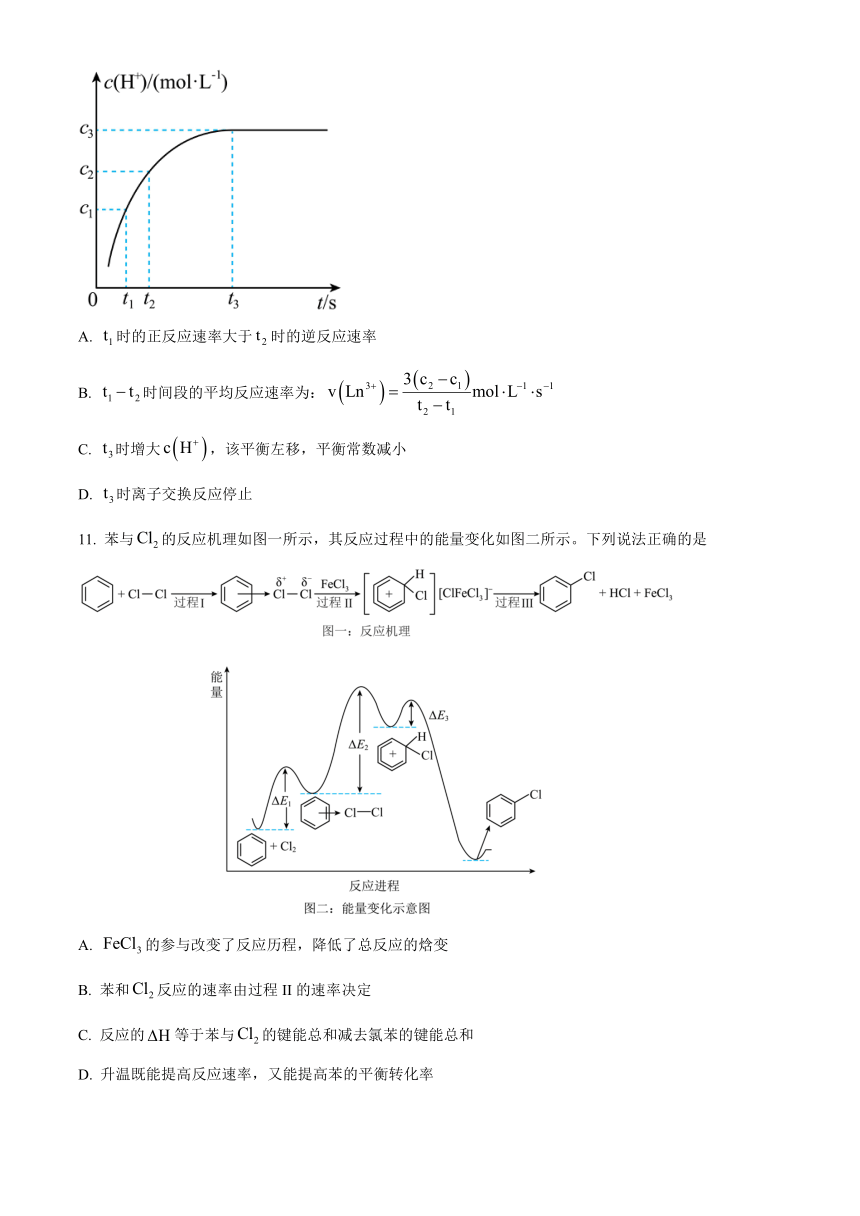
10. 稀土被称为新材料的宝库。稀土中的镧系离于可用离子交换法分离,其反应可表示为:。某温度时,随时间变化关系如图所示。下列说法正确的是
A. 时的正反应速率大于时的逆反应速率
B. 时间段的平均反应速率为:
C. 时增大,该平衡左移,平衡常数减小
D. 时离子交换反应停止
11. 苯与的反应机理如图一所示,其反应过程中的能量变化如图二所示。下列说法正确的是
A. 的参与改变了反应历程,降低了总反应的焓变
B. 苯和反应的速率由过程II的速率决定
C. 反应的等于苯与的键能总和减去氯苯的键能总和
D. 升温既能提高反应速率,又能提高苯的平衡转化率
12. 下列有关实验操作、现象和结论均正确的是
选项 实验操作 实验现象 实验结论
A 将封装有NO2和N2O4混合气体的烧瓶浸泡在热水中 气体颜色变浅 升高温度,平衡向吸热反应方向移动
B 将1mL0.1mol/LKI溶液与5mL0.1mol/LFeCl3溶液混合,再滴加KSCN溶液 溶液变为红色 FeCl3与KI的反应有一定的限度
C 向两份等浓度、等体积的过氧化氢溶液中分别加入2滴等浓度的FeCl3溶液和CuSO4溶液 前者产生气泡较快 催化效率:Fe3+>Cu2+
D 分别取2mL0.5mol/LCuCl2溶液(绿色)加入两支试管中,将其中一支试管先加热,然后置于冷水中,与另一支试管的溶液颜色对比 加热时溶液变为黄绿色;置于冷水中,溶液由黄绿色变为蓝绿色 其他条件不变时,升高温度,平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动
A. A B. B C. C D. D
13. T0时,向容积为5L的恒容密闭容器中充入一定量的A(g)和B(g),发生反应:△H<0。反应过程中的部分数据如下表,下列说法错误的是
t/min n(A)/mol n(B)/mol
0 4.0 2.0
5 2.0 1.0
10 2.0 1.0
A. 其他条件不变,温度变为T1时,平衡时测得C的浓度为0.8mol/L,则T1>T0
B. 8min时,该反应的(正)=(逆)
C. 平衡时,D的体积分数约为14.3%
D. 5min时,向该容器中再充入4.0molA和2.0molB,达新平衡后,B的百分含量变大
14. 利用丙烷C3H8在无氧条件下制备丙烯C3H6的反应方程式为:。向两个初始压强为0.1MPa的相同恒压容器Ⅰ、Ⅱ中都充入等物质的量的丙烷气体,再向Ⅱ容器中充入一定量的水蒸气进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法正确的是
A. b曲线表示的是Ⅰ容器中丙烯随温度变化的物质的量分数
B. A点对应的该反应平衡常数(为以分压表示的平衡常数)
C. 根据B点数据可以计算出丙烷的平衡转化率
D. 相同温度下Ⅱ容器中丙烷的平衡转化率比Ⅰ容器小
15. 常温下,向某溶剂(不参与反应)中加入一定量X、Y和M,所得溶液中同时存在如下平衡:
(ⅰ)
(ⅱ)
(ⅲ)
X、Y的物质的量浓度随反应时间的变化关系如图所示,300 s后反应体系达到平衡状态。
下列说法正确的是
A 100~300 s内,
B. 时,反应(ⅲ)的逆反应速率大于正反应速率
C. 若反应(ⅲ)的,则X比Y更稳定
D. 若再向容器中加入上述溶剂,则、均不变
II卷(共55分)
二、填空题
16. 完成下列问题
(1)下图为常温下碳酸二甲酯的合成反应的反应机理(吸附在催化剂表面上的物种用*标注)。
写出合成碳酸二甲酯的热化学方程式______(已知)。该反应历程中有______步基元反应,写出该反应进程中决速步骤的方程式_______。
(2)以废旧铅酸蓄电池为原料回收铅时会向废旧铅酸蓄电池中加入少量,将和先都转化成,总反应方程式为,过程中涉及如下两个反应,请将②反应的方程式写在横线上。
①
②____________。
(3)钌及其化合物在合成工业上有广泛用途,下图是用钌(Ru)基催化剂催化合成甲酸的过程。每生成液态(摩尔质量)放出的热量。
根据图示写出该反应的热化学方程式:______。
(4)在一定温度下,利用催化剂将分解为和。
相关化学键的键能数据
化学键 H—H N—H
键能 946 436.0 3908
已知该反应的,在下列哪些温度下反应能自发进行?___(填字母)。
A. B. C. D.
17. 某兴趣小组以重铬酸钾溶液为研究对象,根据其“色彩变幻”探究影响化学反应速率和化学平衡的因素。
已知:①溶液存在平衡:。
②含铬元素的离子在溶液中的颜色:(橙色),(黄色),(绿色)。
I.探究影响化学反应速率的因素
组别 温度 K2Cr2O7溶液 Na2SO3溶液 H2SO4溶液 蒸馏水(mL) 溶液变绿色所需时间(秒)
c(mol/L) V(mL) c(mol/L) V(mL) c(mol/L) V(mL)
1 298K 0.1 1 0.2 2 1 2 5
2 298K 0.1 1 0.2 4 1 V1 V2
3 318K 0.1 1 0.2 V3 1 2 5
4 298K 0.1 1 0.2 2 1 4 V4
(1)写出该反应的离子方程式:______。
(2)第1组和第2组实验是探究浓度对反应速率的影响,则_______,___(填“<” “>”或“=”)。
(3)第1组和第3组实验是探究______对反应速率的影响。
(4)设计第4组实验的目的是______。
Ⅱ.探究影响化学平衡的因素
(5)i可证明反应的正反应是______反应(填“吸热”或“放热”)。
(6)ii是验证“只降低生成物浓度,该平衡正向移动”,那么加入的试剂a可能是______。
(7)ⅲ的目的是要验证“增大生成物浓度,该平衡逆向移动”,此实验能否达到预期目的______(填“能”或“不能”),理由是______。
(8)根据实验Ⅱ的现象,可得出结论:氧化性:______(填“>”、“<”或“=”)。
18. 一定条件下,水气变换反应的中间产物是。为探究该反应过程,研究的分解反应,常温下,在密封石英管内完全充满水溶液,使分解,分解产物均完全溶于水。
I. Ⅱ.
反应机理及能量关系如下图:
(1)由图示信息可知,下列说法错误的是______。
A.等物质的量的分解生成放热出的热量比生成放热出的热量多
B.低温时分解,是主要产物
C.体系达平衡时,升高温度,HCOOH的浓度增大
D.压强不再改变时,反应体系达到平衡状态
E.分解过程只涉及极性键的断裂和形成
(2)温度保持不变,溶液中含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。时刻测得的浓度分别为,此时达到峰值,反应达到化学平衡状态,反应I的平衡常数为______;此后,随着反应的进行,c(CO2)逐渐增大,c(CO)逐渐减少,结合反应I、Ⅱ说明原因:____________。
(3)研究发现,在反应I、Ⅱ中,仅对反应I有催化加速作用;相同条件下,若反应起始时溶液中同时还含有盐酸,则上图所示点中,的浓度峰值点可能是_______(填标号)。与不用盐酸相比,CO达浓度峰值时,浓度_________(填“增大”“减小”或“不变”),的值____________(填“增大”“减小”或“不变”)。
(4)实验测得反应Ⅱ的,其中分别为正、逆反应的速率常数。则如图(lgK表示速率常数的对数:表示温度的倒数)所示四条斜线中,能表示随变化关系的是斜线____________。
19. 氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。乙醇与水催化重整制氢发生以下反应,回答下列问题:
反应I:
反应II:
(1)已知反应III:
则__________(用含和的代数式表示)。
(2)将和加入容积为的刚性密闭容器中,容器温度保持,下列不能表示反应达到平衡的标志是____________(填编号)。
A.的体积分数不再变 B.压强不再变化
C.混合气体的平均相对分子质量不再变化 D.混合气体密度不再变化
E.不变
(3)压强为的平衡产率与温度、起始时的关系如图所示,每条曲线表示相同的平衡产率。
①反应II的平衡常数:_______(填“>”、“=”或“<”)。
②的产率:点_________点(填“>”、“=”或“<”)。
③A、B两点产率相等的原因是__________。
(4)压强为下,和发生上述反应,平衡时和的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知CO的选择性]
①573K时,10分钟反应达到平衡,则乙醇的物质的量的变化量=_________mol。
②表示选择性的曲线是__________(填标号)。
③573K时,反应II的____________(保留二位有效数字)。
哈尔滨市第九中学2024—2025学年度上学期
十月月考高二化学考试试卷
(考试时间:75分钟 满分:100分)
第I卷(共45分)
一、选择题(本题共15小题,每小题3分,共45分,每小题只有一个选项符合题意)
【1题答案】
【答案】A
【2题答案】
【答案】C
【3题答案】
【答案】A
【4题答案】
【答案】B
【5题答案】
【答案】C
【6题答案】
【答案】D
【7题答案】
【答案】C
【8题答案】
【答案】D
【9题答案】
【答案】B
【10题答案】
【答案】A
【11题答案】
【答案】B
【12题答案】
【答案】D
【13题答案】
【答案】A
【14题答案】
【答案】B
【15题答案】
【答案】B
II卷(共55分)
二、填空题
【16题答案】
【答案】(1) ①. 2CH3OH(l)+CO2(g)= (l)+H2O(l) ②. 3 ③. CH3OH*+HO·*=CH3O·*+H2O*
(2)
(3)H2(g)+CO2(g)=(g) (4)CD
【17题答案】
【答案】(1)
(2) ①. 3 ②. >
(3)温度 (4)探究相同条件下,硫酸溶液浓度对反应速率的影响
(5)放热 (6)KOH
(7) ①. 不能 ②. 加入浓硫酸,不但增加氢离子浓度平衡逆向移动的情况,同时考虑浓硫酸溶于水放出大量的热的情况,浓硫酸溶于水放出大量的热,平衡也会逆向移动
(8)>
【18题答案】
【答案】(1)DE (2) ①. 5 ②. 反应I是快反应,达到平衡所需要的时间短,随着反应进行,反应Ⅱ消耗HCOOH,使I的平衡逆向移动,c(CO)逐渐减少
(3) ①. b ②. 减小 ③. 不变
(4)c
【19题答案】
【答案】(1)×
(2)D (3) ①. = ②. < ③. B点温度高于A点,升高温度,反应II逆向移动消耗氢气的量与反应I、反应Ⅲ正向移动产生氢气的量相等
(4) ①. 0.6 ②. a ③. 14.04
十月月考高二化学考试试卷
(考试时间:75分钟 满分:100分)
第I卷(共45分)
一、选择题(本题共15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1. 下列事实能用勒夏特列原理解释的是
A. 可用排饱和食盐水法收集 B. 将猪肉放入冰箱中冷藏
C. 平衡混合气体加压后颜色变深 D. 溶液中加少量固体,促进分解
2. 反应 ,其反应速率方程为。下列措施能同时提高平衡转化率和反应速率的是
A. 升高温度 B. 使用催化剂 C. 减小的浓度 D. 增大容器体积
3. 向恒容密闭容器中充入一定体积的,发生反应后达到平衡。若保持温度不变,再充入相同体积的,达到新平衡后,与原平衡相比,下列值增大的是
A. B. 的转化率 C. 的体积分数 D.
4. 氨对发展农业有着重要意义,也是重要的化工原料。合成氨的生产流程示意如下。
下列说法不正确的是
A. 原料气须经过净化处理,以防止催化剂中毒和安全事故发生
B. 合成氨一般选择400~500℃进行,主要是让铁触媒的活性最大,平衡转化率高
C. 热交换的目的是预热原料气,同时对合成的氨气进行降温利于液化分离
D. 新型锰系催化剂将合成氨的温度、压强分别降到了350℃、1MPa,显著降低合成氨的能耗
5. 下列说法正确的是
A. C(石墨,s)=C(金刚石,s)ΔH=+1.9kJ·mol-1,则:由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
B. 已知C2H5OH(1)的燃烧热是1366.8kJ·mol-1,则C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)反应的ΔH=-1366.8kJ·mol-1
C. 一定条件下2SO2(g)+O2(g) 2SO3(g) ΔH1,2SO2(g)+O2(g) 2SO3(l) ΔH2,则ΔH1>ΔH2
D. 在一定温度和压强下,将0.5molN2和1.5molH2充分反应生成NH3(g),放出热量19.3kJ,则其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6kJ·mol-1
6. 将1molN2O5充入10L恒容密闭容器中,在一定温度下发生下列反应:①2N2O5(g)2N2O4(g)+O2(g) K1;②N2O4(g)2NO2(g) K2(K1、K2为反应平衡常数)。10min末,该反应达到平衡,此时c(O2)=0.02mol L-1,c(NO2)=0.06mol L-1,下列说法正确的是
A. N2O5的物质的量分数为20%
B. 若反应N2O5(g)2NO2(g)+O2(g) K3,则K3=
C. v(O2)=0.02mol L-1 min-1
D K1 K2=2×10-4
7. 在密闭容器中进行反应:X(g)+3Y(g)2Z(g),有关下列图像的说法错误的是
A. 依据图a可判断逆反应ΔH>0
B. 在图b中,虚线可表示使用了催化剂
C. 图c可表示增大压强对正逆化学反应速率变化
D. 由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的<0
8. 工业上合成甲醇的反应:CO(g)+2H2(g)CH3OH(g) =-90.8kJ·mol-1.恒温恒容,按不同方式投入反应物,3个密闭容器体积相等,测得反应达到平衡时的有关数据如下,下列说法错误的是
容器 甲 乙 丙
反应物投入量 1molCO 、2molH2 1mol CH3OH 2molCO、4molH2
H2的浓度(mol/L) c1 c2 c3
反应的能量变化 放出Q1 kJ 吸收Q2 kJ 放出Q3 kJ
CH3OH体积分数 φ1 φ2 φ3
反应物转化率 α 1 α 2 α 3
A. 2c1>c3 B. Q1+Q2=90.8 C. α2+α3>100% D. φ2>φ3
9. 乙醇是重要有机化工原料,可由乙烯气相直接水合法制取,已知等物质的量的和的混合气体在一定的条件下反应:,乙烯的平衡转化率与温度、压强的关系如图。下列说法不正确的是
A. 压强由小到大顺序为
B. 当温度从升高到时,增大的倍数大于
C. A点混合气体中的体积分数为
D. 若保持其他条件不变,将容器改为恒压密闭容器,则的平衡转化率将增大
10. 稀土被称为新材料的宝库。稀土中的镧系离于可用离子交换法分离,其反应可表示为:。某温度时,随时间变化关系如图所示。下列说法正确的是
A. 时的正反应速率大于时的逆反应速率
B. 时间段的平均反应速率为:
C. 时增大,该平衡左移,平衡常数减小
D. 时离子交换反应停止
11. 苯与的反应机理如图一所示,其反应过程中的能量变化如图二所示。下列说法正确的是
A. 的参与改变了反应历程,降低了总反应的焓变
B. 苯和反应的速率由过程II的速率决定
C. 反应的等于苯与的键能总和减去氯苯的键能总和
D. 升温既能提高反应速率,又能提高苯的平衡转化率
12. 下列有关实验操作、现象和结论均正确的是
选项 实验操作 实验现象 实验结论
A 将封装有NO2和N2O4混合气体的烧瓶浸泡在热水中 气体颜色变浅 升高温度,平衡向吸热反应方向移动
B 将1mL0.1mol/LKI溶液与5mL0.1mol/LFeCl3溶液混合,再滴加KSCN溶液 溶液变为红色 FeCl3与KI的反应有一定的限度
C 向两份等浓度、等体积的过氧化氢溶液中分别加入2滴等浓度的FeCl3溶液和CuSO4溶液 前者产生气泡较快 催化效率:Fe3+>Cu2+
D 分别取2mL0.5mol/LCuCl2溶液(绿色)加入两支试管中,将其中一支试管先加热,然后置于冷水中,与另一支试管的溶液颜色对比 加热时溶液变为黄绿色;置于冷水中,溶液由黄绿色变为蓝绿色 其他条件不变时,升高温度,平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动
A. A B. B C. C D. D
13. T0时,向容积为5L的恒容密闭容器中充入一定量的A(g)和B(g),发生反应:△H<0。反应过程中的部分数据如下表,下列说法错误的是
t/min n(A)/mol n(B)/mol
0 4.0 2.0
5 2.0 1.0
10 2.0 1.0
A. 其他条件不变,温度变为T1时,平衡时测得C的浓度为0.8mol/L,则T1>T0
B. 8min时,该反应的(正)=(逆)
C. 平衡时,D的体积分数约为14.3%
D. 5min时,向该容器中再充入4.0molA和2.0molB,达新平衡后,B的百分含量变大
14. 利用丙烷C3H8在无氧条件下制备丙烯C3H6的反应方程式为:。向两个初始压强为0.1MPa的相同恒压容器Ⅰ、Ⅱ中都充入等物质的量的丙烷气体,再向Ⅱ容器中充入一定量的水蒸气进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法正确的是
A. b曲线表示的是Ⅰ容器中丙烯随温度变化的物质的量分数
B. A点对应的该反应平衡常数(为以分压表示的平衡常数)
C. 根据B点数据可以计算出丙烷的平衡转化率
D. 相同温度下Ⅱ容器中丙烷的平衡转化率比Ⅰ容器小
15. 常温下,向某溶剂(不参与反应)中加入一定量X、Y和M,所得溶液中同时存在如下平衡:
(ⅰ)
(ⅱ)
(ⅲ)
X、Y的物质的量浓度随反应时间的变化关系如图所示,300 s后反应体系达到平衡状态。
下列说法正确的是
A 100~300 s内,
B. 时,反应(ⅲ)的逆反应速率大于正反应速率
C. 若反应(ⅲ)的,则X比Y更稳定
D. 若再向容器中加入上述溶剂,则、均不变
II卷(共55分)
二、填空题
16. 完成下列问题
(1)下图为常温下碳酸二甲酯的合成反应的反应机理(吸附在催化剂表面上的物种用*标注)。
写出合成碳酸二甲酯的热化学方程式______(已知)。该反应历程中有______步基元反应,写出该反应进程中决速步骤的方程式_______。
(2)以废旧铅酸蓄电池为原料回收铅时会向废旧铅酸蓄电池中加入少量,将和先都转化成,总反应方程式为,过程中涉及如下两个反应,请将②反应的方程式写在横线上。
①
②____________。
(3)钌及其化合物在合成工业上有广泛用途,下图是用钌(Ru)基催化剂催化合成甲酸的过程。每生成液态(摩尔质量)放出的热量。
根据图示写出该反应的热化学方程式:______。
(4)在一定温度下,利用催化剂将分解为和。
相关化学键的键能数据
化学键 H—H N—H
键能 946 436.0 3908
已知该反应的,在下列哪些温度下反应能自发进行?___(填字母)。
A. B. C. D.
17. 某兴趣小组以重铬酸钾溶液为研究对象,根据其“色彩变幻”探究影响化学反应速率和化学平衡的因素。
已知:①溶液存在平衡:。
②含铬元素的离子在溶液中的颜色:(橙色),(黄色),(绿色)。
I.探究影响化学反应速率的因素
组别 温度 K2Cr2O7溶液 Na2SO3溶液 H2SO4溶液 蒸馏水(mL) 溶液变绿色所需时间(秒)
c(mol/L) V(mL) c(mol/L) V(mL) c(mol/L) V(mL)
1 298K 0.1 1 0.2 2 1 2 5
2 298K 0.1 1 0.2 4 1 V1 V2
3 318K 0.1 1 0.2 V3 1 2 5
4 298K 0.1 1 0.2 2 1 4 V4
(1)写出该反应的离子方程式:______。
(2)第1组和第2组实验是探究浓度对反应速率的影响,则_______,___(填“<” “>”或“=”)。
(3)第1组和第3组实验是探究______对反应速率的影响。
(4)设计第4组实验的目的是______。
Ⅱ.探究影响化学平衡的因素
(5)i可证明反应的正反应是______反应(填“吸热”或“放热”)。
(6)ii是验证“只降低生成物浓度,该平衡正向移动”,那么加入的试剂a可能是______。
(7)ⅲ的目的是要验证“增大生成物浓度,该平衡逆向移动”,此实验能否达到预期目的______(填“能”或“不能”),理由是______。
(8)根据实验Ⅱ的现象,可得出结论:氧化性:______(填“>”、“<”或“=”)。
18. 一定条件下,水气变换反应的中间产物是。为探究该反应过程,研究的分解反应,常温下,在密封石英管内完全充满水溶液,使分解,分解产物均完全溶于水。
I. Ⅱ.
反应机理及能量关系如下图:
(1)由图示信息可知,下列说法错误的是______。
A.等物质的量的分解生成放热出的热量比生成放热出的热量多
B.低温时分解,是主要产物
C.体系达平衡时,升高温度,HCOOH的浓度增大
D.压强不再改变时,反应体系达到平衡状态
E.分解过程只涉及极性键的断裂和形成
(2)温度保持不变,溶液中含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。时刻测得的浓度分别为,此时达到峰值,反应达到化学平衡状态,反应I的平衡常数为______;此后,随着反应的进行,c(CO2)逐渐增大,c(CO)逐渐减少,结合反应I、Ⅱ说明原因:____________。
(3)研究发现,在反应I、Ⅱ中,仅对反应I有催化加速作用;相同条件下,若反应起始时溶液中同时还含有盐酸,则上图所示点中,的浓度峰值点可能是_______(填标号)。与不用盐酸相比,CO达浓度峰值时,浓度_________(填“增大”“减小”或“不变”),的值____________(填“增大”“减小”或“不变”)。
(4)实验测得反应Ⅱ的,其中分别为正、逆反应的速率常数。则如图(lgK表示速率常数的对数:表示温度的倒数)所示四条斜线中,能表示随变化关系的是斜线____________。
19. 氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。乙醇与水催化重整制氢发生以下反应,回答下列问题:
反应I:
反应II:
(1)已知反应III:
则__________(用含和的代数式表示)。
(2)将和加入容积为的刚性密闭容器中,容器温度保持,下列不能表示反应达到平衡的标志是____________(填编号)。
A.的体积分数不再变 B.压强不再变化
C.混合气体的平均相对分子质量不再变化 D.混合气体密度不再变化
E.不变
(3)压强为的平衡产率与温度、起始时的关系如图所示,每条曲线表示相同的平衡产率。
①反应II的平衡常数:_______(填“>”、“=”或“<”)。
②的产率:点_________点(填“>”、“=”或“<”)。
③A、B两点产率相等的原因是__________。
(4)压强为下,和发生上述反应,平衡时和的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知CO的选择性]
①573K时,10分钟反应达到平衡,则乙醇的物质的量的变化量=_________mol。
②表示选择性的曲线是__________(填标号)。
③573K时,反应II的____________(保留二位有效数字)。
哈尔滨市第九中学2024—2025学年度上学期
十月月考高二化学考试试卷
(考试时间:75分钟 满分:100分)
第I卷(共45分)
一、选择题(本题共15小题,每小题3分,共45分,每小题只有一个选项符合题意)
【1题答案】
【答案】A
【2题答案】
【答案】C
【3题答案】
【答案】A
【4题答案】
【答案】B
【5题答案】
【答案】C
【6题答案】
【答案】D
【7题答案】
【答案】C
【8题答案】
【答案】D
【9题答案】
【答案】B
【10题答案】
【答案】A
【11题答案】
【答案】B
【12题答案】
【答案】D
【13题答案】
【答案】A
【14题答案】
【答案】B
【15题答案】
【答案】B
II卷(共55分)
二、填空题
【16题答案】
【答案】(1) ①. 2CH3OH(l)+CO2(g)= (l)+H2O(l) ②. 3 ③. CH3OH*+HO·*=CH3O·*+H2O*
(2)
(3)H2(g)+CO2(g)=(g) (4)CD
【17题答案】
【答案】(1)
(2) ①. 3 ②. >
(3)温度 (4)探究相同条件下,硫酸溶液浓度对反应速率的影响
(5)放热 (6)KOH
(7) ①. 不能 ②. 加入浓硫酸,不但增加氢离子浓度平衡逆向移动的情况,同时考虑浓硫酸溶于水放出大量的热的情况,浓硫酸溶于水放出大量的热,平衡也会逆向移动
(8)>
【18题答案】
【答案】(1)DE (2) ①. 5 ②. 反应I是快反应,达到平衡所需要的时间短,随着反应进行,反应Ⅱ消耗HCOOH,使I的平衡逆向移动,c(CO)逐渐减少
(3) ①. b ②. 减小 ③. 不变
(4)c
【19题答案】
【答案】(1)×
(2)D (3) ①. = ②. < ③. B点温度高于A点,升高温度,反应II逆向移动消耗氢气的量与反应I、反应Ⅲ正向移动产生氢气的量相等
(4) ①. 0.6 ②. a ③. 14.04
同课章节目录
