新鲁教版九年级化学第二单元认识物质的构成 各个章节测试试题(含答案)
文档属性
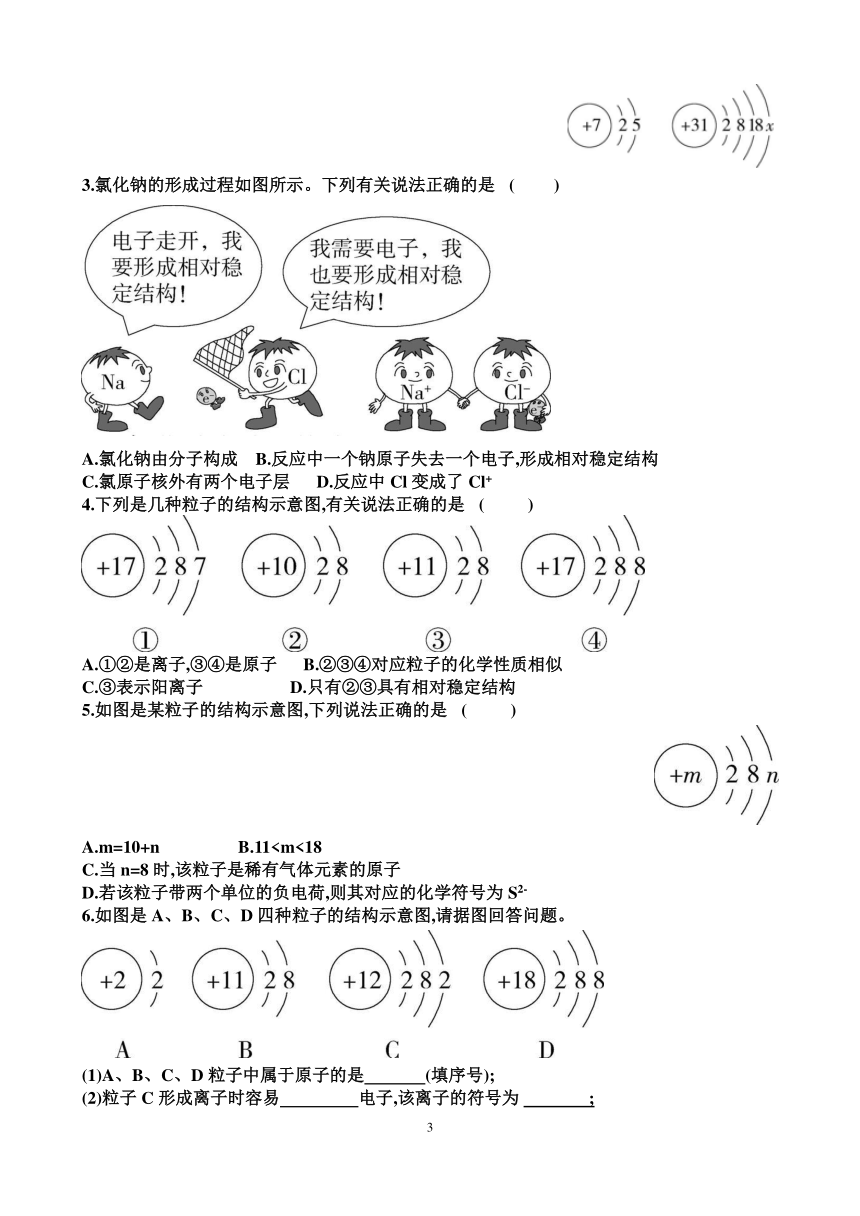
| 名称 | 新鲁教版九年级化学第二单元认识物质的构成 各个章节测试试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 708.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-25 00:00:00 | ||
图片预览




文档简介
第二单元 认识物质的构成
第一节 原 子 第1课时 原子的结构 计量原子的质量
1.1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。根据实验,不能获得的结论是 ( )
A.金原子核带正电 B.金原子核外电子带负电
C.金原子核体积很小 D.金原子核的质量比α粒子大得多
2.下列关于原子的叙述错误的是 ( )
A.原子都是由原子核和核外电子构成的 B.原子核都是由质子和中子构成的
C.原子的质量主要集中在原子核上 D.核内质子数等于核外电子数
3.2023年12月26日11时26分,我国在西昌卫星发射中心成功发射第五十七颗、五十八颗北斗导航卫星。北斗卫星导航系统应用了高精准度的铷原子钟。已知铷原子的核电荷数为37,核内有48个中子,则铷原子的核外电子数为 ( )
A.11 B.48 C.85 D.37
4.下列物质由原子直接构成的是 ( )
A.氧气 B.氧化镁 C.铜 D.二氧化碳
5.如图为某原子结构模型的示意图,其中a、b、c是构成该原子的不同粒子。下列说法正确的是 ( )
A.决定该原子种类的粒子是b B.原子中b与c的数目一定相同
C.原子中a与c的数目一定相同 D.原子的质量主要集中在a和c上
6.根据原子的构成填空。
7.下列有关相对原子质量的说法正确的是 ( )
A.两种原子质量之比等于它们的相对原子质量之比
B.相对原子质量是以碳-12原子的质量作为标准,其他原子的质量跟它比较所得的值
C.相对原子质量就是原子的实际质量
D.原子质量越大,相对原子质量就越小
8.一个碳-12原子的质量为m kg,一个某原子的质量为n kg,则该原子的相对原子质量为 ( )
9.2021年4月,我国科学家首次合成的铀-214是目前已知质量最小的铀原子。其相对原子质量为214,核外电子数是92,则铀-214原子的中子数为 ( )
A.214 B.92 C.122 D.306
10.模型认知是科学研究的一种方法。1911年物理学家卢瑟福完成著名的α粒子轰击金箔实验,提出了有核原子模型。下列各项中,不属于卢瑟福原子结构理论观点的是 ( )
A.原子就像充斥着正电荷的“葡萄干布丁”
B.原子的质量几乎全部集中在原子核上
C.原子核带正电
D.电子在原子核外“很大”空间中运动
11.已知一个碳-12原子的实际质量为1.993×10-26 kg,则一个氧原子的质量是(已知
氧原子的相对原子质量为16) ( )
A.16 g B.16 C.12×16×1.993×10-26 kg D.16×kg
12.锂是制造新能源汽车电池的重要原料。锂原子的构成示意图如图所示,下列有关认识正确的是 ( )
A.锂原子的质子数是2 B.图中带负电的微观粒子是电子
C.锂的原子核内共有5个微观粒子 D.由图可知,锂原子带2个单位负电荷
第2课时 原子与离子、分子
1.镁被誉为“国防金属”,是制造军事装备的重要原料。如图为镁的原子结构示意图,有关镁原子的说法不正确的是( )
A.镁原子核外有3个电子层,共12个电子 B.镁原子不显电性
C.镁原子第2层上的电子能量比第3层上电子的能量高
D.镁原子在化学反应中易失去2个电子
2.氮化镓具有高光电转换效率和优异的电子输运性能,是当前研究的热点。如
图依次是氮和镓的原子结构示意图。下列说法正确的是 ( )
A.氮原子在化学反应中易失去电子 B.镓原子的中子数一定是31
C.镓原子结构示意图中的x等于3 D.两种原子化学性质相似
3.氯化钠的形成过程如图所示。下列有关说法正确的是 ( )
A.氯化钠由分子构成 B.反应中一个钠原子失去一个电子,形成相对稳定结构
C.氯原子核外有两个电子层 D.反应中Cl变成了Cl+
4.下列是几种粒子的结构示意图,有关说法正确的是 ( )
A.①②是离子,③④是原子 B.②③④对应粒子的化学性质相似
C.③表示阳离子 D.只有②③具有相对稳定结构
5.如图是某粒子的结构示意图,下列说法正确的是 ( )
A.m=10+n B.11C.当n=8时,该粒子是稀有气体元素的原子
D.若该粒子带两个单位的负电荷,则其对应的化学符号为S2-
6.如图是A、B、C、D四种粒子的结构示意图,请据图回答问题。
(1)A、B、C、D粒子中属于原子的是 (填序号);
(2)粒子C形成离子时容易 电子,该离子的符号为 ;
(3)与A粒子化学性质相似的粒子是 (填序号,下同);
(4)A、B、C、D粒子中处于相对稳定结构的粒子是 。
7.某粒子R的结构示意图为
(1)当y=3时,该原子是 (填名称);当x=18时,该原子是 (填“金属原子”“非金属原子”或“稀有气体原子”)。
(2)当x=10+y时,该粒子为 ;当x<10+y时,该粒子为 。(填“原子”“阳离子”或“阴离子”)
(3)当y=2时,x= ,该粒子能形成的离子的符号为 。
(4)若该结构示意图表示的粒子的化学符号为R-,则x= ,y= 。
8.如图为铝原子结构示意图。下列有关铝原子的说法正确的是 ( )
A.图中“+”表示铝原子带正电 B.铝原子的质量主要集中在核外13个电子上
C.铝原子在化学反应中易得到电子 D.铝原子核外有3个电子层
9.下列有关粒子的说法中正确的是 ( )
A.原子的原子核都是由质子和中子构成的 B.分子可分,而原子不可再分
C.原子可转化为离子,离子不能转化为原子 D.钠原子和钠离子核电荷数相同
10.下列关于四种粒子的结构示意图说法正确的是 ( )
A.甲、乙的化学性质相似 B.乙表示阴离子
C.丙在化学反应中易失去电子 D.丁中x可能为8
11.模型建构是化学科学研究的基本方法。如图是某同学绘制的原子结构模型和原子结构示意图,有关说法正确的是 ( )
A.③形成的阳离子符号是H+ B.①②属于同类原子
C.①对应的原子结构示意图是④ D.②在化学反应中易失去电子
12.某元素的阳离子A3+的核外有23个电子,核内有30个中子,则该元素的核电荷数和相对原子质量分别为 ( )
A.23 53 B.26 30 C.26 56 D.23 46
13.在①分子、②原子、③质子、④中子、⑤电子、⑥离子、⑦原子最外层电子数中:(填序号)
(1)能构成物质的微粒有 ;
(2)显示电中性的微粒有 ;
(3)质量最小的微粒是 ;
(4)一定带正电的微粒有 ;
(5)一定带负电的微粒有 ;
(6)可能带正电也可能带负电的微粒是 ;
(7)决定原子化学性质的是 ;
(8)决定原子相对原子质量的是 ;
(9)能保持物质化学性质的微粒是 。
第二节 元 素
第1课时 元素和元素符号
1.下列元素属于金属元素的是 ( )
A.氢(H) B.氮(N) C.铝(Al) D.氦(He)
2.我国近代化学先驱徐寿创造了部分元素的汉语名称。下列元素名称与符号不一致的是 ( )
A.钠(Na) B.钙(Ca) C.镁(Hg) D.锰(Mn)
3.地壳中含量最多的金属元素是 ( )
A.Al B.Si C.Fe D.O
4.通过向食盐中添加含碘物质,可预防地方性甲状腺肿大。这里的“碘”是指 ( )
A.原子 B.离子 C.单质 D.元素
5.下列有关元素的说法正确的是 ( )
A.元素是宏观概念,既讲种类又讲个数 B.元素的化学性质由其原子的中子数决定
C.不同元素之间最本质的区别是电子层数不同
D.稀有气体元素原子的最外层电子数不一定是8
6.臭氧(O3)、二氧化氯(ClO2)、过氧化氢(H2O2)等都是生产、生活中常用的消毒剂,这三种物质中都含有 ( )
A.氧分子 B.氧离子 C.氧元素 D.氧气
7.媒体报道:福岛核电站的废水中含有大量的放射性碘-129。碘的元素符号是“I”,下列关于元素符号“I”的说法中,正确的是 ( )
①表示碘元素 ②表示1个碘原子 ③表示1个碘元素
A.①②③ B.②③ C.①② D.①③
8.化学符号是独特的化学语言。下列符号中,既表示一个原子,又表示一种元素,还表示一种物质的是 ( )
A.N B.Fe C.O D.H
9.下列物质中,前者是单质,后者是化合物的是 ( )
A.一氧化碳、食盐水B.水、白酒 C.铁、空气 D.氢气、干冰
10.下列各图中“ ”和“ ”分别表示不同元素的原子,其中表示单质的是 ( )
11.某物质经分析只含有一种元素,则该物质不可能是 ( )
A.单质 B.混合物 C.化合物 D.纯净物
12.宏观与微观相结合是研究和学习化学的重要方法之一。请根据题目回答问题。
(1)根据下图以及所学知识进行判断,纯净物和混合物属于图中的 关系。
(2)有以下几种物质,请按要求填空。
a.冰水混合物 b.空气 c.氧化铜 d.糖水 e.五氧化二磷f.铜 g.液氧
①属于混合物的是 (填字母,下同)。
②属于单质的是 。
(3)如图“”和“”分别表示不同元素的原子,在下列图示中表示纯净物的是 (填字母,下同),表示化合物的是 ;纯净物由分子构成的是 ,由原子直接构成的是 。
13.下列关于单质和化合物的说法不正确的是 ( )
A.单质中只含有一种元素 B.化合物中至少含有两种元素
C.单质中只含有一种微粒 D.化合物中至少含有两种微粒
14.人体缺锌会引起多种疾病,可服用葡萄糖酸锌口服液来补锌。这里的“锌”指的是 ( )
A.原子 B.分子 C.元素 D.单质
15.重氢可应用于光导纤维制备。重氢和氢都属于氢元素,是因为它们的原子具有相同的 ( )
A.质子数 B.中子数 C.体积 D.相对原子质量
16.清朝的《化学鉴原》一书中把地壳中含量第二的元素翻译成“矽”,如今把这种“矽”元素命名为 ( )
A.硒 B.硅 C.铝 D.锡
17.下列各组物质按单质、化合物、混合物的顺序排列的是( )
A.氮气、过氧化氢、海水 B.金刚石、氧化铜、高锰酸钾
C.空气、水银、牛奶 D.铁、氧化镁、冰水混合物
18.下面对于过氧化氢(H2O2)组成的说法,正确的是 ( )
A.过氧化氢由氢气和氧气组成 B.过氧化氢由氢分子和氧分子构成
C.过氧化氢由氢元素和氧元素组成 D.过氧化氢由氢原子和氧原子构成
19.如图是多种多样的物质的组成及构成的思维导图。下列有关说法不正确的是 ( )
A.分子由原子构成 B.氨(NH3)由氨元素组成
C.氯化钠由Na+和Cl-构成 D.构成物质的粒子有分子、原子和离子
20.逻辑推理是化学学习中常用的思维方法,以下推理正确的是 ( )
A.化合物都是由不同种元素组成的,由不同种元素组成的物质一定是化合物
B.单质都是由一种元素组成的,由一种元素组成的物质一定是单质
C.有新物质生成的变化属于化学变化,化学变化一定有新物质生成
D.金属元素原子最外层电子数一般少于四个,最外层电子数少于四个的原子一定属于金属元素
第2课时 元素周期表简介
1.2022年诺贝尔化学奖授予对点击化学等领域做出贡献的科学家。铜离子是点击化学常用的催化剂,铜在元素周期表中的相关信息如图所示,下列说法不正确的是 ( )
A.铜的元素符号是Cu B.铜的原子序数是29
C.铜属于金属元素 D.铜的相对原子质量为63.55 g
2.如图是元素周期表中的一部分及硫原子的结构示意图。下列说法中,错误的是 ( )
A.氩原子相对原子质量是39.95 B.图1中三种元素位于同一族
C.X原子的核外有三个电子层 D.氩原子的中子数是22
3.根据表中提供的信息,以下判断正确的是 ( )
A.Na+和Al3+的核外电子数相同
B.第二周期的Li、Be和B均为金属元素
C.第三周期元素的原子核外电子层数从左到右依次递增
D.在化学变化中镁原子容易失去最外层2个电子形成镁离子,其离子符号是Mg+2
4.建立认识物质的宏观和微观视角之间的关联是化学课标的要求。
(1)近年来,我国航天事业成果显著,“北斗三号”导航卫星搭载了精密计时的铷(Rb)原子钟。图1为铷元素在元素周期表中的信息和铷原子的结构示意图,请回答:
①铷元素原子的质子数为 ,相对原子质量是 。
②n= ,铷元素位于第 周期。
③图2中A~D是四种粒子的结构示意图,其中表示阴离子的是 (填字母),这四种粒子属于 种元素,判断的依据是 。
(2)分析图示信息,铷元素原子的化学性质与图2中的 (填字母)化学性质相似。
5.如图分别为某微观粒子的结构示意图(图1)和元素周期表部分内容(图2),结合图示信息判断,下列有关图1所示微观粒子的说法中,合理的是 ( C )
A.该粒子是阳离子 B.该粒子最外层有8个电子
C.该粒子的相对原子质量为16.00 D.该粒子在化学反应中易失去电子
6.如图是元素周期表的一部分,下列说法错误的是 ( )
A.甲元素的符号是He B.原子序数:乙>丙>甲
C.氮元素的相对原子质量是14.01 D.氖原子的结构示意图为
7.根据下列信息,回答问题。A、B原子的结构示意图如图1所示,图2为元素周期表
的一部分。
(1)A原子的质子数是 ;B原子对应元素在元素周期表中的位置是 (填“甲”“乙”“丙”或“丁”)﹔钠元素的相对原子质量是 。
(2)芯片主要由硅材料制成,图2中硅元素与碳元素属于同一族元素的原因是 。
8.在化学上,把由同种元素组成的不同种单质互称为“同素异形体”。下列各组物质不属于“同素异形体”的是 ( )
A.红磷和白磷 B.金刚石和石墨 C.氧气和臭氧(O3) D.二氧化硫和三氧化硫
9.如表是元素周期表中第二、三周期元素的原子结构示意图,请回答有关问题。
(1)下列各组具有相似化学性质的元素是 (填字母)。
A.Na、Cl B.O、S C.F、Cl D.Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律: 。
(3)某粒子的结构示意图为,当x-y=8时,该粒子的符号为 。
(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质,下列各组粒子中属于等电子体的是 (填字母)。
A.NO和O2 B.CO和N2 C.SO2和CO2 D.Al3+和O2-
第三节 物质组成的表示
第1课时 化学式及其意义 化合价
1.天然气的主要成分是甲烷,其化学式为CH4。下列关于“CH4”的描述错误的是 ( )
A.表示甲烷这种物质 B.表示一个甲烷分子
C.表示甲烷由碳、氢两种元素组成
D.表示甲烷由1个碳原子和4个氢原子组成
2.如图是四位同学对某一物质的化学式意义的描述,符合描述内容的化学式是 ( )
A.Cu B.O3 C.NO2 D.NaCl
3.用适当的化学符号填空。
(1)2个氧原子: ;(2)2个氢分子: ; (3)氖气: ;
(4)地壳中含量最多的金属元素: ; (5)硫离子: ;
(6)保持水化学性质的最小微粒: 。
4.下列关于化合价的叙述正确的是 ( )
①化合价是元素的一种性质,因此称为元素的化合价,而不应称为原子的化合价
②化合物中化合价有正价和负价,其数值是由元素的一个原子得失电子的数目或形成共用电子对的数目决定的
③一种元素只有一种化合价
④在化合物中非金属元素的化合价一定为负值
A.①② B.①③ C.②③④ D.①
5.下列物质的化学式书写正确的是( )
A.氧化铝Al2O3 B.氯化铁FeCl2 C.氧化镁MgO2 D.氯化钙CaCl
6.下列化学用语书写正确的是 ( )
A.三个氮分子:3N2 B.氧化镁中镁元素的化合价:
C.氯离子:Cl-1 D.氧化钙:Ca2O
7.氯酸钾是实验室制取氧气的常用药品之一,其化学式为KClO3,则氯元素的化合价为 ( )
A.-1 B.+1 C.+5 D.+7
8.在N2O5、X、N2O3、N2、NH3五种物质中,它们是按照氮元素化合价由高到低的顺序排列的,则X可能是下列物质中的 ( )
A.NO2 B.NaNO2 C.NH4Cl D.NO
9.磷酸的酸根阴离子符号是PO32﹣,已知磷酸根中,氧元素的化合价为-2价,则磷元素的化合价为( )
A.+3 B.+4 C.+5 D.+6
10.日常生活中,人们常用84消毒液对环境进行消毒。84消毒液是常见的含氯消毒剂,其有效成分中的氯元素为+1价,则84消毒液的有效成分是 ( )
A.氯化钠(NaCl) B.次氯酸钠(NaClO) C.氯酸钠(NaClO3) D.亚氯酸钠(NaClO2)
11.化学用语是学习化学的重要工具,请用正确的化学用语填空。
(1)2个氢氧根离子: ; (2)食盐的主要成分: ;(3)氧化亚铁: ;
(4)用化学符号表示硝酸钾中氮元素的化合价: ;
(5)地壳中含量最多的金属元素与非金属元素形成的化合物的化学式: 。
12.下列化学符号中数字“2”的意义描述正确的是 ( )
①CO2 ②Mg2+ ③2Fe3+ ④ O ⑤2O⑥O2 ⑦2OH- ⑧2CO
A.表示物质中元素化合价的有②④ B.表示一个分子中某种原子的个数的是①
C.表示分子的个数的是⑤⑧ D.表示离子数的是③⑦
13.一氧化二氮(N2O)是一种麻醉剂,少量吸入后可迅速镇痛,且不会损伤心、肺、肝、肾等重要脏器。一氧化二氮(N2O)中氮元素的化合价为( )
A.-1 B.-2 C.+1 D.+2
14.下列化学用语表达正确的是 ( )
A.2个钠离子:2Na B.3个氮原子:N3
C.SO2中氧元素的化合价:S D.氯化锌的化学式:ZnCl
15.元素R在化合物中只有一种化合价,其氧化物的化学式为R2O3,则下列化学式中正确的是 ( )
A.R(OH)2 B.R2(SO4)3 C.RNO3 D.RCO3
16.如图是铜元素和硫元素常见的化合价坐标图,C点表示的化合物的化学式是 ( )
A.CuS B.Cu2S C.CuS2 D.Cu2S2
17.深海鱼油中的DHA(化学式:C22H32O2)是一种特殊的不饱和脂肪酸,这种不饱和脂肪酸是大脑细胞形成、发育及运作不可缺少的物质基础。下列说法正确的是 ( )
A.DHA属于化合物 B.DHA分子由22个碳原子、32个氢原子和2个氧原子构成
C.DHA中含有氧分子 D.DHA由C、H、O三个元素组成
18.下列说法正确的是 ( )
①Mg2+和Mg都属于镁元素,但化学性质不相同
②H:可以表示氢元素、一个氢原子,还有氢气这种物质
③Al3+和3N中的“3”分别表示离子所带电荷数和粒子的个数
④碳-12原子核内含有6个质子和6个中子
⑤、、,图中微粒表示的都是离子
A.①②⑤ B.①③⑤ C.①③④ D.②③⑤
第2课时 物质组成的定量表示
1.下列说法正确的是 ( )
A.Fe2(SO4)3的化学式量为56×2+32+16×4×3=336
B.Na2CO3中钠、碳、氧元素的质量比为23∶12∶16
C.(NH4)2CO3中氢、碳、氮、氧的原子个数比为8∶1∶2∶3
D.Na2O2中钠元素的质量分数为×100%=29.5%
2.如图是某品牌补铁剂的标签,则下列判断错误的是( )
A.富马酸亚铁中碳、氢、铁、氧的原子个数比为4∶2∶1∶4
B.富马酸亚铁中含有11个原子
C.富马酸亚铁的化学式量为170
D.富马酸亚铁中碳元素和氢元素的质量比为24∶1
3.某化合物由碳、氢两种元素组成,且碳、氢元素的质量比为6∶1,该化合物的化学式量为42,则其化学式为 ( )
A.CH4 B.C2H4 C.C2H6 D.C3H6
4.已知R元素的相对原子质量为56,在其氧化物中R元素与氧元素的质量比为7∶3,则该氧化物的化学式为 ( )
A.RO2 B.RO3 C.R2O3 D.R3O4
5.为了保障人们的身体健康,公共场所需要注意消毒杀菌。戊二醛(相对分子质量为100)是一种广谱高效的消毒剂,其分子结构如图所示(注“—”“”表示原子之间相互连接)。试计算:
(1)戊二醛中碳原子、氢原子、氧原子的个数比为 ;
(2) g戊二醛中含碳元素的质量为30 g。
6.人体缺乏维生素C(简称Vc)可能患坏血病,如图所示为某种维生素C药片说明
书的一部分。其中,维生素C“化学式”部分残缺,用“C6H8On”表示。
(1)维生素C的相对分子质量为176,则维生素C“化学式”中n为 。
(2)维生素C中碳、氢、氧原子的个数比为 。(填最简整数比)
(3)维生素C中含量最高的元素是 (填元素名称),22 g维生素C中含该元素的质量为 g。
7.2022年诺贝尔化学奖获得者贝尔托齐从一份有关如何让细胞产生唾液酸(化学式为C11H19NO9)的报告中找到灵感,开创了一种全新的化学理念。以下有关唾液酸的说法不正确的是( )
A.唾液酸由碳、氢、氮、氧四种元素组成 B.唾液酸由40个原子构成
C.唾液酸中碳、氧元素的原子个数比为11∶9 D.唾液酸中氧元素的质量分数最大
8.金银花作为常见的中药材,具有清热解毒、消炎退肿等功效,其有效成分之一是绿原酸(C16H18O9)。下列有关绿原酸的说法正确的是 ( )
A.绿原酸分子由碳、氢、氧三个元素组成 B.绿原酸中碳元素的质量分数最大
C.绿原酸的化学式量是354 g D.绿原酸中碳、氢、氧元素的质量比为16∶18∶9
9.食醋是生活中常用的调味剂,其主要成分乙酸的结构模型图如图所示。下列说法不正确的是 ( )
A.乙酸的化学式为CH3COOH B.乙酸中碳元素和氢元素的质量比为6∶1
C.乙酸由2个碳原子、4个氢原子和2个氧原子构成 D.乙酸中氧元素的质量分数最大
10.医疗中常用体积分数为75%的酒精溶液进行消毒。酒精即乙醇(化学式为C2H5OH),常温下密度为789 kg/m3。请回答:
(1)在常温下,75%的酒精溶液可用75 mL酒精与25 mL水混合配制而成,混合后的总体积 100 mL,总质量 100 g。(填“大于”“小于”或“等于”)。
(2)乙醇分子中碳、氢原子的个数比是 (填最简整数比)。
(3)乙醇中质量分数最大的元素是 (填元素符号)。
(4)46 g乙醇中含氧元素的质量是 。
11.同学们对含有K2SO4、K2SO3、K2S的混合物中各元素含量进行探究,经测定,其中氧元素的质量分数为32%,则含钾元素的质量分数为 ( )
A.48.2% B.47.3% C.46.4% D.49.1%
12.锌是人体健康必需的元素,缺乏锌会引起食欲不振,生长迟缓,发育不良。市售的葡萄糖酸锌口服液对治疗锌缺乏病具有较好疗效。如图是某品牌葡萄糖酸锌口服液的标签,请根据标签信息回答下列问题:
(1)葡萄糖酸锌中锌元素的质量分数是多少 (精确到0.1%)
(2)某患者除正常饮食吸收锌元素外,还需服用该品牌葡萄糖酸锌口服液。若治疗一个疗程需补充104 mg锌元素,而这些锌元素有75%来自该口服液,则患者共需服用多少支葡萄糖酸锌口服液
答案
第一节 原 子 第1课时 原子的结构 计量原子的质量
1.B
2.B
3.D
4.C
5.C
6.略
7.A
8.B
9.C
10.A
11.D
12.B
第2课时 原子与离子、分子
1.C
2.C
3.B
4.C
5.D
6.(1)ACD
(2)失去 Mg2+
(3)D
(4)ABD
7.(1)铝原子 稀有气体原子
(2)原子 阴离子
(3)12 Mg2+
(4)17 8
8.D
9.D
10.D
11.A
12.C
13.(1)①②⑥ ;
(2)①②④ ;
(3)⑤ ;
(4)③ ;
(5)⑤ ;
(6)⑥ ;
(7)⑦ ;
(8)③④ ;
(9)①②⑥ 。
第二节 元 素
第1课时 元素和元素符号
1.C
2.C
3.A
4.D
5.D
6.C
7.C
8.B
9.D
10.D
11.C
12.(1)并列
(2)①bd
②fg 。
(3)AC A A C 。
13.D
14.C
15.A
16.B
17.A
18.C
19.B
20.C
第2课时 元素周期表简介
1.D
2.B
3.A
4.(1)①37 85.47 。
②8 五
③C 3 元素是具有相同质子数的一类原子的总称 。
(2)D
5.C
6.B
7.
(1)8 乙 22.99 。
(2) 硅原子与碳原子的最外层电子数相同 。
8.D
9.(1)BC
(2)从左至右,原子最外层电子数依次递增(合理即可) 。
(3)S2﹣ 。
(4)具BD
第三节 物质组成的表示
第1课时 化学式及其意义 化合价
1.D
2.C
3.略
4.A
5.A
6.A
7.C
8.A
9.C
10.B
11.略
12.B
13.C
14.C
15.B
16.B
17.A
18.C
第2课时 物质组成的定量表示
1.C
2.B
3.D
4.C
5.(1)5:8:2 ;
(2)50
6.
(1)6 。
(2)3:4:3
(3)氧元素 12
7.B
8.B
9.C
10.(1)小于 小于
(2)1:3
(3)C
(4)16g 。
11.A
12.(1)14.3% (2)12支
第一节 原 子 第1课时 原子的结构 计量原子的质量
1.1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。根据实验,不能获得的结论是 ( )
A.金原子核带正电 B.金原子核外电子带负电
C.金原子核体积很小 D.金原子核的质量比α粒子大得多
2.下列关于原子的叙述错误的是 ( )
A.原子都是由原子核和核外电子构成的 B.原子核都是由质子和中子构成的
C.原子的质量主要集中在原子核上 D.核内质子数等于核外电子数
3.2023年12月26日11时26分,我国在西昌卫星发射中心成功发射第五十七颗、五十八颗北斗导航卫星。北斗卫星导航系统应用了高精准度的铷原子钟。已知铷原子的核电荷数为37,核内有48个中子,则铷原子的核外电子数为 ( )
A.11 B.48 C.85 D.37
4.下列物质由原子直接构成的是 ( )
A.氧气 B.氧化镁 C.铜 D.二氧化碳
5.如图为某原子结构模型的示意图,其中a、b、c是构成该原子的不同粒子。下列说法正确的是 ( )
A.决定该原子种类的粒子是b B.原子中b与c的数目一定相同
C.原子中a与c的数目一定相同 D.原子的质量主要集中在a和c上
6.根据原子的构成填空。
7.下列有关相对原子质量的说法正确的是 ( )
A.两种原子质量之比等于它们的相对原子质量之比
B.相对原子质量是以碳-12原子的质量作为标准,其他原子的质量跟它比较所得的值
C.相对原子质量就是原子的实际质量
D.原子质量越大,相对原子质量就越小
8.一个碳-12原子的质量为m kg,一个某原子的质量为n kg,则该原子的相对原子质量为 ( )
9.2021年4月,我国科学家首次合成的铀-214是目前已知质量最小的铀原子。其相对原子质量为214,核外电子数是92,则铀-214原子的中子数为 ( )
A.214 B.92 C.122 D.306
10.模型认知是科学研究的一种方法。1911年物理学家卢瑟福完成著名的α粒子轰击金箔实验,提出了有核原子模型。下列各项中,不属于卢瑟福原子结构理论观点的是 ( )
A.原子就像充斥着正电荷的“葡萄干布丁”
B.原子的质量几乎全部集中在原子核上
C.原子核带正电
D.电子在原子核外“很大”空间中运动
11.已知一个碳-12原子的实际质量为1.993×10-26 kg,则一个氧原子的质量是(已知
氧原子的相对原子质量为16) ( )
A.16 g B.16 C.12×16×1.993×10-26 kg D.16×kg
12.锂是制造新能源汽车电池的重要原料。锂原子的构成示意图如图所示,下列有关认识正确的是 ( )
A.锂原子的质子数是2 B.图中带负电的微观粒子是电子
C.锂的原子核内共有5个微观粒子 D.由图可知,锂原子带2个单位负电荷
第2课时 原子与离子、分子
1.镁被誉为“国防金属”,是制造军事装备的重要原料。如图为镁的原子结构示意图,有关镁原子的说法不正确的是( )
A.镁原子核外有3个电子层,共12个电子 B.镁原子不显电性
C.镁原子第2层上的电子能量比第3层上电子的能量高
D.镁原子在化学反应中易失去2个电子
2.氮化镓具有高光电转换效率和优异的电子输运性能,是当前研究的热点。如
图依次是氮和镓的原子结构示意图。下列说法正确的是 ( )
A.氮原子在化学反应中易失去电子 B.镓原子的中子数一定是31
C.镓原子结构示意图中的x等于3 D.两种原子化学性质相似
3.氯化钠的形成过程如图所示。下列有关说法正确的是 ( )
A.氯化钠由分子构成 B.反应中一个钠原子失去一个电子,形成相对稳定结构
C.氯原子核外有两个电子层 D.反应中Cl变成了Cl+
4.下列是几种粒子的结构示意图,有关说法正确的是 ( )
A.①②是离子,③④是原子 B.②③④对应粒子的化学性质相似
C.③表示阳离子 D.只有②③具有相对稳定结构
5.如图是某粒子的结构示意图,下列说法正确的是 ( )
A.m=10+n B.11
D.若该粒子带两个单位的负电荷,则其对应的化学符号为S2-
6.如图是A、B、C、D四种粒子的结构示意图,请据图回答问题。
(1)A、B、C、D粒子中属于原子的是 (填序号);
(2)粒子C形成离子时容易 电子,该离子的符号为 ;
(3)与A粒子化学性质相似的粒子是 (填序号,下同);
(4)A、B、C、D粒子中处于相对稳定结构的粒子是 。
7.某粒子R的结构示意图为
(1)当y=3时,该原子是 (填名称);当x=18时,该原子是 (填“金属原子”“非金属原子”或“稀有气体原子”)。
(2)当x=10+y时,该粒子为 ;当x<10+y时,该粒子为 。(填“原子”“阳离子”或“阴离子”)
(3)当y=2时,x= ,该粒子能形成的离子的符号为 。
(4)若该结构示意图表示的粒子的化学符号为R-,则x= ,y= 。
8.如图为铝原子结构示意图。下列有关铝原子的说法正确的是 ( )
A.图中“+”表示铝原子带正电 B.铝原子的质量主要集中在核外13个电子上
C.铝原子在化学反应中易得到电子 D.铝原子核外有3个电子层
9.下列有关粒子的说法中正确的是 ( )
A.原子的原子核都是由质子和中子构成的 B.分子可分,而原子不可再分
C.原子可转化为离子,离子不能转化为原子 D.钠原子和钠离子核电荷数相同
10.下列关于四种粒子的结构示意图说法正确的是 ( )
A.甲、乙的化学性质相似 B.乙表示阴离子
C.丙在化学反应中易失去电子 D.丁中x可能为8
11.模型建构是化学科学研究的基本方法。如图是某同学绘制的原子结构模型和原子结构示意图,有关说法正确的是 ( )
A.③形成的阳离子符号是H+ B.①②属于同类原子
C.①对应的原子结构示意图是④ D.②在化学反应中易失去电子
12.某元素的阳离子A3+的核外有23个电子,核内有30个中子,则该元素的核电荷数和相对原子质量分别为 ( )
A.23 53 B.26 30 C.26 56 D.23 46
13.在①分子、②原子、③质子、④中子、⑤电子、⑥离子、⑦原子最外层电子数中:(填序号)
(1)能构成物质的微粒有 ;
(2)显示电中性的微粒有 ;
(3)质量最小的微粒是 ;
(4)一定带正电的微粒有 ;
(5)一定带负电的微粒有 ;
(6)可能带正电也可能带负电的微粒是 ;
(7)决定原子化学性质的是 ;
(8)决定原子相对原子质量的是 ;
(9)能保持物质化学性质的微粒是 。
第二节 元 素
第1课时 元素和元素符号
1.下列元素属于金属元素的是 ( )
A.氢(H) B.氮(N) C.铝(Al) D.氦(He)
2.我国近代化学先驱徐寿创造了部分元素的汉语名称。下列元素名称与符号不一致的是 ( )
A.钠(Na) B.钙(Ca) C.镁(Hg) D.锰(Mn)
3.地壳中含量最多的金属元素是 ( )
A.Al B.Si C.Fe D.O
4.通过向食盐中添加含碘物质,可预防地方性甲状腺肿大。这里的“碘”是指 ( )
A.原子 B.离子 C.单质 D.元素
5.下列有关元素的说法正确的是 ( )
A.元素是宏观概念,既讲种类又讲个数 B.元素的化学性质由其原子的中子数决定
C.不同元素之间最本质的区别是电子层数不同
D.稀有气体元素原子的最外层电子数不一定是8
6.臭氧(O3)、二氧化氯(ClO2)、过氧化氢(H2O2)等都是生产、生活中常用的消毒剂,这三种物质中都含有 ( )
A.氧分子 B.氧离子 C.氧元素 D.氧气
7.媒体报道:福岛核电站的废水中含有大量的放射性碘-129。碘的元素符号是“I”,下列关于元素符号“I”的说法中,正确的是 ( )
①表示碘元素 ②表示1个碘原子 ③表示1个碘元素
A.①②③ B.②③ C.①② D.①③
8.化学符号是独特的化学语言。下列符号中,既表示一个原子,又表示一种元素,还表示一种物质的是 ( )
A.N B.Fe C.O D.H
9.下列物质中,前者是单质,后者是化合物的是 ( )
A.一氧化碳、食盐水B.水、白酒 C.铁、空气 D.氢气、干冰
10.下列各图中“ ”和“ ”分别表示不同元素的原子,其中表示单质的是 ( )
11.某物质经分析只含有一种元素,则该物质不可能是 ( )
A.单质 B.混合物 C.化合物 D.纯净物
12.宏观与微观相结合是研究和学习化学的重要方法之一。请根据题目回答问题。
(1)根据下图以及所学知识进行判断,纯净物和混合物属于图中的 关系。
(2)有以下几种物质,请按要求填空。
a.冰水混合物 b.空气 c.氧化铜 d.糖水 e.五氧化二磷f.铜 g.液氧
①属于混合物的是 (填字母,下同)。
②属于单质的是 。
(3)如图“”和“”分别表示不同元素的原子,在下列图示中表示纯净物的是 (填字母,下同),表示化合物的是 ;纯净物由分子构成的是 ,由原子直接构成的是 。
13.下列关于单质和化合物的说法不正确的是 ( )
A.单质中只含有一种元素 B.化合物中至少含有两种元素
C.单质中只含有一种微粒 D.化合物中至少含有两种微粒
14.人体缺锌会引起多种疾病,可服用葡萄糖酸锌口服液来补锌。这里的“锌”指的是 ( )
A.原子 B.分子 C.元素 D.单质
15.重氢可应用于光导纤维制备。重氢和氢都属于氢元素,是因为它们的原子具有相同的 ( )
A.质子数 B.中子数 C.体积 D.相对原子质量
16.清朝的《化学鉴原》一书中把地壳中含量第二的元素翻译成“矽”,如今把这种“矽”元素命名为 ( )
A.硒 B.硅 C.铝 D.锡
17.下列各组物质按单质、化合物、混合物的顺序排列的是( )
A.氮气、过氧化氢、海水 B.金刚石、氧化铜、高锰酸钾
C.空气、水银、牛奶 D.铁、氧化镁、冰水混合物
18.下面对于过氧化氢(H2O2)组成的说法,正确的是 ( )
A.过氧化氢由氢气和氧气组成 B.过氧化氢由氢分子和氧分子构成
C.过氧化氢由氢元素和氧元素组成 D.过氧化氢由氢原子和氧原子构成
19.如图是多种多样的物质的组成及构成的思维导图。下列有关说法不正确的是 ( )
A.分子由原子构成 B.氨(NH3)由氨元素组成
C.氯化钠由Na+和Cl-构成 D.构成物质的粒子有分子、原子和离子
20.逻辑推理是化学学习中常用的思维方法,以下推理正确的是 ( )
A.化合物都是由不同种元素组成的,由不同种元素组成的物质一定是化合物
B.单质都是由一种元素组成的,由一种元素组成的物质一定是单质
C.有新物质生成的变化属于化学变化,化学变化一定有新物质生成
D.金属元素原子最外层电子数一般少于四个,最外层电子数少于四个的原子一定属于金属元素
第2课时 元素周期表简介
1.2022年诺贝尔化学奖授予对点击化学等领域做出贡献的科学家。铜离子是点击化学常用的催化剂,铜在元素周期表中的相关信息如图所示,下列说法不正确的是 ( )
A.铜的元素符号是Cu B.铜的原子序数是29
C.铜属于金属元素 D.铜的相对原子质量为63.55 g
2.如图是元素周期表中的一部分及硫原子的结构示意图。下列说法中,错误的是 ( )
A.氩原子相对原子质量是39.95 B.图1中三种元素位于同一族
C.X原子的核外有三个电子层 D.氩原子的中子数是22
3.根据表中提供的信息,以下判断正确的是 ( )
A.Na+和Al3+的核外电子数相同
B.第二周期的Li、Be和B均为金属元素
C.第三周期元素的原子核外电子层数从左到右依次递增
D.在化学变化中镁原子容易失去最外层2个电子形成镁离子,其离子符号是Mg+2
4.建立认识物质的宏观和微观视角之间的关联是化学课标的要求。
(1)近年来,我国航天事业成果显著,“北斗三号”导航卫星搭载了精密计时的铷(Rb)原子钟。图1为铷元素在元素周期表中的信息和铷原子的结构示意图,请回答:
①铷元素原子的质子数为 ,相对原子质量是 。
②n= ,铷元素位于第 周期。
③图2中A~D是四种粒子的结构示意图,其中表示阴离子的是 (填字母),这四种粒子属于 种元素,判断的依据是 。
(2)分析图示信息,铷元素原子的化学性质与图2中的 (填字母)化学性质相似。
5.如图分别为某微观粒子的结构示意图(图1)和元素周期表部分内容(图2),结合图示信息判断,下列有关图1所示微观粒子的说法中,合理的是 ( C )
A.该粒子是阳离子 B.该粒子最外层有8个电子
C.该粒子的相对原子质量为16.00 D.该粒子在化学反应中易失去电子
6.如图是元素周期表的一部分,下列说法错误的是 ( )
A.甲元素的符号是He B.原子序数:乙>丙>甲
C.氮元素的相对原子质量是14.01 D.氖原子的结构示意图为
7.根据下列信息,回答问题。A、B原子的结构示意图如图1所示,图2为元素周期表
的一部分。
(1)A原子的质子数是 ;B原子对应元素在元素周期表中的位置是 (填“甲”“乙”“丙”或“丁”)﹔钠元素的相对原子质量是 。
(2)芯片主要由硅材料制成,图2中硅元素与碳元素属于同一族元素的原因是 。
8.在化学上,把由同种元素组成的不同种单质互称为“同素异形体”。下列各组物质不属于“同素异形体”的是 ( )
A.红磷和白磷 B.金刚石和石墨 C.氧气和臭氧(O3) D.二氧化硫和三氧化硫
9.如表是元素周期表中第二、三周期元素的原子结构示意图,请回答有关问题。
(1)下列各组具有相似化学性质的元素是 (填字母)。
A.Na、Cl B.O、S C.F、Cl D.Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律: 。
(3)某粒子的结构示意图为,当x-y=8时,该粒子的符号为 。
(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质,下列各组粒子中属于等电子体的是 (填字母)。
A.NO和O2 B.CO和N2 C.SO2和CO2 D.Al3+和O2-
第三节 物质组成的表示
第1课时 化学式及其意义 化合价
1.天然气的主要成分是甲烷,其化学式为CH4。下列关于“CH4”的描述错误的是 ( )
A.表示甲烷这种物质 B.表示一个甲烷分子
C.表示甲烷由碳、氢两种元素组成
D.表示甲烷由1个碳原子和4个氢原子组成
2.如图是四位同学对某一物质的化学式意义的描述,符合描述内容的化学式是 ( )
A.Cu B.O3 C.NO2 D.NaCl
3.用适当的化学符号填空。
(1)2个氧原子: ;(2)2个氢分子: ; (3)氖气: ;
(4)地壳中含量最多的金属元素: ; (5)硫离子: ;
(6)保持水化学性质的最小微粒: 。
4.下列关于化合价的叙述正确的是 ( )
①化合价是元素的一种性质,因此称为元素的化合价,而不应称为原子的化合价
②化合物中化合价有正价和负价,其数值是由元素的一个原子得失电子的数目或形成共用电子对的数目决定的
③一种元素只有一种化合价
④在化合物中非金属元素的化合价一定为负值
A.①② B.①③ C.②③④ D.①
5.下列物质的化学式书写正确的是( )
A.氧化铝Al2O3 B.氯化铁FeCl2 C.氧化镁MgO2 D.氯化钙CaCl
6.下列化学用语书写正确的是 ( )
A.三个氮分子:3N2 B.氧化镁中镁元素的化合价:
C.氯离子:Cl-1 D.氧化钙:Ca2O
7.氯酸钾是实验室制取氧气的常用药品之一,其化学式为KClO3,则氯元素的化合价为 ( )
A.-1 B.+1 C.+5 D.+7
8.在N2O5、X、N2O3、N2、NH3五种物质中,它们是按照氮元素化合价由高到低的顺序排列的,则X可能是下列物质中的 ( )
A.NO2 B.NaNO2 C.NH4Cl D.NO
9.磷酸的酸根阴离子符号是PO32﹣,已知磷酸根中,氧元素的化合价为-2价,则磷元素的化合价为( )
A.+3 B.+4 C.+5 D.+6
10.日常生活中,人们常用84消毒液对环境进行消毒。84消毒液是常见的含氯消毒剂,其有效成分中的氯元素为+1价,则84消毒液的有效成分是 ( )
A.氯化钠(NaCl) B.次氯酸钠(NaClO) C.氯酸钠(NaClO3) D.亚氯酸钠(NaClO2)
11.化学用语是学习化学的重要工具,请用正确的化学用语填空。
(1)2个氢氧根离子: ; (2)食盐的主要成分: ;(3)氧化亚铁: ;
(4)用化学符号表示硝酸钾中氮元素的化合价: ;
(5)地壳中含量最多的金属元素与非金属元素形成的化合物的化学式: 。
12.下列化学符号中数字“2”的意义描述正确的是 ( )
①CO2 ②Mg2+ ③2Fe3+ ④ O ⑤2O⑥O2 ⑦2OH- ⑧2CO
A.表示物质中元素化合价的有②④ B.表示一个分子中某种原子的个数的是①
C.表示分子的个数的是⑤⑧ D.表示离子数的是③⑦
13.一氧化二氮(N2O)是一种麻醉剂,少量吸入后可迅速镇痛,且不会损伤心、肺、肝、肾等重要脏器。一氧化二氮(N2O)中氮元素的化合价为( )
A.-1 B.-2 C.+1 D.+2
14.下列化学用语表达正确的是 ( )
A.2个钠离子:2Na B.3个氮原子:N3
C.SO2中氧元素的化合价:S D.氯化锌的化学式:ZnCl
15.元素R在化合物中只有一种化合价,其氧化物的化学式为R2O3,则下列化学式中正确的是 ( )
A.R(OH)2 B.R2(SO4)3 C.RNO3 D.RCO3
16.如图是铜元素和硫元素常见的化合价坐标图,C点表示的化合物的化学式是 ( )
A.CuS B.Cu2S C.CuS2 D.Cu2S2
17.深海鱼油中的DHA(化学式:C22H32O2)是一种特殊的不饱和脂肪酸,这种不饱和脂肪酸是大脑细胞形成、发育及运作不可缺少的物质基础。下列说法正确的是 ( )
A.DHA属于化合物 B.DHA分子由22个碳原子、32个氢原子和2个氧原子构成
C.DHA中含有氧分子 D.DHA由C、H、O三个元素组成
18.下列说法正确的是 ( )
①Mg2+和Mg都属于镁元素,但化学性质不相同
②H:可以表示氢元素、一个氢原子,还有氢气这种物质
③Al3+和3N中的“3”分别表示离子所带电荷数和粒子的个数
④碳-12原子核内含有6个质子和6个中子
⑤、、,图中微粒表示的都是离子
A.①②⑤ B.①③⑤ C.①③④ D.②③⑤
第2课时 物质组成的定量表示
1.下列说法正确的是 ( )
A.Fe2(SO4)3的化学式量为56×2+32+16×4×3=336
B.Na2CO3中钠、碳、氧元素的质量比为23∶12∶16
C.(NH4)2CO3中氢、碳、氮、氧的原子个数比为8∶1∶2∶3
D.Na2O2中钠元素的质量分数为×100%=29.5%
2.如图是某品牌补铁剂的标签,则下列判断错误的是( )
A.富马酸亚铁中碳、氢、铁、氧的原子个数比为4∶2∶1∶4
B.富马酸亚铁中含有11个原子
C.富马酸亚铁的化学式量为170
D.富马酸亚铁中碳元素和氢元素的质量比为24∶1
3.某化合物由碳、氢两种元素组成,且碳、氢元素的质量比为6∶1,该化合物的化学式量为42,则其化学式为 ( )
A.CH4 B.C2H4 C.C2H6 D.C3H6
4.已知R元素的相对原子质量为56,在其氧化物中R元素与氧元素的质量比为7∶3,则该氧化物的化学式为 ( )
A.RO2 B.RO3 C.R2O3 D.R3O4
5.为了保障人们的身体健康,公共场所需要注意消毒杀菌。戊二醛(相对分子质量为100)是一种广谱高效的消毒剂,其分子结构如图所示(注“—”“”表示原子之间相互连接)。试计算:
(1)戊二醛中碳原子、氢原子、氧原子的个数比为 ;
(2) g戊二醛中含碳元素的质量为30 g。
6.人体缺乏维生素C(简称Vc)可能患坏血病,如图所示为某种维生素C药片说明
书的一部分。其中,维生素C“化学式”部分残缺,用“C6H8On”表示。
(1)维生素C的相对分子质量为176,则维生素C“化学式”中n为 。
(2)维生素C中碳、氢、氧原子的个数比为 。(填最简整数比)
(3)维生素C中含量最高的元素是 (填元素名称),22 g维生素C中含该元素的质量为 g。
7.2022年诺贝尔化学奖获得者贝尔托齐从一份有关如何让细胞产生唾液酸(化学式为C11H19NO9)的报告中找到灵感,开创了一种全新的化学理念。以下有关唾液酸的说法不正确的是( )
A.唾液酸由碳、氢、氮、氧四种元素组成 B.唾液酸由40个原子构成
C.唾液酸中碳、氧元素的原子个数比为11∶9 D.唾液酸中氧元素的质量分数最大
8.金银花作为常见的中药材,具有清热解毒、消炎退肿等功效,其有效成分之一是绿原酸(C16H18O9)。下列有关绿原酸的说法正确的是 ( )
A.绿原酸分子由碳、氢、氧三个元素组成 B.绿原酸中碳元素的质量分数最大
C.绿原酸的化学式量是354 g D.绿原酸中碳、氢、氧元素的质量比为16∶18∶9
9.食醋是生活中常用的调味剂,其主要成分乙酸的结构模型图如图所示。下列说法不正确的是 ( )
A.乙酸的化学式为CH3COOH B.乙酸中碳元素和氢元素的质量比为6∶1
C.乙酸由2个碳原子、4个氢原子和2个氧原子构成 D.乙酸中氧元素的质量分数最大
10.医疗中常用体积分数为75%的酒精溶液进行消毒。酒精即乙醇(化学式为C2H5OH),常温下密度为789 kg/m3。请回答:
(1)在常温下,75%的酒精溶液可用75 mL酒精与25 mL水混合配制而成,混合后的总体积 100 mL,总质量 100 g。(填“大于”“小于”或“等于”)。
(2)乙醇分子中碳、氢原子的个数比是 (填最简整数比)。
(3)乙醇中质量分数最大的元素是 (填元素符号)。
(4)46 g乙醇中含氧元素的质量是 。
11.同学们对含有K2SO4、K2SO3、K2S的混合物中各元素含量进行探究,经测定,其中氧元素的质量分数为32%,则含钾元素的质量分数为 ( )
A.48.2% B.47.3% C.46.4% D.49.1%
12.锌是人体健康必需的元素,缺乏锌会引起食欲不振,生长迟缓,发育不良。市售的葡萄糖酸锌口服液对治疗锌缺乏病具有较好疗效。如图是某品牌葡萄糖酸锌口服液的标签,请根据标签信息回答下列问题:
(1)葡萄糖酸锌中锌元素的质量分数是多少 (精确到0.1%)
(2)某患者除正常饮食吸收锌元素外,还需服用该品牌葡萄糖酸锌口服液。若治疗一个疗程需补充104 mg锌元素,而这些锌元素有75%来自该口服液,则患者共需服用多少支葡萄糖酸锌口服液
答案
第一节 原 子 第1课时 原子的结构 计量原子的质量
1.B
2.B
3.D
4.C
5.C
6.略
7.A
8.B
9.C
10.A
11.D
12.B
第2课时 原子与离子、分子
1.C
2.C
3.B
4.C
5.D
6.(1)ACD
(2)失去 Mg2+
(3)D
(4)ABD
7.(1)铝原子 稀有气体原子
(2)原子 阴离子
(3)12 Mg2+
(4)17 8
8.D
9.D
10.D
11.A
12.C
13.(1)①②⑥ ;
(2)①②④ ;
(3)⑤ ;
(4)③ ;
(5)⑤ ;
(6)⑥ ;
(7)⑦ ;
(8)③④ ;
(9)①②⑥ 。
第二节 元 素
第1课时 元素和元素符号
1.C
2.C
3.A
4.D
5.D
6.C
7.C
8.B
9.D
10.D
11.C
12.(1)并列
(2)①bd
②fg 。
(3)AC A A C 。
13.D
14.C
15.A
16.B
17.A
18.C
19.B
20.C
第2课时 元素周期表简介
1.D
2.B
3.A
4.(1)①37 85.47 。
②8 五
③C 3 元素是具有相同质子数的一类原子的总称 。
(2)D
5.C
6.B
7.
(1)8 乙 22.99 。
(2) 硅原子与碳原子的最外层电子数相同 。
8.D
9.(1)BC
(2)从左至右,原子最外层电子数依次递增(合理即可) 。
(3)S2﹣ 。
(4)具BD
第三节 物质组成的表示
第1课时 化学式及其意义 化合价
1.D
2.C
3.略
4.A
5.A
6.A
7.C
8.A
9.C
10.B
11.略
12.B
13.C
14.C
15.B
16.B
17.A
18.C
第2课时 物质组成的定量表示
1.C
2.B
3.D
4.C
5.(1)5:8:2 ;
(2)50
6.
(1)6 。
(2)3:4:3
(3)氧元素 12
7.B
8.B
9.C
10.(1)小于 小于
(2)1:3
(3)C
(4)16g 。
11.A
12.(1)14.3% (2)12支
同课章节目录
