5.2.3+硝酸+酸雨及防治课件(共30张PPT)2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2.3+硝酸+酸雨及防治课件(共30张PPT)2023-2024学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-27 18:53:01 | ||
图片预览









文档简介
(共30张PPT)
第五章 化工生产中的
重要非金属元素
第二节 氮及其化合物
第三课时 硝酸 酸雨及防治
5.2.3 硝酸 酸雨及防治
铂金饰品以其所代表着“永恒”的含义,受到大多数人的喜爱。但铂金真的是永恒的吗?
否,王水能很轻易的将铂金溶解,而王水的主要成分之一是硝酸。
5.2.3 硝酸 酸雨及防治
资料卡片
能使不溶于硝酸的金属如 金、铂 等溶解。
浓硝酸 和 浓盐酸 按体积比为 1∶3
混合得到的混合物。
王 水
5.2.3 硝酸 酸雨及防治
1. 硝酸的物理性质
一、硝酸
硝酸是无色液体,但久置的浓硝酸为什么会显黄色?
刚倒出来
久置后
⑴纯硝酸是无色、易挥发、有刺激性气味的液体。
⑵能以任意比溶于水;
⑶密度比水大;
⑷沸点低:83℃;
⑸常用浓硝酸的浓度为69%。
开瓶瓶口有白雾
发烟硝酸(W>98%)
参与化学反应温度不宜过高
5.2.3 硝酸 酸雨及防治
一、硝酸
运输硝酸的铝槽车发生泄漏事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
问题1:为什么现场有大量红棕色的烟雾?
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
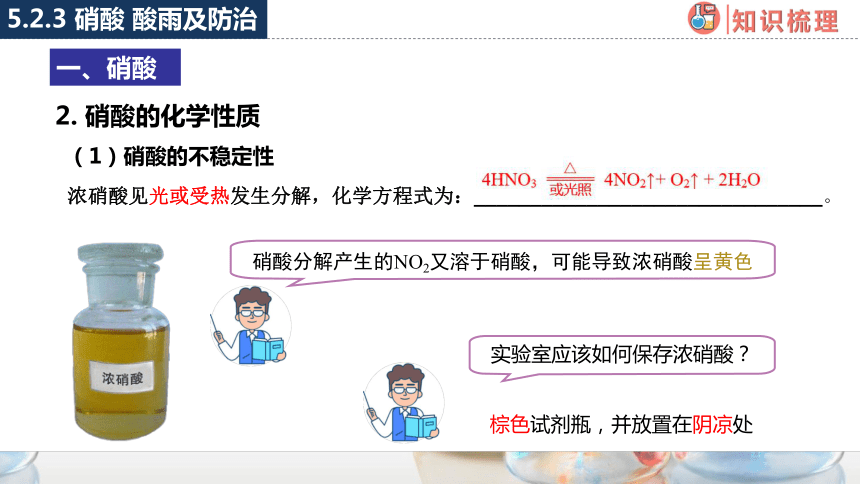
(1)硝酸的不稳定性
浓硝酸见光或受热发生分解,化学方程式为:_______________________________。
硝酸分解产生的NO2又溶于硝酸,可能导致浓硝酸呈黄色
实验室应该如何保存浓硝酸?
棕色试剂瓶,并放置在阴凉处
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
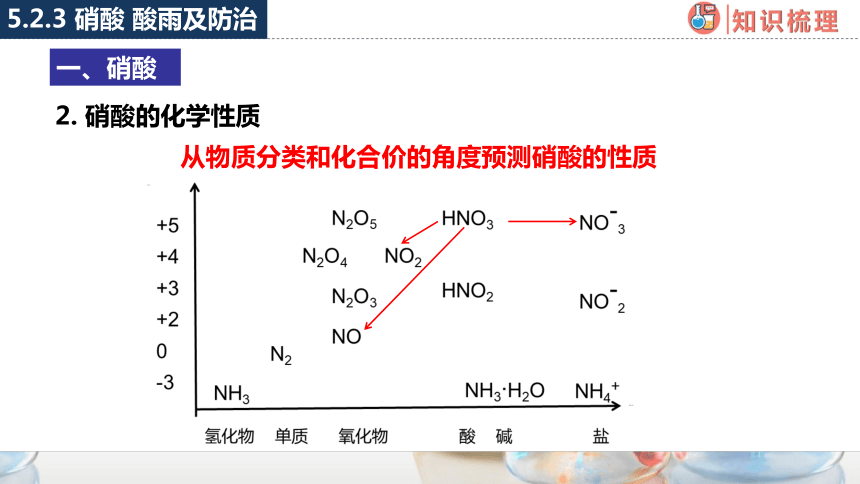
从物质分类和化合价的角度预测硝酸的性质
5.2.3 硝酸 酸雨及防治
一、硝酸
运输硝酸的铝槽车发生泄漏事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
问题2:为什么可以用纯碱处理泄漏出来的硝酸?
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
(2)酸性
HNO3=H++NO3-
①与指示剂反应:
稀硝酸使石蕊溶液由紫色变为红色,浓硝酸使紫色石蕊溶液先变红(酸性)后褪色(强氧化性)
②与碱反应:
Fe(OH)3+3HNO3=Fe(NO3)3+3H2O
③与碱性氧化物反应:
CuO+HNO3=Cu(NO3)2+H2O
④与弱酸盐反应:
CaCO3+HNO3=Ca(NO3)2+CO2↑+H2O
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
(3)强氧化性
稀硝酸和浓硝酸都有强氧化性
由于HNO3中的N +5价,处在最高价,故硝酸具有较强的得电子能力……
且浓度越大氧化性越强:浓HNO3>稀HNO3
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
(3)强氧化性—与非活泼金属(Cu)反应
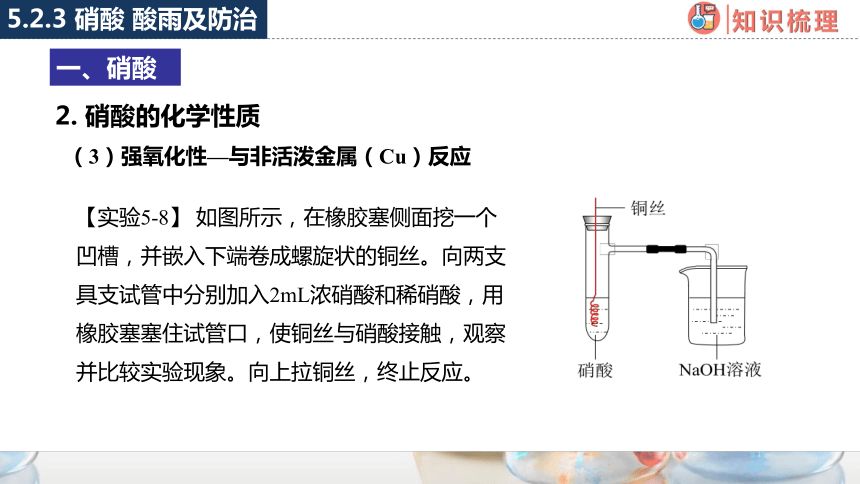
【实验5-8】 如图所示,在橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。向两支具支试管中分别加入2mL浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝与硝酸接触,观察并比较实验现象。向上拉铜丝,终止反应。
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
(3)强氧化性—与非活泼金属(Cu)反应
硝酸浓度 实验现象 实验结论
浓硝酸 反应 、铜丝 ,产生 色气体,溶液呈绿色 铜与浓硝酸反应生成 ,
化学方程式:_________________
________________________
剧烈
变细
红棕
NO2
Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
稀硝酸 反应 、铜丝 ,产生 气体,溶液呈蓝色 铜与稀硝酸反应生成 ,
化学方程式:________________________
________________________
缓慢
变细
无色
NO
3Cu+8HNO3(稀)===
3Cu(NO3)2+2NO↑+4H2O
浓硝酸的还原产物为 NO2,稀硝酸的还原产物为 NO 。
5.2.3 硝酸 酸雨及防治
一、硝酸
运输硝酸的铝槽车发生泄漏事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
问题3:为什么可以用铝槽车运输浓硝酸?
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
(3)强氧化性—与活泼金属(Fe、Al)反应
①常温下, Fe、Al与浓H2SO4或浓HNO3反应,生成了致密的氧化膜,阻止酸与内层金属进一步反应,从而保护了金属,这个过程叫做“钝化”。
②加热下,浓硝酸与较活泼金属 ( Fe、Al ) 直接反应
Al + 6HNO3(浓) Al(NO3)3 + 3NO2↑ + 3H2O
Fe + 6HNO3(浓) Fe(NO3)3 + 3NO2↑ + 3H2O
试着写出少量/过量Fe粉分别于稀硝酸反应的方程式。
Fe + 4HNO3(稀) = Fe(NO3)3 + NO↑+ 2H2O
3Fe + 8HNO3(稀) = 3Fe(NO3)2 + 2NO↑+ 4H2O
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
(3)强氧化性—与非金属(C、S)反应
① 木炭与浓硝酸:C+4HNO3(浓) CO2↑+4NO2↑+2H2O
② 硫与浓硝酸:S + 6HNO3(浓) H2SO4+ 6NO2↑+2H2O
硝酸具有强氧化性,试写出浓硝酸与C、S的反应
5.2.3 硝酸 酸雨及防治
3. 硝酸的工业制法
一、硝酸
小杨老师 15521324728
微信公众号:杨sir化学
N2
NH3
H2
O2
O2
H2O
HNO3
NO
NO2
为了吸收更充分,往往同时通入O2
5.2.3 硝酸 酸雨及防治
二、酸雨及防治
5.2.3 硝酸 酸雨及防治
二、酸雨及防治
SO2、NOx 的主要来源
汽车的尾气。
煤、石油和某些含硫的金属矿物的燃烧或冶炼。
SO2、NOx的危害:
SO2与NOx会引起呼吸道疾病,严重时会使人死亡。溶于水形成酸雨;
SO2:
NOx:
酸雨:主要指 pH小于5.6 的雨水,主要含有硫酸和硝酸
成因:主要是大气中的 SO2 与 NOx 溶于雨水形成的
5.2.3 硝酸 酸雨及防治
二、酸雨及防治
类型:
硫酸型:
硝酸型:
途径1
途径2
2SO2+O2 2SO3
△
催化剂
SO3+H2O===H2SO4
NO
HNO3
N2
NO2
3NO2+H2O===2HNO3+NO
2NO+O2 ==2NO2
放电
N2+O2=== 2NO
5.2.3硝酸 酸雨及防治二、酸雨及防治酸雨的危害
5.2.3 硝酸 酸雨及防治
二、酸雨及防治
酸雨的防治
(1) 调整能源结构,积极开发新能源
(2) 对煤进行处理,如选洗加工、综合开发、在
煤中加入适量的生石灰、对排放的烟进行处理等
(3) 改进汽车尾气的处理技术,控制尾气排放
(4) 加强工厂废气的回收处理,充分利用原料
(5) 种植能够吸收 SO2 的有关树木
5.2.3 硝酸 酸雨及防治
相关链接
常见的环境污染
环境污染 形成原因 主要危害
温室效应 大气中CO2含量不断增加 全球变暖,冰川融化
酸雨 SO2和氮氧化物的排放 土壤酸化,腐蚀建筑物
光化学烟雾 氮氧化物和碳氢化合物的排放 危害人体健康和植物生长
臭氧空洞 氮氧化物和氟氯代烃的排放 地球上的生物受太阳紫外线的伤害加剧
5.2.3 硝酸 酸雨及防治
赤潮和水华 含磷洗衣粉的大量使用及废水的任意排放 使藻类过度繁殖,水质恶化,发生在海水中为赤潮,淡水中为水华
白色污染 聚乙烯塑料的大量使用、任意丢弃 破坏土壤结构和生态环境
相关链接
【例1】下列关于硝酸的叙述,正确的是( )
A.稀硝酸能与Fe发生反应,浓硝酸不能
B.浓硝酸和稀硝酸都是强氧化剂
C.稀硝酸是弱酸,浓硝酸是强酸
D.稀硝酸与Cu反应,生成NO,而浓硝酸与Cu反应只生成NO2
B
题型一:硝酸的性质
【变1-1】在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质,铜粉溶解的是( )
① FeCl3 ② Fe2O3 ③ Cu(NO3) 2 ④ KNO3
A.只有①或② B.只有②或④
C.只有①或②或③ D.①②③④中任意一种
D
题型一:硝酸的性质
【变2-1】将22.4 g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是( )
A.反应后生成的盐只有Fe(NO3) 3
B.反应后生成的盐只有Fe(NO3) 2
C.反应后生成的盐为Fe(NO3) 2和Fe(NO3) 3,其物质的量之比为1∶3
D.反应后生成的盐为Fe(NO3) 2和Fe(NO3) 3,其物质的量之比为3∶1
D
题型二:硝酸的计算
【变2-3】某浓度稀HNO3与金属M反应时,能得到+2价硝酸盐,反应时M与HNO3的物质的量之比为5 ∶12,则反应时HNO3的还原产物是 ( )
A.NH4NO3 B.N2 C.N2O D.NO
B
题型二:硝酸的相关计算
【例6】烟气脱硝(将NOx转化成无害物质)是工业废气处理中的重要工艺。相对传统的处理工艺,活性炭吸附脱硝法具有工艺过程无二次污染、氮资源和脱硝剂可循环利用等优点。回答下列问题。
(1)活性炭吸附脱硝法的工艺流程如图所示。
该流程中活性炭的作用是____________,若入口烟气中NOx以NO形式参加反应,则相应的化学方程式为____________________________________。
题型三:酸雨的形成与防治
催化剂
(2)某同学选择如下装置(省略夹持仪器)对该方法进行模拟实验:
①实验前,按h→j,i→k的顺序连接仪器,检查装置__________。按h→j而不是h→k连接仪器的原因是____________________________________________________________。
②先通入空气,再打开A、B中分液漏斗的活塞,观察到B中出现红棕色气体,此时,所获得的氮氧化物中一定含有______气体。
③装置 F 除了能用于判断气体流速和脱硝效果外,还可用于__________。
题型三:酸雨的形成与防治
气密性
氨气密度较小,可使反应气体混合均匀,提高原料利用率
NO2
尾气吸收
第五章 化工生产中的
重要非金属元素
第二节 氮及其化合物
第三课时 硝酸 酸雨及防治
5.2.3 硝酸 酸雨及防治
铂金饰品以其所代表着“永恒”的含义,受到大多数人的喜爱。但铂金真的是永恒的吗?
否,王水能很轻易的将铂金溶解,而王水的主要成分之一是硝酸。
5.2.3 硝酸 酸雨及防治
资料卡片
能使不溶于硝酸的金属如 金、铂 等溶解。
浓硝酸 和 浓盐酸 按体积比为 1∶3
混合得到的混合物。
王 水
5.2.3 硝酸 酸雨及防治
1. 硝酸的物理性质
一、硝酸
硝酸是无色液体,但久置的浓硝酸为什么会显黄色?
刚倒出来
久置后
⑴纯硝酸是无色、易挥发、有刺激性气味的液体。
⑵能以任意比溶于水;
⑶密度比水大;
⑷沸点低:83℃;
⑸常用浓硝酸的浓度为69%。
开瓶瓶口有白雾
发烟硝酸(W>98%)
参与化学反应温度不宜过高
5.2.3 硝酸 酸雨及防治
一、硝酸
运输硝酸的铝槽车发生泄漏事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
问题1:为什么现场有大量红棕色的烟雾?
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
(1)硝酸的不稳定性
浓硝酸见光或受热发生分解,化学方程式为:_______________________________。
硝酸分解产生的NO2又溶于硝酸,可能导致浓硝酸呈黄色
实验室应该如何保存浓硝酸?
棕色试剂瓶,并放置在阴凉处
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
从物质分类和化合价的角度预测硝酸的性质
5.2.3 硝酸 酸雨及防治
一、硝酸
运输硝酸的铝槽车发生泄漏事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
问题2:为什么可以用纯碱处理泄漏出来的硝酸?
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
(2)酸性
HNO3=H++NO3-
①与指示剂反应:
稀硝酸使石蕊溶液由紫色变为红色,浓硝酸使紫色石蕊溶液先变红(酸性)后褪色(强氧化性)
②与碱反应:
Fe(OH)3+3HNO3=Fe(NO3)3+3H2O
③与碱性氧化物反应:
CuO+HNO3=Cu(NO3)2+H2O
④与弱酸盐反应:
CaCO3+HNO3=Ca(NO3)2+CO2↑+H2O
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
(3)强氧化性
稀硝酸和浓硝酸都有强氧化性
由于HNO3中的N +5价,处在最高价,故硝酸具有较强的得电子能力……
且浓度越大氧化性越强:浓HNO3>稀HNO3
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
(3)强氧化性—与非活泼金属(Cu)反应
【实验5-8】 如图所示,在橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。向两支具支试管中分别加入2mL浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝与硝酸接触,观察并比较实验现象。向上拉铜丝,终止反应。
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
(3)强氧化性—与非活泼金属(Cu)反应
硝酸浓度 实验现象 实验结论
浓硝酸 反应 、铜丝 ,产生 色气体,溶液呈绿色 铜与浓硝酸反应生成 ,
化学方程式:_________________
________________________
剧烈
变细
红棕
NO2
Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
稀硝酸 反应 、铜丝 ,产生 气体,溶液呈蓝色 铜与稀硝酸反应生成 ,
化学方程式:________________________
________________________
缓慢
变细
无色
NO
3Cu+8HNO3(稀)===
3Cu(NO3)2+2NO↑+4H2O
浓硝酸的还原产物为 NO2,稀硝酸的还原产物为 NO 。
5.2.3 硝酸 酸雨及防治
一、硝酸
运输硝酸的铝槽车发生泄漏事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
问题3:为什么可以用铝槽车运输浓硝酸?
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
(3)强氧化性—与活泼金属(Fe、Al)反应
①常温下, Fe、Al与浓H2SO4或浓HNO3反应,生成了致密的氧化膜,阻止酸与内层金属进一步反应,从而保护了金属,这个过程叫做“钝化”。
②加热下,浓硝酸与较活泼金属 ( Fe、Al ) 直接反应
Al + 6HNO3(浓) Al(NO3)3 + 3NO2↑ + 3H2O
Fe + 6HNO3(浓) Fe(NO3)3 + 3NO2↑ + 3H2O
试着写出少量/过量Fe粉分别于稀硝酸反应的方程式。
Fe + 4HNO3(稀) = Fe(NO3)3 + NO↑+ 2H2O
3Fe + 8HNO3(稀) = 3Fe(NO3)2 + 2NO↑+ 4H2O
5.2.3 硝酸 酸雨及防治
2. 硝酸的化学性质
一、硝酸
(3)强氧化性—与非金属(C、S)反应
① 木炭与浓硝酸:C+4HNO3(浓) CO2↑+4NO2↑+2H2O
② 硫与浓硝酸:S + 6HNO3(浓) H2SO4+ 6NO2↑+2H2O
硝酸具有强氧化性,试写出浓硝酸与C、S的反应
5.2.3 硝酸 酸雨及防治
3. 硝酸的工业制法
一、硝酸
小杨老师 15521324728
微信公众号:杨sir化学
N2
NH3
H2
O2
O2
H2O
HNO3
NO
NO2
为了吸收更充分,往往同时通入O2
5.2.3 硝酸 酸雨及防治
二、酸雨及防治
5.2.3 硝酸 酸雨及防治
二、酸雨及防治
SO2、NOx 的主要来源
汽车的尾气。
煤、石油和某些含硫的金属矿物的燃烧或冶炼。
SO2、NOx的危害:
SO2与NOx会引起呼吸道疾病,严重时会使人死亡。溶于水形成酸雨;
SO2:
NOx:
酸雨:主要指 pH小于5.6 的雨水,主要含有硫酸和硝酸
成因:主要是大气中的 SO2 与 NOx 溶于雨水形成的
5.2.3 硝酸 酸雨及防治
二、酸雨及防治
类型:
硫酸型:
硝酸型:
途径1
途径2
2SO2+O2 2SO3
△
催化剂
SO3+H2O===H2SO4
NO
HNO3
N2
NO2
3NO2+H2O===2HNO3+NO
2NO+O2 ==2NO2
放电
N2+O2=== 2NO
5.2.3硝酸 酸雨及防治二、酸雨及防治酸雨的危害
5.2.3 硝酸 酸雨及防治
二、酸雨及防治
酸雨的防治
(1) 调整能源结构,积极开发新能源
(2) 对煤进行处理,如选洗加工、综合开发、在
煤中加入适量的生石灰、对排放的烟进行处理等
(3) 改进汽车尾气的处理技术,控制尾气排放
(4) 加强工厂废气的回收处理,充分利用原料
(5) 种植能够吸收 SO2 的有关树木
5.2.3 硝酸 酸雨及防治
相关链接
常见的环境污染
环境污染 形成原因 主要危害
温室效应 大气中CO2含量不断增加 全球变暖,冰川融化
酸雨 SO2和氮氧化物的排放 土壤酸化,腐蚀建筑物
光化学烟雾 氮氧化物和碳氢化合物的排放 危害人体健康和植物生长
臭氧空洞 氮氧化物和氟氯代烃的排放 地球上的生物受太阳紫外线的伤害加剧
5.2.3 硝酸 酸雨及防治
赤潮和水华 含磷洗衣粉的大量使用及废水的任意排放 使藻类过度繁殖,水质恶化,发生在海水中为赤潮,淡水中为水华
白色污染 聚乙烯塑料的大量使用、任意丢弃 破坏土壤结构和生态环境
相关链接
【例1】下列关于硝酸的叙述,正确的是( )
A.稀硝酸能与Fe发生反应,浓硝酸不能
B.浓硝酸和稀硝酸都是强氧化剂
C.稀硝酸是弱酸,浓硝酸是强酸
D.稀硝酸与Cu反应,生成NO,而浓硝酸与Cu反应只生成NO2
B
题型一:硝酸的性质
【变1-1】在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质,铜粉溶解的是( )
① FeCl3 ② Fe2O3 ③ Cu(NO3) 2 ④ KNO3
A.只有①或② B.只有②或④
C.只有①或②或③ D.①②③④中任意一种
D
题型一:硝酸的性质
【变2-1】将22.4 g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是( )
A.反应后生成的盐只有Fe(NO3) 3
B.反应后生成的盐只有Fe(NO3) 2
C.反应后生成的盐为Fe(NO3) 2和Fe(NO3) 3,其物质的量之比为1∶3
D.反应后生成的盐为Fe(NO3) 2和Fe(NO3) 3,其物质的量之比为3∶1
D
题型二:硝酸的计算
【变2-3】某浓度稀HNO3与金属M反应时,能得到+2价硝酸盐,反应时M与HNO3的物质的量之比为5 ∶12,则反应时HNO3的还原产物是 ( )
A.NH4NO3 B.N2 C.N2O D.NO
B
题型二:硝酸的相关计算
【例6】烟气脱硝(将NOx转化成无害物质)是工业废气处理中的重要工艺。相对传统的处理工艺,活性炭吸附脱硝法具有工艺过程无二次污染、氮资源和脱硝剂可循环利用等优点。回答下列问题。
(1)活性炭吸附脱硝法的工艺流程如图所示。
该流程中活性炭的作用是____________,若入口烟气中NOx以NO形式参加反应,则相应的化学方程式为____________________________________。
题型三:酸雨的形成与防治
催化剂
(2)某同学选择如下装置(省略夹持仪器)对该方法进行模拟实验:
①实验前,按h→j,i→k的顺序连接仪器,检查装置__________。按h→j而不是h→k连接仪器的原因是____________________________________________________________。
②先通入空气,再打开A、B中分液漏斗的活塞,观察到B中出现红棕色气体,此时,所获得的氮氧化物中一定含有______气体。
③装置 F 除了能用于判断气体流速和脱硝效果外,还可用于__________。
题型三:酸雨的形成与防治
气密性
氨气密度较小,可使反应气体混合均匀,提高原料利用率
NO2
尾气吸收
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
