化学反应计算中的常用方法 2025年高考化学考向分析(共35张PPT)
文档属性
| 名称 | 化学反应计算中的常用方法 2025年高考化学考向分析(共35张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-27 00:00:00 | ||
图片预览











文档简介
(共35张PPT)
2025年高考化学考向分析
化学反应计算中的常用方法
守恒法巧解计算题
1.(2023山东)三氯甲硅烷 是制取高纯
硅的重要原料,常温下为无色液体,沸点为 ,
熔点为 ,易水解。采用如下方法测定溶
有少量的 纯度。
灼烧
冷却干燥
A、C
样品经水解、干燥等预处理过程,得硅酸水合物后,进行如下实验操作:①______,
②__________(填操作名称),③称量等操作,测得所得固体氧化物质量为 ,从下列仪
器中选出①、②中需使用的仪器,依次为_______(填标号)。测得样品纯度为
_______________(用含、 的代数式表示)。
【解析】 由后续操作可知, 水解得到的硅酸水合物要先在坩埚中灼烧
(得到),然后在干燥器中冷却干燥 ,使用的仪器分别为A、C。根据硅原子
守恒可得关系式,则样品中的质量为 ,故样品纯度
为 。
2.(2022湖南)产品中 的含量测定。
(1)称取产品,用 水溶解,酸化,加热至近沸。
(2)在不断搅拌下,向(1)所得溶液中逐滴加入热的 溶液。
(3)沉淀完全后, 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质
量为 。
产品中 的质量分数为_______(结果保留三位有效数字)。
【解析】 分析题意可知,(3)中称量的白色固体为 ,其物
质的量为,根据钡原子守恒,产品中 的物质的量也
是,因此 的质量为
,产品中 的质量分数为
。
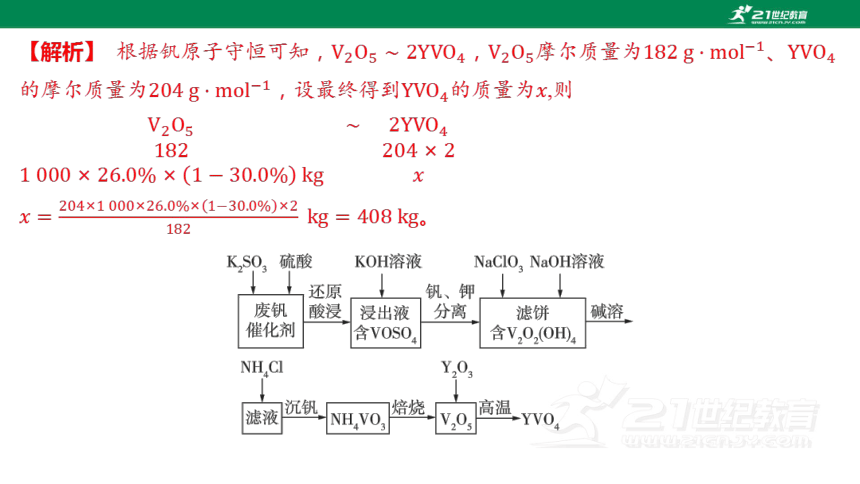
3.(2023山东滕州期中)钒酸钇 广泛应用于光纤通信领域,一种用废钒催化剂
(含、、,少量)制取 的工艺流程如图所示:
某废钒催化剂中的含量为,某工厂用 该废钒催化剂且用该工艺流程
生产,整个流程中的损耗率为,则最终得到_____ 。
408
【解析】 根据钒原子守恒可知,,摩尔质量为、
的摩尔质量为,设最终得到的质量为 ,则
。
差量法妙解计算题
4.(2024湖北武汉三中月考)为了检验某含有杂质的 样品的纯度,现将
样品加热,其质量变为 ,则该样品的纯度(质量分数)是( )
A
A. B.
C. D.
【解析】 分析形成差量的原因:碳酸氢钠受热分解,发生反应
,反应后生成了二氧化碳与水,固体质量减小,产
生质量差。
由题意可知,质量变化值为,设样品中含的质量为 ,则有
,解得,则 的质量分数为
。
杰哥支招
差量法的解题思路是分析形成“差量”的原因(往往透过化学方程式分析),并根据题意
确定“理论差值”,再根据题目提供的“实际差值”,列出比例式,求出答案。
5.取一定量的粉末与稀硫酸充分反应后,将一根 铁棒插入上述溶液中,至
铁棒质量不再变化时,铁棒增重,并收集到气体(标准状况)。 粉末
的质量为( )
D
A. B. C. D.
【解析】 分析题意可知,粉末与稀硫酸充分反应后,稀硫酸过量,稀硫酸与 发
生的反应为 ,收集到标准状况下的 ,则
,可知与稀硫酸反应的铁有 ,质量减少了
。与稀硫酸反应生成的也会与 反应,化学方程式为
。铁棒与稀硫酸反应质量减少 ,但到最后铁棒却增重
,可知与反应使铁棒质量增加了 (【关键】必须分析出差量的由
来)。列式进行计算,如下:
解得 ,此为硫酸铜的物质的量,也等于原先氧化铜的物质的量(【提醒】铜
原子守恒),因此 。
关系式、关系量流畅解计算题
大招2 对应练习
解题觉醒
第一步,根据所求量,推求目标物质的物质的量。
第二步,根据已知条件,求得直求物质的物质的量。
第三步,寻求直求物质的物质的量与目标物质的物质的量的关系。
第四步,根据关系进行计算。
6.(2023河南平许济洛四市二模)己二酸[HOOC(CH2)4COOH]是一种十分重要的二元羧
酸,主要用在合成尼龙、 可降解塑料等生产领域。某实验室在碱性条件下,
已知:环己醇相对分子质量为100,熔点为,沸点为,密度为 ;己二
酸相对分子质量为146,微溶于水,且温度越低溶解度越小。
用高锰酸钾氧化环己醇制备己二酸,反应原理如下:
实验步骤如下:
ⅰ.向三颈瓶中加入碳酸钠和 温水,边搅拌
边加入 高锰酸钾。
ⅱ.待高锰酸钾溶解后,用滴管慢慢加入 环己醇,
维持反应温度在 之间。
ⅲ.环己醇滴加完毕,待反应完成,使二氧化锰沉淀凝
结,然后加适量固体亚硫酸氢钠除去过量的高锰酸钾。
ⅳ.趁热抽滤,滤渣用热水洗涤三次,合并滤液与洗涤
液,用浓盐酸调至 。
.将滤液加热浓缩至 左右,冷却、结晶、抽滤、
洗涤、干燥、称重(得到产品 ),计算产率。
本实验中己二酸的产率为____ (保留两位有效数
字)。
42
【解析】 第一步,求己二酸的产率,需要求得
己二酸的理论物质的量。
第二步,根据已知条件“加入 环己醇”可求
第三步,寻求环己醇与己二酸的量的关系。结合题中数据可知环己醇是少量的,因此以
环己醇的量来计算理论上生成的己二酸的量,根据碳原子守恒可得 。
第四步,根据关系式进行计算。 ,则
,己二酸的产率为
。
得,则 。
7.(2023湖南常德一中检测)测定高铁酸钾样品的纯度,步骤如下:
①称取高铁酸钾样品,完全溶解于 浓溶液中,再加入足量亚铬酸钾
反应后配成 溶液。
②取上述溶液于锥形瓶中,加入稀硫酸调至,用 的硫
酸亚铁铵溶液滴定,消耗标准硫酸亚铁铵溶液 。
已知测定过程中发生如下反应: ,
, 。
计算样品中 的质量分数:_______。
【解析】 第一步,根据所求量“样品中 的质量分数”,可推知目标物质的物质的量
是样品中 的物质的量。
第二步,根据已知条件“用的硫酸亚铁铵 溶液滴定,
消耗标准硫酸亚铁铵溶液”,可直接求得 的物质的量。
第三步,需要寻求的是与 的关系。
第四步,根据关系式进行计算。
样品中的物质的量为 (【注意】本题是
把样品先配成溶液,再取 进行滴定实验,因此最终滴定实验
计算出来的是 溶液中的物质的量,需要扩大至5倍才是原样品中的物质的量),
则样品中的质量分数为 。
1.有和的混合物,溶于水形成溶液,加入的 溶液,充分
反应后滤出沉淀,再向滤液中加入 片,过一段时间取出(反应完全),洗涤、
干燥后称其质量为,则原混合物中和 的物质的量各为( )
B
A.、 B.、
C.、 D.、
【解析】 解题关键:分析形成“差量”的原因 ,并根据题意确
定“理论差值”,再根据题目提供的“实际差值”,列出比例式,求出答案。
分析题意可知,与和反应后,滤液中剩余的和 反应,形成“差
量”。设与反应的硝酸银的物质的量为 ,则有
,解得。原溶液中的 ,则
。和混合物的质量为 ,
则 。联立解得:
、 。
2.(2023天津红桥区模拟)一定质量、的混合物,在足量 气流中加热充分
反应,冷却后测得剩余固体全为铁单质,且比原固体混合物减轻了 ;将等质量的原
混合物与硫酸溶液反应,欲使之完全溶解,需 的硫酸溶液的体积至少为
( )
B
A. B. C. D.
【解析】 分析形成“差量”的原因:、分别与 发生反应
、 ,反应后生成了水,固体质量减
小,产生质量差,则固体混合物减轻的质量即为原固体混合物中氧元素的质量,即
。、分别与 发生反应
、,氧原子与 结合
生成,根据氧原子守恒知,则 ,需
的硫酸溶液的体积至少为 。
3.(2023山东济宁模拟)测定产品中钛含量可用滴定分析法:精确称取 样
品放入锥形瓶中,加入热的硫酸和硫酸铵的混合溶液,使其溶解。冷却,稀释,得到含
的溶液。加入金属铝,将全部转化为 ,加入指示剂,用
溶液滴定至终点,将氧化为 ,重复操作2次,消
耗溶液体积的平均值为。产品中 的质量分数为
_____。
【解析】 第一步,求产品中的质量分数,需要求得产品中 的物质的量。
第二步,根据已知条件“消耗 溶液体积的平均值为
”,可求得 。
第三步,寻求与的关系。根据原子守恒及得失电子守恒得 。
第四步,根据关系式进行计算。,则产品中 的质量为
,产品中的质量分数为 。
4.(2023四川成都七中二诊)苯乙酮可用于制香皂和香烟,也可用作纤维素酯和树脂等
的溶剂和塑料工业生产中的增塑剂,是一种重要的化工原料,可由苯经下述反应制备:
。
相关物质的部分物理性质如表所示:
名称 熔点/ 沸点/ 密度/ 溶解性
乙酸酐 140 1.082 与水反应(生成乙酸)
苯 5.5 80.5 0.879 不溶于水
苯乙酮 20.5 202 1.028 微溶于水
实验步骤如下:
步骤1:向三颈烧瓶中迅速加入粉状无水和无水苯。在搅拌下将 乙酸
酐自恒压滴液漏斗慢慢滴加到三颈烧瓶中,控制乙酸酐滴加的速率(约 加完)。
加完后,待反应稍缓和后在沸水浴中搅拌回流,直到不再有 气体逸出为止。
步骤2:将反应混合物冷却到室温,在搅拌下倒入装有的盐酸和 碎冰的
烧杯中(在通风橱中进行),若仍有固体不溶物,可补加适量 的盐酸使之完全溶解。
将混合物转入分液漏斗中,分出有机层,水层用苯萃取两次(每次 )。合并有机
层,依次用溶液、水洗涤,再用无水 干燥。
步骤3:先在水浴上蒸馏回收苯,稍冷后改用空气冷凝管蒸馏,测得苯乙酮的质量约
。
本次实验苯乙酮的产率为_____(结果保留两位有效数字)。
【解析】 第一步,求苯乙酮的产率,需要求得苯乙酮的理论物质的量。
第二步,根据已知条件“无水苯”及题表中苯的密度,可求得 (苯)
;根据已知条件“ 乙酸酐”及题表中乙酸酐的密度,
可求得(乙酸酐)。反应物按照物质的量比为 反应,
可知理论上生成苯乙酮的物质的量由乙酸酐的物质的量决定(【杰哥支招】多个反应物
参与的反应,在计算产物的理论产量时,必须确认用哪一个反应物的物质的量去计算!
反应中完全消耗掉的物质,就是决定产物多少的物质)。
第三步,寻求(苯乙酮)与(乙酸酐)的关系。由反应原理可知理论上 (苯乙酮)
(乙酸酐)。
第四步,根据关系式进行计算。(苯乙酮)(乙酸酐) ,则苯乙酮的
理论产量为,则苯乙酮的产率为 。
5.(2024浙江杭州检测)某研究小组欲制备
(相对分子质量为 ),按如下
流程开展实验:
测定产品纯度:称取 样品,配制成
溶液,移取 溶液于锥形瓶中,加
指示剂,用 标准溶
液滴定至砖红色(有 沉淀生成),消耗
(1) 应该选择___(填“”或“ ”)计算产品的纯度,理由是_____________________。
产品混有含的杂质
标准溶液;再向溶液中加适量浓 ,砖红色褪去的同时配位键被破
坏,继续用上述标准溶液滴定至砖红色(有沉淀生成),消耗 标准
溶液 。
(2) 产品的纯度为________。
【解析】 (1)结合产品化学式和滴定原理可知,
若产品中不存在含的杂质,则应为 的2倍,
而实际上大于的2倍,所以产品中混有含 的
杂质,因此应选择 计算产品纯度。
(2)第一步,求产品纯度,需要求得 产
品中 的物质的量。
第二步,选择计算产品纯度,根据“消耗
标准溶液 ”,可求得
。
第三步,寻求与 的关
系。滴定消耗标准溶液 时,
。
第四步,根据关系式进行计算。 产品中
,则产品的纯度为
。
6.(2023浙江温州二模)连二亚硫酸钠 俗称保险粉,是印染工业中常用的漂
白剂。工业中经典的制取方法是以、、 为原料制备连二亚硫酸钠。取
产品与足量甲醛水溶液混合于锥形瓶中,生成甲醛亚硫酸氢钠与甲醛次硫酸氢
钠: ,在所得的混合溶液
中加入 ,轻轻振荡,发生反应
。以淀粉为指示剂,过量的 用
的标准溶液滴定。已知: 。
消耗标准溶液 ,则产品的纯度为________(结果保留四位有效数字)。
【解析】 第一步,求产品的纯度,需要求得产品中 的物质的量。
第二步,根据已知条件“消耗标准溶液 ”,可求得
;根据已知条件“加入 ”,
可求得 。
第三步,寻求与、 的关系。根据
和
,可得关系式
;根据 ,可得关系
式。故 。
第四步,根据关系式进行计算。 ,则产
品的纯度为 。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
2025年高考化学考向分析
化学反应计算中的常用方法
守恒法巧解计算题
1.(2023山东)三氯甲硅烷 是制取高纯
硅的重要原料,常温下为无色液体,沸点为 ,
熔点为 ,易水解。采用如下方法测定溶
有少量的 纯度。
灼烧
冷却干燥
A、C
样品经水解、干燥等预处理过程,得硅酸水合物后,进行如下实验操作:①______,
②__________(填操作名称),③称量等操作,测得所得固体氧化物质量为 ,从下列仪
器中选出①、②中需使用的仪器,依次为_______(填标号)。测得样品纯度为
_______________(用含、 的代数式表示)。
【解析】 由后续操作可知, 水解得到的硅酸水合物要先在坩埚中灼烧
(得到),然后在干燥器中冷却干燥 ,使用的仪器分别为A、C。根据硅原子
守恒可得关系式,则样品中的质量为 ,故样品纯度
为 。
2.(2022湖南)产品中 的含量测定。
(1)称取产品,用 水溶解,酸化,加热至近沸。
(2)在不断搅拌下,向(1)所得溶液中逐滴加入热的 溶液。
(3)沉淀完全后, 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质
量为 。
产品中 的质量分数为_______(结果保留三位有效数字)。
【解析】 分析题意可知,(3)中称量的白色固体为 ,其物
质的量为,根据钡原子守恒,产品中 的物质的量也
是,因此 的质量为
,产品中 的质量分数为
。
3.(2023山东滕州期中)钒酸钇 广泛应用于光纤通信领域,一种用废钒催化剂
(含、、,少量)制取 的工艺流程如图所示:
某废钒催化剂中的含量为,某工厂用 该废钒催化剂且用该工艺流程
生产,整个流程中的损耗率为,则最终得到_____ 。
408
【解析】 根据钒原子守恒可知,,摩尔质量为、
的摩尔质量为,设最终得到的质量为 ,则
。
差量法妙解计算题
4.(2024湖北武汉三中月考)为了检验某含有杂质的 样品的纯度,现将
样品加热,其质量变为 ,则该样品的纯度(质量分数)是( )
A
A. B.
C. D.
【解析】 分析形成差量的原因:碳酸氢钠受热分解,发生反应
,反应后生成了二氧化碳与水,固体质量减小,产
生质量差。
由题意可知,质量变化值为,设样品中含的质量为 ,则有
,解得,则 的质量分数为
。
杰哥支招
差量法的解题思路是分析形成“差量”的原因(往往透过化学方程式分析),并根据题意
确定“理论差值”,再根据题目提供的“实际差值”,列出比例式,求出答案。
5.取一定量的粉末与稀硫酸充分反应后,将一根 铁棒插入上述溶液中,至
铁棒质量不再变化时,铁棒增重,并收集到气体(标准状况)。 粉末
的质量为( )
D
A. B. C. D.
【解析】 分析题意可知,粉末与稀硫酸充分反应后,稀硫酸过量,稀硫酸与 发
生的反应为 ,收集到标准状况下的 ,则
,可知与稀硫酸反应的铁有 ,质量减少了
。与稀硫酸反应生成的也会与 反应,化学方程式为
。铁棒与稀硫酸反应质量减少 ,但到最后铁棒却增重
,可知与反应使铁棒质量增加了 (【关键】必须分析出差量的由
来)。列式进行计算,如下:
解得 ,此为硫酸铜的物质的量,也等于原先氧化铜的物质的量(【提醒】铜
原子守恒),因此 。
关系式、关系量流畅解计算题
大招2 对应练习
解题觉醒
第一步,根据所求量,推求目标物质的物质的量。
第二步,根据已知条件,求得直求物质的物质的量。
第三步,寻求直求物质的物质的量与目标物质的物质的量的关系。
第四步,根据关系进行计算。
6.(2023河南平许济洛四市二模)己二酸[HOOC(CH2)4COOH]是一种十分重要的二元羧
酸,主要用在合成尼龙、 可降解塑料等生产领域。某实验室在碱性条件下,
已知:环己醇相对分子质量为100,熔点为,沸点为,密度为 ;己二
酸相对分子质量为146,微溶于水,且温度越低溶解度越小。
用高锰酸钾氧化环己醇制备己二酸,反应原理如下:
实验步骤如下:
ⅰ.向三颈瓶中加入碳酸钠和 温水,边搅拌
边加入 高锰酸钾。
ⅱ.待高锰酸钾溶解后,用滴管慢慢加入 环己醇,
维持反应温度在 之间。
ⅲ.环己醇滴加完毕,待反应完成,使二氧化锰沉淀凝
结,然后加适量固体亚硫酸氢钠除去过量的高锰酸钾。
ⅳ.趁热抽滤,滤渣用热水洗涤三次,合并滤液与洗涤
液,用浓盐酸调至 。
.将滤液加热浓缩至 左右,冷却、结晶、抽滤、
洗涤、干燥、称重(得到产品 ),计算产率。
本实验中己二酸的产率为____ (保留两位有效数
字)。
42
【解析】 第一步,求己二酸的产率,需要求得
己二酸的理论物质的量。
第二步,根据已知条件“加入 环己醇”可求
第三步,寻求环己醇与己二酸的量的关系。结合题中数据可知环己醇是少量的,因此以
环己醇的量来计算理论上生成的己二酸的量,根据碳原子守恒可得 。
第四步,根据关系式进行计算。 ,则
,己二酸的产率为
。
得,则 。
7.(2023湖南常德一中检测)测定高铁酸钾样品的纯度,步骤如下:
①称取高铁酸钾样品,完全溶解于 浓溶液中,再加入足量亚铬酸钾
反应后配成 溶液。
②取上述溶液于锥形瓶中,加入稀硫酸调至,用 的硫
酸亚铁铵溶液滴定,消耗标准硫酸亚铁铵溶液 。
已知测定过程中发生如下反应: ,
, 。
计算样品中 的质量分数:_______。
【解析】 第一步,根据所求量“样品中 的质量分数”,可推知目标物质的物质的量
是样品中 的物质的量。
第二步,根据已知条件“用的硫酸亚铁铵 溶液滴定,
消耗标准硫酸亚铁铵溶液”,可直接求得 的物质的量。
第三步,需要寻求的是与 的关系。
第四步,根据关系式进行计算。
样品中的物质的量为 (【注意】本题是
把样品先配成溶液,再取 进行滴定实验,因此最终滴定实验
计算出来的是 溶液中的物质的量,需要扩大至5倍才是原样品中的物质的量),
则样品中的质量分数为 。
1.有和的混合物,溶于水形成溶液,加入的 溶液,充分
反应后滤出沉淀,再向滤液中加入 片,过一段时间取出(反应完全),洗涤、
干燥后称其质量为,则原混合物中和 的物质的量各为( )
B
A.、 B.、
C.、 D.、
【解析】 解题关键:分析形成“差量”的原因 ,并根据题意确
定“理论差值”,再根据题目提供的“实际差值”,列出比例式,求出答案。
分析题意可知,与和反应后,滤液中剩余的和 反应,形成“差
量”。设与反应的硝酸银的物质的量为 ,则有
,解得。原溶液中的 ,则
。和混合物的质量为 ,
则 。联立解得:
、 。
2.(2023天津红桥区模拟)一定质量、的混合物,在足量 气流中加热充分
反应,冷却后测得剩余固体全为铁单质,且比原固体混合物减轻了 ;将等质量的原
混合物与硫酸溶液反应,欲使之完全溶解,需 的硫酸溶液的体积至少为
( )
B
A. B. C. D.
【解析】 分析形成“差量”的原因:、分别与 发生反应
、 ,反应后生成了水,固体质量减
小,产生质量差,则固体混合物减轻的质量即为原固体混合物中氧元素的质量,即
。、分别与 发生反应
、,氧原子与 结合
生成,根据氧原子守恒知,则 ,需
的硫酸溶液的体积至少为 。
3.(2023山东济宁模拟)测定产品中钛含量可用滴定分析法:精确称取 样
品放入锥形瓶中,加入热的硫酸和硫酸铵的混合溶液,使其溶解。冷却,稀释,得到含
的溶液。加入金属铝,将全部转化为 ,加入指示剂,用
溶液滴定至终点,将氧化为 ,重复操作2次,消
耗溶液体积的平均值为。产品中 的质量分数为
_____。
【解析】 第一步,求产品中的质量分数,需要求得产品中 的物质的量。
第二步,根据已知条件“消耗 溶液体积的平均值为
”,可求得 。
第三步,寻求与的关系。根据原子守恒及得失电子守恒得 。
第四步,根据关系式进行计算。,则产品中 的质量为
,产品中的质量分数为 。
4.(2023四川成都七中二诊)苯乙酮可用于制香皂和香烟,也可用作纤维素酯和树脂等
的溶剂和塑料工业生产中的增塑剂,是一种重要的化工原料,可由苯经下述反应制备:
。
相关物质的部分物理性质如表所示:
名称 熔点/ 沸点/ 密度/ 溶解性
乙酸酐 140 1.082 与水反应(生成乙酸)
苯 5.5 80.5 0.879 不溶于水
苯乙酮 20.5 202 1.028 微溶于水
实验步骤如下:
步骤1:向三颈烧瓶中迅速加入粉状无水和无水苯。在搅拌下将 乙酸
酐自恒压滴液漏斗慢慢滴加到三颈烧瓶中,控制乙酸酐滴加的速率(约 加完)。
加完后,待反应稍缓和后在沸水浴中搅拌回流,直到不再有 气体逸出为止。
步骤2:将反应混合物冷却到室温,在搅拌下倒入装有的盐酸和 碎冰的
烧杯中(在通风橱中进行),若仍有固体不溶物,可补加适量 的盐酸使之完全溶解。
将混合物转入分液漏斗中,分出有机层,水层用苯萃取两次(每次 )。合并有机
层,依次用溶液、水洗涤,再用无水 干燥。
步骤3:先在水浴上蒸馏回收苯,稍冷后改用空气冷凝管蒸馏,测得苯乙酮的质量约
。
本次实验苯乙酮的产率为_____(结果保留两位有效数字)。
【解析】 第一步,求苯乙酮的产率,需要求得苯乙酮的理论物质的量。
第二步,根据已知条件“无水苯”及题表中苯的密度,可求得 (苯)
;根据已知条件“ 乙酸酐”及题表中乙酸酐的密度,
可求得(乙酸酐)。反应物按照物质的量比为 反应,
可知理论上生成苯乙酮的物质的量由乙酸酐的物质的量决定(【杰哥支招】多个反应物
参与的反应,在计算产物的理论产量时,必须确认用哪一个反应物的物质的量去计算!
反应中完全消耗掉的物质,就是决定产物多少的物质)。
第三步,寻求(苯乙酮)与(乙酸酐)的关系。由反应原理可知理论上 (苯乙酮)
(乙酸酐)。
第四步,根据关系式进行计算。(苯乙酮)(乙酸酐) ,则苯乙酮的
理论产量为,则苯乙酮的产率为 。
5.(2024浙江杭州检测)某研究小组欲制备
(相对分子质量为 ),按如下
流程开展实验:
测定产品纯度:称取 样品,配制成
溶液,移取 溶液于锥形瓶中,加
指示剂,用 标准溶
液滴定至砖红色(有 沉淀生成),消耗
(1) 应该选择___(填“”或“ ”)计算产品的纯度,理由是_____________________。
产品混有含的杂质
标准溶液;再向溶液中加适量浓 ,砖红色褪去的同时配位键被破
坏,继续用上述标准溶液滴定至砖红色(有沉淀生成),消耗 标准
溶液 。
(2) 产品的纯度为________。
【解析】 (1)结合产品化学式和滴定原理可知,
若产品中不存在含的杂质,则应为 的2倍,
而实际上大于的2倍,所以产品中混有含 的
杂质,因此应选择 计算产品纯度。
(2)第一步,求产品纯度,需要求得 产
品中 的物质的量。
第二步,选择计算产品纯度,根据“消耗
标准溶液 ”,可求得
。
第三步,寻求与 的关
系。滴定消耗标准溶液 时,
。
第四步,根据关系式进行计算。 产品中
,则产品的纯度为
。
6.(2023浙江温州二模)连二亚硫酸钠 俗称保险粉,是印染工业中常用的漂
白剂。工业中经典的制取方法是以、、 为原料制备连二亚硫酸钠。取
产品与足量甲醛水溶液混合于锥形瓶中,生成甲醛亚硫酸氢钠与甲醛次硫酸氢
钠: ,在所得的混合溶液
中加入 ,轻轻振荡,发生反应
。以淀粉为指示剂,过量的 用
的标准溶液滴定。已知: 。
消耗标准溶液 ,则产品的纯度为________(结果保留四位有效数字)。
【解析】 第一步,求产品的纯度,需要求得产品中 的物质的量。
第二步,根据已知条件“消耗标准溶液 ”,可求得
;根据已知条件“加入 ”,
可求得 。
第三步,寻求与、 的关系。根据
和
,可得关系式
;根据 ,可得关系
式。故 。
第四步,根据关系式进行计算。 ,则产
品的纯度为 。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
