氮及其重要化合物 -2025年高考化学考向分析(共42张PPT)
文档属性
| 名称 | 氮及其重要化合物 -2025年高考化学考向分析(共42张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-27 19:09:13 | ||
图片预览











文档简介
(共42张PPT)
2025年高考化学考向分析
氮及其重要化合物
1.[选变判]
(1) (2023新课标改编)室温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气
体,后者无明显现象,则稀硝酸的氧化性比浓硝酸的强( )
×
(2) (2023浙江1月选考)工业上用氨的催化氧化制备 ( )
√
(3) (2022北京改编)过量铁粉与稀硝酸反应,产生无色气体时发生反应的离子方程
式为 ( )
×
(4) (2022浙江1月选考)将少量通入 溶液:
( )
√
(5) (2022浙江1月选考改编)鉴别食盐与亚硝酸钠,各取少量固体加水溶解,分别
滴加含淀粉的 溶液,振荡,观察溶液颜色变化,溶液变蓝色的为亚硝酸钠,溶液不变
蓝的为食盐( )
×
(6) (2021全国甲改编)实验室用加热氯化铵固体的方法制备氨气( )
×
(7) (2021全国甲改编)实验室用将铝片加到冷浓硝酸中的方法制备二氧化氮( )
×
(8) (2021山东)向浓中插入红热的炭,产生红棕色气体,证明炭可与浓
反应生成 ( )
×
(9) (2021湖南)与在密闭容器中充分反应后的分子数为 ( )
×
(10) (2021河北)浓和稀与反应的还原产物分别为和 ,故稀
氧化性更强( )
×
(11) (2021浙江1月选考)工业上可用氨水消除燃煤烟气中的二氧化硫( )
√
(12) (2020山东改编)大气中 参与酸雨形成,涉及氧化还原反应( )
√
(13) ( )
×
(14) 用烧碱处理含高浓度 的废水并回收利用氨( )
√
【解析】 (1)室温下,铁遇浓硝酸发生钝化,因此不能据此判断稀硝酸和浓硝酸的氧
化性强弱,错误。
(2)工业上用氨的催化氧化制备 ,正确。
(3)铁粉过量时,其与稀硝酸反应生成、、 ,离子方程式为
,错误。
(4)将少量通入溶液,发生歧化反应,生成、和 ,反应的
离子方程式为 ,正确。
(5)亚硝酸根离子和硝酸根离子类似,需要酸化后才具有较强的氧化性,酸化的亚硝
酸根离子可以与具有还原性的 反应,离子方程式为
,但该鉴别方案未酸化,错误。
(6)固体受热后分解生成和,但试管口温度较低,和 在试管口还
会再重新化合生成固体,应该用加热和固体的方法来制备 ,错
误。
(7)将铝片加到冷浓硝酸中,铝片会发生钝化,反应会迅速停止,无法制备 ,实验
室常用与浓硝酸反应制备 ,化学方程式为
,错误。
(8)向浓中插入红热的炭,产生的红棕色气体有可能是炭与浓 反应生成的
,也有可能是浓受热分解生成的 ,
错误。
(9)与反应生成,而会发生反应 ,因此
最终达平衡时容器内的分子数小于 ,错误。
(10)氧化剂的氧化性强弱与其得电子的多少没有必然的关系(【关键】氧化剂的氧化
性强弱取决于其得电子的能力,而不是得电子的多少),不能因为稀硝酸与 反应生
成 转移电子数较多,就断定稀硝酸氧化性强。在相同条件下,铜与浓硝酸反应的剧
烈程度大于与稀硝酸反应的,因此浓的氧化性大于稀 ,错误。
(11)氨水是碱性溶液,可以与反应生成可溶的或 ,可以消除
燃煤烟气中的二氧化硫,减少空气污染,正确。
(12) 与水反应可形成硝酸型酸雨,反应的化学方程式为
,涉及氧化还原反应,正确。
(13)将与先后通入中,析出的是固体而不是 固体,
错误。
(14)烧碱即,可以与反应生成氨气,因此可用烧碱处理含高浓度 的废
水并回收利用氨,正确。
2.(2023山东)实验室中使用盐酸、硫酸和硝酸时,对应关系错误的是( )
D
A.稀盐酸:配制 溶液 B.稀硫酸:蔗糖和淀粉的水解
C.稀硝酸:清洗附有银镜的试管 D.浓硫酸和浓硝酸的混合溶液:苯的磺化
【解析】 A(√)在水中发生水解:,配制 溶
液加入稀盐酸可以抑制 水解。
B(√)蔗糖和淀粉的水解可加入稀硫酸作催化剂。
C(√)可与稀硝酸发生反应 ,可清洗附
有银镜的试管。
D(×)苯的磺化是苯和浓硫酸共热生成苯磺酸,不需要用到浓硝酸;苯与浓硫酸和浓
硝酸的混合溶液共热可以生成硝基苯,是苯的硝化反应。
3.(2023江苏)氮及其化合物的转化具有重要应用。下列说法不正确的是( )
B
A.实验室探究稀硝酸与铜反应的气态产物:
B.工业制硝酸过程中的物质转化:
C.汽车尾气催化转化器中发生的主要反应:
D.实验室制备少量的原理:
【解析】 A(√)铜与稀硝酸反应生成气体,与反应生成 。
B(×)与在放电或高温条件下生成,但与不反应,和 一起通入水
中才能生成 。
C(√)汽车尾气有与等污染性气体,利用尾气催化转化器促进与 反应使其
转化成无毒无害的和 ,检查方程式符合原子守恒与得失电子守恒。
D(√)实验室利用氯化铵和氢氧化钙固体共热制备氨气,化学方程式为
。
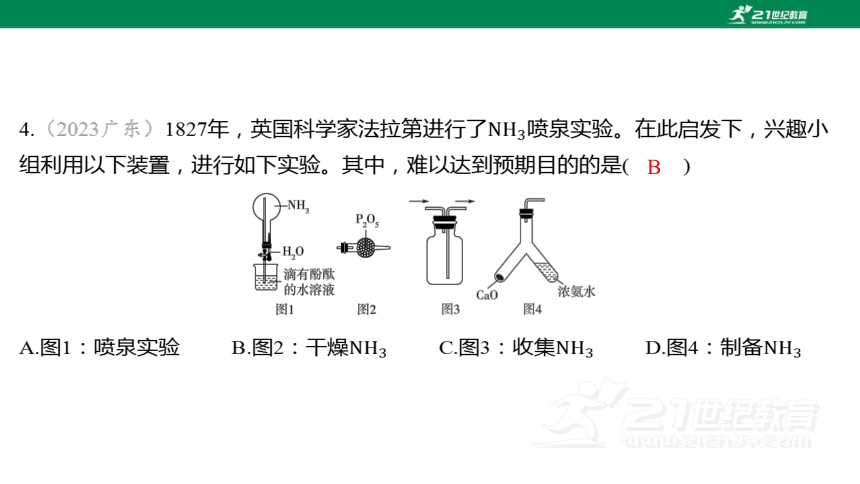
4.(2023广东)1827年,英国科学家法拉第进行了 喷泉实验。在此启发下,兴趣小
组利用以下装置,进行如下实验。其中,难以达到预期目的的是( )
B
A.图1:喷泉实验 B.图2:干燥 C.图3:收集 D.图4:制备
【解析】 A(√)打开止水夹,将滴管中的水
挤压到烧瓶中, 极易溶于水,烧瓶中的压
强快速降低,烧杯中滴有酚酞的水溶液会快速
上升,从而产生喷泉。
B(×)为酸性氧化物,会与碱性气体发生反应,因此不可以用干燥 。
C(√) 极易溶于水且密度比空气小,可采用向下排空气法收集(集气瓶的导管短进
长出)。
D(√)将浓氨水倒入一侧,与反应大量放热,受热分解生成 ,
可用此装置来制备 。
5.(2023广东汕头质监)将铜丝插入浓硝酸中进行如图
(a~c是浸有相应试剂的棉花)所示的探究实验,下列分
析正确的是( )
B
A. 与浓硝酸反应,硝酸只表现出酸性,产生红棕色气
体
B. 处可观察到棉花变红后褪色
C.处观察到棉花变蓝,体现了 的还原性
D.处 能与产生的气体发生复分解反应
【解析】 铜丝与浓硝酸发生反应 ,
氮元素化合价降低,硝酸表现出氧化性和酸性。
溶于水生成硝酸,可使紫色石蕊溶液变红,而
硝酸的强氧化性又使其褪色。
溶于水生成硝酸,硝酸将氧化成, 处观察
到棉花变蓝,体现了硝酸的氧化性。
吸收尾气和生成亚硝酸钠, 元素化合
价发生变化,属于氧化还原反应。
6.(2022浙江6月选考)亚硝酸钠俗称“工业盐”,其外观、口感与食盐相似,人若误服
会中毒。现将适量某样品(成分为亚硝酸钠或氯化钠)溶于水配成溶液,分别取少量该
溶液于试管中进行实验。下列方案设计、现象和结论都正确的是( )
方案设计 现象和结论
A 先加入少量溶液,再加 溶液和足量 稀硝酸,振荡 若产生白色沉淀,则样品为亚硝
酸钠
B 加到少量 溶液中,再加硫酸酸化,振荡 若溶液褪色,则样品为亚硝酸钠
C 先加到少量 溶液中,再加入稀盐酸酸化, 振荡 若溶液变黄色,则样品为亚硝酸
钠
D 先加入少量溶液,再加入 溶液和稀 硝酸,振荡 若产生白色沉淀,则样品为亚硝
酸钠
C
【解析】 若样品为 ,按照A项的方案设计也会出现白色沉淀,因此无法判定
样品是否为亚硝酸钠。
酸性条件下高锰酸钾溶液也可以氧化电离出的,因此 溶液褪色,无
法证明样品为亚硝酸钠。
若样品为亚硝酸钠,则加入稀盐酸酸化可以生成具有氧化性的亚硝酸,亚硝酸可以
把氧化为 ,溶液变为黄色。
加入的稀具有氧化性,可以将氧化为,与 结合可以生成硫酸钡
白色沉淀,无法证明一定是亚硝酸氧化了 ,因而也无法证明样品是否为亚硝酸钠。
7.下列装置可以达到相应实验目的的有( )
A
A.1项 B.2项 C.3项 D.4项
【解析】 ①氨气密度小于空气,导管应伸入试管底部,采用向下
排空气法收集,错误。②受热分解生成和 ,降温时
和又结合生成,不但得不到 还会堵塞导管,因
此不能用加热的方法来制备,错误。③ 与浓硝酸反
应可制备,但会与 反应
,不能用排水法收集 ,应该用
向上排空气法收集,错误。④难溶于水,也不能和 溶液
反应,无法完成喷泉实验,错误。⑤受热分解生成 和
,碱石灰可以吸收并干燥,但不能使湿润的蓝色石蕊试纸变红; 可
以吸收并干燥,但不能使湿润的酚酞试纸变红,因此无法检测出和 ,
错误。正确的装置应该是碱石灰与 对调位置,才能达到实验目的。⑥二氧化氮和溴
蒸气都呈红棕色,溶于水变为无色溶液并生成无色气体, 通入水中溶
液呈橙黄色,因此能用该装置鉴别和 ,正确。
8.(2023广东深圳外国语学校模拟)研究发现“利用零价铁还
原 可脱除地下废水中的硝酸盐”。实验室利用如图装置
探究铁粉与 溶液的反应,实验步骤有如下六步:
①打开弹簧夹,缓慢通入,并保持后续反应均在 氛围中进行;
②加入已调至2.5的酸性溶液 ,一段时间后铁粉部分溶解,
溶液逐渐变为浅绿色;待铁粉不再溶解后静置,发现剩余固体表面有少量白色物质附着;
③连接好装置,并检查装置的气密性;
④检测到滤液中存在、和 ;
⑤装好药品;
⑥过滤剩余固体时,表面的白色物质变为红褐色。
回答下列问题:
(1) 实验前使用仪器 的第一步操作是_____________
_________。
检查分液漏斗是否漏液
(2) 通入并保持后续反应均在 氛围中进行的目
的是____________________________________________
_____。
排尽装置中的空气,排除空气中的氧气对实验的干扰
(3) 实验步骤的正确顺序是______________(填序号)。
(4) 白色物质是_________(填化学式)。
(5) 检验滤液中 的实验方案是____________________________________________
____________________________________________________。
③⑤①②⑥④
取一定量的滤液于试管中,加入稀硫酸,溶液中有气泡产生,且逸出的气体变为红棕色,则滤液中含有
(6) 某地下废水中的含量测定。取 废水,加入稀硫酸酸化,再加入
标准溶液(过量),充分反应后,用酸性 标
准溶液滴定剩余的,消耗酸性标准溶液的体积为 。
① 酸性标准溶液与 反应的离子方程式为______________________________
_____________。
② 该地下废水中的含量为____________(用含、、、、 的代数
式表示)。
【解析】 (1)实验前需要对分液漏斗进行检漏。(2)
反应开始一段时间后铁粉部分溶解,溶液逐渐变为浅绿
色,说明有生成,及反应生成的 易被氧化,
故通入并保持后续反应均在 氛围中进行的目的是
排尽装置中的空气,排除空气中的氧气对实验的干扰。(3)连接好装置后应先检查装
置气密性,加入实验药品,结合第(2)问分析,通入,然后发生反应(加入 酸
性溶液),过滤剩余固体,最后检测滤液中成分。故实验步骤的正确顺序为③⑤①②⑥
④。(4)反应有生成,结合实验步骤⑥中表面的白色物质 在过滤时被空
气中的氧气氧化变为红褐色可知,白色物质为 。(5)实验步骤②中
加入酸性溶液,一段时间后铁粉部分溶解,说明酸性条件下 具有强氧化性,
又滤液中含有,酸性条件下、 会反应生成
无色气体,与空气中的反应生成红棕色的 ,
故实验方案为取一定量的滤液于试管中,加入稀硫酸,
溶液中有气泡产生,且逸出的气体变为红棕色,则滤液
中含有。(6)①与 发生反应的离子方
程式为 。
向废水中加入稀硫酸后,被还原成 ,反应
的离子方程式为
,剩余的
被 氧化,发生反应
,则废
水中 的含量为
。
1.(2023辽宁丹东检测)自然界中氮循环过程如图所示,下列说法错误的是( )
D
A.反硝化过程中,含氮物质被还原
B.氨氧化过程中,与 理论物质的量
之比为
C.属于氮的固定, 发生还原反
应
D.土壤中 有利于除去水体中的铵态氮
【解析】 反硝化过程中 转化为
或, 元素化合价降低,含氮物质被
还原。
氨氧化过程中,发生归中反应
,与
理论物质的量之比为 。
将氮气转化为氮的化合物,属于氮的固定,氮元素化合价降低, 发生
还原反应。
由题图可知,土壤中能与水体中的 (硝态)反应,可以除去水体中的硝
态氮。
2.(2023广东六校联考)部分含及 物质的
分类与相应化合价关系如图所示,下列推断
不合理的是( )
B
A.可以通过的催化氧化反应制备
B.工业上通过 来制备
C.浓的溶液和浓的溶液反应可以得到
D.加热(固态钾盐)可以产生
【解析】
氨气催化氧化可生成一氧化氮:
。
工业上制 的过程为氨气催化氧化生
成一氧化氮,一氧化氮和氧气反应生成二氧
化氮,二氧化氮和水反应生成硝酸,即 。
浓溶液和浓 溶液可发生归中反应生成氯气。
。
3.(2023湖南娄底模拟)实验室用 (肼,又名联氨,常温下为无色油状液体,沸点
为,具有与氨相似的气味,有弱碱性和较强的还原性)还原 制备纳米
的装置(部分夹持及加热装置已省略)如图所示。已知:溶液与 溶液
在加热条件下反应能得到 。
下列说法不正确的是( )
D
A.装置②⑥中分别盛装浓硫酸和稀硫酸
B.无水硫酸铜由白色变为蓝色,说明从装置④出来的气体中含有水蒸气
C.装置④中发生反应的化学方程式为
D.加入反应试剂后,先打开,待装置④中反应完且冷却至室温,再打开 排尽装置
中的
【解析】
.
根据上述分析可知,装置②⑥中分别盛装浓硫酸和稀硫酸。
有较强的还原性,可能会和空气中的 反应,干扰实验,故加入反应试剂后,
应该先打开,利用①中产生的排尽装置中的空气,再关闭,再打开 ,加入
进行反应,待装置④中反应结束且冷却至室温后,关闭打开 ,利用①中产生
的排尽装置中的 。
4.(2023湖北武汉洪山中学模拟)实验室可利用与反应制备亚硝酰氯 ,装置
如图。已知亚硝酰氯的沸点为 ,遇水生成一种氯化物和两种氮的常见氧化物,其
中一种呈红棕色。下列说法错误的是( )
C
A. 装置的优点是随开随用,随关随停
B.若无装置, 中可能发生反应:
C.装入药品打开后,应先打开再打开
D. 中冰盐水的作用是冷凝并收集亚硝酰氯
【解析】 打开时, 装置中稀硝酸与铜丝
接触生成,关闭后,生成的 将稀硝酸压入
左侧,使铜丝与稀硝酸脱离,反应停止,从而实现
随开随用,随关随停。
中生成的中有水蒸气,若不通过进行干燥,水蒸气会进入 中与生成的亚硝
酰氯发生反应生成、和 。
装入药品打开后,应先打开,待氯气将装置中的空气排尽后再打开 ,否则
会与空气中的氧气发生反应。
亚硝酰氯的沸点为 ,用冰盐水有利于产物的冷凝收集。
5.(2023广东六校联考) 可用于面粉的漂白和
杀菌。已知: 为黄色油状液体,熔点为
,沸点为, 以上易爆炸。实验室
可用和溶液反应制取 ,实验装置如下:
(1) 三卤化氮分子的空间结构与相似,热稳定性比强的 有_____。
在热水中易水解,反应液有漂白性,写出 水解的化学方程式:_________________
________________________________________________________________________。
(2) 试剂 为________;仪器D的作用是_______________________________________
_________。
吸收尾气、,防止空气中水蒸气进入使水解
(3) 向蒸馏烧瓶内的溶液中通入过量 ,B中反应的化学
方程式为____________________________,
待反应至油状液体不再增加,关闭装置A、B间的止水夹,控制水
(或)
浴加热的温度范围为________________________________,将产品 蒸出。
待反应结束,为测定溶液中残留的 的物质的量浓度,进行如下操作:
ⅰ.取蒸馏烧瓶中的反应液,加入过量饱和 溶液充分反应后,再加入过
量的 溶液,微热;
ⅱ.用的稀硫酸吸收产生的 ,得到溶液A;
ⅲ.用的标准液滴定溶液A至滴定终点,消耗 标准液。
(4) 滴定至终点时溶液中溶质仅有 和
,用含的代数式表示溶液中残留的
的物质的量浓度为________ 。
(5) 为减小误差,滴定时最适宜的指示剂为___(填标号)。
.酚酞 .甲基橙
.石蕊 .淀粉溶液
【解析】 .
(1)卤族元素的非金属性越强,三卤化氮中氮卤键的键长越短,键能越大,分子的热稳
定性越强,故三氟化氮的热稳定性强于三氯化氮;由题意可知,三氯化氮在热水中水解
生成的漂白性物质为次氯酸,结合原子守恒可知,还生成氨气,故反应的化学方程式为
。
(3)装置B中氯气与氯化铵溶液在水浴加热条件下反应生成三氯化氮和 ;由题给信
息可知,实验时,为保证三氯化氮顺利蒸出,同时防止三氯化氮发生爆炸,水浴加热的
温度应控制在 之间。
(4)由题意可知,操作ⅰ中,操作ⅱ中 ,
操作ⅲ中,滴定过程中消耗 氢氧化钠标准液,则
用于吸收氨气的 的物质的量为
, 由氮原子守恒可知,溶液中残留的三氯化氮的物质的量浓度为
。
(5)由题目信息可知,滴定终点时溶液因 水解显酸性,因此为减小误差,
滴定时最适宜的指示剂为甲基橙(变色范围为 )。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
2025年高考化学考向分析
氮及其重要化合物
1.[选变判]
(1) (2023新课标改编)室温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气
体,后者无明显现象,则稀硝酸的氧化性比浓硝酸的强( )
×
(2) (2023浙江1月选考)工业上用氨的催化氧化制备 ( )
√
(3) (2022北京改编)过量铁粉与稀硝酸反应,产生无色气体时发生反应的离子方程
式为 ( )
×
(4) (2022浙江1月选考)将少量通入 溶液:
( )
√
(5) (2022浙江1月选考改编)鉴别食盐与亚硝酸钠,各取少量固体加水溶解,分别
滴加含淀粉的 溶液,振荡,观察溶液颜色变化,溶液变蓝色的为亚硝酸钠,溶液不变
蓝的为食盐( )
×
(6) (2021全国甲改编)实验室用加热氯化铵固体的方法制备氨气( )
×
(7) (2021全国甲改编)实验室用将铝片加到冷浓硝酸中的方法制备二氧化氮( )
×
(8) (2021山东)向浓中插入红热的炭,产生红棕色气体,证明炭可与浓
反应生成 ( )
×
(9) (2021湖南)与在密闭容器中充分反应后的分子数为 ( )
×
(10) (2021河北)浓和稀与反应的还原产物分别为和 ,故稀
氧化性更强( )
×
(11) (2021浙江1月选考)工业上可用氨水消除燃煤烟气中的二氧化硫( )
√
(12) (2020山东改编)大气中 参与酸雨形成,涉及氧化还原反应( )
√
(13) ( )
×
(14) 用烧碱处理含高浓度 的废水并回收利用氨( )
√
【解析】 (1)室温下,铁遇浓硝酸发生钝化,因此不能据此判断稀硝酸和浓硝酸的氧
化性强弱,错误。
(2)工业上用氨的催化氧化制备 ,正确。
(3)铁粉过量时,其与稀硝酸反应生成、、 ,离子方程式为
,错误。
(4)将少量通入溶液,发生歧化反应,生成、和 ,反应的
离子方程式为 ,正确。
(5)亚硝酸根离子和硝酸根离子类似,需要酸化后才具有较强的氧化性,酸化的亚硝
酸根离子可以与具有还原性的 反应,离子方程式为
,但该鉴别方案未酸化,错误。
(6)固体受热后分解生成和,但试管口温度较低,和 在试管口还
会再重新化合生成固体,应该用加热和固体的方法来制备 ,错
误。
(7)将铝片加到冷浓硝酸中,铝片会发生钝化,反应会迅速停止,无法制备 ,实验
室常用与浓硝酸反应制备 ,化学方程式为
,错误。
(8)向浓中插入红热的炭,产生的红棕色气体有可能是炭与浓 反应生成的
,也有可能是浓受热分解生成的 ,
错误。
(9)与反应生成,而会发生反应 ,因此
最终达平衡时容器内的分子数小于 ,错误。
(10)氧化剂的氧化性强弱与其得电子的多少没有必然的关系(【关键】氧化剂的氧化
性强弱取决于其得电子的能力,而不是得电子的多少),不能因为稀硝酸与 反应生
成 转移电子数较多,就断定稀硝酸氧化性强。在相同条件下,铜与浓硝酸反应的剧
烈程度大于与稀硝酸反应的,因此浓的氧化性大于稀 ,错误。
(11)氨水是碱性溶液,可以与反应生成可溶的或 ,可以消除
燃煤烟气中的二氧化硫,减少空气污染,正确。
(12) 与水反应可形成硝酸型酸雨,反应的化学方程式为
,涉及氧化还原反应,正确。
(13)将与先后通入中,析出的是固体而不是 固体,
错误。
(14)烧碱即,可以与反应生成氨气,因此可用烧碱处理含高浓度 的废
水并回收利用氨,正确。
2.(2023山东)实验室中使用盐酸、硫酸和硝酸时,对应关系错误的是( )
D
A.稀盐酸:配制 溶液 B.稀硫酸:蔗糖和淀粉的水解
C.稀硝酸:清洗附有银镜的试管 D.浓硫酸和浓硝酸的混合溶液:苯的磺化
【解析】 A(√)在水中发生水解:,配制 溶
液加入稀盐酸可以抑制 水解。
B(√)蔗糖和淀粉的水解可加入稀硫酸作催化剂。
C(√)可与稀硝酸发生反应 ,可清洗附
有银镜的试管。
D(×)苯的磺化是苯和浓硫酸共热生成苯磺酸,不需要用到浓硝酸;苯与浓硫酸和浓
硝酸的混合溶液共热可以生成硝基苯,是苯的硝化反应。
3.(2023江苏)氮及其化合物的转化具有重要应用。下列说法不正确的是( )
B
A.实验室探究稀硝酸与铜反应的气态产物:
B.工业制硝酸过程中的物质转化:
C.汽车尾气催化转化器中发生的主要反应:
D.实验室制备少量的原理:
【解析】 A(√)铜与稀硝酸反应生成气体,与反应生成 。
B(×)与在放电或高温条件下生成,但与不反应,和 一起通入水
中才能生成 。
C(√)汽车尾气有与等污染性气体,利用尾气催化转化器促进与 反应使其
转化成无毒无害的和 ,检查方程式符合原子守恒与得失电子守恒。
D(√)实验室利用氯化铵和氢氧化钙固体共热制备氨气,化学方程式为
。
4.(2023广东)1827年,英国科学家法拉第进行了 喷泉实验。在此启发下,兴趣小
组利用以下装置,进行如下实验。其中,难以达到预期目的的是( )
B
A.图1:喷泉实验 B.图2:干燥 C.图3:收集 D.图4:制备
【解析】 A(√)打开止水夹,将滴管中的水
挤压到烧瓶中, 极易溶于水,烧瓶中的压
强快速降低,烧杯中滴有酚酞的水溶液会快速
上升,从而产生喷泉。
B(×)为酸性氧化物,会与碱性气体发生反应,因此不可以用干燥 。
C(√) 极易溶于水且密度比空气小,可采用向下排空气法收集(集气瓶的导管短进
长出)。
D(√)将浓氨水倒入一侧,与反应大量放热,受热分解生成 ,
可用此装置来制备 。
5.(2023广东汕头质监)将铜丝插入浓硝酸中进行如图
(a~c是浸有相应试剂的棉花)所示的探究实验,下列分
析正确的是( )
B
A. 与浓硝酸反应,硝酸只表现出酸性,产生红棕色气
体
B. 处可观察到棉花变红后褪色
C.处观察到棉花变蓝,体现了 的还原性
D.处 能与产生的气体发生复分解反应
【解析】 铜丝与浓硝酸发生反应 ,
氮元素化合价降低,硝酸表现出氧化性和酸性。
溶于水生成硝酸,可使紫色石蕊溶液变红,而
硝酸的强氧化性又使其褪色。
溶于水生成硝酸,硝酸将氧化成, 处观察
到棉花变蓝,体现了硝酸的氧化性。
吸收尾气和生成亚硝酸钠, 元素化合
价发生变化,属于氧化还原反应。
6.(2022浙江6月选考)亚硝酸钠俗称“工业盐”,其外观、口感与食盐相似,人若误服
会中毒。现将适量某样品(成分为亚硝酸钠或氯化钠)溶于水配成溶液,分别取少量该
溶液于试管中进行实验。下列方案设计、现象和结论都正确的是( )
方案设计 现象和结论
A 先加入少量溶液,再加 溶液和足量 稀硝酸,振荡 若产生白色沉淀,则样品为亚硝
酸钠
B 加到少量 溶液中,再加硫酸酸化,振荡 若溶液褪色,则样品为亚硝酸钠
C 先加到少量 溶液中,再加入稀盐酸酸化, 振荡 若溶液变黄色,则样品为亚硝酸
钠
D 先加入少量溶液,再加入 溶液和稀 硝酸,振荡 若产生白色沉淀,则样品为亚硝
酸钠
C
【解析】 若样品为 ,按照A项的方案设计也会出现白色沉淀,因此无法判定
样品是否为亚硝酸钠。
酸性条件下高锰酸钾溶液也可以氧化电离出的,因此 溶液褪色,无
法证明样品为亚硝酸钠。
若样品为亚硝酸钠,则加入稀盐酸酸化可以生成具有氧化性的亚硝酸,亚硝酸可以
把氧化为 ,溶液变为黄色。
加入的稀具有氧化性,可以将氧化为,与 结合可以生成硫酸钡
白色沉淀,无法证明一定是亚硝酸氧化了 ,因而也无法证明样品是否为亚硝酸钠。
7.下列装置可以达到相应实验目的的有( )
A
A.1项 B.2项 C.3项 D.4项
【解析】 ①氨气密度小于空气,导管应伸入试管底部,采用向下
排空气法收集,错误。②受热分解生成和 ,降温时
和又结合生成,不但得不到 还会堵塞导管,因
此不能用加热的方法来制备,错误。③ 与浓硝酸反
应可制备,但会与 反应
,不能用排水法收集 ,应该用
向上排空气法收集,错误。④难溶于水,也不能和 溶液
反应,无法完成喷泉实验,错误。⑤受热分解生成 和
,碱石灰可以吸收并干燥,但不能使湿润的蓝色石蕊试纸变红; 可
以吸收并干燥,但不能使湿润的酚酞试纸变红,因此无法检测出和 ,
错误。正确的装置应该是碱石灰与 对调位置,才能达到实验目的。⑥二氧化氮和溴
蒸气都呈红棕色,溶于水变为无色溶液并生成无色气体, 通入水中溶
液呈橙黄色,因此能用该装置鉴别和 ,正确。
8.(2023广东深圳外国语学校模拟)研究发现“利用零价铁还
原 可脱除地下废水中的硝酸盐”。实验室利用如图装置
探究铁粉与 溶液的反应,实验步骤有如下六步:
①打开弹簧夹,缓慢通入,并保持后续反应均在 氛围中进行;
②加入已调至2.5的酸性溶液 ,一段时间后铁粉部分溶解,
溶液逐渐变为浅绿色;待铁粉不再溶解后静置,发现剩余固体表面有少量白色物质附着;
③连接好装置,并检查装置的气密性;
④检测到滤液中存在、和 ;
⑤装好药品;
⑥过滤剩余固体时,表面的白色物质变为红褐色。
回答下列问题:
(1) 实验前使用仪器 的第一步操作是_____________
_________。
检查分液漏斗是否漏液
(2) 通入并保持后续反应均在 氛围中进行的目
的是____________________________________________
_____。
排尽装置中的空气,排除空气中的氧气对实验的干扰
(3) 实验步骤的正确顺序是______________(填序号)。
(4) 白色物质是_________(填化学式)。
(5) 检验滤液中 的实验方案是____________________________________________
____________________________________________________。
③⑤①②⑥④
取一定量的滤液于试管中,加入稀硫酸,溶液中有气泡产生,且逸出的气体变为红棕色,则滤液中含有
(6) 某地下废水中的含量测定。取 废水,加入稀硫酸酸化,再加入
标准溶液(过量),充分反应后,用酸性 标
准溶液滴定剩余的,消耗酸性标准溶液的体积为 。
① 酸性标准溶液与 反应的离子方程式为______________________________
_____________。
② 该地下废水中的含量为____________(用含、、、、 的代数
式表示)。
【解析】 (1)实验前需要对分液漏斗进行检漏。(2)
反应开始一段时间后铁粉部分溶解,溶液逐渐变为浅绿
色,说明有生成,及反应生成的 易被氧化,
故通入并保持后续反应均在 氛围中进行的目的是
排尽装置中的空气,排除空气中的氧气对实验的干扰。(3)连接好装置后应先检查装
置气密性,加入实验药品,结合第(2)问分析,通入,然后发生反应(加入 酸
性溶液),过滤剩余固体,最后检测滤液中成分。故实验步骤的正确顺序为③⑤①②⑥
④。(4)反应有生成,结合实验步骤⑥中表面的白色物质 在过滤时被空
气中的氧气氧化变为红褐色可知,白色物质为 。(5)实验步骤②中
加入酸性溶液,一段时间后铁粉部分溶解,说明酸性条件下 具有强氧化性,
又滤液中含有,酸性条件下、 会反应生成
无色气体,与空气中的反应生成红棕色的 ,
故实验方案为取一定量的滤液于试管中,加入稀硫酸,
溶液中有气泡产生,且逸出的气体变为红棕色,则滤液
中含有。(6)①与 发生反应的离子方
程式为 。
向废水中加入稀硫酸后,被还原成 ,反应
的离子方程式为
,剩余的
被 氧化,发生反应
,则废
水中 的含量为
。
1.(2023辽宁丹东检测)自然界中氮循环过程如图所示,下列说法错误的是( )
D
A.反硝化过程中,含氮物质被还原
B.氨氧化过程中,与 理论物质的量
之比为
C.属于氮的固定, 发生还原反
应
D.土壤中 有利于除去水体中的铵态氮
【解析】 反硝化过程中 转化为
或, 元素化合价降低,含氮物质被
还原。
氨氧化过程中,发生归中反应
,与
理论物质的量之比为 。
将氮气转化为氮的化合物,属于氮的固定,氮元素化合价降低, 发生
还原反应。
由题图可知,土壤中能与水体中的 (硝态)反应,可以除去水体中的硝
态氮。
2.(2023广东六校联考)部分含及 物质的
分类与相应化合价关系如图所示,下列推断
不合理的是( )
B
A.可以通过的催化氧化反应制备
B.工业上通过 来制备
C.浓的溶液和浓的溶液反应可以得到
D.加热(固态钾盐)可以产生
【解析】
氨气催化氧化可生成一氧化氮:
。
工业上制 的过程为氨气催化氧化生
成一氧化氮,一氧化氮和氧气反应生成二氧
化氮,二氧化氮和水反应生成硝酸,即 。
浓溶液和浓 溶液可发生归中反应生成氯气。
。
3.(2023湖南娄底模拟)实验室用 (肼,又名联氨,常温下为无色油状液体,沸点
为,具有与氨相似的气味,有弱碱性和较强的还原性)还原 制备纳米
的装置(部分夹持及加热装置已省略)如图所示。已知:溶液与 溶液
在加热条件下反应能得到 。
下列说法不正确的是( )
D
A.装置②⑥中分别盛装浓硫酸和稀硫酸
B.无水硫酸铜由白色变为蓝色,说明从装置④出来的气体中含有水蒸气
C.装置④中发生反应的化学方程式为
D.加入反应试剂后,先打开,待装置④中反应完且冷却至室温,再打开 排尽装置
中的
【解析】
.
根据上述分析可知,装置②⑥中分别盛装浓硫酸和稀硫酸。
有较强的还原性,可能会和空气中的 反应,干扰实验,故加入反应试剂后,
应该先打开,利用①中产生的排尽装置中的空气,再关闭,再打开 ,加入
进行反应,待装置④中反应结束且冷却至室温后,关闭打开 ,利用①中产生
的排尽装置中的 。
4.(2023湖北武汉洪山中学模拟)实验室可利用与反应制备亚硝酰氯 ,装置
如图。已知亚硝酰氯的沸点为 ,遇水生成一种氯化物和两种氮的常见氧化物,其
中一种呈红棕色。下列说法错误的是( )
C
A. 装置的优点是随开随用,随关随停
B.若无装置, 中可能发生反应:
C.装入药品打开后,应先打开再打开
D. 中冰盐水的作用是冷凝并收集亚硝酰氯
【解析】 打开时, 装置中稀硝酸与铜丝
接触生成,关闭后,生成的 将稀硝酸压入
左侧,使铜丝与稀硝酸脱离,反应停止,从而实现
随开随用,随关随停。
中生成的中有水蒸气,若不通过进行干燥,水蒸气会进入 中与生成的亚硝
酰氯发生反应生成、和 。
装入药品打开后,应先打开,待氯气将装置中的空气排尽后再打开 ,否则
会与空气中的氧气发生反应。
亚硝酰氯的沸点为 ,用冰盐水有利于产物的冷凝收集。
5.(2023广东六校联考) 可用于面粉的漂白和
杀菌。已知: 为黄色油状液体,熔点为
,沸点为, 以上易爆炸。实验室
可用和溶液反应制取 ,实验装置如下:
(1) 三卤化氮分子的空间结构与相似,热稳定性比强的 有_____。
在热水中易水解,反应液有漂白性,写出 水解的化学方程式:_________________
________________________________________________________________________。
(2) 试剂 为________;仪器D的作用是_______________________________________
_________。
吸收尾气、,防止空气中水蒸气进入使水解
(3) 向蒸馏烧瓶内的溶液中通入过量 ,B中反应的化学
方程式为____________________________,
待反应至油状液体不再增加,关闭装置A、B间的止水夹,控制水
(或)
浴加热的温度范围为________________________________,将产品 蒸出。
待反应结束,为测定溶液中残留的 的物质的量浓度,进行如下操作:
ⅰ.取蒸馏烧瓶中的反应液,加入过量饱和 溶液充分反应后,再加入过
量的 溶液,微热;
ⅱ.用的稀硫酸吸收产生的 ,得到溶液A;
ⅲ.用的标准液滴定溶液A至滴定终点,消耗 标准液。
(4) 滴定至终点时溶液中溶质仅有 和
,用含的代数式表示溶液中残留的
的物质的量浓度为________ 。
(5) 为减小误差,滴定时最适宜的指示剂为___(填标号)。
.酚酞 .甲基橙
.石蕊 .淀粉溶液
【解析】 .
(1)卤族元素的非金属性越强,三卤化氮中氮卤键的键长越短,键能越大,分子的热稳
定性越强,故三氟化氮的热稳定性强于三氯化氮;由题意可知,三氯化氮在热水中水解
生成的漂白性物质为次氯酸,结合原子守恒可知,还生成氨气,故反应的化学方程式为
。
(3)装置B中氯气与氯化铵溶液在水浴加热条件下反应生成三氯化氮和 ;由题给信
息可知,实验时,为保证三氯化氮顺利蒸出,同时防止三氯化氮发生爆炸,水浴加热的
温度应控制在 之间。
(4)由题意可知,操作ⅰ中,操作ⅱ中 ,
操作ⅲ中,滴定过程中消耗 氢氧化钠标准液,则
用于吸收氨气的 的物质的量为
, 由氮原子守恒可知,溶液中残留的三氯化氮的物质的量浓度为
。
(5)由题目信息可知,滴定终点时溶液因 水解显酸性,因此为减小误差,
滴定时最适宜的指示剂为甲基橙(变色范围为 )。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
