化学反应原理综合 -2025年高考化学考向分析(共44张PPT)
文档属性
| 名称 | 化学反应原理综合 -2025年高考化学考向分析(共44张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-27 19:18:01 | ||
图片预览










文档简介
(共44张PPT)
2025年高考化学考向分析
化学反应原理综合
1.(2023新课标)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回
答下列问题:
(1) 根据图1数据计算反应的_____ 。
图2 反应机理
(2) 研究表明,合成氨反应在 催化剂上可能通过图2机理
进行表示催化剂表面吸附位, 表示被吸附于催化剂表面
的 。判断上述反应机理中,速率控制步骤(即速率最慢步
骤)为_______(填步骤前的标号),理由是______________
_____________________________________________。
(ⅱ)
氮氮三键的键能比氢氢单键的键能大,使其断裂需要的能量最多
(3) 合成氨催化剂前驱体(主要成分为)使用前经还原,生成 包裹的
。已知属于立方晶系, 晶胞参数,密度为。则
晶胞中含
有的原子数为__________(列出计算式,阿伏加德罗常数的值为 )。
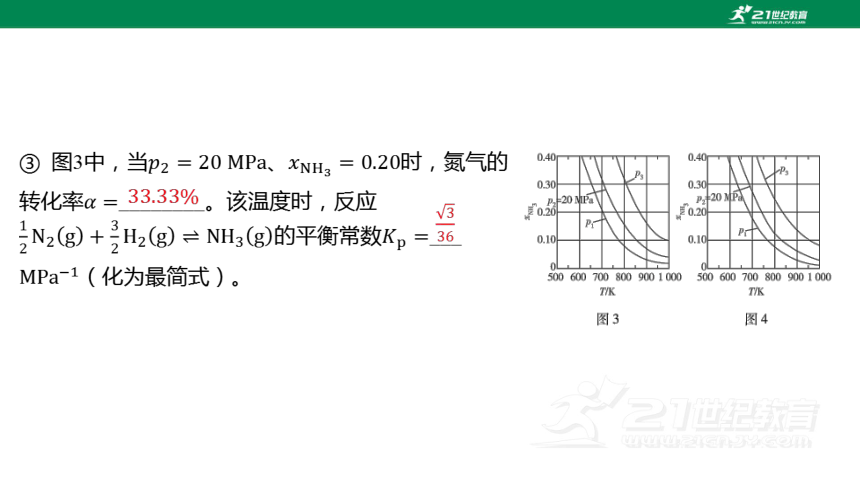
(4) 在不同压强下,以两种不同组成进料,反应达平
衡时氨的摩尔分数与温度的计算结果如图所示。其中一
种进料组成为、 ,另一种为
、、。(物质 的摩尔
分数: )
① 图中压强由小到大的顺序为_____________,判断的依据是______________________
____________________________________________________________________________
___________。
合成氨的反应为气体分子数减小的反应,增大压强使其平衡正向移动,温度相同时,压强越大,平衡时氨的摩尔分数越大
② 进料组成中含有惰性气体 的图是_____。
图4
③ 图3中,当、 时,氮气的
转化率 ________。该温度时,反应
的平衡常数 ___
(化为最简式)。
【解析】 (1)可利用公式“ 断裂旧键吸收的总能量-形
成新键释放的总能量”来计算该反应的反应热,结合能量转换
关系图列式得 。
(2)分析题图1可知,断裂中键所需要吸收的能量是,因此 键的
键能为;断裂中键所需要吸收的能量是,因此
键的键能为 。在化学反应中,最大能垒的步骤为速率控制步骤,结合题图
2可知,(ⅱ)是在催化剂表面断键的步骤,由于键的键能比 键的键能大,使
其断裂需要的能量最多,因此速率控制步骤为(ⅱ)。
(3)已知属于立方晶系,晶胞参数 ,密度
为,设其晶胞中含有的原子数为 ,利用密度
公
式计算晶体密度 ,解得
。(4)①合成氨反应为
,反应后气体分子总数减小,因
此压强增大有利于平衡正向移动(口诀:小压大移),即压
强越大平衡时氨的摩尔分数越大。在相同温度下,反应达平
衡时氨的摩尔分数: ,因此压强由小到大的顺
序为 。
②题图3与题图4有四个变量:温度、压强、反应达平衡时氨
的摩尔分数、不同组成进料,因此在解题时需要控制变量,
取题图3和题图4相同温度(如)和相同压强(如 )进
行比较。在同温同压下加入惰性气体 ,可视为反应气体减
压(【点拨】总压不变的条件下,加入,反应物和 的
分压皆降低,效果等同反应气体减压),平衡向气体分子数
增大的方向移动,即逆向移动(口诀:小压大移),则反应
达平衡时氨的摩尔分数降低。对比题图3与题图4可发现,在
、 条件下,题图4对应的平衡时氨的摩尔分数较小,
因此进料组成中含有惰性气体 的图是题图4。
③题图3中,进料组成为、 (注意:题
图3对应的没有惰性气体), 。假设进
料中氢气和氮气的物质的量分别为和 ,达到平衡
时氮气的变化量为 ,则有:
根据题目 列式求解,
,解得 ,因此氮气
的转化率 。
平衡时、、的物质的量分别为、、 ,
平衡时、、的物质的量分数分别为、、 ,因此该
温度时反应 的平衡常
数 。
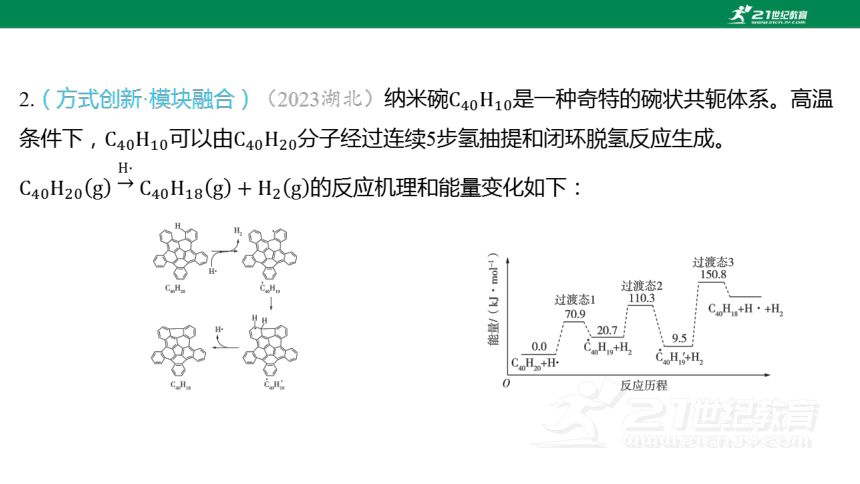
2.(方式创新·模块融合)(2023湖北)纳米碗 是一种奇特的碗状共轭体系。高温
条件下,可以由 分子经过连续5步氢抽提和闭环脱氢反应生成。
的反应机理和能量变化如下:
回答下列问题:
(1) 已知中的碳氢键和碳碳键的键能分别为 和
,键能为。估算 的
_____ 。
128
(2) 图示历程包含___个基元反应,其中速率最慢的是第___个。
(3) 纳米碗中五元环和六元环结构的数目分别为___、____。
3
3
6
10
(4) 时,假定体系内只有反应 发生,反应过程
中压强恒定为(即的初始压强),平衡转化率为 ,该反应的平衡常数 为
________(用平衡分压代替平衡浓度计算,分压 总压×物质的量分数)。
(5) 及
反应的( 为平衡常数)
随温度倒数的关系如图所示。已知本实验条件下,
(为理想气体常数, 为截距)。图中两条
线几乎平行,从结构的角度分析其原因是_________________
____________________________。
反应前后化学键的变化相同,反应热近似相等
(6) 下列措施既能提高反应物的平衡转化率,又能增大生成 的反应速率的是__
(填标号)。
.升高温度.增大压强 .加入催化剂
【解析】 .
(1)分析题图可知,图示历程包含3个基元反应:第一步基元反应
断裂1个碳氢键,生成1个 键;第二步基元反应
生成1个碳碳单键,断裂1个碳碳 键;第三步基元反应
断裂1个碳氢键,生成1个碳碳 键。整体分析可知
反应 发生的过程中相当于断裂2个碳氢键、生成1个
键和1个碳碳单键,所以总反应 的
。
(2)活化能越大,反应速率越慢,第三步基元反应活化能最大,因此反应速率最慢。
(3)分析 的结构可知其含有1个五元环、10个六元环,每脱两个氢形成一个五元
环,则 总共含有6个五元环、10个六元环。
(4)设反应物的初始投料量为,平衡转化率为 ,列三段式进行计算,如
下:
平衡总物质的量为
则、、 ,该反应的平衡常数
。
(5),可知两条线的斜率为 ,两条线几乎平行,
说明斜率几乎相等,由于 为理想气体常数,斜率几乎相等则表示焓变几乎相等,这是
因为在反应过程中,断裂和形成的化学键相同,因此反应热 近似相等。
(【杰哥补充】由题目所给的反应机理可知, 反应前后
键的变化是生成1个碳碳单键与断掉1个碳氢键,可以推知
反应前后键的变化也是生成1个碳碳单键与断掉1个碳氢
键)
(6)分析题目所给的反应历程图可知, 为吸热反应,
可推知生成 的反应也是吸热反应,因此温度升高,可以使平衡正向移动,既可以
提高平衡转化率也可以增加反应速率,符合题意。
分析题给反应,可推知生成 的反应是气体分
子数之和增大的反应,加压虽然可以提高反应速率,但加压会使平衡逆向移动,降低反
应物的平衡转化率,不符合题意。
加入催化剂,平衡不移动,不能提高平衡转化率,不符合题意。
3.(2023山东)一定条件下,水气变换反应的中间产物是 。
为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
Ⅰ. (快)
Ⅱ. (慢)
研究发现,在反应Ⅰ、Ⅱ中, 仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为
反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
回答下列问题:
(1) 一定条件下,反应Ⅰ、Ⅱ的焓变分别为、 ,则该条件下水气变换反应的焓变
___________(用含、 的代数式表示)。
(2) 反应Ⅰ正反应速率方程为,为反应速率常数。 温度下,
电离平衡常数为,当平衡浓度为时,浓度为______ ,
此时反应Ⅰ正反应速率________(用含、和 的代数式表示)。
(3) 温度下,在密封石英管内完全充满
水溶液,使 分解,分解产物均完
全溶于水。含碳物种浓度与反应时间的变化关系如图所示
(忽略碳元素的其他存在形式)。时刻测得、 的
浓度分别为、 ,反应Ⅱ达平衡时,
测得的浓度为。体系达平衡后 _____
(用含 的代数式表示,下同),反应Ⅱ的平衡常数为_ ___。
相同条件下,若反应起始时溶液中同时还含有盐酸,则图示点、、、 中,
新的浓度峰值点可能是___(填标号)。与不含盐酸相比,达浓度峰值时, 浓度
______(填“增大”“减小”或“不变”), 的值______(填“增大”“减小”或“不变”)。
减小
不变
【解析】 (1)根据盖斯定律,反应Ⅱ-反应Ⅰ 水气变换反
应,故水气变换反应的焓变 。
(2)温度时, 建立电离平衡,则:
,由于
,因此 。
。
(3)分析题图可知,在时 浓度最高,由于反应Ⅰ速率
远大于反应Ⅱ,可知在 时速
率极快的反应Ⅰ达到平衡,且反应Ⅰ的平衡常数
,之后反应速率较慢的
反应Ⅱ逐渐消耗,由于在温度 下为定值,
因此 浓度会逐渐降低。反应起始时充满
水溶液,时 、
,根据元素质量守恒可知,水溶液
中含C元素的粒子总浓度为,因此 时
, 反
应Ⅰ的平衡常数 ,且根
据题目信息“近似认为反应Ⅰ建
立平衡后始终处于平衡状态”,因此在后 浓度始终是
浓度的5倍。当反应Ⅱ达平衡时,
,根据元素质量守恒可知,
此时,且 是
的5倍,因此 、
, ;反
应Ⅱ的平衡常数
。根据题目信息“ 仅对反
应Ⅰ有催化加速作用”,因此
加入 盐酸后,反应Ⅰ的反应速率增加,因此可
以在更短时间达到平衡,因此排除和 ,催化剂不影响平衡
移动,故的浓度峰值不变,为点。由图可知, 达新
的浓度峰值时,浓度减小;温度相同 不变,因此
不变。
1.(2022山东潍坊二模)以 和焦炭为原料的炼铁工业会产生大量的碳氧化物,研究
碳氧化物的转化对“双碳”目标的实现具有重要意义。实验室模拟炼铁过程,并在一定条
件下完成的转化。测得 时相关变化及数据如图1、2所示。回答下列问题:
炼铁工业:
图1
图2 相关的热力学数据
图 3
已知:反应 ,
(1) 在密闭容器中加入和焦炭(容器中与 的体
积比为),发生反应,初始压强为,经 达
平衡时完全反应,该体系总压为,计算
时间段内用 压强变化表示的平均反应速率为____
4
不变
,反应Ⅲ的___。保持其他条件不变,向体系中充入一定量 ,平衡
后 ______(填“增大”“减小” 或“不变”)。
(2) 时,反应Ⅱ、Ⅲ的 分别为
、 ,则反应
的 _____________
______,该温度下的标准焓 ___________
。
(3) 时,向 的恒容密闭容器中充入一定量炼铁生
产中经纯化处理后得到的,再通入一定量 ,使初始压
强为 。在催化条件下发生反应:
。反应达到平衡时,
的分压
与起始时 的关系如图3所示。
① 当时,反应达到平衡后,若再向容器中通入和 ,使二者分压
均增大,则达到新平衡时, 的平衡转化率将______(填“增大”“减小”或“不
变”)。
增大
② 当时,反应达到平衡状态后, 的分压可能对应图像中的点___
(填“D”“”或“ ”)。
【解析】 (1)起始时与的体积比为,体系总压为 ,则
、,经达平衡时 完全反应,平衡时气体成分为
、和,根据反应Ⅱ的 ,则平衡时
,根据平衡时体系总压为 ,则平衡时
,用 压强变化表示的平均反应速率为
。反应Ⅲ 的
。保持其他条件不变,向体系中充入一定量 ,根据反
应Ⅰ的不变,则平衡后 不变。(2)反应Ⅱ为
,反应Ⅲ为
。根据盖斯定律,由反应Ⅱ 反应
Ⅲ,可得
。根据 生成物总能
量-反应物总能量,反应 的
,则。(3)①当 时,设起始时
,,初始压强为,则 、
,平衡时 ,根据恒温、恒容时气体的压强之比等
于气体物质的量之比,,解得 ,列三段式:
则平衡时、 、
、,故 。反
应达到平衡后,若再向容器中通入和,使二者分压均增大 ,
,平衡正向移动, 的平衡转化率增大。②
当反应物按化学计量数之比投料,达到平衡时生成物的百分含量最大,当 时,
达到平衡后,的分压应小于C点,故可能是图像中的 点。
2.(2023广东六校联考)氨的催化氧化反应是硝酸工业中的重要反应,某条件下 与
作用时可发生如下3个反应:
Ⅰ.
Ⅱ.
Ⅲ.
已知: 时,相关物质的焓的数据如图1。
(1) 根据相关物质的焓计算________ 。
(2) 将一定比例的、和 的混合气体以一
定流速通过装有催化剂的反应管, 的转化率、
生成 的选择性与温度的关系如图2所示。
① 除去工业尾气中的 适宜的温度为_________
____________________________。
左右(范围内都对)
② 随着温度的升高, 的选择性下降的原因可能
催化剂对生成的反应活性下降,副反应的速率变大
为_________________________________________________。
(3) 在一定温度下,氨气溶于水的过程及其平衡常数为:
其中为的平衡压强,为 在水溶液中的平衡浓度。
设氨气在水中的溶解浓度,则用、和
表示 的代数式为______________。
(4) 为了探究大气中对和 反应的影响,图3
和图4展示了无与有 存在时反应过程的相关构型,
下表中列出了相关构型的相对能量。
构型A 构型B 构型C 构型D
相对能量/ 0 33.70
构型 构型 构型 构型
相对能量/ 0 25.48
① 无 存在时的决速步骤为_______。
步骤3
② 对比图3与图4, 的功能为____________________
_________________________________________________
_____。
与和之间形成氢键,活化了键,降低了反应活化能,总体作为催化剂
【解析】 (1) 生成物总焓-反应物总焓,结合题图
1可知, 。
(2)①由题图2可知,随着温度的升高,氨气的转化率增大,当温度高于 时,氨气的转化率变化不大,
随着温度的升高,氮气的选择性降低,综合考虑温度应
该控制在范围内。(3)由
可得 ,根据题给化学方程式可知,
,由于 ,故
,所以 ,
,则
。(4)①由题图
3及表中数据可知,构型B转化为构型C的活化能最大,
则步骤3反应速率最慢,是无 存在时的决速步骤。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
2025年高考化学考向分析
化学反应原理综合
1.(2023新课标)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回
答下列问题:
(1) 根据图1数据计算反应的_____ 。
图2 反应机理
(2) 研究表明,合成氨反应在 催化剂上可能通过图2机理
进行表示催化剂表面吸附位, 表示被吸附于催化剂表面
的 。判断上述反应机理中,速率控制步骤(即速率最慢步
骤)为_______(填步骤前的标号),理由是______________
_____________________________________________。
(ⅱ)
氮氮三键的键能比氢氢单键的键能大,使其断裂需要的能量最多
(3) 合成氨催化剂前驱体(主要成分为)使用前经还原,生成 包裹的
。已知属于立方晶系, 晶胞参数,密度为。则
晶胞中含
有的原子数为__________(列出计算式,阿伏加德罗常数的值为 )。
(4) 在不同压强下,以两种不同组成进料,反应达平
衡时氨的摩尔分数与温度的计算结果如图所示。其中一
种进料组成为、 ,另一种为
、、。(物质 的摩尔
分数: )
① 图中压强由小到大的顺序为_____________,判断的依据是______________________
____________________________________________________________________________
___________。
合成氨的反应为气体分子数减小的反应,增大压强使其平衡正向移动,温度相同时,压强越大,平衡时氨的摩尔分数越大
② 进料组成中含有惰性气体 的图是_____。
图4
③ 图3中,当、 时,氮气的
转化率 ________。该温度时,反应
的平衡常数 ___
(化为最简式)。
【解析】 (1)可利用公式“ 断裂旧键吸收的总能量-形
成新键释放的总能量”来计算该反应的反应热,结合能量转换
关系图列式得 。
(2)分析题图1可知,断裂中键所需要吸收的能量是,因此 键的
键能为;断裂中键所需要吸收的能量是,因此
键的键能为 。在化学反应中,最大能垒的步骤为速率控制步骤,结合题图
2可知,(ⅱ)是在催化剂表面断键的步骤,由于键的键能比 键的键能大,使
其断裂需要的能量最多,因此速率控制步骤为(ⅱ)。
(3)已知属于立方晶系,晶胞参数 ,密度
为,设其晶胞中含有的原子数为 ,利用密度
公
式计算晶体密度 ,解得
。(4)①合成氨反应为
,反应后气体分子总数减小,因
此压强增大有利于平衡正向移动(口诀:小压大移),即压
强越大平衡时氨的摩尔分数越大。在相同温度下,反应达平
衡时氨的摩尔分数: ,因此压强由小到大的顺
序为 。
②题图3与题图4有四个变量:温度、压强、反应达平衡时氨
的摩尔分数、不同组成进料,因此在解题时需要控制变量,
取题图3和题图4相同温度(如)和相同压强(如 )进
行比较。在同温同压下加入惰性气体 ,可视为反应气体减
压(【点拨】总压不变的条件下,加入,反应物和 的
分压皆降低,效果等同反应气体减压),平衡向气体分子数
增大的方向移动,即逆向移动(口诀:小压大移),则反应
达平衡时氨的摩尔分数降低。对比题图3与题图4可发现,在
、 条件下,题图4对应的平衡时氨的摩尔分数较小,
因此进料组成中含有惰性气体 的图是题图4。
③题图3中,进料组成为、 (注意:题
图3对应的没有惰性气体), 。假设进
料中氢气和氮气的物质的量分别为和 ,达到平衡
时氮气的变化量为 ,则有:
根据题目 列式求解,
,解得 ,因此氮气
的转化率 。
平衡时、、的物质的量分别为、、 ,
平衡时、、的物质的量分数分别为、、 ,因此该
温度时反应 的平衡常
数 。
2.(方式创新·模块融合)(2023湖北)纳米碗 是一种奇特的碗状共轭体系。高温
条件下,可以由 分子经过连续5步氢抽提和闭环脱氢反应生成。
的反应机理和能量变化如下:
回答下列问题:
(1) 已知中的碳氢键和碳碳键的键能分别为 和
,键能为。估算 的
_____ 。
128
(2) 图示历程包含___个基元反应,其中速率最慢的是第___个。
(3) 纳米碗中五元环和六元环结构的数目分别为___、____。
3
3
6
10
(4) 时,假定体系内只有反应 发生,反应过程
中压强恒定为(即的初始压强),平衡转化率为 ,该反应的平衡常数 为
________(用平衡分压代替平衡浓度计算,分压 总压×物质的量分数)。
(5) 及
反应的( 为平衡常数)
随温度倒数的关系如图所示。已知本实验条件下,
(为理想气体常数, 为截距)。图中两条
线几乎平行,从结构的角度分析其原因是_________________
____________________________。
反应前后化学键的变化相同,反应热近似相等
(6) 下列措施既能提高反应物的平衡转化率,又能增大生成 的反应速率的是__
(填标号)。
.升高温度.增大压强 .加入催化剂
【解析】 .
(1)分析题图可知,图示历程包含3个基元反应:第一步基元反应
断裂1个碳氢键,生成1个 键;第二步基元反应
生成1个碳碳单键,断裂1个碳碳 键;第三步基元反应
断裂1个碳氢键,生成1个碳碳 键。整体分析可知
反应 发生的过程中相当于断裂2个碳氢键、生成1个
键和1个碳碳单键,所以总反应 的
。
(2)活化能越大,反应速率越慢,第三步基元反应活化能最大,因此反应速率最慢。
(3)分析 的结构可知其含有1个五元环、10个六元环,每脱两个氢形成一个五元
环,则 总共含有6个五元环、10个六元环。
(4)设反应物的初始投料量为,平衡转化率为 ,列三段式进行计算,如
下:
平衡总物质的量为
则、、 ,该反应的平衡常数
。
(5),可知两条线的斜率为 ,两条线几乎平行,
说明斜率几乎相等,由于 为理想气体常数,斜率几乎相等则表示焓变几乎相等,这是
因为在反应过程中,断裂和形成的化学键相同,因此反应热 近似相等。
(【杰哥补充】由题目所给的反应机理可知, 反应前后
键的变化是生成1个碳碳单键与断掉1个碳氢键,可以推知
反应前后键的变化也是生成1个碳碳单键与断掉1个碳氢
键)
(6)分析题目所给的反应历程图可知, 为吸热反应,
可推知生成 的反应也是吸热反应,因此温度升高,可以使平衡正向移动,既可以
提高平衡转化率也可以增加反应速率,符合题意。
分析题给反应,可推知生成 的反应是气体分
子数之和增大的反应,加压虽然可以提高反应速率,但加压会使平衡逆向移动,降低反
应物的平衡转化率,不符合题意。
加入催化剂,平衡不移动,不能提高平衡转化率,不符合题意。
3.(2023山东)一定条件下,水气变换反应的中间产物是 。
为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
Ⅰ. (快)
Ⅱ. (慢)
研究发现,在反应Ⅰ、Ⅱ中, 仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为
反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
回答下列问题:
(1) 一定条件下,反应Ⅰ、Ⅱ的焓变分别为、 ,则该条件下水气变换反应的焓变
___________(用含、 的代数式表示)。
(2) 反应Ⅰ正反应速率方程为,为反应速率常数。 温度下,
电离平衡常数为,当平衡浓度为时,浓度为______ ,
此时反应Ⅰ正反应速率________(用含、和 的代数式表示)。
(3) 温度下,在密封石英管内完全充满
水溶液,使 分解,分解产物均完
全溶于水。含碳物种浓度与反应时间的变化关系如图所示
(忽略碳元素的其他存在形式)。时刻测得、 的
浓度分别为、 ,反应Ⅱ达平衡时,
测得的浓度为。体系达平衡后 _____
(用含 的代数式表示,下同),反应Ⅱ的平衡常数为_ ___。
相同条件下,若反应起始时溶液中同时还含有盐酸,则图示点、、、 中,
新的浓度峰值点可能是___(填标号)。与不含盐酸相比,达浓度峰值时, 浓度
______(填“增大”“减小”或“不变”), 的值______(填“增大”“减小”或“不变”)。
减小
不变
【解析】 (1)根据盖斯定律,反应Ⅱ-反应Ⅰ 水气变换反
应,故水气变换反应的焓变 。
(2)温度时, 建立电离平衡,则:
,由于
,因此 。
。
(3)分析题图可知,在时 浓度最高,由于反应Ⅰ速率
远大于反应Ⅱ,可知在 时速
率极快的反应Ⅰ达到平衡,且反应Ⅰ的平衡常数
,之后反应速率较慢的
反应Ⅱ逐渐消耗,由于在温度 下为定值,
因此 浓度会逐渐降低。反应起始时充满
水溶液,时 、
,根据元素质量守恒可知,水溶液
中含C元素的粒子总浓度为,因此 时
, 反
应Ⅰ的平衡常数 ,且根
据题目信息“近似认为反应Ⅰ建
立平衡后始终处于平衡状态”,因此在后 浓度始终是
浓度的5倍。当反应Ⅱ达平衡时,
,根据元素质量守恒可知,
此时,且 是
的5倍,因此 、
, ;反
应Ⅱ的平衡常数
。根据题目信息“ 仅对反
应Ⅰ有催化加速作用”,因此
加入 盐酸后,反应Ⅰ的反应速率增加,因此可
以在更短时间达到平衡,因此排除和 ,催化剂不影响平衡
移动,故的浓度峰值不变,为点。由图可知, 达新
的浓度峰值时,浓度减小;温度相同 不变,因此
不变。
1.(2022山东潍坊二模)以 和焦炭为原料的炼铁工业会产生大量的碳氧化物,研究
碳氧化物的转化对“双碳”目标的实现具有重要意义。实验室模拟炼铁过程,并在一定条
件下完成的转化。测得 时相关变化及数据如图1、2所示。回答下列问题:
炼铁工业:
图1
图2 相关的热力学数据
图 3
已知:反应 ,
(1) 在密闭容器中加入和焦炭(容器中与 的体
积比为),发生反应,初始压强为,经 达
平衡时完全反应,该体系总压为,计算
时间段内用 压强变化表示的平均反应速率为____
4
不变
,反应Ⅲ的___。保持其他条件不变,向体系中充入一定量 ,平衡
后 ______(填“增大”“减小” 或“不变”)。
(2) 时,反应Ⅱ、Ⅲ的 分别为
、 ,则反应
的 _____________
______,该温度下的标准焓 ___________
。
(3) 时,向 的恒容密闭容器中充入一定量炼铁生
产中经纯化处理后得到的,再通入一定量 ,使初始压
强为 。在催化条件下发生反应:
。反应达到平衡时,
的分压
与起始时 的关系如图3所示。
① 当时,反应达到平衡后,若再向容器中通入和 ,使二者分压
均增大,则达到新平衡时, 的平衡转化率将______(填“增大”“减小”或“不
变”)。
增大
② 当时,反应达到平衡状态后, 的分压可能对应图像中的点___
(填“D”“”或“ ”)。
【解析】 (1)起始时与的体积比为,体系总压为 ,则
、,经达平衡时 完全反应,平衡时气体成分为
、和,根据反应Ⅱ的 ,则平衡时
,根据平衡时体系总压为 ,则平衡时
,用 压强变化表示的平均反应速率为
。反应Ⅲ 的
。保持其他条件不变,向体系中充入一定量 ,根据反
应Ⅰ的不变,则平衡后 不变。(2)反应Ⅱ为
,反应Ⅲ为
。根据盖斯定律,由反应Ⅱ 反应
Ⅲ,可得
。根据 生成物总能
量-反应物总能量,反应 的
,则。(3)①当 时,设起始时
,,初始压强为,则 、
,平衡时 ,根据恒温、恒容时气体的压强之比等
于气体物质的量之比,,解得 ,列三段式:
则平衡时、 、
、,故 。反
应达到平衡后,若再向容器中通入和,使二者分压均增大 ,
,平衡正向移动, 的平衡转化率增大。②
当反应物按化学计量数之比投料,达到平衡时生成物的百分含量最大,当 时,
达到平衡后,的分压应小于C点,故可能是图像中的 点。
2.(2023广东六校联考)氨的催化氧化反应是硝酸工业中的重要反应,某条件下 与
作用时可发生如下3个反应:
Ⅰ.
Ⅱ.
Ⅲ.
已知: 时,相关物质的焓的数据如图1。
(1) 根据相关物质的焓计算________ 。
(2) 将一定比例的、和 的混合气体以一
定流速通过装有催化剂的反应管, 的转化率、
生成 的选择性与温度的关系如图2所示。
① 除去工业尾气中的 适宜的温度为_________
____________________________。
左右(范围内都对)
② 随着温度的升高, 的选择性下降的原因可能
催化剂对生成的反应活性下降,副反应的速率变大
为_________________________________________________。
(3) 在一定温度下,氨气溶于水的过程及其平衡常数为:
其中为的平衡压强,为 在水溶液中的平衡浓度。
设氨气在水中的溶解浓度,则用、和
表示 的代数式为______________。
(4) 为了探究大气中对和 反应的影响,图3
和图4展示了无与有 存在时反应过程的相关构型,
下表中列出了相关构型的相对能量。
构型A 构型B 构型C 构型D
相对能量/ 0 33.70
构型 构型 构型 构型
相对能量/ 0 25.48
① 无 存在时的决速步骤为_______。
步骤3
② 对比图3与图4, 的功能为____________________
_________________________________________________
_____。
与和之间形成氢键,活化了键,降低了反应活化能,总体作为催化剂
【解析】 (1) 生成物总焓-反应物总焓,结合题图
1可知, 。
(2)①由题图2可知,随着温度的升高,氨气的转化率增大,当温度高于 时,氨气的转化率变化不大,
随着温度的升高,氮气的选择性降低,综合考虑温度应
该控制在范围内。(3)由
可得 ,根据题给化学方程式可知,
,由于 ,故
,所以 ,
,则
。(4)①由题图
3及表中数据可知,构型B转化为构型C的活化能最大,
则步骤3反应速率最慢,是无 存在时的决速步骤。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
