化学反应的方向 化学反应的调控 -2025年高考化学考向分析(共52张PPT)
文档属性
| 名称 | 化学反应的方向 化学反应的调控 -2025年高考化学考向分析(共52张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-27 19:19:28 | ||
图片预览










文档简介
(共52张PPT)
2025年高考化学考向分析
化学反应的方向
化学反应的调控
化学反应进行的方向
1.(2022浙江1月选考) 型强电解质在水中的溶解(可视作特殊的化学反应)表示为
,其焓变和熵变分别为和。对于不同组成的 型强电
解质,下列说法正确的是( )
D
A.和均大于零 B.和 均小于零
C.可能大于零或小于零,大于零 D.和 均可能大于零或小于零
【解析】 强电解质溶于水放热,,强电解质 溶于水吸热,
。
型强电解质固体溶于水转化为离子,混乱度增加,但离子在水中存在水合
过程,使水的混乱度下降,所以整个溶解过程的熵变取决于固体转化为离子的熵增和水
合过程的熵减两个作用的相对大小,若前者占主导,则溶解过程熵增,反之熵减。
2.(2021浙江6月选考)相同温度和压强下,关于物质熵的大小比较,合理的是( )
B
A.
B.
C.
D.(,金刚石)( ,石墨)
【解析】 相同条件下,的原子个数多于 ,故熵:
。
相同条件下,同一物质的物质的量越大,其熵越大,即熵:
。
等量的同一物质不同状态时的熵:固态 液态 气态,即熵:
。
石墨与金刚石互为同素异形体,由晶体结构可知,金刚石有着更为有序的原子结
构,其熵较低,即熵:(,金刚石)( ,石墨)。
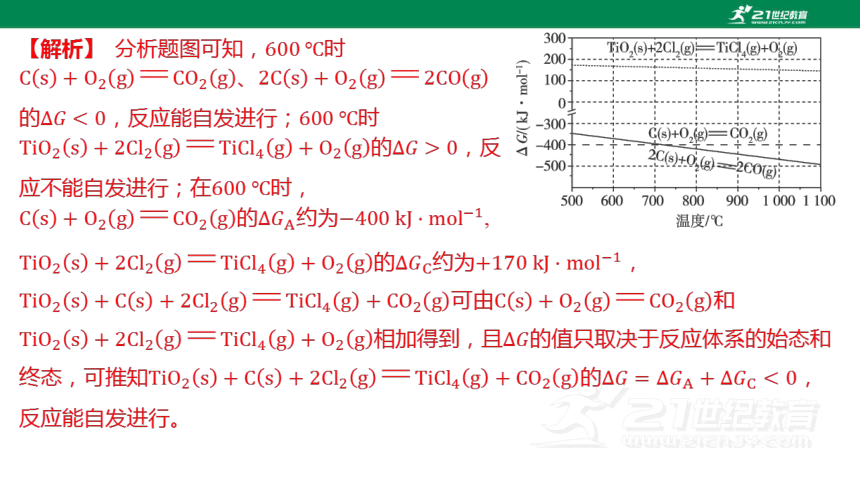
3.(2022湖南)已知, 的值只取决于反应体系的始态和终态,忽略
、随温度的变化。若,则该反应可以自发进行。根据下图判断: 时,下
列反应不能自发进行的是( )
C
A.
B.
C.
D.
【解析】 分析题图可知, 时
、
的,反应能自发进行; 时
的 ,反
应不能自发进行;在 时,
的约为 ,
的约为 ,
可由 和
相加得到,且 的值只取决于反应体系的始态和
终态,可推知的 ,
反应能自发进行。
4.(2021湖南)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可
通过氨热分解法制氢气。相关化学键的键能数据如表所示:
化学键
键能 946 436.0 390.8
一定温度下,利用催化剂将分解为和 。
(1) 反应_______ 。
(2) 已知该反应的 ,在下列哪些温度下反应能自发进行?
_____(填标号)。
CD
A. B. C. D.
【解析】 (1)根据 反应物的键能总和-生成物的键能总和,可知反应
的 。
(2)
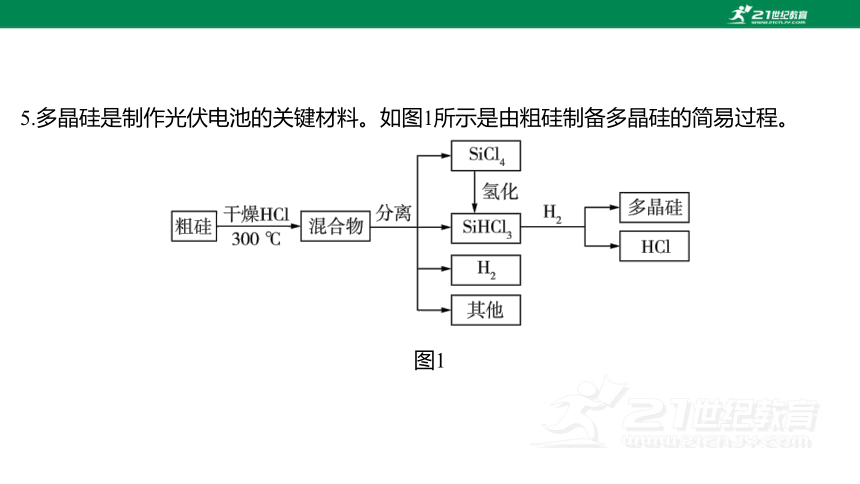
5.多晶硅是制作光伏电池的关键材料。如图1所示是由粗硅制备多晶硅的简易过程。
图1
回答下列问题:
Ⅰ.硅粉与在时反应生成气体和,放出 热量,该反应的热化学
方程式为_ _____________________________________________________。 的电子
式为_ _______。
Ⅱ.将氢化为 有三种方法,对应的反应依次为:
①
②
③
(1) 氢化过程中所需的高纯度可用惰性电极电解溶液制备,写出产生 的电极
名称______(填“阳极”或“阴极”),该电极反应式为__________________________。
阴极
(2) 已知体系自由能变,时反应自发进行。三个氢化反应的
与温度的关系如图2所示,可知:反应①能自发进行的最低温度是_________;相同温度下,反
应②比反应①的 小,主要原因是______________________________。
,导致反应②的小
图2
图3
(3) 不同温度下反应②中 转化率如图3所示。下列
叙述正确的是_____(填序号)。
、
点:
.点 点
.反应适宜温度:
(4) 反应③的___________(用、 表示)。
温度升高,反应③的平衡常数 ______(填“增大”“减小”或
“不变”)。
减小
(5) 由粗硅制备多晶硅过程中循环使用的物质除、和 外,还有_________
(填分子式)。
、
【解析】 Ⅰ.反应物为固态、气态,生成物是气态的和 ,反应条件是
,配平时将 的化学计量数定为1,由此写出热化学方程式:
。中与1个 、3个
分别形成共价单键,每个周围补上电子以满足8电子稳定结构,故 的电子式
为 。
Ⅱ.
(1)用惰性电极电解溶液,在阳极放电生成 ,电极反应式为
;在阴极不反应,放电生成 ,电极反应式为
(用惰性电极电解溶液等同电解,阴极生成 、
阳极生成)。(2)由题图可以看出,温度达到以上反应①的 才会小于0,
因此反应①能自发进行的最低温度是 。反应①反应前后的气体分子数不变,可
知反应①的变化很小(不同物质的是不同的,但是气体物质的量如果有变化则 变
化较大);反应②反应前后气体分子数减小,,单从 来看,在同温条件下反
应②的应该偏大,但实际情况是反应②比反应①的 小,原因就是反应①的
、反应②的,导致在相同温度下,反应②比反应①的 小。
(3)题图3是经典的转化率对温度的关系图,在较低温度时,反应速率较慢,在给定的
时间内未达到平衡,所以温度越高,反应速率越快,相同时间内 的转化率增加;在
较高温度时,反应速率快,在给定的时间内已经达到平衡,随着温度升高 的转化率
降低,可知该反应为放热反应。B点未达平衡, 的转化率还能继续增加,可知B点
反应正向进行,正反应速率大于逆反应速率,项正确。点温度高于A点,所以
点点,项错误。之间, 的转化率较高,选择此温度范围比较合
适,项正确。(4)根据盖斯定律,由反应②-反应①得反应③,所以 ;
由于、,所以 必小于0。对放热反应而言,化学平衡常数随着温度
的升高而减小。(5)反应①生成的 可用于流程中粗硅提纯的第1步,三个可逆反应
中剩余的 也可循环使用。
化学反应原理在化工生产中的调控作用
6.(2023湖南)聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1) 已知下列反应的热化学方程式:
计算反应的______ 。
(2) 在某温度、下,向反应器中充入 气态乙苯发生反应④,其平衡转化
率为,欲将平衡转化率提高至,需要向反应器中充入___ 水蒸气作为稀释
气(计算时忽略副反应)。
5
(3) 在、下,以水蒸气作稀释气、 作催化剂,乙苯除脱氢生成苯
乙烯外,还会发生如下两个副反应:
⑤
⑥
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性
随乙苯转化率的
变化曲线如图所示,其中曲线 代表的产物是______,理由是_____
_________________________________________________________
_________________________________________________________
___________。
甲苯
生成苯乙烯是主反应,选择性最高;而主反应生成的可以加快反应⑥的正反应速率,随着反应逐渐进行,甲苯的选择性相比于苯升高幅度较大
(4) 关于本反应体系中催化剂 的描述错误的是_____。
BD
A.射线衍射技术可测定晶体结构 B. 可改变乙苯平衡转化率
C.降低了乙苯脱氢反应的活化能 D.改变 颗粒大小不影响反应速率
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某(Ⅰ)的配合物促进
(引发剂,表示卤素)生成自由基 ,实现苯乙烯可控聚合。
(5) 引发剂、、 中活性最高的是__________。
(6) 室温下,在配体的水溶液中形成,其反应平衡常数为;
在水中的溶度积常数为。由此可知,在配体 的水溶液中溶解反应的平衡常数
为_______(所有化学方程式中化学计量数关系均为最简整数比)。
【解析】 (1)根据盖斯定律,由 可得
| 。
(2)在某温度、下,向反应器中充入 气态乙苯发生反应④。乙苯的平衡
转化率为,列三段式计算 ,如下:
平衡时总物质的量为
设欲将平衡转化率提高至,充入的物质的量为 (链接大招19),可列
三段式计算,如下:
平衡时总物质的量为(充入的 要列入总物质的量)
(温度不变,不变),解得 。
(3)生成苯乙烯的反应是主反应,选择性肯定比副反应所生成的苯和甲苯高,因此在
乙苯转化率相同的条件下,选择性最高的曲线 代表的产物是苯乙烯。随着反应进行,
反应物乙苯的压强逐渐降低,因此反应④、⑤、⑥的正反应速率应逐渐降低,但由于主
反应④的产物有, 压强的增加可以提高反应⑥的正反应速率,因此反应⑤和⑥相
比,随着反应逐渐进行(即乙苯转化率逐渐升高),反应物乙苯会更多地转化成反应⑥
的产物甲苯,因此选择性升高幅度甲苯会逐渐高于苯,由此可知曲线 代表的产物是甲
苯。
(4)测定晶体结构最常用的仪器是射线衍射仪,因此 射线衍射技术可测定
晶体结构。
是催化剂,催化剂不能使平衡发生移动,不能改变乙苯平衡转化率。
作催化剂,可以降低乙苯脱氢反应的活化能,提高反应速率。
改变 颗粒大小,可以增大固体催化剂与气体反应物的接触表面积,因此可以
改变反应速率。
(5)根据题目所给信息可知,断裂的碳卤键可以生成自由基 ,键
长:,键长越长则键能越小,化学键越易断裂,故 最容易
生成自由基 ,活性最高。
(6)根据题目信息写出平衡常数所对应的可逆反应,即
; ,溶度积常数为
。在配体 的水溶液中溶解所对应的可逆反应为
,该反应可由上述两个可逆反应相加而得,
化学方程式相加则平衡常数相乘,因此在配体 的水溶液中溶解反应的平衡常数为
。
7.(2022辽宁)工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其
获得诺贝尔奖,其反应为
。
回答下列问题:
(1) 合成氨反应在常温下____(填“能”或“不能”)自发进行。
(2) ____温(填“高”或“低”,下同)有利于提高反应速率,____温有利于提高平衡转
化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用 。
能
高
低
(3) 针对反应速率与平衡产率的矛盾,我国科学家提出了以下解决方案:
复合催化剂。
图1
图2
下列说法正确的是__。
时,复合催化剂比单一催化剂效率更高
.同温同压下,复合催化剂有利于提高氨的平衡产率
.温度越高,复合催化剂活性一定越高
(4) 某合成氨速率方程为,根据表中数据, ____。
实验
1
2
3
4
在合成氨过程中,需要不断分离出氨的原因为__。
.有利于平衡正向移动
.防止催化剂中毒
.提高正反应速率
【解析】 (1)常温下 ,
,
故合成氨反应在常温下能自发进行。(2)其他条件一定时,升高温度,反应速率加快;合成氨反应是放热反应,温度降低能使平衡正向移动,提高平衡转化率。(3)由题图1可知,时,复合催化剂(有 )催化时合成氨反应的反应速率比单一催化
剂(没有)催化时大很多,说明时复合催化剂比单一催化剂效率更高, 项正
确。同温同压下,复合催化剂能提高反应速率,但不能改变平衡状态,故不能提高氨的
平衡产率,项错误。温度过高,复合催化剂可能会失去活性,催化效率反而降低, 项
错误。(4)观察表格,挑选、 浓度都相同的实验1、3,分别代入合成氨的
速率方程可得、,联立解得 。合成
氨过程中,不断分离出氨,即降低体系中,平衡正向移动(分离氨气导致 降
低,因此 ,平衡正向移动),值得注意的是分离出氨气不会提高正反应速率,
正确, 错误。产物氨不会使催化剂中毒(如果氨会使这个催化剂中毒,那怎么可能还
使用这个催化剂呢), 错误。
1.(2022湖北部分学校质检)反应进行的方向是化学反应原理的重要组成部分之一。下
列说法正确的是( )
D
A.一定温度和压强下,某种给定物质的、 均为定值
B.根据反应的自发性可以预测该反应发生的快慢
C.某可逆反应的正反应能够自发进行,则该反应的 一定小于零
D.常温下,反应不能自发进行,则该反应的
【解析】 一定温度和压强下,某种给定物质的、 均为定值。
根据反应的自发性只能判断反应进行的方向,不能预测反应发生的快慢。
由可知,在、 和高温条件下,正反应也具有自发性。
反应不能自发进行,即,由于该反应的,则其 。
2.(2023江苏)金属硫化物 催化反应
,既可以除去天然气中
的,又可以获得 。下列说法正确的是( )
C
A.该反应的
B.该反应的平衡常数
C.题图所示的反应机理中,步骤Ⅰ可理解为 中带部分负电荷
的与催化剂中的 之间发生作用
D.该反应中每消耗 ,转移电子的数目约为
【解析】 ,左侧
反应物气体分子数之和为3,右侧生成物气体分子数之和为
5, 。
由化学方程式结合平衡常数表达式可知,
。
的电负性比大,因此中带部分负电荷,又分析题图可知,经过步骤Ⅰ后
中带部分负电荷的与催化剂中的 之间形成作用力。
中C的化合价为,中C的化合价为,可知每与 反应,
转移电子物质的量为,因此每消耗,转移电子的物质的量为 ,数目
约为 。
3.如图表示生成几种氯化物反应的自由能变化 随温度变化情况。若在图示温度范围内
焓变和熵变不变,且,其中为常数,为温度,反应①②③的
随温度 的变化关系如图所示。
反应①:
反应②:
反应③:
下列说法错误的是( )
D
A.反应①在温度为时的平衡常数 为1
B.反应②的平衡常数随温度升高而减小
C.反应③是熵增反应
D.在温度为时,不能用还原
【解析】 分析题图可知反应①在温度为时 ,又
,故 。
由化学方程式可知,反应②为反应前后气体分子数减小的反
应,其熵变;从题图可知反应②的,
且,可推知 ,平衡常数随温度升高而减小。
反应③的随温度升高而降低,且,因此 。
若能用还原,则还原 的反应可由反应③-反应②得到,即
,温度大于时,反应③的小于反应②的 ,
则的为负值,说明在温度大于(如 )时
反应能发生,可用还原 。
4.(图像创新)(2023辽宁名校联考) 时,向图1中带隔板的密闭容器两侧各充入
与,抽出隔板发生反应:
(绝对值很小,以下简称“该反应”),反应过程中自由能 (由体系的焓、熵与温度
共同决定:)随体系中氢气的体积分数 变化的示意图如图2所示,
其中 点为曲线最低点。则下列说法错误的是( )
A.自由能由下降到是抽出隔板时与 混合造成的
B.时,在 点该反应达到进行的限度
C.由点点过程中,故该反应在点满足:
D.若时该反应的平衡常数为64,则
√
【解析】 由题图2可知,、的横坐标相同,可知此时反应并未发生,自由能
减小是由体系熵增引起的。
化学反应总是向着体系的自由能减小的方向进行,直到体系达到平衡, 点为曲线
最低点,时,在 点该反应达到进行的限度。
过程中, 的体积分数增大,说明平衡逆向移动,则逆反应速率大于正反应
速率,正、逆反应速率之比 。
开始充入的和各为,由反应 可知,反应前
后气体的总物质的量不变,平衡时,的体积分数为,的物质的量为 ,反
应的氢气的物质的量为,的物质的量为 ,设容器体积
为,平衡常数, 。
5.(2022上海)铵态氮肥的过度使用会导致水体的富营养化,研究发现,可以用化学方
法和生物方法去除氨氮。现探究去除溶液中氨氮的最适宜条件。
(1) 化学方法一般用次氯酸钠氧化。次氯酸钠可以和水中溶解的氨气反应得到无毒无
害物质,其离子方程式为 。次氯酸钠溶液中含氯
的微粒有____________。
、
(2) 现定义:氨氮脱除率 氨氮脱除率受
溶液和的影响。如表是不同 下的氨氮脱除率:
反应前氮元素质量 反应后氮元素质量 氨氮脱除率
5.8 49.3 24.11
6.9 49.3 19.08
7.7 49.3 16.86
8.8 49.3 18.88
9.3 49.3 25.29
图示为最适宜条件,和 起始投料比例不同的情况下的氨氮脱除率。
试分析为什么最佳时,按照投料氨氮脱除率较低,只有 ,写出两个可能的原因:
____________________________________________________________________________
_________________________________。
次氯酸钠中价的氯元素和产物中价的氯元素发生归中反应,导致次氯酸钠有所消耗;次氯酸根离子发生水解有所消耗
(3) 由上述信息判断,反应的最佳 范围是_________,最佳投料比是_____。
3.25
【解析】 (1)由于为弱酸, 在溶液中会发生水解反应
,因此次氯酸钠溶液中含氯的微粒有和 。(2)根
据反应知,当和的起始投料比为 时,
理论上氨氮的脱除率为,而实际上氨氮的脱除率只有 ,根据
、 可推测其原因。(3)由题
表中数据知,当时,氨氮脱除率,说明 由7.7
增大到,氨氮脱除率一直降低,因此反应的最佳范围为 ,由图中曲线可
以看出,最佳投料比为3.25。
6.(2023山东青岛调研) 甲烷化反应合成替代天然气,是其循环利用的重要路径之
一。
(1) 甲烷化主反应: 。
副反应:Ⅰ. ;
Ⅱ. ;
Ⅲ. 。
则_____ 。
(2) 副反应Ⅱ所生成的 也能发生甲烷化反应,反应的化学方程式为______________
_____________________________________________________________________。
原料气中氢碳比对副反应有影响,实际生产中 值较大时能有效防止积碳的
原因是_________________________________________________。
促进反应正向进行,将积碳消耗
(3) 根据热力学平衡原理,有利于主反应生成更多甲烷的是__(填标号)。
.高温、高压 .低温、低压
.高压、低温 .低压、高温
(4) 以和 为初始原料,在催化剂
作用下保持总压为 发生反应
,不同温度下在
相同时间测得 的转化率如图。
① A点的反应速率___(填“ ”“ ”或“ ”)。
② B点的平衡常数 _ ____。
③ 由图像可知,影响该催化剂活性的因素有______________________。
温度和催化剂中含量
(5) 经验公式为(为活化能,单位为; 为速率
常数;和为常数,单位为)。甲烷化反应的速率常数与温度 的
关系如图,___________ (保留3位有效数字)。
【解析】 (1)根据盖斯定律,由主反应-
副反应Ⅰ,可得副反应Ⅲ,故
。(2)
由原子守恒可知, 发生甲烷化反应
(与反应),生成甲烷和 。
增大时,相当于二氧化碳浓度不
变,增大氢气浓度,会促进反应 正向进行,将积碳消耗。(3)
主反应为放热、气体分子数减小的反应,根据化学平衡移动原理,降温、加压其平衡正
向移动,有利于生成更多甲烷,故 正确。(4)①结合催化剂不影响平衡移动及题图知,
B点处于平衡状态,A点转化率小于平衡转化率,反应正向进行,故A点 。
②B点的平衡转化率为 ,列三段式:
平衡时气体的 。则B点平衡常
数 。③分析题图
可知,温度和催化剂中 含量影响催化剂
的活性。(5)将C、D点数据分别代入公式
得 、
,解得
。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
2025年高考化学考向分析
化学反应的方向
化学反应的调控
化学反应进行的方向
1.(2022浙江1月选考) 型强电解质在水中的溶解(可视作特殊的化学反应)表示为
,其焓变和熵变分别为和。对于不同组成的 型强电
解质,下列说法正确的是( )
D
A.和均大于零 B.和 均小于零
C.可能大于零或小于零,大于零 D.和 均可能大于零或小于零
【解析】 强电解质溶于水放热,,强电解质 溶于水吸热,
。
型强电解质固体溶于水转化为离子,混乱度增加,但离子在水中存在水合
过程,使水的混乱度下降,所以整个溶解过程的熵变取决于固体转化为离子的熵增和水
合过程的熵减两个作用的相对大小,若前者占主导,则溶解过程熵增,反之熵减。
2.(2021浙江6月选考)相同温度和压强下,关于物质熵的大小比较,合理的是( )
B
A.
B.
C.
D.(,金刚石)( ,石墨)
【解析】 相同条件下,的原子个数多于 ,故熵:
。
相同条件下,同一物质的物质的量越大,其熵越大,即熵:
。
等量的同一物质不同状态时的熵:固态 液态 气态,即熵:
。
石墨与金刚石互为同素异形体,由晶体结构可知,金刚石有着更为有序的原子结
构,其熵较低,即熵:(,金刚石)( ,石墨)。
3.(2022湖南)已知, 的值只取决于反应体系的始态和终态,忽略
、随温度的变化。若,则该反应可以自发进行。根据下图判断: 时,下
列反应不能自发进行的是( )
C
A.
B.
C.
D.
【解析】 分析题图可知, 时
、
的,反应能自发进行; 时
的 ,反
应不能自发进行;在 时,
的约为 ,
的约为 ,
可由 和
相加得到,且 的值只取决于反应体系的始态和
终态,可推知的 ,
反应能自发进行。
4.(2021湖南)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可
通过氨热分解法制氢气。相关化学键的键能数据如表所示:
化学键
键能 946 436.0 390.8
一定温度下,利用催化剂将分解为和 。
(1) 反应_______ 。
(2) 已知该反应的 ,在下列哪些温度下反应能自发进行?
_____(填标号)。
CD
A. B. C. D.
【解析】 (1)根据 反应物的键能总和-生成物的键能总和,可知反应
的 。
(2)
5.多晶硅是制作光伏电池的关键材料。如图1所示是由粗硅制备多晶硅的简易过程。
图1
回答下列问题:
Ⅰ.硅粉与在时反应生成气体和,放出 热量,该反应的热化学
方程式为_ _____________________________________________________。 的电子
式为_ _______。
Ⅱ.将氢化为 有三种方法,对应的反应依次为:
①
②
③
(1) 氢化过程中所需的高纯度可用惰性电极电解溶液制备,写出产生 的电极
名称______(填“阳极”或“阴极”),该电极反应式为__________________________。
阴极
(2) 已知体系自由能变,时反应自发进行。三个氢化反应的
与温度的关系如图2所示,可知:反应①能自发进行的最低温度是_________;相同温度下,反
应②比反应①的 小,主要原因是______________________________。
,导致反应②的小
图2
图3
(3) 不同温度下反应②中 转化率如图3所示。下列
叙述正确的是_____(填序号)。
、
点:
.点 点
.反应适宜温度:
(4) 反应③的___________(用、 表示)。
温度升高,反应③的平衡常数 ______(填“增大”“减小”或
“不变”)。
减小
(5) 由粗硅制备多晶硅过程中循环使用的物质除、和 外,还有_________
(填分子式)。
、
【解析】 Ⅰ.反应物为固态、气态,生成物是气态的和 ,反应条件是
,配平时将 的化学计量数定为1,由此写出热化学方程式:
。中与1个 、3个
分别形成共价单键,每个周围补上电子以满足8电子稳定结构,故 的电子式
为 。
Ⅱ.
(1)用惰性电极电解溶液,在阳极放电生成 ,电极反应式为
;在阴极不反应,放电生成 ,电极反应式为
(用惰性电极电解溶液等同电解,阴极生成 、
阳极生成)。(2)由题图可以看出,温度达到以上反应①的 才会小于0,
因此反应①能自发进行的最低温度是 。反应①反应前后的气体分子数不变,可
知反应①的变化很小(不同物质的是不同的,但是气体物质的量如果有变化则 变
化较大);反应②反应前后气体分子数减小,,单从 来看,在同温条件下反
应②的应该偏大,但实际情况是反应②比反应①的 小,原因就是反应①的
、反应②的,导致在相同温度下,反应②比反应①的 小。
(3)题图3是经典的转化率对温度的关系图,在较低温度时,反应速率较慢,在给定的
时间内未达到平衡,所以温度越高,反应速率越快,相同时间内 的转化率增加;在
较高温度时,反应速率快,在给定的时间内已经达到平衡,随着温度升高 的转化率
降低,可知该反应为放热反应。B点未达平衡, 的转化率还能继续增加,可知B点
反应正向进行,正反应速率大于逆反应速率,项正确。点温度高于A点,所以
点点,项错误。之间, 的转化率较高,选择此温度范围比较合
适,项正确。(4)根据盖斯定律,由反应②-反应①得反应③,所以 ;
由于、,所以 必小于0。对放热反应而言,化学平衡常数随着温度
的升高而减小。(5)反应①生成的 可用于流程中粗硅提纯的第1步,三个可逆反应
中剩余的 也可循环使用。
化学反应原理在化工生产中的调控作用
6.(2023湖南)聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1) 已知下列反应的热化学方程式:
计算反应的______ 。
(2) 在某温度、下,向反应器中充入 气态乙苯发生反应④,其平衡转化
率为,欲将平衡转化率提高至,需要向反应器中充入___ 水蒸气作为稀释
气(计算时忽略副反应)。
5
(3) 在、下,以水蒸气作稀释气、 作催化剂,乙苯除脱氢生成苯
乙烯外,还会发生如下两个副反应:
⑤
⑥
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性
随乙苯转化率的
变化曲线如图所示,其中曲线 代表的产物是______,理由是_____
_________________________________________________________
_________________________________________________________
___________。
甲苯
生成苯乙烯是主反应,选择性最高;而主反应生成的可以加快反应⑥的正反应速率,随着反应逐渐进行,甲苯的选择性相比于苯升高幅度较大
(4) 关于本反应体系中催化剂 的描述错误的是_____。
BD
A.射线衍射技术可测定晶体结构 B. 可改变乙苯平衡转化率
C.降低了乙苯脱氢反应的活化能 D.改变 颗粒大小不影响反应速率
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某(Ⅰ)的配合物促进
(引发剂,表示卤素)生成自由基 ,实现苯乙烯可控聚合。
(5) 引发剂、、 中活性最高的是__________。
(6) 室温下,在配体的水溶液中形成,其反应平衡常数为;
在水中的溶度积常数为。由此可知,在配体 的水溶液中溶解反应的平衡常数
为_______(所有化学方程式中化学计量数关系均为最简整数比)。
【解析】 (1)根据盖斯定律,由 可得
| 。
(2)在某温度、下,向反应器中充入 气态乙苯发生反应④。乙苯的平衡
转化率为,列三段式计算 ,如下:
平衡时总物质的量为
设欲将平衡转化率提高至,充入的物质的量为 (链接大招19),可列
三段式计算,如下:
平衡时总物质的量为(充入的 要列入总物质的量)
(温度不变,不变),解得 。
(3)生成苯乙烯的反应是主反应,选择性肯定比副反应所生成的苯和甲苯高,因此在
乙苯转化率相同的条件下,选择性最高的曲线 代表的产物是苯乙烯。随着反应进行,
反应物乙苯的压强逐渐降低,因此反应④、⑤、⑥的正反应速率应逐渐降低,但由于主
反应④的产物有, 压强的增加可以提高反应⑥的正反应速率,因此反应⑤和⑥相
比,随着反应逐渐进行(即乙苯转化率逐渐升高),反应物乙苯会更多地转化成反应⑥
的产物甲苯,因此选择性升高幅度甲苯会逐渐高于苯,由此可知曲线 代表的产物是甲
苯。
(4)测定晶体结构最常用的仪器是射线衍射仪,因此 射线衍射技术可测定
晶体结构。
是催化剂,催化剂不能使平衡发生移动,不能改变乙苯平衡转化率。
作催化剂,可以降低乙苯脱氢反应的活化能,提高反应速率。
改变 颗粒大小,可以增大固体催化剂与气体反应物的接触表面积,因此可以
改变反应速率。
(5)根据题目所给信息可知,断裂的碳卤键可以生成自由基 ,键
长:,键长越长则键能越小,化学键越易断裂,故 最容易
生成自由基 ,活性最高。
(6)根据题目信息写出平衡常数所对应的可逆反应,即
; ,溶度积常数为
。在配体 的水溶液中溶解所对应的可逆反应为
,该反应可由上述两个可逆反应相加而得,
化学方程式相加则平衡常数相乘,因此在配体 的水溶液中溶解反应的平衡常数为
。
7.(2022辽宁)工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其
获得诺贝尔奖,其反应为
。
回答下列问题:
(1) 合成氨反应在常温下____(填“能”或“不能”)自发进行。
(2) ____温(填“高”或“低”,下同)有利于提高反应速率,____温有利于提高平衡转
化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用 。
能
高
低
(3) 针对反应速率与平衡产率的矛盾,我国科学家提出了以下解决方案:
复合催化剂。
图1
图2
下列说法正确的是__。
时,复合催化剂比单一催化剂效率更高
.同温同压下,复合催化剂有利于提高氨的平衡产率
.温度越高,复合催化剂活性一定越高
(4) 某合成氨速率方程为,根据表中数据, ____。
实验
1
2
3
4
在合成氨过程中,需要不断分离出氨的原因为__。
.有利于平衡正向移动
.防止催化剂中毒
.提高正反应速率
【解析】 (1)常温下 ,
,
故合成氨反应在常温下能自发进行。(2)其他条件一定时,升高温度,反应速率加快;合成氨反应是放热反应,温度降低能使平衡正向移动,提高平衡转化率。(3)由题图1可知,时,复合催化剂(有 )催化时合成氨反应的反应速率比单一催化
剂(没有)催化时大很多,说明时复合催化剂比单一催化剂效率更高, 项正
确。同温同压下,复合催化剂能提高反应速率,但不能改变平衡状态,故不能提高氨的
平衡产率,项错误。温度过高,复合催化剂可能会失去活性,催化效率反而降低, 项
错误。(4)观察表格,挑选、 浓度都相同的实验1、3,分别代入合成氨的
速率方程可得、,联立解得 。合成
氨过程中,不断分离出氨,即降低体系中,平衡正向移动(分离氨气导致 降
低,因此 ,平衡正向移动),值得注意的是分离出氨气不会提高正反应速率,
正确, 错误。产物氨不会使催化剂中毒(如果氨会使这个催化剂中毒,那怎么可能还
使用这个催化剂呢), 错误。
1.(2022湖北部分学校质检)反应进行的方向是化学反应原理的重要组成部分之一。下
列说法正确的是( )
D
A.一定温度和压强下,某种给定物质的、 均为定值
B.根据反应的自发性可以预测该反应发生的快慢
C.某可逆反应的正反应能够自发进行,则该反应的 一定小于零
D.常温下,反应不能自发进行,则该反应的
【解析】 一定温度和压强下,某种给定物质的、 均为定值。
根据反应的自发性只能判断反应进行的方向,不能预测反应发生的快慢。
由可知,在、 和高温条件下,正反应也具有自发性。
反应不能自发进行,即,由于该反应的,则其 。
2.(2023江苏)金属硫化物 催化反应
,既可以除去天然气中
的,又可以获得 。下列说法正确的是( )
C
A.该反应的
B.该反应的平衡常数
C.题图所示的反应机理中,步骤Ⅰ可理解为 中带部分负电荷
的与催化剂中的 之间发生作用
D.该反应中每消耗 ,转移电子的数目约为
【解析】 ,左侧
反应物气体分子数之和为3,右侧生成物气体分子数之和为
5, 。
由化学方程式结合平衡常数表达式可知,
。
的电负性比大,因此中带部分负电荷,又分析题图可知,经过步骤Ⅰ后
中带部分负电荷的与催化剂中的 之间形成作用力。
中C的化合价为,中C的化合价为,可知每与 反应,
转移电子物质的量为,因此每消耗,转移电子的物质的量为 ,数目
约为 。
3.如图表示生成几种氯化物反应的自由能变化 随温度变化情况。若在图示温度范围内
焓变和熵变不变,且,其中为常数,为温度,反应①②③的
随温度 的变化关系如图所示。
反应①:
反应②:
反应③:
下列说法错误的是( )
D
A.反应①在温度为时的平衡常数 为1
B.反应②的平衡常数随温度升高而减小
C.反应③是熵增反应
D.在温度为时,不能用还原
【解析】 分析题图可知反应①在温度为时 ,又
,故 。
由化学方程式可知,反应②为反应前后气体分子数减小的反
应,其熵变;从题图可知反应②的,
且,可推知 ,平衡常数随温度升高而减小。
反应③的随温度升高而降低,且,因此 。
若能用还原,则还原 的反应可由反应③-反应②得到,即
,温度大于时,反应③的小于反应②的 ,
则的为负值,说明在温度大于(如 )时
反应能发生,可用还原 。
4.(图像创新)(2023辽宁名校联考) 时,向图1中带隔板的密闭容器两侧各充入
与,抽出隔板发生反应:
(绝对值很小,以下简称“该反应”),反应过程中自由能 (由体系的焓、熵与温度
共同决定:)随体系中氢气的体积分数 变化的示意图如图2所示,
其中 点为曲线最低点。则下列说法错误的是( )
A.自由能由下降到是抽出隔板时与 混合造成的
B.时,在 点该反应达到进行的限度
C.由点点过程中,故该反应在点满足:
D.若时该反应的平衡常数为64,则
√
【解析】 由题图2可知,、的横坐标相同,可知此时反应并未发生,自由能
减小是由体系熵增引起的。
化学反应总是向着体系的自由能减小的方向进行,直到体系达到平衡, 点为曲线
最低点,时,在 点该反应达到进行的限度。
过程中, 的体积分数增大,说明平衡逆向移动,则逆反应速率大于正反应
速率,正、逆反应速率之比 。
开始充入的和各为,由反应 可知,反应前
后气体的总物质的量不变,平衡时,的体积分数为,的物质的量为 ,反
应的氢气的物质的量为,的物质的量为 ,设容器体积
为,平衡常数, 。
5.(2022上海)铵态氮肥的过度使用会导致水体的富营养化,研究发现,可以用化学方
法和生物方法去除氨氮。现探究去除溶液中氨氮的最适宜条件。
(1) 化学方法一般用次氯酸钠氧化。次氯酸钠可以和水中溶解的氨气反应得到无毒无
害物质,其离子方程式为 。次氯酸钠溶液中含氯
的微粒有____________。
、
(2) 现定义:氨氮脱除率 氨氮脱除率受
溶液和的影响。如表是不同 下的氨氮脱除率:
反应前氮元素质量 反应后氮元素质量 氨氮脱除率
5.8 49.3 24.11
6.9 49.3 19.08
7.7 49.3 16.86
8.8 49.3 18.88
9.3 49.3 25.29
图示为最适宜条件,和 起始投料比例不同的情况下的氨氮脱除率。
试分析为什么最佳时,按照投料氨氮脱除率较低,只有 ,写出两个可能的原因:
____________________________________________________________________________
_________________________________。
次氯酸钠中价的氯元素和产物中价的氯元素发生归中反应,导致次氯酸钠有所消耗;次氯酸根离子发生水解有所消耗
(3) 由上述信息判断,反应的最佳 范围是_________,最佳投料比是_____。
3.25
【解析】 (1)由于为弱酸, 在溶液中会发生水解反应
,因此次氯酸钠溶液中含氯的微粒有和 。(2)根
据反应知,当和的起始投料比为 时,
理论上氨氮的脱除率为,而实际上氨氮的脱除率只有 ,根据
、 可推测其原因。(3)由题
表中数据知,当时,氨氮脱除率,说明 由7.7
增大到,氨氮脱除率一直降低,因此反应的最佳范围为 ,由图中曲线可
以看出,最佳投料比为3.25。
6.(2023山东青岛调研) 甲烷化反应合成替代天然气,是其循环利用的重要路径之
一。
(1) 甲烷化主反应: 。
副反应:Ⅰ. ;
Ⅱ. ;
Ⅲ. 。
则_____ 。
(2) 副反应Ⅱ所生成的 也能发生甲烷化反应,反应的化学方程式为______________
_____________________________________________________________________。
原料气中氢碳比对副反应有影响,实际生产中 值较大时能有效防止积碳的
原因是_________________________________________________。
促进反应正向进行,将积碳消耗
(3) 根据热力学平衡原理,有利于主反应生成更多甲烷的是__(填标号)。
.高温、高压 .低温、低压
.高压、低温 .低压、高温
(4) 以和 为初始原料,在催化剂
作用下保持总压为 发生反应
,不同温度下在
相同时间测得 的转化率如图。
① A点的反应速率___(填“ ”“ ”或“ ”)。
② B点的平衡常数 _ ____。
③ 由图像可知,影响该催化剂活性的因素有______________________。
温度和催化剂中含量
(5) 经验公式为(为活化能,单位为; 为速率
常数;和为常数,单位为)。甲烷化反应的速率常数与温度 的
关系如图,___________ (保留3位有效数字)。
【解析】 (1)根据盖斯定律,由主反应-
副反应Ⅰ,可得副反应Ⅲ,故
。(2)
由原子守恒可知, 发生甲烷化反应
(与反应),生成甲烷和 。
增大时,相当于二氧化碳浓度不
变,增大氢气浓度,会促进反应 正向进行,将积碳消耗。(3)
主反应为放热、气体分子数减小的反应,根据化学平衡移动原理,降温、加压其平衡正
向移动,有利于生成更多甲烷,故 正确。(4)①结合催化剂不影响平衡移动及题图知,
B点处于平衡状态,A点转化率小于平衡转化率,反应正向进行,故A点 。
②B点的平衡转化率为 ,列三段式:
平衡时气体的 。则B点平衡常
数 。③分析题图
可知,温度和催化剂中 含量影响催化剂
的活性。(5)将C、D点数据分别代入公式
得 、
,解得
。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
