化学反应速率 -2025年高考化学考向分析(共79张PPT)
文档属性
| 名称 | 化学反应速率 -2025年高考化学考向分析(共79张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-27 19:21:06 | ||
图片预览










文档简介
(共79张PPT)
2025年高考化学考向分析
化学反应速率
化学反应速率的计算及影响因素
1.(2022浙江1月选考)在恒温恒容条件下,发生反应, 随时间的
变化如图中曲线甲所示。下列说法不正确的是( )
C
A.从、两点坐标可求得从到 时间间隔内该化学反应的平均速率
B.从 点切线的斜率可求得该化学反应在反应开始时的瞬时速率
C.在不同时刻都存在关系:
D.维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,
随时间变化关系如图中曲线乙所示
【解析】 由、两点的横、纵坐标可得到和,则到 的
平均反应速率 。
当点无限接近点时,趋近于0,的平均反应速率即为
点的瞬时速率,点处的切线的斜率,故从 点切线的斜率可求
得反应开始时的瞬时速率。
在不同时刻都有 。
其他条件相同,加入催化剂,反应达到平衡的时间缩短,但平衡转化率不变。
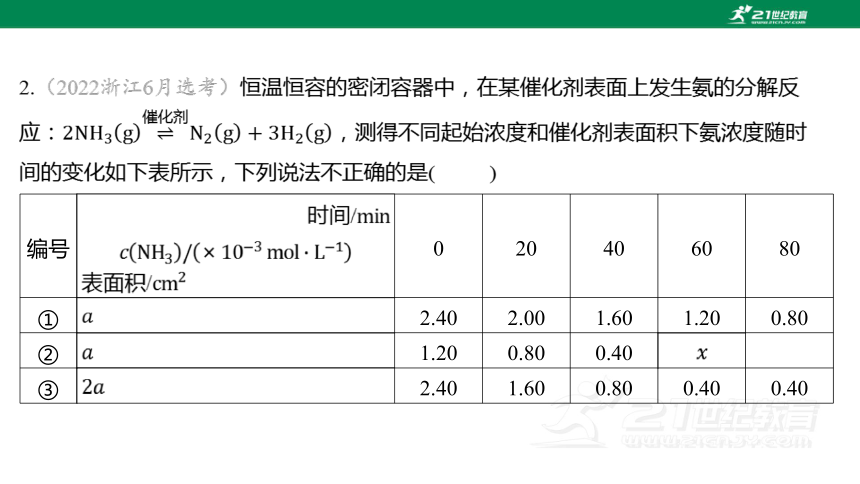
2.(2022浙江6月选考)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反
应: ,测得不同起始浓度和催化剂表面积下氨浓度随时
间的变化如下表所示,下列说法不正确的是( )
编号 时间/ 表面积/ 0 20 40 60 80
① 2.40 2.00 1.60 1.20 0.80
② 1.20 0.80 0.40
③ 2.40 1.60 0.80 0.40 0.40
A.实验①,,
B.实验②,时处于平衡状态,
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
【解析】 实验①中, ,氨气浓度变化量为
,
,根据反应速率之比等于化学
计量数之比推知, 。
√
催化剂表面积大小只影响反应速率,不影响平衡,实验③中 初始浓度与实验①
中一样,实验③达到平衡时浓度为 ,则实验①达到平衡时
浓度也是;实验②中 初始浓度是实验①的一半,在恒温恒
容下,实验②相当于实验①减压,对于 而言,减压相当
于平衡正移了,所以实验①中的平衡浓度为 ,而实验②因为
有了平衡正移的效果,所以的平衡浓度小于,也就是 。
分析表格数据可知,实验①、实验②在、 氨气浓度变化量
都是 ,也代表在这些时间段内反应速率相同,而实验①、实验②
的催化剂表面积都是相同的,不同之处在于实验①中初始浓度是实验②中 初始
浓度的两倍,可知在相同条件下,增加氨气浓度,反应速率并没有增大。
对比实验①和实验③, 初始浓度相同,实验③中催化剂表面积是实验①中催化
剂表面积的2倍,实验③先达到平衡状态,可知实验③的反应速率大,说明相同条件下,
增加催化剂的表面积,反应速率增大。
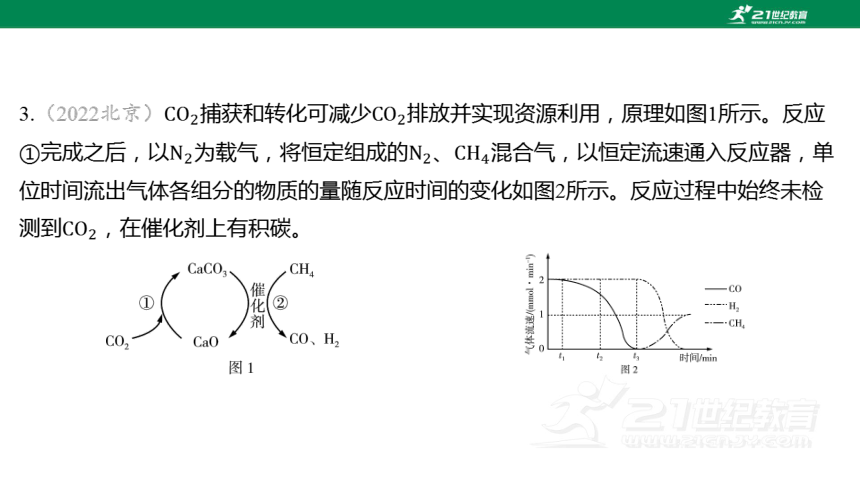
3.(2022北京)捕获和转化可减少 排放并实现资源利用,原理如图1所示。反应
①完成之后,以为载气,将恒定组成的、 混合气,以恒定流速通入反应器,单
位时间流出气体各组分的物质的量随反应时间的变化如图2所示。反应过程中始终未检
测到 ,在催化剂上有积碳。
下列说法不正确的是( )
C
A.反应①为;反应②为
B.,比多,且生成 的速率不变,推测有副反应
C.时,副反应生成的速率大于反应②生成 的速率
D.之后,生成 的速率为0,是因为反应②不再发生
【解析】 由题图1所示信息可知,反应①的反应物为和,生成物为 ,
因此反应①的化学方程式为;反应②的反应物为和 ,生
成物为、、,因此反应②的化学方程式为 。
由题图2信息可知,,比多,且生成 的速率不变,根
据反应②的化学方程式,和应该是按生成的,为何 少了呢?我们发现,题
目还提到“反应过程中始终未检测到,在催化剂上有积碳”,所以合理推断是 发
生了副反应 。
(【提醒】无论是主反应还是上述可能发生的副反应,每消耗1个都是生成2个 ,
因此在之间,流出速率都是固定的,但有部分生成C而不是 ,
因此就比 少了)
时,的流速大约是 (本题是比大小,不需要准确数值),
可知主反应中一起生成的流速也大约是,由于时 流速是
,表示副反应中生成的流速大约是,可知 时,
副反应生成的速率小于反应②生成 的速率。
由题图2信息可知,之后,生成的速率为0,生成 的速率也逐渐减小最后
为0,而的流速逐渐增大,最终恢复到(别忘了 始终以恒定流速
通入反应器),判断是因为反应②不再发生,随后副反应速率逐渐减小最终停止,最终
不再消耗,和 不再生成。
4.(2023广东广州联考二模)汽车尾气中 生成的反应为
。一定条件下,等物质的量的 和
在恒容密闭容器中反应,曲线表示该反应在温度下
随时间的变化,曲线 表示该反应在某一起始条件改变时
随时间 的变化。下列叙述不正确的是( )
B
A.温度下,内
B.点小于点
C.曲线 对应的条件改变可能是充入氧气
D.若曲线对应的条件改变是升高温度,则
【解析】 温度下,内氮气的浓度从减少到 ,
。
可画出速率-时间图像进行分析,如图:
假设曲线对应的条件改变是充入氧气,增加反应物 ,反应速率加快,更快达到
平衡,且平衡时氮气的浓度比曲线 对应的小。
若曲线 对应的条件改变是升温,则说明升温平衡正向移动,则正反应为吸热反应。
有关基元反应、活化能、催化剂的分析
5.(2024广东六校联考)反应物转化为产物 时的能量变化与反应进程的关系如图
曲线①所示,使用催化剂 后能量变化与反应进程的关系如图曲线②所示。下列说法正
确的是( )
C
A.稳定性:
B.使用催化剂降低了该反应的焓变
C.使用催化剂后,反应历程分3步进行
D.使用催化剂后,反应历程中的决速步为
【解析】 的能量比 高,根据能量越低物质
越稳定,知稳定性: 。
使用催化剂可以降低活化能,但不改变焓变。
使用催化剂后,反应历程为 、
、 ,分3步进行。
由题图可知,使用催化剂后,反应历程中
的活化能最大,为决速步。
6.(2022广东)在相同条件下研究催化剂Ⅰ、Ⅱ对反应
的影响,各物质浓度随反应时间 的部分变化曲线
如图,则( )
D
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.曲线表示使用催化剂Ⅱ时的浓度随 的变化
D.使用催化剂Ⅰ时, 内,
【解析】 由题图可知,无催化剂时,生成物浓度一
直在增加,只是反应比较慢,说明无催化剂时反应也能
进行 。(【提醒】催化剂只能影响化学反应的快慢,不
能决定反应是否发生)
分析题图可知,在相同时间内,催化剂Ⅰ对应的产物
浓度变化量大、反应速率快,可说明催化剂Ⅰ比催化剂Ⅱ
催化效果好,说明催化剂Ⅰ使反应活化能更低,反应更快。
图中的曲线表示的是反应物的浓度随的变化,在内 的浓度变化为
,根据反应方程式可知,在内生成物 的浓度变化为
,对应的是催化剂Ⅰ,因此曲线表示使用催化剂Ⅰ时的浓度随 的变化。
使用催化剂Ⅰ时,的浓度随的变化为曲线,在 内,则
。
7.(2021山东)标记的乙酸甲酯在足量 溶液中发生
水解,部分反应历程可表示
为
。能量变化如图所示。已知
为快速平衡,下列说法正确的是 ( )
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在
C.反应结束后,溶液中存在
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
√
【解析】 一般来说,反应的活化能越高,反应速率越慢,分
析题图可知,反应Ⅰ和反应Ⅳ的活化能较高,因此反应的决速步为
反应Ⅰ、Ⅳ。
反应Ⅰ生成 ,由题目信息“
为快速平衡”可知会有 生成,最后再经过反应Ⅱ,断 键,生成
和,因此反应结束后,溶液中存在 。
参与反应Ⅲ的离子有 、 ,但无论是哪种
离子参与反应,反应Ⅲ都只会生成,溶液中没有 。
总反应的焓变应该是生成物的总能量-反应物的总能量,
(【技法】总反应的焓变反应Ⅰ的活化能-反应Ⅱ的活化能 反应
Ⅲ的活化能-反应Ⅳ的活化能)反应Ⅰ与反应Ⅳ活化能的差值从图形
上来看,很明显不是总反应的焓变。
8.(2023山东济南三模,双选)萘与三氧化硫反应同时生成 萘磺酸( )与
萘磺酸( ),稳定性:萘磺酸 萘磺酸,反应过程中的能量变
化如图所示,1、2、3、4是中间产物,、 各代表一种产物。下列说法正确的是
( )
A.较高温度下,反应的主要产物是 萘磺酸
B.升高相同温度,生成 萘磺酸的反应速率变化更大
C.实验中测得2的浓度大于4,是因为生成 的反应焓变更大
D.选择不同催化剂,对产物中、 的含量不会产生影响
【解析】 由题目信息“稳定性:萘磺酸 萘磺酸”,可知稳定性大的
萘磺酸能量较低(【点拨】能量越低越稳定),则表示萘磺酸,表示 萘
磺酸;分析题图,生成萘磺酸的决速步骤(反应物)的活化能较生成 萘磺酸
的决速步骤(反应物 )的活化能大,而活化能较大的反应其反应速率受温度影响较
大(【杰哥补充】此结论可以通过阿伦尼乌斯公式导证出来,高中不需要知道过程,直
接作为二级结论记忆即可),因此较高温度下,生成 萘磺酸的反应速率增幅较大,
可知较高温度下,反应的主要产物是 萘磺酸。
√
√
反应的活化能较大,反应的活化能较小,因此 的反应速率较小,
所以实验中测得2的浓度大于4。
催化剂具有选择性,如某种催化剂能提高生成的反应速率,但却不能提高生成
的反应速率,因此选择不同催化剂,会影响反应的选择性,进而影响产物中、 的含
量。
9.(2022海南)某空间站的生命保障系统功能之一是实现氧循环。其中涉及反应:
。
在相同条件下,与 还会发生不利于氧循环的副反应:
。在反应器中按 通入
反应物,在不同温度、不同催化剂条件下,反应进行到 时,测得反应器中
、浓度 如表所示。
催化剂
催化剂Ⅰ 10.8 12 722 345.2 42 780
催化剂Ⅱ 9.2 10 775 34 38 932
在选择使用催化剂Ⅰ和条件下反应,生成 的平均反应速率为____
;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和 的反应
条件,原因是________________________________________________________________
_______________________。
5.4
相同催化剂,的反应速率更快,相同温度,催化剂Ⅱ副反应物浓度低,甲烷与甲醇的比例高
【解析】 在选择使用催化剂Ⅰ和 条件下反应,由题表中信息可知,
的浓度由0增加到,因此,生成 的平均
反应速率为 。空间站氧循环涉及的反应为
,不利于氧循环的副反应为
,可知氧循环反应速率越快,单位时间内
生成越多而越少[即 越大],越有利于空间站的氧循环。由题表中
信息可知,在选择使用催化剂Ⅰ和条件下反应, 的浓度由0增加
到, ;在选择使用催化剂Ⅱ和
的反应条件下,的浓度由0增加到 ,
;在选择使用催化剂Ⅰ和 条件下反应,
的浓度由0增加到 ,
;在选择使用催化剂Ⅱ和 的反应条件
下,的浓度由0增加到 ,
。 ,甲烷的浓度太低了,可知氧循环
速率慢,不合适;,催化剂Ⅱ对应的 是催化剂Ⅰ对应的将近10倍,因此
使用催化剂Ⅱ和 的反应条件是最合适的。
10.(2023全国甲)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1) 电喷雾电离等方法得到的(、、等)与
反应可得。与 反应能高选择性地生成甲醇。分别
在和 下(其他反应条件相同)进行反应
,结果如图所示。图中 的曲线
是___(填“”或“”)。、时 的转化率为
_________________(列出算式)。
(2) 分别与、 反应,体系的能量随反应进程
的变化如图所示(两者历程相似,图中以 示例)。
(ⅰ) 步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是__
(填“Ⅰ”或“Ⅱ”)。
Ⅰ
(ⅱ) 直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则
与反应的能量变化应为图中曲线___(填“”或“ ”)。
(ⅲ) 与反应,氘代甲醇的产量___(填“ ”“”或“ ”)。
若与 反应,生成的氘代甲醇有___种。
2
【解析】 (1)由原子守恒可知, 为
定值,随着反应进行,逐渐转变为 ,则
减小,故 逐渐增大。温度
越高,反应速率越大,在相同时间内 的
变化量越大,因此曲线表示、曲线表示 。
设起始时,则根据原子守恒,始终为 。
根据题图,在
、时 ,即
,因此的转化率为 。
(2)(ⅰ)步骤Ⅰ涉及键断裂和 键生成,涉及
氢原子成键变化;步骤Ⅱ涉及键、 键断裂和
键生成,没有涉及氢原子成键变化。
(ⅱ)的D(氘)是比的更重的 的同位素,根
据题目信息“直接参与化学键变化的元素被替换为更重的
同位素时,反应速率会变慢”,因此与 反应的步
骤Ⅰ速率较慢,对应的活化能较高,根据图示可知,
与反应的能量变化应为图中曲线 。
(ⅲ)根据(ⅱ)所给的信息以及步骤Ⅰ的成键变化可知,
断裂键并生成键的速率比断裂 键并生成
键的速率慢,因此相同时间内生成 比生成
少,产量。若与
反应,可以断裂键并生成键得到 ,也
可以断裂键并生成键得到 ,因此生成
的氘代甲醇有2种。
“环形”反应机理图与“梯形”能量关系图分析
大招14 对应练习
解题觉醒
“梯形”能量关系图分析
第一步:分析图像中反应的起始物与最终物质所具有的相对能量大小,确定总反应的焓
变及反应吸、放热类型。
第二步:计算每步反应的能垒,确定决速步骤,确定慢反应和快反应。
第三步:根据图像分析结合题目要求作答。
“环形”反应机理图分析
第一步:审题干,明确反应目的,确定催化剂、反应物和生成物。
第二步:分析图像,找出图像中的反应物、生成物、催化剂、中间体。
(1)“箭头”指入的为反应物,“箭头”指出的为生成物。
(2)按“箭头”方向,最终生成物与起始反应物中间的物质一般为催化剂。
(3)“环上”物质除催化剂外,其余为中间体。
第三步:根据图像分析结合题目要求作答。
11.(2023安徽安庆模拟)任何有机化合物的分子都是由特定
碳骨架构成的,构建碳骨架是合成有机化合物的重要任务。
某构建碳骨架的反应历程如图所示,下列关于该反应的说法
错误的是( )
C
A.反应过程中 的成键数目发生改变
B.图中所示物质间的转化有非极性键的断裂和形成
C.分子中采用 杂化的仅有C原子
D.该构建碳骨架的总反应为
,
原子利用率为
【解析】 .
中钴原子的成键数目均为4,③中钴原子的成键
数目为5,⑤中钴原子的成键数目为6,说明反应过程中 的
成键数目发生改变。
过程非极性键碳碳双键断裂, 过程非极
性键碳碳单键形成。
甲醇分子中饱和碳原子和饱和氧原子的杂化方式都为 。
总反应的产物唯一,原子利用率为 。
12.(2023江西赣州期末)铋基催化剂对 电化学还原制
取 具有高效选择性,其反应历程与能量变化如图所
示,其中吸附在催化剂表面上的物种用*标注。下列说法错
误的是( )
D
A.使用催化剂更有利于 的吸附
B.使用不同铋基催化剂,反应的焓变相等
C.电化学还原制取的反应的
D.生成 的反应:
【解析】
13.(2023湖南) 是一种强还原性的高
能物质,在航天、能源等领域有广泛应用。
我国科学家合成的某 (Ⅱ)催化剂
(用 表示)能高效电催化
氧化合成 ,其反应机理如图所示。
下列说法错误的是( )
B
A.(Ⅱ)被氧化至(Ⅲ)后,配体 失去质子能力增强
B.中的化合价为
C.该过程有非极性键的形成
D.该过程的总反应式:
. .
.
【解析】
(Ⅱ)被氧化至 (Ⅲ)后,由于
正电性提高,更容易吸引电子,使配体
的键极性增强,更容易以 的
形式失去,即配体失去质子 能力增
强,从题图也可以看出,
失去的和结合变为 。
由上述分析可知,中 的化合价为
。
变为
时,有非
极性键 键形成。
由上述分析知D项正确。
14.(2023河北联考)某科研团队合作开发了活性位点催化剂,
先“吸氢”再将硝基化合物转化为氨基化合物,反应历程和每步的
活化能如图所示:
下列说法正确的是( )
C
A. 是该反应历程的中间产物
B.提高Ⅲ Ⅳ的反应速率,对快速提升总反应速率起决定性作用
C.Ⅰ Ⅱ Ⅲ Ⅳ的转化过程中, 元素的化合价逐渐降低
D.总反应为
【解析】 .
为催化剂而非中间产物。
根据题图中各步的活化能 可知,由硝基苯变为中间产物Ⅰ的活化能最大,属于
决速步骤,因此提高硝基苯 Ⅰ的反应速率,对快速提升总反应速率起决定性作用。
有机反应中,“去”或“加 ”的反应是氧化反应,化合价升
高;“去”或“加 ”的反应是还原反应,化合价降低。题图反应历
程中,物质Ⅰ 物质Ⅱ的反应中“加”,化合价降低;物质Ⅱ 物
质Ⅲ的反应中“去”,化合价降低;物质Ⅲ 物质Ⅳ的反应中
“去”,化合价降低。因此Ⅰ Ⅱ Ⅲ Ⅳ的转化过程中, 元
素的化合价逐渐降低。
由上述分析知D项错误。
15.(2023山东德州三模)苯和甲醇在催化剂
上反应生成甲苯的计算机模拟反应能
量如图所示。已知:代表反应过渡态、 代表
反应中间体。下列有关说法正确的是( )
D
A.反应过程中决速步骤的为
B.反应过程中不存在 键的形成
C.反应过程中铝元素的化合价发生了变化
D.降低温度能够增大苯的平衡转化率
【解析】
第一个基元反应的活化能最高,为决速步骤, 。
转化为的反应过程中, 中
键断裂,产物中 键形成。
反应过程中始终与形成4个共价键, 元素的化合价没有发生变化。
初始物质总能量 最终产物总能量,总反应为放热反应, ,降温,平衡正向
移动,反应物的平衡转化率提高。
速率常数
16.反应的速率方程为 ,该
反应在不同条件下的反应速率如下:
温度/ 反应速率
0.1 0.1
0.2 0.2
0.3 0.2
0.3 0.2
下列说法正确的是( )
C
A.
B.,
C.其他条件不变时,反应体系中四种物质浓度的改变,只有反应物浓度的改变对 有影
响,且 影响较大
D.在、条件下,若反应速率为,则
【解析】 温度越高,反应速率越大,当 ,
时,时的速率大于时的速率,所以 。
把时、和 、
代入速率方程 ,得
,则;把时 、
和、 代入速率方程
,得,则、 。
由速率方程可知,在其他条件不变时(即速率常数 不变)的
前提下,只有反应物浓度的改变对有影响,且 对速率的影响较大。
在、条件下,设,若反应速率为 ,则
,得,即 。
17.(2023安徽蚌埠三模)1889年, 提出了反应速率
常数随温度的变化关系、均为常数 。已知
,经历反应1和反应2两步。
反应
反应
两步反应的活化能。某课题组通过实验绘制出两步反应 表示平衡常数
、随 的变化曲线如图所示。下列说法不正确的是( )
B
A.与充分反应,放出热量小于
B.曲线③表示的是随 的变化关系
C.温度越高,单位时间内 的转化率可能越低
D.相同条件下,浓度的变化比 浓度的变化对反应速率影响更显著
【解析】 反应1、反应2均为放热反应,升高温度,平衡逆向移
动,平衡常数减小,故曲线①②为 曲线;升高温度,反应
速率增大,变大,故曲线③④为曲线;
、C均为常数,两步反应的活化能 ,则反应2斜率
的绝对值更大,故曲线④为随 的变化关系。
根据盖斯定律,由反应 反应2得
,
由于反应为可逆反应,故与 充分反应,放出的
热量小于 。
曲线④表示的是随 的变化关系。
反应 为放热反应,温度升高,
平衡逆向移动,则单位时间内 的转化率可能降低。
活化能越小反应越快,活化能越大反应越慢,决定总反应
速率的是慢反应。两步反应的活化能 ,反应2为决速
步,故相同条件下,浓度的变化比 浓度的变化对反应速率
影响更显著。
18.(1) (2020全国Ⅱ)高温下,甲烷生成乙烷的反应为 。反应
在初期阶段的速率方程为,其中 为反应速率常数。
① 设反应开始时的反应速率为,甲烷的转化率为 时的反应速率为,则
__________ 。
② 对于处于初期阶段的该反应,下列说法正确的是_____(填标号)。
AD
A.增加甲烷浓度,增大 B.增加浓度, 增大
C.乙烷的生成速率逐渐增大 D.降低反应温度, 减小
(2) (2020全国Ⅰ)接触法制硫酸生产中的关键工序是 的催化氧化:
。研究表明, 催化氧化的反
应速率方程为 。
式中:为反应速率常数,随温度升高而增大; 为 平衡转化
率,为某时刻转化率,为常数。在 时,将一系列温
度下的、 值代入上述速率方程,得到 曲线,如图所示。
曲线上最大值所对应温度称为该下反应的最适宜温度。
升高温度,增大使逐渐提高,但 降低使逐渐下降。时,增大对的提高大于 引起的降低;后,增大对的提高小于 引起的降低
时,逐渐提高;后, 逐渐下降。原因是__________________________________
____________________________________________________________________________
__________________________。
【解析】 (1)①设反应开始时甲烷浓度为,甲烷转化率为 时,甲烷的浓度为
。据,反应开始时,甲烷转化率为 时,
,所以。②根据,增大 浓度反应速率增
大,A项正确;由速率方程可知,初期阶段的反应速率与 浓度无关,B项
错误;反应物的浓度逐渐减小,结合速率方程可知, 的生成速率逐渐减小,C项
错误;反应速率常数与温度有关,温度降低,反应速率常数减小,D项正确。
1.(2023河北保定模拟)已知 的速率方程为
,为探究反应速率与 的关系,进行如下实
验:向锥形瓶中加入一定体积的溶液、 溶
液、醋酸溶液和水,充分搅拌,保持体系温度为 ,用秒表测量收集
所需要的时间 ,实验数据如下表。下列说法正确的是( )
实 验
溶液 溶液 醋酸溶液 水 1 4.0 4.0 8.0 332
2 6.0 4.0 4.0 6.0 148
3 4.0 4.0 4.0 83
4 12.0 4.0 4.0 37
A.;
B.实验3用表示的平均反应速率
C.醋酸不参与反应,其浓度的大小对该反应速率无影响
D.速率方程中
√
【解析】 为探究反应速率与的关系, 浓度应保持不变,根据实验
2数据可知,溶液总体积为,根据控制变量法,即变量单一可知, ,
, 。
题中没有给出标准状况这个条件,不能用来计算 的物质的量。
由速率方程知, 的浓度对反应速率有影响,则醋酸的浓度也会影响反应速率。
根据实验1和实验3数据分析,实验3中的 是实验1中的2倍,实验1和实验3
所用的时间比值为,可知反应速率和的平方成正比,故 。
2.(陌生概念)(2022葫芦岛测试)已知反应 ,速率方程为
。在金 表面分解的实验数据如表所示。
已知: 为速率常数,只与温度、催化剂有关,与反应物浓度无关;
时,该反应为0级反应,时,该反应为1级反应,以此类推, 可以为整数,
也可以为分数;
③浓度消耗一半所用的时间叫半衰期 。
0 20 40 60 80 100
0.100 0.080 0.060 0.020 0
下列说法正确的是( )
D
A.
B.该反应为2级反应
C.该反应的速率常数
D.保持其他条件不变,若起始浓度为,则半衰期为
【解析】 分析题表数据知, 的浓度变化与时间成正比,该反应是匀速反应,
。
为直线方程,的浓度与时间成正比,则 ,该反应是0级反
应。
该反应的反应速率
。
设起始浓度为,又,则 ,温度、催化剂不变,速率常数不变,
半衰期与起始浓度成正比,根据题表数据知,起始浓度为 时,半衰期为
,温度不变,速率常数不变,则起始浓度为时,半衰期为 。
3.(2023河南八市开学考)某科研团队用
催化苯酚羰基化合成 ,
并提出合成 的反应机理(如图所示),下
列有关该反应机理的说法错误的是( )
B
A.和 在反应中作中间产物
B.反应过程中 的化合价始终保持不变
C.反应过程中降低了反应的活化能,但未改变反应的
D.总反应方程式为
. .
.
【解析】
由上述分析知A项正确、D项正确。
该过程最后一步转化为 ,
的化合价升高。
由上述分析可知 作催化剂,催化剂
只能改变反应历程和降低活化能,加快反应速
率,但不能改变反应的 。
4.(2023浙江十校联考)恒温恒容条件下,向密闭容器中加入一定量 ,发生反应的化
学方程式为,。反应①的速率方程 ,反应②的速率方程
,式中、为速率常数。图a为该体系中、、 浓度随时间变化的曲线,
图b为反应①和②的~ 曲线。下列说法正确的是( )
A.随 的减小,反应①的速率不断下降,而反应②的速率不断增大
B.某时间段体系可能存在如下关系:
C.欲提高 的产率,需降低反应温度且控制反应时间
D.温度高于 时,总反应速率由反应②决定
√
【解析】 题图a分析:由题图a先判断,浓度一直降低的是,先生成,再生成 ,所
以浓度先升后降的是,持续上升的是。反应①的速率,由于 浓度一直降低,
所以 也一直降低。
题图b分析:随着逐渐增大,逐渐减小(即逐渐减小,速率常数 逐渐减小),且
反应②对应的速率常数随温度变化较为剧烈(也就是升温,增大幅度大于 ;降
温,减小幅度也大于)。反应①生成而反应②消耗 ,温度升高可以增大反应①
的反应速率进而提高 的产率,但必须控制好温度,若温度太高,反应②对应的速率常
数会明显大于,那此时反应②速率就会大幅增加,消耗 的速率也会大幅增加,导致
最终 的产率降低。
反应②的速率方程,由于浓度是先增后减,所以 先增大后减小。
在浓度达到最大值之前,单位时间内减少的浓度和 增加的浓度,即
;在浓度达到最大值之后,由于和浓度都减少,而 浓度增加,
单位时间内和减少的浓度增加的浓度,即 。
欲提高 的产率,可以适当提高温度加快反应①的速率,但要控制好温度与反应时
间,选择 的产率最大的温度与时间点。
当温度高于时, ,反应①为慢反应,因此,总反应速率由反应①决定。
杰哥补充
选项D其实用“阿伦尼乌斯公式 ”来解释更为完整,但对于高中题目我们进行
简化:在相同温度下,速率常数 越小,则对应反应的活化能越大,而活化能大的为慢
反应,决定总反应速率。
5.(2023山东模拟)已知。 时,向一恒容密闭
容器中充入一定量 ,发生上述反应,测得的数据如表所示。上述反应的正、逆反
应速率分别为和,、 为速率常数,只受
温度的影响。下列说法不正确的是( )
时间/ 0 500 1 000 1 500 2 000 2 500 3 000
5.00 3.52 2.40 1.75 1.23 1.00 1.00
C
A. 后,该反应体系内气体的平均相对分子质量不再发生变化
B.内,用表示的平均反应速率为
C.
D.若该反应在下的平衡常数为,则
【解析】 题给反应是气体分子数增大的吸热反应,由题给表格信息可知,
后,反应已达到平衡状态,故反应体系内气体的平均相对分子质量不再发生变化。
由题给热化学方程式可知, ,(【易错】速率之比等于化学计
量数之比)内,用 表示的平均反应速率为
。
当反应达到平衡后,, 、
,,则 。
该反应在下的,又 ,降低温度,平衡
逆向移动,平衡常数减小,若在时平衡常数为,则 。
6.(2023东北三省四市联考)光气 是一种重要的有机中间体,剧毒,是无色或略
带黄色的气体。
合成光气的反应为 ,反应的速率方程为
,已知 。测得速率和浓度的关系如表
所示。
序号
① 0.2 0.2
② 0.4 0.2
③ 0.2 0.8
(1) ___,__, __。
1
(2) 关于合成光气的反应。下列说法正确的是_____(填标号)。
BD
A.增大 浓度,正反应速率加快,逆反应速率不变
B.升高温度,、均增大,且 增大的程度大
C.改用其他催化剂,活化能改变,、 均不变
D.增大总压, 的转化率提高,平衡常数不变
【解析】 (1)由速率方程 可得
, ,由表中数据可得
, ,
,由得,解得,由得,解得 ,
平衡时,合成光气的净速率为0,即 ,又因
,可得,则 ,
,又因,故。
(2)合成光气的反应为,达平衡时增大 浓度,平衡
正向移动,正反应速率瞬时增大,随后减小,逆反应速率瞬时不变,随后增大。
合成光气的反应为放热反应,升高温度,平衡逆向移动,、均增大,且 逆
增大的程度大。
改用其他催化剂,活化能改变,反应速率改变,、 均改变。
平衡常数只与温度有关,因此增大总压,平衡正向移动, 的转化率提高,但平
衡常数不变。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
2025年高考化学考向分析
化学反应速率
化学反应速率的计算及影响因素
1.(2022浙江1月选考)在恒温恒容条件下,发生反应, 随时间的
变化如图中曲线甲所示。下列说法不正确的是( )
C
A.从、两点坐标可求得从到 时间间隔内该化学反应的平均速率
B.从 点切线的斜率可求得该化学反应在反应开始时的瞬时速率
C.在不同时刻都存在关系:
D.维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,
随时间变化关系如图中曲线乙所示
【解析】 由、两点的横、纵坐标可得到和,则到 的
平均反应速率 。
当点无限接近点时,趋近于0,的平均反应速率即为
点的瞬时速率,点处的切线的斜率,故从 点切线的斜率可求
得反应开始时的瞬时速率。
在不同时刻都有 。
其他条件相同,加入催化剂,反应达到平衡的时间缩短,但平衡转化率不变。
2.(2022浙江6月选考)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反
应: ,测得不同起始浓度和催化剂表面积下氨浓度随时
间的变化如下表所示,下列说法不正确的是( )
编号 时间/ 表面积/ 0 20 40 60 80
① 2.40 2.00 1.60 1.20 0.80
② 1.20 0.80 0.40
③ 2.40 1.60 0.80 0.40 0.40
A.实验①,,
B.实验②,时处于平衡状态,
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
【解析】 实验①中, ,氨气浓度变化量为
,
,根据反应速率之比等于化学
计量数之比推知, 。
√
催化剂表面积大小只影响反应速率,不影响平衡,实验③中 初始浓度与实验①
中一样,实验③达到平衡时浓度为 ,则实验①达到平衡时
浓度也是;实验②中 初始浓度是实验①的一半,在恒温恒
容下,实验②相当于实验①减压,对于 而言,减压相当
于平衡正移了,所以实验①中的平衡浓度为 ,而实验②因为
有了平衡正移的效果,所以的平衡浓度小于,也就是 。
分析表格数据可知,实验①、实验②在、 氨气浓度变化量
都是 ,也代表在这些时间段内反应速率相同,而实验①、实验②
的催化剂表面积都是相同的,不同之处在于实验①中初始浓度是实验②中 初始
浓度的两倍,可知在相同条件下,增加氨气浓度,反应速率并没有增大。
对比实验①和实验③, 初始浓度相同,实验③中催化剂表面积是实验①中催化
剂表面积的2倍,实验③先达到平衡状态,可知实验③的反应速率大,说明相同条件下,
增加催化剂的表面积,反应速率增大。
3.(2022北京)捕获和转化可减少 排放并实现资源利用,原理如图1所示。反应
①完成之后,以为载气,将恒定组成的、 混合气,以恒定流速通入反应器,单
位时间流出气体各组分的物质的量随反应时间的变化如图2所示。反应过程中始终未检
测到 ,在催化剂上有积碳。
下列说法不正确的是( )
C
A.反应①为;反应②为
B.,比多,且生成 的速率不变,推测有副反应
C.时,副反应生成的速率大于反应②生成 的速率
D.之后,生成 的速率为0,是因为反应②不再发生
【解析】 由题图1所示信息可知,反应①的反应物为和,生成物为 ,
因此反应①的化学方程式为;反应②的反应物为和 ,生
成物为、、,因此反应②的化学方程式为 。
由题图2信息可知,,比多,且生成 的速率不变,根
据反应②的化学方程式,和应该是按生成的,为何 少了呢?我们发现,题
目还提到“反应过程中始终未检测到,在催化剂上有积碳”,所以合理推断是 发
生了副反应 。
(【提醒】无论是主反应还是上述可能发生的副反应,每消耗1个都是生成2个 ,
因此在之间,流出速率都是固定的,但有部分生成C而不是 ,
因此就比 少了)
时,的流速大约是 (本题是比大小,不需要准确数值),
可知主反应中一起生成的流速也大约是,由于时 流速是
,表示副反应中生成的流速大约是,可知 时,
副反应生成的速率小于反应②生成 的速率。
由题图2信息可知,之后,生成的速率为0,生成 的速率也逐渐减小最后
为0,而的流速逐渐增大,最终恢复到(别忘了 始终以恒定流速
通入反应器),判断是因为反应②不再发生,随后副反应速率逐渐减小最终停止,最终
不再消耗,和 不再生成。
4.(2023广东广州联考二模)汽车尾气中 生成的反应为
。一定条件下,等物质的量的 和
在恒容密闭容器中反应,曲线表示该反应在温度下
随时间的变化,曲线 表示该反应在某一起始条件改变时
随时间 的变化。下列叙述不正确的是( )
B
A.温度下,内
B.点小于点
C.曲线 对应的条件改变可能是充入氧气
D.若曲线对应的条件改变是升高温度,则
【解析】 温度下,内氮气的浓度从减少到 ,
。
可画出速率-时间图像进行分析,如图:
假设曲线对应的条件改变是充入氧气,增加反应物 ,反应速率加快,更快达到
平衡,且平衡时氮气的浓度比曲线 对应的小。
若曲线 对应的条件改变是升温,则说明升温平衡正向移动,则正反应为吸热反应。
有关基元反应、活化能、催化剂的分析
5.(2024广东六校联考)反应物转化为产物 时的能量变化与反应进程的关系如图
曲线①所示,使用催化剂 后能量变化与反应进程的关系如图曲线②所示。下列说法正
确的是( )
C
A.稳定性:
B.使用催化剂降低了该反应的焓变
C.使用催化剂后,反应历程分3步进行
D.使用催化剂后,反应历程中的决速步为
【解析】 的能量比 高,根据能量越低物质
越稳定,知稳定性: 。
使用催化剂可以降低活化能,但不改变焓变。
使用催化剂后,反应历程为 、
、 ,分3步进行。
由题图可知,使用催化剂后,反应历程中
的活化能最大,为决速步。
6.(2022广东)在相同条件下研究催化剂Ⅰ、Ⅱ对反应
的影响,各物质浓度随反应时间 的部分变化曲线
如图,则( )
D
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.曲线表示使用催化剂Ⅱ时的浓度随 的变化
D.使用催化剂Ⅰ时, 内,
【解析】 由题图可知,无催化剂时,生成物浓度一
直在增加,只是反应比较慢,说明无催化剂时反应也能
进行 。(【提醒】催化剂只能影响化学反应的快慢,不
能决定反应是否发生)
分析题图可知,在相同时间内,催化剂Ⅰ对应的产物
浓度变化量大、反应速率快,可说明催化剂Ⅰ比催化剂Ⅱ
催化效果好,说明催化剂Ⅰ使反应活化能更低,反应更快。
图中的曲线表示的是反应物的浓度随的变化,在内 的浓度变化为
,根据反应方程式可知,在内生成物 的浓度变化为
,对应的是催化剂Ⅰ,因此曲线表示使用催化剂Ⅰ时的浓度随 的变化。
使用催化剂Ⅰ时,的浓度随的变化为曲线,在 内,则
。
7.(2021山东)标记的乙酸甲酯在足量 溶液中发生
水解,部分反应历程可表示
为
。能量变化如图所示。已知
为快速平衡,下列说法正确的是 ( )
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在
C.反应结束后,溶液中存在
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
√
【解析】 一般来说,反应的活化能越高,反应速率越慢,分
析题图可知,反应Ⅰ和反应Ⅳ的活化能较高,因此反应的决速步为
反应Ⅰ、Ⅳ。
反应Ⅰ生成 ,由题目信息“
为快速平衡”可知会有 生成,最后再经过反应Ⅱ,断 键,生成
和,因此反应结束后,溶液中存在 。
参与反应Ⅲ的离子有 、 ,但无论是哪种
离子参与反应,反应Ⅲ都只会生成,溶液中没有 。
总反应的焓变应该是生成物的总能量-反应物的总能量,
(【技法】总反应的焓变反应Ⅰ的活化能-反应Ⅱ的活化能 反应
Ⅲ的活化能-反应Ⅳ的活化能)反应Ⅰ与反应Ⅳ活化能的差值从图形
上来看,很明显不是总反应的焓变。
8.(2023山东济南三模,双选)萘与三氧化硫反应同时生成 萘磺酸( )与
萘磺酸( ),稳定性:萘磺酸 萘磺酸,反应过程中的能量变
化如图所示,1、2、3、4是中间产物,、 各代表一种产物。下列说法正确的是
( )
A.较高温度下,反应的主要产物是 萘磺酸
B.升高相同温度,生成 萘磺酸的反应速率变化更大
C.实验中测得2的浓度大于4,是因为生成 的反应焓变更大
D.选择不同催化剂,对产物中、 的含量不会产生影响
【解析】 由题目信息“稳定性:萘磺酸 萘磺酸”,可知稳定性大的
萘磺酸能量较低(【点拨】能量越低越稳定),则表示萘磺酸,表示 萘
磺酸;分析题图,生成萘磺酸的决速步骤(反应物)的活化能较生成 萘磺酸
的决速步骤(反应物 )的活化能大,而活化能较大的反应其反应速率受温度影响较
大(【杰哥补充】此结论可以通过阿伦尼乌斯公式导证出来,高中不需要知道过程,直
接作为二级结论记忆即可),因此较高温度下,生成 萘磺酸的反应速率增幅较大,
可知较高温度下,反应的主要产物是 萘磺酸。
√
√
反应的活化能较大,反应的活化能较小,因此 的反应速率较小,
所以实验中测得2的浓度大于4。
催化剂具有选择性,如某种催化剂能提高生成的反应速率,但却不能提高生成
的反应速率,因此选择不同催化剂,会影响反应的选择性,进而影响产物中、 的含
量。
9.(2022海南)某空间站的生命保障系统功能之一是实现氧循环。其中涉及反应:
。
在相同条件下,与 还会发生不利于氧循环的副反应:
。在反应器中按 通入
反应物,在不同温度、不同催化剂条件下,反应进行到 时,测得反应器中
、浓度 如表所示。
催化剂
催化剂Ⅰ 10.8 12 722 345.2 42 780
催化剂Ⅱ 9.2 10 775 34 38 932
在选择使用催化剂Ⅰ和条件下反应,生成 的平均反应速率为____
;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和 的反应
条件,原因是________________________________________________________________
_______________________。
5.4
相同催化剂,的反应速率更快,相同温度,催化剂Ⅱ副反应物浓度低,甲烷与甲醇的比例高
【解析】 在选择使用催化剂Ⅰ和 条件下反应,由题表中信息可知,
的浓度由0增加到,因此,生成 的平均
反应速率为 。空间站氧循环涉及的反应为
,不利于氧循环的副反应为
,可知氧循环反应速率越快,单位时间内
生成越多而越少[即 越大],越有利于空间站的氧循环。由题表中
信息可知,在选择使用催化剂Ⅰ和条件下反应, 的浓度由0增加
到, ;在选择使用催化剂Ⅱ和
的反应条件下,的浓度由0增加到 ,
;在选择使用催化剂Ⅰ和 条件下反应,
的浓度由0增加到 ,
;在选择使用催化剂Ⅱ和 的反应条件
下,的浓度由0增加到 ,
。 ,甲烷的浓度太低了,可知氧循环
速率慢,不合适;,催化剂Ⅱ对应的 是催化剂Ⅰ对应的将近10倍,因此
使用催化剂Ⅱ和 的反应条件是最合适的。
10.(2023全国甲)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1) 电喷雾电离等方法得到的(、、等)与
反应可得。与 反应能高选择性地生成甲醇。分别
在和 下(其他反应条件相同)进行反应
,结果如图所示。图中 的曲线
是___(填“”或“”)。、时 的转化率为
_________________(列出算式)。
(2) 分别与、 反应,体系的能量随反应进程
的变化如图所示(两者历程相似,图中以 示例)。
(ⅰ) 步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是__
(填“Ⅰ”或“Ⅱ”)。
Ⅰ
(ⅱ) 直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则
与反应的能量变化应为图中曲线___(填“”或“ ”)。
(ⅲ) 与反应,氘代甲醇的产量___(填“ ”“”或“ ”)。
若与 反应,生成的氘代甲醇有___种。
2
【解析】 (1)由原子守恒可知, 为
定值,随着反应进行,逐渐转变为 ,则
减小,故 逐渐增大。温度
越高,反应速率越大,在相同时间内 的
变化量越大,因此曲线表示、曲线表示 。
设起始时,则根据原子守恒,始终为 。
根据题图,在
、时 ,即
,因此的转化率为 。
(2)(ⅰ)步骤Ⅰ涉及键断裂和 键生成,涉及
氢原子成键变化;步骤Ⅱ涉及键、 键断裂和
键生成,没有涉及氢原子成键变化。
(ⅱ)的D(氘)是比的更重的 的同位素,根
据题目信息“直接参与化学键变化的元素被替换为更重的
同位素时,反应速率会变慢”,因此与 反应的步
骤Ⅰ速率较慢,对应的活化能较高,根据图示可知,
与反应的能量变化应为图中曲线 。
(ⅲ)根据(ⅱ)所给的信息以及步骤Ⅰ的成键变化可知,
断裂键并生成键的速率比断裂 键并生成
键的速率慢,因此相同时间内生成 比生成
少,产量。若与
反应,可以断裂键并生成键得到 ,也
可以断裂键并生成键得到 ,因此生成
的氘代甲醇有2种。
“环形”反应机理图与“梯形”能量关系图分析
大招14 对应练习
解题觉醒
“梯形”能量关系图分析
第一步:分析图像中反应的起始物与最终物质所具有的相对能量大小,确定总反应的焓
变及反应吸、放热类型。
第二步:计算每步反应的能垒,确定决速步骤,确定慢反应和快反应。
第三步:根据图像分析结合题目要求作答。
“环形”反应机理图分析
第一步:审题干,明确反应目的,确定催化剂、反应物和生成物。
第二步:分析图像,找出图像中的反应物、生成物、催化剂、中间体。
(1)“箭头”指入的为反应物,“箭头”指出的为生成物。
(2)按“箭头”方向,最终生成物与起始反应物中间的物质一般为催化剂。
(3)“环上”物质除催化剂外,其余为中间体。
第三步:根据图像分析结合题目要求作答。
11.(2023安徽安庆模拟)任何有机化合物的分子都是由特定
碳骨架构成的,构建碳骨架是合成有机化合物的重要任务。
某构建碳骨架的反应历程如图所示,下列关于该反应的说法
错误的是( )
C
A.反应过程中 的成键数目发生改变
B.图中所示物质间的转化有非极性键的断裂和形成
C.分子中采用 杂化的仅有C原子
D.该构建碳骨架的总反应为
,
原子利用率为
【解析】 .
中钴原子的成键数目均为4,③中钴原子的成键
数目为5,⑤中钴原子的成键数目为6,说明反应过程中 的
成键数目发生改变。
过程非极性键碳碳双键断裂, 过程非极
性键碳碳单键形成。
甲醇分子中饱和碳原子和饱和氧原子的杂化方式都为 。
总反应的产物唯一,原子利用率为 。
12.(2023江西赣州期末)铋基催化剂对 电化学还原制
取 具有高效选择性,其反应历程与能量变化如图所
示,其中吸附在催化剂表面上的物种用*标注。下列说法错
误的是( )
D
A.使用催化剂更有利于 的吸附
B.使用不同铋基催化剂,反应的焓变相等
C.电化学还原制取的反应的
D.生成 的反应:
【解析】
13.(2023湖南) 是一种强还原性的高
能物质,在航天、能源等领域有广泛应用。
我国科学家合成的某 (Ⅱ)催化剂
(用 表示)能高效电催化
氧化合成 ,其反应机理如图所示。
下列说法错误的是( )
B
A.(Ⅱ)被氧化至(Ⅲ)后,配体 失去质子能力增强
B.中的化合价为
C.该过程有非极性键的形成
D.该过程的总反应式:
. .
.
【解析】
(Ⅱ)被氧化至 (Ⅲ)后,由于
正电性提高,更容易吸引电子,使配体
的键极性增强,更容易以 的
形式失去,即配体失去质子 能力增
强,从题图也可以看出,
失去的和结合变为 。
由上述分析可知,中 的化合价为
。
变为
时,有非
极性键 键形成。
由上述分析知D项正确。
14.(2023河北联考)某科研团队合作开发了活性位点催化剂,
先“吸氢”再将硝基化合物转化为氨基化合物,反应历程和每步的
活化能如图所示:
下列说法正确的是( )
C
A. 是该反应历程的中间产物
B.提高Ⅲ Ⅳ的反应速率,对快速提升总反应速率起决定性作用
C.Ⅰ Ⅱ Ⅲ Ⅳ的转化过程中, 元素的化合价逐渐降低
D.总反应为
【解析】 .
为催化剂而非中间产物。
根据题图中各步的活化能 可知,由硝基苯变为中间产物Ⅰ的活化能最大,属于
决速步骤,因此提高硝基苯 Ⅰ的反应速率,对快速提升总反应速率起决定性作用。
有机反应中,“去”或“加 ”的反应是氧化反应,化合价升
高;“去”或“加 ”的反应是还原反应,化合价降低。题图反应历
程中,物质Ⅰ 物质Ⅱ的反应中“加”,化合价降低;物质Ⅱ 物
质Ⅲ的反应中“去”,化合价降低;物质Ⅲ 物质Ⅳ的反应中
“去”,化合价降低。因此Ⅰ Ⅱ Ⅲ Ⅳ的转化过程中, 元
素的化合价逐渐降低。
由上述分析知D项错误。
15.(2023山东德州三模)苯和甲醇在催化剂
上反应生成甲苯的计算机模拟反应能
量如图所示。已知:代表反应过渡态、 代表
反应中间体。下列有关说法正确的是( )
D
A.反应过程中决速步骤的为
B.反应过程中不存在 键的形成
C.反应过程中铝元素的化合价发生了变化
D.降低温度能够增大苯的平衡转化率
【解析】
第一个基元反应的活化能最高,为决速步骤, 。
转化为的反应过程中, 中
键断裂,产物中 键形成。
反应过程中始终与形成4个共价键, 元素的化合价没有发生变化。
初始物质总能量 最终产物总能量,总反应为放热反应, ,降温,平衡正向
移动,反应物的平衡转化率提高。
速率常数
16.反应的速率方程为 ,该
反应在不同条件下的反应速率如下:
温度/ 反应速率
0.1 0.1
0.2 0.2
0.3 0.2
0.3 0.2
下列说法正确的是( )
C
A.
B.,
C.其他条件不变时,反应体系中四种物质浓度的改变,只有反应物浓度的改变对 有影
响,且 影响较大
D.在、条件下,若反应速率为,则
【解析】 温度越高,反应速率越大,当 ,
时,时的速率大于时的速率,所以 。
把时、和 、
代入速率方程 ,得
,则;把时 、
和、 代入速率方程
,得,则、 。
由速率方程可知,在其他条件不变时(即速率常数 不变)的
前提下,只有反应物浓度的改变对有影响,且 对速率的影响较大。
在、条件下,设,若反应速率为 ,则
,得,即 。
17.(2023安徽蚌埠三模)1889年, 提出了反应速率
常数随温度的变化关系、均为常数 。已知
,经历反应1和反应2两步。
反应
反应
两步反应的活化能。某课题组通过实验绘制出两步反应 表示平衡常数
、随 的变化曲线如图所示。下列说法不正确的是( )
B
A.与充分反应,放出热量小于
B.曲线③表示的是随 的变化关系
C.温度越高,单位时间内 的转化率可能越低
D.相同条件下,浓度的变化比 浓度的变化对反应速率影响更显著
【解析】 反应1、反应2均为放热反应,升高温度,平衡逆向移
动,平衡常数减小,故曲线①②为 曲线;升高温度,反应
速率增大,变大,故曲线③④为曲线;
、C均为常数,两步反应的活化能 ,则反应2斜率
的绝对值更大,故曲线④为随 的变化关系。
根据盖斯定律,由反应 反应2得
,
由于反应为可逆反应,故与 充分反应,放出的
热量小于 。
曲线④表示的是随 的变化关系。
反应 为放热反应,温度升高,
平衡逆向移动,则单位时间内 的转化率可能降低。
活化能越小反应越快,活化能越大反应越慢,决定总反应
速率的是慢反应。两步反应的活化能 ,反应2为决速
步,故相同条件下,浓度的变化比 浓度的变化对反应速率
影响更显著。
18.(1) (2020全国Ⅱ)高温下,甲烷生成乙烷的反应为 。反应
在初期阶段的速率方程为,其中 为反应速率常数。
① 设反应开始时的反应速率为,甲烷的转化率为 时的反应速率为,则
__________ 。
② 对于处于初期阶段的该反应,下列说法正确的是_____(填标号)。
AD
A.增加甲烷浓度,增大 B.增加浓度, 增大
C.乙烷的生成速率逐渐增大 D.降低反应温度, 减小
(2) (2020全国Ⅰ)接触法制硫酸生产中的关键工序是 的催化氧化:
。研究表明, 催化氧化的反
应速率方程为 。
式中:为反应速率常数,随温度升高而增大; 为 平衡转化
率,为某时刻转化率,为常数。在 时,将一系列温
度下的、 值代入上述速率方程,得到 曲线,如图所示。
曲线上最大值所对应温度称为该下反应的最适宜温度。
升高温度,增大使逐渐提高,但 降低使逐渐下降。时,增大对的提高大于 引起的降低;后,增大对的提高小于 引起的降低
时,逐渐提高;后, 逐渐下降。原因是__________________________________
____________________________________________________________________________
__________________________。
【解析】 (1)①设反应开始时甲烷浓度为,甲烷转化率为 时,甲烷的浓度为
。据,反应开始时,甲烷转化率为 时,
,所以。②根据,增大 浓度反应速率增
大,A项正确;由速率方程可知,初期阶段的反应速率与 浓度无关,B项
错误;反应物的浓度逐渐减小,结合速率方程可知, 的生成速率逐渐减小,C项
错误;反应速率常数与温度有关,温度降低,反应速率常数减小,D项正确。
1.(2023河北保定模拟)已知 的速率方程为
,为探究反应速率与 的关系,进行如下实
验:向锥形瓶中加入一定体积的溶液、 溶
液、醋酸溶液和水,充分搅拌,保持体系温度为 ,用秒表测量收集
所需要的时间 ,实验数据如下表。下列说法正确的是( )
实 验
溶液 溶液 醋酸溶液 水 1 4.0 4.0 8.0 332
2 6.0 4.0 4.0 6.0 148
3 4.0 4.0 4.0 83
4 12.0 4.0 4.0 37
A.;
B.实验3用表示的平均反应速率
C.醋酸不参与反应,其浓度的大小对该反应速率无影响
D.速率方程中
√
【解析】 为探究反应速率与的关系, 浓度应保持不变,根据实验
2数据可知,溶液总体积为,根据控制变量法,即变量单一可知, ,
, 。
题中没有给出标准状况这个条件,不能用来计算 的物质的量。
由速率方程知, 的浓度对反应速率有影响,则醋酸的浓度也会影响反应速率。
根据实验1和实验3数据分析,实验3中的 是实验1中的2倍,实验1和实验3
所用的时间比值为,可知反应速率和的平方成正比,故 。
2.(陌生概念)(2022葫芦岛测试)已知反应 ,速率方程为
。在金 表面分解的实验数据如表所示。
已知: 为速率常数,只与温度、催化剂有关,与反应物浓度无关;
时,该反应为0级反应,时,该反应为1级反应,以此类推, 可以为整数,
也可以为分数;
③浓度消耗一半所用的时间叫半衰期 。
0 20 40 60 80 100
0.100 0.080 0.060 0.020 0
下列说法正确的是( )
D
A.
B.该反应为2级反应
C.该反应的速率常数
D.保持其他条件不变,若起始浓度为,则半衰期为
【解析】 分析题表数据知, 的浓度变化与时间成正比,该反应是匀速反应,
。
为直线方程,的浓度与时间成正比,则 ,该反应是0级反
应。
该反应的反应速率
。
设起始浓度为,又,则 ,温度、催化剂不变,速率常数不变,
半衰期与起始浓度成正比,根据题表数据知,起始浓度为 时,半衰期为
,温度不变,速率常数不变,则起始浓度为时,半衰期为 。
3.(2023河南八市开学考)某科研团队用
催化苯酚羰基化合成 ,
并提出合成 的反应机理(如图所示),下
列有关该反应机理的说法错误的是( )
B
A.和 在反应中作中间产物
B.反应过程中 的化合价始终保持不变
C.反应过程中降低了反应的活化能,但未改变反应的
D.总反应方程式为
. .
.
【解析】
由上述分析知A项正确、D项正确。
该过程最后一步转化为 ,
的化合价升高。
由上述分析可知 作催化剂,催化剂
只能改变反应历程和降低活化能,加快反应速
率,但不能改变反应的 。
4.(2023浙江十校联考)恒温恒容条件下,向密闭容器中加入一定量 ,发生反应的化
学方程式为,。反应①的速率方程 ,反应②的速率方程
,式中、为速率常数。图a为该体系中、、 浓度随时间变化的曲线,
图b为反应①和②的~ 曲线。下列说法正确的是( )
A.随 的减小,反应①的速率不断下降,而反应②的速率不断增大
B.某时间段体系可能存在如下关系:
C.欲提高 的产率,需降低反应温度且控制反应时间
D.温度高于 时,总反应速率由反应②决定
√
【解析】 题图a分析:由题图a先判断,浓度一直降低的是,先生成,再生成 ,所
以浓度先升后降的是,持续上升的是。反应①的速率,由于 浓度一直降低,
所以 也一直降低。
题图b分析:随着逐渐增大,逐渐减小(即逐渐减小,速率常数 逐渐减小),且
反应②对应的速率常数随温度变化较为剧烈(也就是升温,增大幅度大于 ;降
温,减小幅度也大于)。反应①生成而反应②消耗 ,温度升高可以增大反应①
的反应速率进而提高 的产率,但必须控制好温度,若温度太高,反应②对应的速率常
数会明显大于,那此时反应②速率就会大幅增加,消耗 的速率也会大幅增加,导致
最终 的产率降低。
反应②的速率方程,由于浓度是先增后减,所以 先增大后减小。
在浓度达到最大值之前,单位时间内减少的浓度和 增加的浓度,即
;在浓度达到最大值之后,由于和浓度都减少,而 浓度增加,
单位时间内和减少的浓度增加的浓度,即 。
欲提高 的产率,可以适当提高温度加快反应①的速率,但要控制好温度与反应时
间,选择 的产率最大的温度与时间点。
当温度高于时, ,反应①为慢反应,因此,总反应速率由反应①决定。
杰哥补充
选项D其实用“阿伦尼乌斯公式 ”来解释更为完整,但对于高中题目我们进行
简化:在相同温度下,速率常数 越小,则对应反应的活化能越大,而活化能大的为慢
反应,决定总反应速率。
5.(2023山东模拟)已知。 时,向一恒容密闭
容器中充入一定量 ,发生上述反应,测得的数据如表所示。上述反应的正、逆反
应速率分别为和,、 为速率常数,只受
温度的影响。下列说法不正确的是( )
时间/ 0 500 1 000 1 500 2 000 2 500 3 000
5.00 3.52 2.40 1.75 1.23 1.00 1.00
C
A. 后,该反应体系内气体的平均相对分子质量不再发生变化
B.内,用表示的平均反应速率为
C.
D.若该反应在下的平衡常数为,则
【解析】 题给反应是气体分子数增大的吸热反应,由题给表格信息可知,
后,反应已达到平衡状态,故反应体系内气体的平均相对分子质量不再发生变化。
由题给热化学方程式可知, ,(【易错】速率之比等于化学计
量数之比)内,用 表示的平均反应速率为
。
当反应达到平衡后,, 、
,,则 。
该反应在下的,又 ,降低温度,平衡
逆向移动,平衡常数减小,若在时平衡常数为,则 。
6.(2023东北三省四市联考)光气 是一种重要的有机中间体,剧毒,是无色或略
带黄色的气体。
合成光气的反应为 ,反应的速率方程为
,已知 。测得速率和浓度的关系如表
所示。
序号
① 0.2 0.2
② 0.4 0.2
③ 0.2 0.8
(1) ___,__, __。
1
(2) 关于合成光气的反应。下列说法正确的是_____(填标号)。
BD
A.增大 浓度,正反应速率加快,逆反应速率不变
B.升高温度,、均增大,且 增大的程度大
C.改用其他催化剂,活化能改变,、 均不变
D.增大总压, 的转化率提高,平衡常数不变
【解析】 (1)由速率方程 可得
, ,由表中数据可得
, ,
,由得,解得,由得,解得 ,
平衡时,合成光气的净速率为0,即 ,又因
,可得,则 ,
,又因,故。
(2)合成光气的反应为,达平衡时增大 浓度,平衡
正向移动,正反应速率瞬时增大,随后减小,逆反应速率瞬时不变,随后增大。
合成光气的反应为放热反应,升高温度,平衡逆向移动,、均增大,且 逆
增大的程度大。
改用其他催化剂,活化能改变,反应速率改变,、 均改变。
平衡常数只与温度有关,因此增大总压,平衡正向移动, 的转化率提高,但平
衡常数不变。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
