电离平衡 -2025年高考化学考向分析(共50张PPT)
文档属性
| 名称 | 电离平衡 -2025年高考化学考向分析(共50张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-27 19:21:59 | ||
图片预览










文档简介
(共50张PPT)
2025年高考化学考向分析
电离平衡
弱电解质的电离平衡
1.(2023广东六校联考)二元酸在水中存在电离: ,
。下列说法正确的是( )
C
A. 溶液中含A的物种有3种
B.室温下,溶液中水电离出的
C.溶液中
D.将的溶液加水稀释, 减小
【解析】 根据题给电离方程式可知, 第一步完全电离,第二步部分电离,则
溶液中含A的物种有和 ,共2种。
只电离,不水解,溶液显酸性,水的电离受到抑制,故室温下,
溶液中水电离出的 。
溶液中存在电荷守恒:
(【口诀】阳离子摆一边、阴离子摆一边,电荷数往前乘),溶液显酸性,
,故 。
,将的溶液加水稀释,促进水解, 减
少,增加,所以 增大。
2.(2020北京)室温下,对于 醋酸溶液,下列判断正确的是( )
C
A.该溶液中的粒子数为
B.加入少量固体后,溶液的 降低
C.滴加溶液过程中,与之和始终为
D.与溶液反应的离子方程式为
【解析】 属于弱电解质,不能完全电离, 醋酸溶液中,
粒子数小于 。
加入少量固体,抑制醋酸的电离(同离子效应), 浓度降低,溶液
的 升高。
根据元素质量守恒: 醋酸溶液中
。
醋酸是弱电解质,在离子反应中不能拆写成离子,正确的离子方程式为
。
3.(2021浙江6月选考)某同学拟用计测定溶液以探究某酸 是否为弱电解质。下
列说法正确的是( )
B
A.时,若测得溶液,则 是弱酸
B.时,若测得溶液且,则 是弱酸
C.时,若测得溶液,取该溶液,加蒸馏水稀释至 ,测得
,,则 是弱酸
D.时,若测得溶液,取该溶液,升温至,测得 ,
,则 是弱酸
【解析】 时,溶液,即溶液呈中性,说明 不水
解, 为强酸。
时,的溶液且,说明 部分电离,溶液中存
在电离平衡,即 为弱酸。
无论是强酸还是弱酸,当 时,将溶液稀释至体积为原来的10倍时,稀
释后溶液的只能接近7,即,故据此无法判断 是弱酸。(一般来说,将
强酸的溶液稀释至体积为原来的10倍, 增大1,C项需考虑特殊情况,若原来酸溶液
的,稀释至体积为原来的10倍类似于无限稀释,会出现 变化小于1的情况,故
据此无法判断该酸是强酸还是弱酸)
若为强酸,则 溶液呈中性,但升温能促进水的电离,水的离子积常数增大,
溶液中、均增大,即溶液减小,,故据此不能判断 为弱酸。
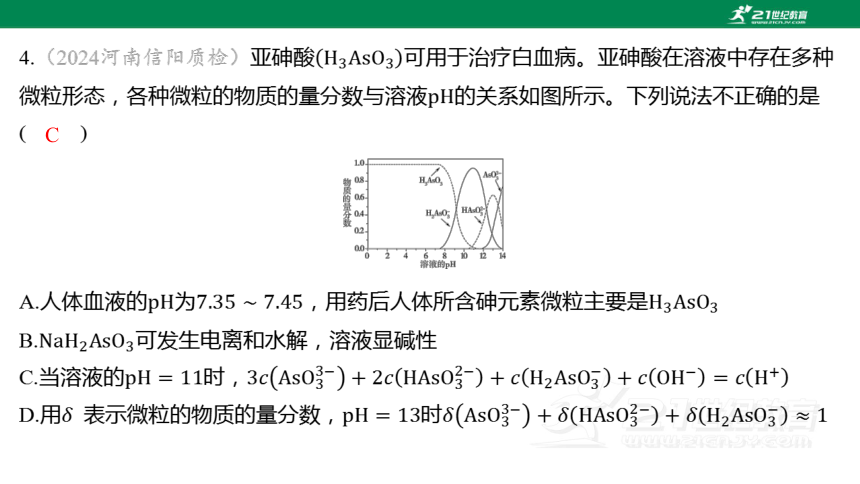
4.(2024河南信阳质检)亚砷酸 可用于治疗白血病。亚砷酸在溶液中存在多种
微粒形态,各种微粒的物质的量分数与溶液 的关系如图所示。下列说法不正确的是
( )
C
A.人体血液的为,用药后人体所含砷元素微粒主要是
B. 可发生电离和水解,溶液显碱性
C.当溶液的时,
D.用 表示微粒的物质的量分数,时
【解析】 分析题图可知当在之间时,
元素的主要存在形式为 。
分析题图及砷元素的存在形式可知, 可发生电
离和水解,又的物质的量分数最大时,溶液
(【说明】 的水解程度大于其电离程度),溶液显碱性。
当溶液的时,溶液中阳离子除 外还有加入的碱的阳离子,则根据电荷守
恒有 。
分析题图可知,当溶液的时,溶液中含的微粒主要有 、
、,用 表示微粒的物质的量分数,则
。
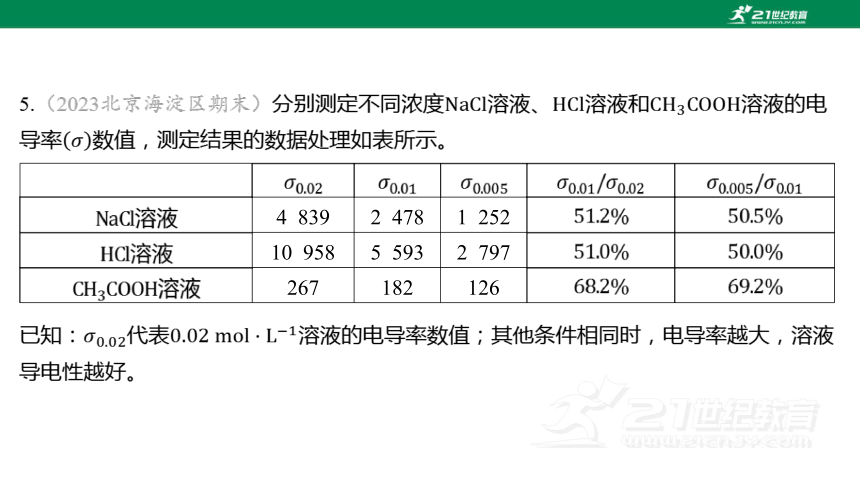
5.(2023北京海淀区期末)分别测定不同浓度溶液、溶液和 溶液的电
导率 数值,测定结果的数据处理如表所示。
溶液 4 839 2 478 1 252
溶液 10 958 5 593 2 797
溶液 267 182 126
已知:代表 溶液的电导率数值;其他条件相同时,电导率越大,溶液
导电性越好。
下列说法不正确的是( )
B
A.仅由 的数据不能说明三种电解质的强弱
B.表中数据不能说明同等条件下与 的导电能力强弱
C. 比值数据能说明 存在电离平衡
D.溶液的 数据能说明溶液越稀, 的电离程度越大
【解析】 、均为强电解质,不能仅由的数据说明、 电解质的
强弱。
同等条件下,氯离子浓度相同,氯离子的导电能力相同, 溶液的电导率大于
溶液的电导率,说明同等条件下的导电能力比 的导电能力强。
分析题表中数据可知,溶液、溶液的 比值数据约等于浓度之比,说
明两者均不存在电离平衡,而溶液的 比值数据却大于浓度之比,说明
存在电离平衡,且由和的值知,溶液越稀, 的
电离程度越大。
6.(2022全国乙)常温下,一元酸的。在某体系中,与 离
子不能穿过隔膜,未电离的 可自由穿过该膜(如图所示)。设溶液中
,当达到平衡时,下列叙述正确的是( )
B
A.溶液Ⅰ中
B.溶液Ⅱ中的的电离度为
C.溶液Ⅰ和Ⅱ中的 不相等
D.溶液Ⅰ和Ⅱ中的之比为
【解析】 常温下溶液Ⅰ的 ,则
溶液Ⅰ中,
。
常温下溶液Ⅱ的 ,即 ,代入
,可推出
,因此
。
根据题意,未电离的可自由穿过隔膜,故溶液Ⅰ和Ⅱ中的 相等。
溶液Ⅰ的
,
,因此溶液Ⅰ中
,即
;由B项分析知,溶
液Ⅱ中 ,即
,
两溶液的相等 。
杰哥支招
溶液Ⅰ的浓度很小,会促使
平衡逆移,降低;当溶液Ⅰ中的
降低,溶液Ⅱ中的 便会移动到溶液Ⅰ中,因
此从A原子守恒角度来看,溶液Ⅰ中的
肯定要大于溶液Ⅱ中的 ,D项不用计
算也可以判断是错误的,在考试中可以节省
大量推导时间哦
电离平衡常数
7.(2023重庆调研)常温下,部分弱酸的电离平衡常数如表所示。下列离子方程式书写正
确的是( )
化学式
电离常 数 ; ;
C
A.向溶液中滴加少量氯水:
B.向溶液中通入过量
C.向溶液中通入少量
D.向溶液中通入过量
【解析】 根据题表电离常数可知,酸性:,向 溶液中滴
加少量氯水,、都能与反应生成 ,正确的离子方程式为
。
根据题表电离常数可知,酸性:,向 溶液中通入过量
,生成和,正确的离子方程式为 。
向溶液中通入过量,发生氧化还原反应: 。
8.(2023广东二模)时,苯胺的电离平衡常数 。下列说
法正确的是( )
D
A.苯胺的电离方程式为
B.分别加热浓度均为的溶液和溶液,两者的 均增大
C.浓度为的溶液中,
D.等体积、等浓度的溶液和 溶液混合后,溶液呈酸性
【解析】 苯胺是一元弱碱,电离方程式为 。
为强酸弱碱盐,水解使溶液呈酸性,且水解反应是吸热反应,升高温
度,水解程度增大,溶液中浓度增大,溶液减小; 是强酸,在水溶液中完全
电离,升高温度,溶液的 基本不变。
苯胺是一元弱碱,在溶液中部分电离,溶液呈碱性,且还存在水的电离,溶液中
的 。
由电离常数可知,的水解常数 ,
则等体积、等浓度的溶液和溶液混合后, 的电离程度小于
的水解程度,溶液呈酸性。
9.(2023河北石家庄质检)时,已知 的氨水中存在如下平衡:
下列说法正确的是( )
C
A.反应①和②互为可逆反应
B.该氨水中存在
C.若该氨水中,则
D.向该氨水中加入硫酸,当 时,溶液呈中性
【解析】 可逆反应是指在相同条件下既可正向进行,也可逆向进行的化学反应,
反应①和②的反应物和生成物不完全相同,不互为可逆反应。
根据电荷守恒,氨水中存在 。
反应反应②可得
,则 ,结合电荷守恒
以及,可得 。
溶液呈中性,则 ,根据电荷守恒
,知 。
10.(2023湖北名校联合测评)常温下,向 溶液中滴加等浓度
的弱酸溶液,所得混合溶液中与 的关系如图所示。已知
。下列说法正确的是( )
C
A.
B.恰好完全反应时,溶液中
C.当溶液呈中性时,一定存在
D.时的值比 时的大
【解析】 .
,
,则 。
由A项分析知,酸性:,向 溶液中滴
加弱酸溶液,发生反应: ,恰
好完全反应时,生成等物质的量浓度的和 ,但是
会发生电离, 会发生水解
, 电离程
度和 水解程度不一样,故浓度不相等。
根据电荷守恒可知溶液中
,溶液为中
性时, ,混合溶液中一定存在关系:
,则 成立。
,
电离平衡常数只与温度有关,
时的值与 时相等。
11.(2022广东)食醋是烹饪美食的调味品,有效成分主要为醋酸(用表示)。 的
应用与其电离平衡密切相关。时,的 。
(1) 某小组研究下 电离平衡的影响因素。
提出假设 稀释溶液或改变浓度, 电离平衡会发生移动。
设计方案并完成实验 用浓度均为 的
和 溶液,按下表配制总体积相同的系列溶
液;测定 ,记录数据。
① 根据表中信息,补充数据:_____, ______。
3.00
33.00
② 由实验Ⅰ和Ⅱ可知,稀释 溶液,电离平衡____(填“正”或“逆”)向移动;结合表中数据,
给出判断理由: ______________________________________________________________
________________________________________________________________ 。
正
③由实验Ⅱ可知,增大浓度, 电离平衡逆向移动。
实验Ⅱ中的的浓度为实验Ⅰ的 ,稀释10倍后,假设电离平衡不移
动,理论为,实际为,说明稀释时,促进了 的电离
实验结论 假设成立。
(2) 小组分析上表数据发现:随着的增加,的值逐渐接近的 。
查阅资料获悉:一定条件下,按配制的溶液中,的值等于的 。
对比数据发现,实验中与资料数据 存在一定差异;推测可能由
物质浓度准确程度不够引起,故先准确测定 溶液的浓度再验证。
移取溶液,加入2滴酚酞溶液,用 溶液滴定至终
点,消耗体积为,则该溶液的浓度为________ 。画出上述过程的滴
定曲线示意图并标注滴定终点。
用上述溶液和溶液,配制等物质的量的与 混合溶
液,测定 ,结果与资料数据相符。
【答案】
(3) 小组进一步提出:如果只有浓度均约为的和 溶液,如何准确
测定的 小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
Ⅰ 移取溶液,用溶液滴定至终点,消耗溶液
Ⅱ _ _______________________________________________,测得溶液的 为4.76
移取溶液,向其中加入溶液
实验总结 得到的结果与资料数据相符,方案可行。
(4) 根据 可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途________________
______________________。
、杀菌消毒(其他合理答案也可)
【解析】 (1)①实验中, ,两种溶液的浓度相等,当
时,,为保证溶液的总体积为 ,则
。②由实验Ⅰ、Ⅱ的数据分析,实验Ⅱ中的浓度为实验Ⅰ中的,但是没有从2.86变为,浓度相对变大
实际为,说明稀释时,促进了的电离。(2)与以物质的量为反应,则 ,
。
与完全反应时,生成强碱弱酸盐 ,滴定终点时,溶液显碱性,所以加
入溶液时,对应的滴定终点溶液的 。(3)醋酸的电离平衡:
,平衡常数,当时, ,故
在Ⅱ中,向溶液中加入溶液,反应后的溶液中和 浓度
相等,测定溶液的,即可得出。(4) 为弱酸,可以用于自来水的杀菌消毒。
1.常温下,下列用来判断 是一种弱酸的说法正确的是( )
①向的溶液中加入固体,溶液 增大
相同的盐酸和溶液,取相同体积分别用标准 溶液滴定测其浓度,
溶液消耗的 溶液的体积较大
溶液的
的盐酸与过量的反应,当加入 固体后,反应速率减慢,但
生成氢气的总量不变
⑤相同物质的量浓度、相同体积的 溶液和盐酸分别与足量的活泼金属反应,
消耗金属的量相同
的溶液与的 溶液等体积混合后溶液呈酸性
溶液中有两种分子存在
⑧醋酸钠溶液的 大于7
A.②③④⑤⑥⑦ B.①②③④⑥⑦⑧ C.②③⑤⑥⑧ D.全部
√
【解析】
序号 解释 正误
① 加入固体,溶液增大,说明结合 生成了 ,故可知 为弱酸 正确
② 中和等体积、相同的盐酸和溶液, 溶液消耗的 溶液的体积较大,说明溶液的浓度大,则 为弱 酸 正确
③ 溶液的,说明溶液中 小于 ,故 为弱酸 正确
④ 盐酸与反应,加入 固体,反应速率减慢,说明溶液中 减小,则可知与反应生成了弱酸,故可知 为弱酸 正确
序号 解释 正误
⑤ 同浓度、同体积的 溶液和盐酸分别与足量的活泼金属反应,消 耗金属的量相同,不能说明 是弱酸 不正
确
⑥ 之和为14的强酸与溶液,等体积混和后,溶液呈中性,而 之和 为14的弱酸与 溶液,等体积混和后,溶液呈酸性 正确
⑦ 水溶液中有水分子存在,则另一种分子必为醋酸分子,可知醋酸不完全 电离,则 是弱酸 正确
⑧ 醋酸钠溶液的大于7,说明醋酸钠溶液呈碱性,故可知 是弱 酸 正确
续表
2.(2023北京东城区模拟)时,的电离常数, 的电离常
数、 。下列说法不正确的是( )
B
A.溶液和 溶液中离子种类相同
B.时,反应的
C.,物质的量浓度相同的溶液与溶液的 前者小于后者
D.向氯水中加入少量固体, 增大
【解析】 碳酸钠在水中电离出钠离子和碳酸根离子,碳酸根离子水解生成碳酸氢
根离子,碳酸氢根离子水解生成碳酸分子,溶液中还存在水的电离,故 溶液中
存在的离子有、、、、 ,碳酸氢钠在水中电离出钠离子和碳酸氢
根离子,碳酸氢根离子电离出碳酸根离子和氢离子,碳酸氢根离子水解生成碳酸分子,
溶液中还存在水的电离,故溶液中存在的离子有、、、 、
,两溶液中离子种类相同。
时,反应 的
。
次氯酸的电离平衡常数比碳酸氢根离子的电离平衡常数大,根据越弱越水解分析,
碳酸根离子的水解程度比的大,故等物质的量浓度的溶液与 溶液,
溶液碱性较强, 较大。
氯水中存在平衡:,向氯水中加入固体, 和碳
酸氢钠反应,平衡右移,由电离常数知, 不与碳酸氢钠反应(【点拨】酸性:
,不满足“强制弱”的复分解反应,可用假设法进行验证,假设
与碳酸氢钠反应,发生复分解反应应生成和 ,但与题给酸性强弱顺序
不符,故不反应),故 增大。
3.(2023杭州质检)时,的、的 ,下列
说法正确的是( )
B
A.分别测定某溶液、醋酸溶液的,前者小于后者,可以证明的
B.向的溶液中加入的 溶液,溶液中水的电离程度
与纯水相同,可能小于或大于
C.向的溶液中加入的 溶液充分反应,所得
溶液中
D.将的溶液与的醋酸混合, 的电离度增大
【解析】 没有指明测定相同浓度的溶液、醋酸溶液的,不能根据溶液的
证明 的电离常数大于醋酸的电离常数。
向溶液中加入等体积等浓度的溶液,得到溶液, 水解促进水的电离,
当溶液中水的电离程度与纯水相同时,可能是或过量,或 电离对水电
离的抑制作用和水解对水电离的促进作用相互抵消,因此 可能小于或大于
。
两溶液充分反应后,得到等物质的量的和的混合溶液, 的水解常数
的,因此的水解程度小于的电离程度, 。
将的溶液与的醋酸混合,溶液中不变, 的电离度不变。
4.(2023广东模拟)时, 第一步完全电离,第二步电离平衡常数
。下列说法正确的是( )
B
A. 溶液显碱性
B.溶液中存在
C.的溶液中,
D.向溶液中滴加溶液至中性时,
【解析】 第一步完全电离,则溶液中, 只电离不水解,溶
液显酸性。
溶液中存在元素质量守恒: 。
的溶液中, ,则
。
向溶液中滴加溶液至中性时, ,
,故 。
5.(2023河北沧州一中阶段检测)焦亚硫酸钠 在医药、橡胶、印染、食品等
方面应用广泛。利用烟道气中的生产 的工艺如图所示。下列对Ⅰ、Ⅱ、Ⅲ中
发生的主要反应的离子方程式判断错误的是( )
弱电解质 电离常数
、
、
A.Ⅰ中:
B.Ⅱ中:
C.Ⅲ中:
D.Ⅲ中:
√
【解析】 .
6.(信息应用)(2023江苏竞赛)许多无水体系有着与水溶液相似的性质,无水硫酸便
是其中一例。
已知无水硫酸中存在如下三个平衡:
下列说法不正确的是( )
D
A.无水硫酸中
B.的酸性可能强于
C.无水硫酸黏稠的原因之一是分子间存在氢键
D.已知 ,得出结论:硝酸酸性强于硫酸
【解析】 由 可知,无水硫酸中
。
的非金属性强于的,吸电子能力更强, 电离出氢离子的能力可能更强,
故的酸性可能强于 。
分子间存在氢键可增大无水硫酸分子间作用力,使无水硫酸黏稠。
中电离产生了和
和结合生成,电离产生了和和结合生成, 体
现酸性, 没有体现酸性。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
2025年高考化学考向分析
电离平衡
弱电解质的电离平衡
1.(2023广东六校联考)二元酸在水中存在电离: ,
。下列说法正确的是( )
C
A. 溶液中含A的物种有3种
B.室温下,溶液中水电离出的
C.溶液中
D.将的溶液加水稀释, 减小
【解析】 根据题给电离方程式可知, 第一步完全电离,第二步部分电离,则
溶液中含A的物种有和 ,共2种。
只电离,不水解,溶液显酸性,水的电离受到抑制,故室温下,
溶液中水电离出的 。
溶液中存在电荷守恒:
(【口诀】阳离子摆一边、阴离子摆一边,电荷数往前乘),溶液显酸性,
,故 。
,将的溶液加水稀释,促进水解, 减
少,增加,所以 增大。
2.(2020北京)室温下,对于 醋酸溶液,下列判断正确的是( )
C
A.该溶液中的粒子数为
B.加入少量固体后,溶液的 降低
C.滴加溶液过程中,与之和始终为
D.与溶液反应的离子方程式为
【解析】 属于弱电解质,不能完全电离, 醋酸溶液中,
粒子数小于 。
加入少量固体,抑制醋酸的电离(同离子效应), 浓度降低,溶液
的 升高。
根据元素质量守恒: 醋酸溶液中
。
醋酸是弱电解质,在离子反应中不能拆写成离子,正确的离子方程式为
。
3.(2021浙江6月选考)某同学拟用计测定溶液以探究某酸 是否为弱电解质。下
列说法正确的是( )
B
A.时,若测得溶液,则 是弱酸
B.时,若测得溶液且,则 是弱酸
C.时,若测得溶液,取该溶液,加蒸馏水稀释至 ,测得
,,则 是弱酸
D.时,若测得溶液,取该溶液,升温至,测得 ,
,则 是弱酸
【解析】 时,溶液,即溶液呈中性,说明 不水
解, 为强酸。
时,的溶液且,说明 部分电离,溶液中存
在电离平衡,即 为弱酸。
无论是强酸还是弱酸,当 时,将溶液稀释至体积为原来的10倍时,稀
释后溶液的只能接近7,即,故据此无法判断 是弱酸。(一般来说,将
强酸的溶液稀释至体积为原来的10倍, 增大1,C项需考虑特殊情况,若原来酸溶液
的,稀释至体积为原来的10倍类似于无限稀释,会出现 变化小于1的情况,故
据此无法判断该酸是强酸还是弱酸)
若为强酸,则 溶液呈中性,但升温能促进水的电离,水的离子积常数增大,
溶液中、均增大,即溶液减小,,故据此不能判断 为弱酸。
4.(2024河南信阳质检)亚砷酸 可用于治疗白血病。亚砷酸在溶液中存在多种
微粒形态,各种微粒的物质的量分数与溶液 的关系如图所示。下列说法不正确的是
( )
C
A.人体血液的为,用药后人体所含砷元素微粒主要是
B. 可发生电离和水解,溶液显碱性
C.当溶液的时,
D.用 表示微粒的物质的量分数,时
【解析】 分析题图可知当在之间时,
元素的主要存在形式为 。
分析题图及砷元素的存在形式可知, 可发生电
离和水解,又的物质的量分数最大时,溶液
(【说明】 的水解程度大于其电离程度),溶液显碱性。
当溶液的时,溶液中阳离子除 外还有加入的碱的阳离子,则根据电荷守
恒有 。
分析题图可知,当溶液的时,溶液中含的微粒主要有 、
、,用 表示微粒的物质的量分数,则
。
5.(2023北京海淀区期末)分别测定不同浓度溶液、溶液和 溶液的电
导率 数值,测定结果的数据处理如表所示。
溶液 4 839 2 478 1 252
溶液 10 958 5 593 2 797
溶液 267 182 126
已知:代表 溶液的电导率数值;其他条件相同时,电导率越大,溶液
导电性越好。
下列说法不正确的是( )
B
A.仅由 的数据不能说明三种电解质的强弱
B.表中数据不能说明同等条件下与 的导电能力强弱
C. 比值数据能说明 存在电离平衡
D.溶液的 数据能说明溶液越稀, 的电离程度越大
【解析】 、均为强电解质,不能仅由的数据说明、 电解质的
强弱。
同等条件下,氯离子浓度相同,氯离子的导电能力相同, 溶液的电导率大于
溶液的电导率,说明同等条件下的导电能力比 的导电能力强。
分析题表中数据可知,溶液、溶液的 比值数据约等于浓度之比,说
明两者均不存在电离平衡,而溶液的 比值数据却大于浓度之比,说明
存在电离平衡,且由和的值知,溶液越稀, 的
电离程度越大。
6.(2022全国乙)常温下,一元酸的。在某体系中,与 离
子不能穿过隔膜,未电离的 可自由穿过该膜(如图所示)。设溶液中
,当达到平衡时,下列叙述正确的是( )
B
A.溶液Ⅰ中
B.溶液Ⅱ中的的电离度为
C.溶液Ⅰ和Ⅱ中的 不相等
D.溶液Ⅰ和Ⅱ中的之比为
【解析】 常温下溶液Ⅰ的 ,则
溶液Ⅰ中,
。
常温下溶液Ⅱ的 ,即 ,代入
,可推出
,因此
。
根据题意,未电离的可自由穿过隔膜,故溶液Ⅰ和Ⅱ中的 相等。
溶液Ⅰ的
,
,因此溶液Ⅰ中
,即
;由B项分析知,溶
液Ⅱ中 ,即
,
两溶液的相等 。
杰哥支招
溶液Ⅰ的浓度很小,会促使
平衡逆移,降低;当溶液Ⅰ中的
降低,溶液Ⅱ中的 便会移动到溶液Ⅰ中,因
此从A原子守恒角度来看,溶液Ⅰ中的
肯定要大于溶液Ⅱ中的 ,D项不用计
算也可以判断是错误的,在考试中可以节省
大量推导时间哦
电离平衡常数
7.(2023重庆调研)常温下,部分弱酸的电离平衡常数如表所示。下列离子方程式书写正
确的是( )
化学式
电离常 数 ; ;
C
A.向溶液中滴加少量氯水:
B.向溶液中通入过量
C.向溶液中通入少量
D.向溶液中通入过量
【解析】 根据题表电离常数可知,酸性:,向 溶液中滴
加少量氯水,、都能与反应生成 ,正确的离子方程式为
。
根据题表电离常数可知,酸性:,向 溶液中通入过量
,生成和,正确的离子方程式为 。
向溶液中通入过量,发生氧化还原反应: 。
8.(2023广东二模)时,苯胺的电离平衡常数 。下列说
法正确的是( )
D
A.苯胺的电离方程式为
B.分别加热浓度均为的溶液和溶液,两者的 均增大
C.浓度为的溶液中,
D.等体积、等浓度的溶液和 溶液混合后,溶液呈酸性
【解析】 苯胺是一元弱碱,电离方程式为 。
为强酸弱碱盐,水解使溶液呈酸性,且水解反应是吸热反应,升高温
度,水解程度增大,溶液中浓度增大,溶液减小; 是强酸,在水溶液中完全
电离,升高温度,溶液的 基本不变。
苯胺是一元弱碱,在溶液中部分电离,溶液呈碱性,且还存在水的电离,溶液中
的 。
由电离常数可知,的水解常数 ,
则等体积、等浓度的溶液和溶液混合后, 的电离程度小于
的水解程度,溶液呈酸性。
9.(2023河北石家庄质检)时,已知 的氨水中存在如下平衡:
下列说法正确的是( )
C
A.反应①和②互为可逆反应
B.该氨水中存在
C.若该氨水中,则
D.向该氨水中加入硫酸,当 时,溶液呈中性
【解析】 可逆反应是指在相同条件下既可正向进行,也可逆向进行的化学反应,
反应①和②的反应物和生成物不完全相同,不互为可逆反应。
根据电荷守恒,氨水中存在 。
反应反应②可得
,则 ,结合电荷守恒
以及,可得 。
溶液呈中性,则 ,根据电荷守恒
,知 。
10.(2023湖北名校联合测评)常温下,向 溶液中滴加等浓度
的弱酸溶液,所得混合溶液中与 的关系如图所示。已知
。下列说法正确的是( )
C
A.
B.恰好完全反应时,溶液中
C.当溶液呈中性时,一定存在
D.时的值比 时的大
【解析】 .
,
,则 。
由A项分析知,酸性:,向 溶液中滴
加弱酸溶液,发生反应: ,恰
好完全反应时,生成等物质的量浓度的和 ,但是
会发生电离, 会发生水解
, 电离程
度和 水解程度不一样,故浓度不相等。
根据电荷守恒可知溶液中
,溶液为中
性时, ,混合溶液中一定存在关系:
,则 成立。
,
电离平衡常数只与温度有关,
时的值与 时相等。
11.(2022广东)食醋是烹饪美食的调味品,有效成分主要为醋酸(用表示)。 的
应用与其电离平衡密切相关。时,的 。
(1) 某小组研究下 电离平衡的影响因素。
提出假设 稀释溶液或改变浓度, 电离平衡会发生移动。
设计方案并完成实验 用浓度均为 的
和 溶液,按下表配制总体积相同的系列溶
液;测定 ,记录数据。
① 根据表中信息,补充数据:_____, ______。
3.00
33.00
② 由实验Ⅰ和Ⅱ可知,稀释 溶液,电离平衡____(填“正”或“逆”)向移动;结合表中数据,
给出判断理由: ______________________________________________________________
________________________________________________________________ 。
正
③由实验Ⅱ可知,增大浓度, 电离平衡逆向移动。
实验Ⅱ中的的浓度为实验Ⅰ的 ,稀释10倍后,假设电离平衡不移
动,理论为,实际为,说明稀释时,促进了 的电离
实验结论 假设成立。
(2) 小组分析上表数据发现:随着的增加,的值逐渐接近的 。
查阅资料获悉:一定条件下,按配制的溶液中,的值等于的 。
对比数据发现,实验中与资料数据 存在一定差异;推测可能由
物质浓度准确程度不够引起,故先准确测定 溶液的浓度再验证。
移取溶液,加入2滴酚酞溶液,用 溶液滴定至终
点,消耗体积为,则该溶液的浓度为________ 。画出上述过程的滴
定曲线示意图并标注滴定终点。
用上述溶液和溶液,配制等物质的量的与 混合溶
液,测定 ,结果与资料数据相符。
【答案】
(3) 小组进一步提出:如果只有浓度均约为的和 溶液,如何准确
测定的 小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
Ⅰ 移取溶液,用溶液滴定至终点,消耗溶液
Ⅱ _ _______________________________________________,测得溶液的 为4.76
移取溶液,向其中加入溶液
实验总结 得到的结果与资料数据相符,方案可行。
(4) 根据 可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途________________
______________________。
、杀菌消毒(其他合理答案也可)
【解析】 (1)①实验中, ,两种溶液的浓度相等,当
时,,为保证溶液的总体积为 ,则
。②由实验Ⅰ、Ⅱ的数据分析,实验Ⅱ中的浓度为实验Ⅰ中的,但是没有从2.86变为,浓度相对变大
实际为,说明稀释时,促进了的电离。(2)与以物质的量为反应,则 ,
。
与完全反应时,生成强碱弱酸盐 ,滴定终点时,溶液显碱性,所以加
入溶液时,对应的滴定终点溶液的 。(3)醋酸的电离平衡:
,平衡常数,当时, ,故
在Ⅱ中,向溶液中加入溶液,反应后的溶液中和 浓度
相等,测定溶液的,即可得出。(4) 为弱酸,可以用于自来水的杀菌消毒。
1.常温下,下列用来判断 是一种弱酸的说法正确的是( )
①向的溶液中加入固体,溶液 增大
相同的盐酸和溶液,取相同体积分别用标准 溶液滴定测其浓度,
溶液消耗的 溶液的体积较大
溶液的
的盐酸与过量的反应,当加入 固体后,反应速率减慢,但
生成氢气的总量不变
⑤相同物质的量浓度、相同体积的 溶液和盐酸分别与足量的活泼金属反应,
消耗金属的量相同
的溶液与的 溶液等体积混合后溶液呈酸性
溶液中有两种分子存在
⑧醋酸钠溶液的 大于7
A.②③④⑤⑥⑦ B.①②③④⑥⑦⑧ C.②③⑤⑥⑧ D.全部
√
【解析】
序号 解释 正误
① 加入固体,溶液增大,说明结合 生成了 ,故可知 为弱酸 正确
② 中和等体积、相同的盐酸和溶液, 溶液消耗的 溶液的体积较大,说明溶液的浓度大,则 为弱 酸 正确
③ 溶液的,说明溶液中 小于 ,故 为弱酸 正确
④ 盐酸与反应,加入 固体,反应速率减慢,说明溶液中 减小,则可知与反应生成了弱酸,故可知 为弱酸 正确
序号 解释 正误
⑤ 同浓度、同体积的 溶液和盐酸分别与足量的活泼金属反应,消 耗金属的量相同,不能说明 是弱酸 不正
确
⑥ 之和为14的强酸与溶液,等体积混和后,溶液呈中性,而 之和 为14的弱酸与 溶液,等体积混和后,溶液呈酸性 正确
⑦ 水溶液中有水分子存在,则另一种分子必为醋酸分子,可知醋酸不完全 电离,则 是弱酸 正确
⑧ 醋酸钠溶液的大于7,说明醋酸钠溶液呈碱性,故可知 是弱 酸 正确
续表
2.(2023北京东城区模拟)时,的电离常数, 的电离常
数、 。下列说法不正确的是( )
B
A.溶液和 溶液中离子种类相同
B.时,反应的
C.,物质的量浓度相同的溶液与溶液的 前者小于后者
D.向氯水中加入少量固体, 增大
【解析】 碳酸钠在水中电离出钠离子和碳酸根离子,碳酸根离子水解生成碳酸氢
根离子,碳酸氢根离子水解生成碳酸分子,溶液中还存在水的电离,故 溶液中
存在的离子有、、、、 ,碳酸氢钠在水中电离出钠离子和碳酸氢
根离子,碳酸氢根离子电离出碳酸根离子和氢离子,碳酸氢根离子水解生成碳酸分子,
溶液中还存在水的电离,故溶液中存在的离子有、、、 、
,两溶液中离子种类相同。
时,反应 的
。
次氯酸的电离平衡常数比碳酸氢根离子的电离平衡常数大,根据越弱越水解分析,
碳酸根离子的水解程度比的大,故等物质的量浓度的溶液与 溶液,
溶液碱性较强, 较大。
氯水中存在平衡:,向氯水中加入固体, 和碳
酸氢钠反应,平衡右移,由电离常数知, 不与碳酸氢钠反应(【点拨】酸性:
,不满足“强制弱”的复分解反应,可用假设法进行验证,假设
与碳酸氢钠反应,发生复分解反应应生成和 ,但与题给酸性强弱顺序
不符,故不反应),故 增大。
3.(2023杭州质检)时,的、的 ,下列
说法正确的是( )
B
A.分别测定某溶液、醋酸溶液的,前者小于后者,可以证明的
B.向的溶液中加入的 溶液,溶液中水的电离程度
与纯水相同,可能小于或大于
C.向的溶液中加入的 溶液充分反应,所得
溶液中
D.将的溶液与的醋酸混合, 的电离度增大
【解析】 没有指明测定相同浓度的溶液、醋酸溶液的,不能根据溶液的
证明 的电离常数大于醋酸的电离常数。
向溶液中加入等体积等浓度的溶液,得到溶液, 水解促进水的电离,
当溶液中水的电离程度与纯水相同时,可能是或过量,或 电离对水电
离的抑制作用和水解对水电离的促进作用相互抵消,因此 可能小于或大于
。
两溶液充分反应后,得到等物质的量的和的混合溶液, 的水解常数
的,因此的水解程度小于的电离程度, 。
将的溶液与的醋酸混合,溶液中不变, 的电离度不变。
4.(2023广东模拟)时, 第一步完全电离,第二步电离平衡常数
。下列说法正确的是( )
B
A. 溶液显碱性
B.溶液中存在
C.的溶液中,
D.向溶液中滴加溶液至中性时,
【解析】 第一步完全电离,则溶液中, 只电离不水解,溶
液显酸性。
溶液中存在元素质量守恒: 。
的溶液中, ,则
。
向溶液中滴加溶液至中性时, ,
,故 。
5.(2023河北沧州一中阶段检测)焦亚硫酸钠 在医药、橡胶、印染、食品等
方面应用广泛。利用烟道气中的生产 的工艺如图所示。下列对Ⅰ、Ⅱ、Ⅲ中
发生的主要反应的离子方程式判断错误的是( )
弱电解质 电离常数
、
、
A.Ⅰ中:
B.Ⅱ中:
C.Ⅲ中:
D.Ⅲ中:
√
【解析】 .
6.(信息应用)(2023江苏竞赛)许多无水体系有着与水溶液相似的性质,无水硫酸便
是其中一例。
已知无水硫酸中存在如下三个平衡:
下列说法不正确的是( )
D
A.无水硫酸中
B.的酸性可能强于
C.无水硫酸黏稠的原因之一是分子间存在氢键
D.已知 ,得出结论:硝酸酸性强于硫酸
【解析】 由 可知,无水硫酸中
。
的非金属性强于的,吸电子能力更强, 电离出氢离子的能力可能更强,
故的酸性可能强于 。
分子间存在氢键可增大无水硫酸分子间作用力,使无水硫酸黏稠。
中电离产生了和
和结合生成,电离产生了和和结合生成, 体
现酸性, 没有体现酸性。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
