定量型实验 -2025年高考化学考向分析(共43张PPT)
文档属性
| 名称 | 定量型实验 -2025年高考化学考向分析(共43张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-27 19:31:38 | ||
图片预览







文档简介
(共43张PPT)
2025年高考化学考向分析
定量型实验
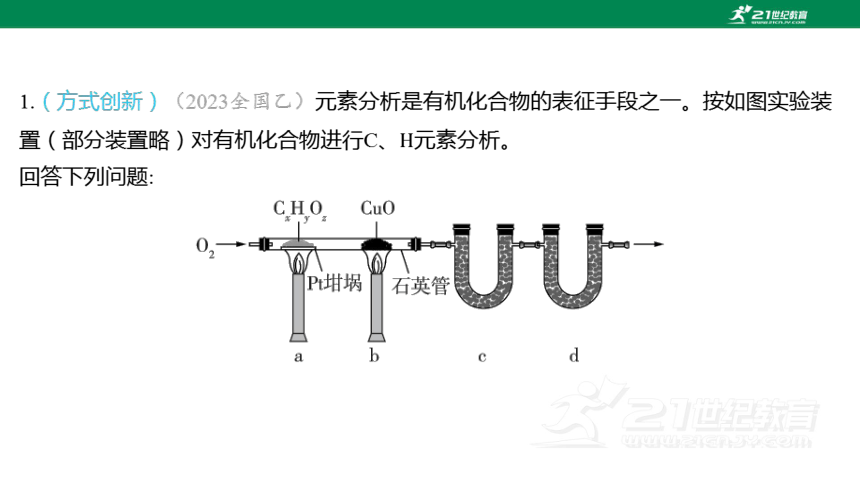
1.(方式创新)(2023全国乙)元素分析是有机化合物的表征手段之一。按如图实验装
置(部分装置略)对有机化合物进行C、 元素分析。
回答下列问题:
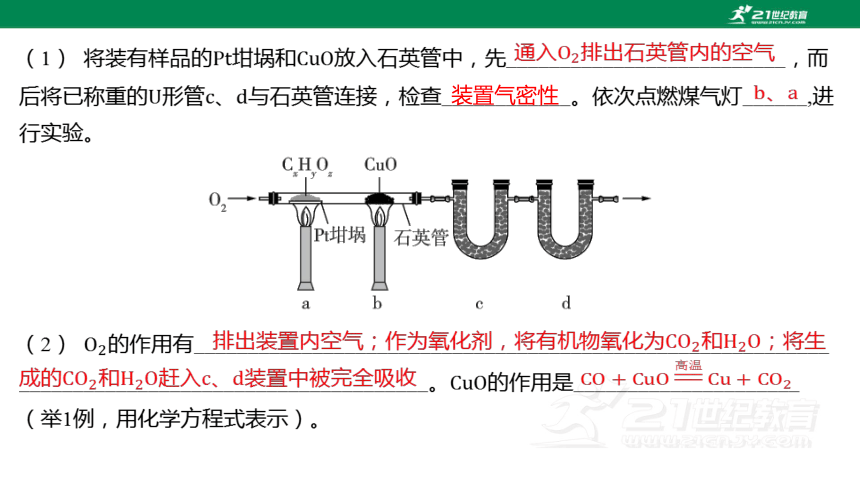
(1) 将装有样品的坩埚和 放入石英管中,先__________________________,而
后将已称重的形管、 与石英管连接,检查____________。依次点燃煤气灯______,进
行实验。
通入排出石英管内的空气
装置气密性
、
(2) 的作用有___________________________________________________________
______________________________________。 的作用是_____________________
(举1例,用化学方程式表示)。
排出装置内空气;作为氧化剂,将有机物氧化为和;将生成的和赶入、装置中被完全吸收
(3) 和中的试剂分别是___、___(填标号)。和 中的试剂不可调换,理由是
__________________________________。
A.
B.
C.碱石灰
D.
A
C
碱石灰会同时吸收水蒸气和二氧化碳
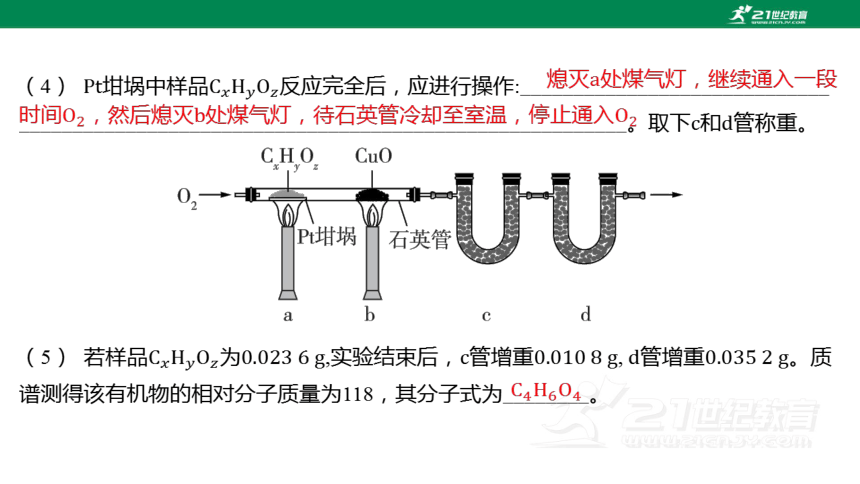
(4) 坩埚中样品 反应完全后,应进行操作:_____________________________
_________________________________________________________。取下和 管称重。
熄灭处煤气灯,继续通入一段时间,然后熄灭处煤气灯,待石英管冷却至室温,停止通入
(5) 若样品为,实验结束后,管增重,管增重 。质
谱测得该有机物的相对分子质量为118,其分子式为________。
【解析】 (1)将装有样品的坩埚和放入石英管中,先通入 排出石英管内的空
气,避免原先石英管内的、干扰实验测定。再将已称重的形管、 与石英管
连接,然后检查装置气密性。若坩埚内的有机物不完全燃烧生成,后面的 可作
为氧化剂,在高温条件下将再氧化为,为了达到该目的,应先点燃 处酒精灯后
再点燃处酒精灯,保证生成的可以完全被氧化为。(2)实验中 的作用:①可
以排出装置内空气;②作为氧化剂,将有机物氧化为和;③持续通入的 ,可
以将生成的和吹送到、装置中,使其完全被吸收,提高实验的准确度。
作为氧化剂,将可能生成的氧化为,其化学方程式为 。
(3)有机物燃烧后生成的用吸收,用碱石灰吸收,其中 管
装、管装碱石灰,二者不可调换,这是因为碱石灰能同时吸收和 ,若碱
石灰放在前面,增加的重量既有又有,则无法判定原有机物中所含C、 的物质
的量,也就无法确定有机物分子式。(4)坩埚中样品反应完全后,先关闭 处煤气灯
(处煤气灯先不关闭,保证能全被氧化为),由于装置内仍有残留的和 ,
因此要继续通入一段时间,将和吹送至、装置中,接着熄灭 处煤气灯,
待石英管冷却至室温,再停止通入 。
(5)管装有无水,用来吸收生成的,因此增重量即为 的质量,据此可计
算原有机物中原子的物质的量; 管
装有碱石灰,用来吸收生成的,因此增重量为 的质量,据此可计算原有机物中C
原子的物质的量;有机物中 元素的质量为
,其物质的量
;该有机物中C、、 三种元素原子的物质的量
比为,最简式为 (相对分子质量为59),经质
谱测得该有机物的相对分子质量为118,则其分子式为 。
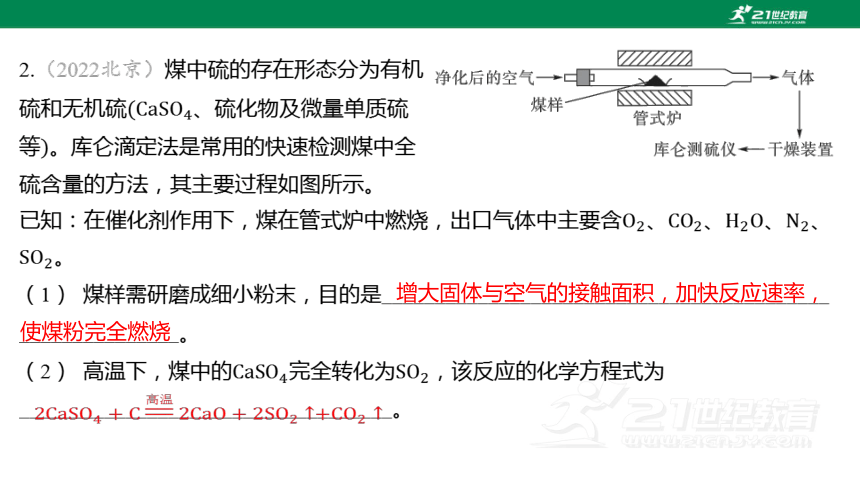
2.(2022北京)煤中硫的存在形态分为有机
硫和无机硫 、硫化物及微量单质硫
等 。库仑滴定法是常用的快速检测煤中全
硫含量的方法,其主要过程如图所示。
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体中主要含、、、 、
。
(1) 煤样需研磨成细小粉末,目的是__________________________________________
_______________。
(2) 高温下,煤中的完全转化为 ,该反应的化学方程式为
___________________________________。
增大固体与空气的接触面积,加快反应速率,使煤粉完全燃烧
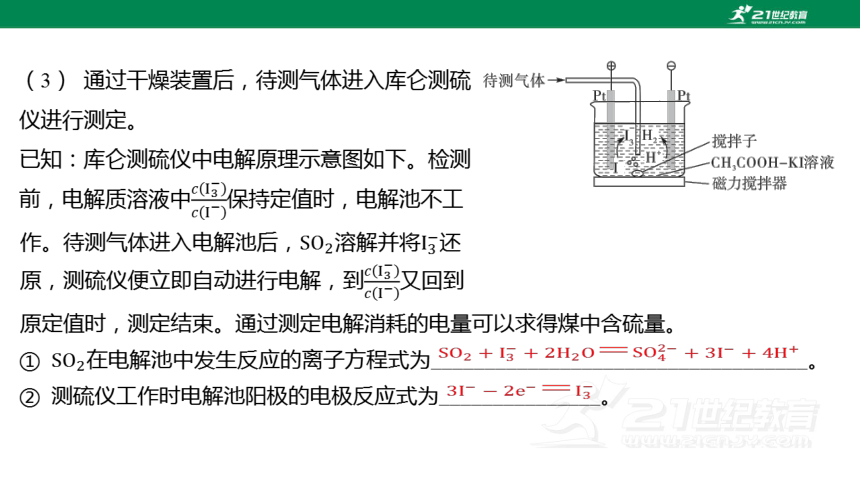
(3) 通过干燥装置后,待测气体进入库仑测硫
仪进行测定。
已知:库仑测硫仪中电解原理示意图如下。检测
前,电解质溶液中 保持定值时,电解池不工
① 在电解池中发生反应的离子方程式为___________________________________。
② 测硫仪工作时电解池阳极的电极反应式为_______________。
作。待测气体进入电解池后,溶解并将 还
原,测硫仪便立即自动进行电解,到 又回到
原定值时,测定结束。通过测定电解消耗的电量可以求得煤中含硫量。
(4) 煤样为,电解消耗的电量为 库仑。
煤样中硫的质量分数为_______。
已知:电解中转移 电子所消耗的电量
为96 500库仑。
(5) 条件控制和误差分析。
① 测定过程中,需要控制电解质溶液的。当时,非电解生成的 使测得的全
硫含量偏小,生成 的离子方程式为_____________________________。
② 管式炉中煤样燃烧时会有少量 产生,使测得的全硫含量______(填“偏大”或“偏
小”),该测量结果可进行校正。
偏小
【解析】 (3)①根据题目信息,气体进入电解池后,溶解并将还原成, 在
水溶液中被氧化成,离子方程式为 。②与
外接电源正极相接的为电解池阳极,在阳极被氧化成 ,电极反应式为
。(4)由与 反应的离子方程式,以及测硫仪工作时电解池的阳极
电极反应式,可以得到关系式,电解消耗的电量为 库仑,则
,因此 ,则煤样中硫的质量分数为
。(5)①当时,非电解生成的 使测得的全硫含量偏小,说
明在时溶液有其他反应会生成,推知应该是待测气体中的将氧化成 。②
煤燃烧时有产生,说明硫元素没有全部转化为,测定过程中,溶解到水中的
减少,与反应所生成的会偏少,电解时需要生成的 会偏少,则转移电子数偏
小,导致测得全硫含量结果偏小。
3.(2020天津)为测定 溶液的浓度,甲、乙两同学设计了两个方案。回答下列问
题:
Ⅰ.甲方案
实验原理:
实验步骤:
(1) 判断 沉淀完全的操作及现象为_____
__________________________________________。
向上层清液中继续滴加溶液,无白色沉淀生成
(2) 步骤②判断沉淀是否洗净所选用的试剂为____________。
(3) 步骤③灼烧时盛装样品的仪器名称为______。
(4) 固体质量为,则____ 。
溶液
坩埚
(5) 若步骤①从烧杯中转移沉淀时未洗涤烧杯,
则测得 ______(填“偏高”“偏低”或“无
影响”)。
偏低
Ⅱ.乙方案
实验原理:
实验步骤:
①按如图连接方式安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、 中加入图示的试剂
④调整D、 中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录
⑤将 溶液滴入A中并搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动管,保持D、 中两液面相平,读数并记录
⑦处理数据
(6) 步骤②为________________。
检查装置气密性
(7) 步骤⑥需保证体系恢复到室温的原因是___(填序号)。
.反应热受温度影响
(8) 粉质量为,若测得体积为,已知实验条件下 ,则
_ _________ (列出计算表达式)。
.气体密度受温度影响
.反应速率受温度影响
(9) 若步骤 管液面高于D管,未调液面即读数,则
测得 ______(填“偏高”“偏低”或“无影响”)。
偏高
(10) 是否能用同样的装置和方法测定 溶液的浓度:____(填“是”或“否”)。
否
【解析】 原理对接 甲方案的测定原理是将 转化
为,然后称量出 的质量,再根据关系式
求出 的物质的量。因此实验中需
要准确地获得的质量。乙方案的原理是根据锌能与、 反应,先用足量的锌
与一定量的 溶液反应,然后用足量的稀硫酸与锌反应,测量出生成的氢气的体积,
由此计算出与硫酸反应消耗掉的锌的量,最后再根据与 溶液反应的锌的量求出
的物质的量,最后求出 溶液的物质的量浓度。
(1)加入溶液后,若已经完全沉淀,则向上层清液中继续加入 溶液时
就不会产生新的沉淀,故相应的检验方法是向上层清液中加入 溶液,没有白色沉
淀出现,说明沉淀完全。(2)沉淀中所含有的杂质为、 ,可用
溶液检验最后一次洗涤液中是否含有 的方法来
达到目的。(3)灼烧固体时通常在坩埚中进行。(4)
的物质的量是,由“ ”守恒可知
,
。(5)
由于烧杯内壁会沾有一定量 ,因此若不洗涤烧杯,
会导致损失,由此计算出的 的量少于理论
值,从而导致测量出的 溶液浓度偏低。(6)由于
实验涉及气体,故装置连接好后应检查装置的气密性。
(7)由于气体密度受温度影响,故要想准确测量氢气
的体积,必须保证反应前后体系温度相等,故答案为 。
(8)消耗的锌的物质的量为 ,生成的
,因此与反应的 的物质的
量为 ,故
。(9)当 管液面高于D
管时,说明C、D中气体压强大于大气压,这样测量出
的气体体积值偏小,由 的计算表达式知测量出
的 偏高。(10)比镁活泼的金属都与水反应,
故不能用此方法、此装置测定 溶液的浓度。
1.(2023陕西名校二联)碳酸锰 是制造高性能
磁性材料的主要原料。实验室以 为原料制备少
量并研究其性质,制备 的装置如图1所示。
已知: 难溶于水、乙醇,在干燥空气中稳定,
开始分解。 请回答下列问题:
(1) 仪器B的名称为______________。
恒压滴液漏斗
(2) 在烧瓶中加入一定量的 固体粉末,滴加硫
酸酸化的 溶液,其反应的离子方程式为________
________________________________________________,
反应过程中 随时间的变化曲线如图2所示,则
反应产生的对反应具有催化作用
(3) 反应一段时间,当装置A中的溶液由紫色变为无色时,再滴加 溶液,充
分反应生成。生成 的离子方程式为_________________________________
____________________________________________________________________________。
(4) 实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再__________,即得
到干燥的 固体。用乙醇洗涤的优点是____________________________。
低温烘干
防止潮湿的被空气氧化
时 迅速增大的原因是___________________________________。
(5) 在空气中加热 固体,随着温度的升高,残留固体的质量变化如图3所示,
则A点的成分为______(填化学式), 反应的化学方程式为___________________
___________________________________________________________________________。
【装置剖析】
【热重曲线分析】
实验 目的 制备少量 并研究其性质
实验 操作 及相 关分 析 (2)反应过程中随时间的变化曲线如题图2所示,时 迅
速增大,其原因是反应产生的 对反应具有催化作用。
(4)在开始分解,故反应制备的 用乙醇洗涤后,应低温
烘干,得到干燥的固体。 难溶于水、乙醇,在干燥空气中稳定,
结合易被氧化可知,用乙醇洗涤的优点是防止潮湿的 被空气氧化
2.(2023山东济南一中等名校三模)碳酸钐(摩尔质量为 )为
难溶于水的白色粉末,可用于治疗高磷酸盐血症。回答下列问题:
Ⅰ.实验室通过将和通入溶液中制备水合碳酸钐
(1) 装置的连接顺序是 __,___ (填接口标号)。
(2) 实验有不足之处,改进办法是____________________________________________
_______________。
在甲与丙(或与)之间接一个盛有饱和碳酸氢钠溶液的洗气瓶
(3) 生成水合碳酸钐的化学方程式为______
________________________________________
_____________________________________。
(4) 若氨气过量,溶液碱性太强会生成副产物 ,反应的化学方程式为
___________________________________________________。
Ⅱ.碳酸钐质量分数的测定:
准确称取产品试样,溶于稀盐酸中,加入 缓冲溶液,
加入紫脲酸铵混合指示剂,用 标准溶液滴定至
呈蓝紫色,消耗溶液 。
(5) 产品中碳酸钐的质量分数 _______。
Ⅲ.测定 中结晶水的含量:
下图为测定分解产物的实验装置,将装置A称重,记为 。将提纯
后的样品装入装置A中,再次将装置A称重,记为 ,将装有试剂的装置C称重,记
为 。按下图连接好装置进行实验。
实验步骤:
①打开、和,缓缓通入 ;
②数分钟后关闭____,打开____,点燃酒精喷灯,加热装置A中样品;
③一段时间后,熄灭酒精喷灯,打开,通入数分钟后,冷却到室温,关闭和 ,
称量装置A。重复上述操作步骤,直至装置A恒重,记为(此时装置A中为 )。
称重装置C,记为 。
(6) 实验步骤②中关闭________,打开____(填写止水夹标号)。
、
(7) 计算中结晶水数目_ __________________(用含、 、
的代数式表示)。
【装置剖析】
实验目的 制备水合碳酸钐 ,并进行定量测定
实验计算及 相关分析 (5)根据 得出
,
(7)
________________________________________________________________________________________________________
3.(图像创新)(2023安徽、云南等四省联考)醋酸钴与双水杨醛缩乙二胺形成的配合
物 具有可逆载氧能力,能模拟金属蛋白的载氧作用,在催化氧化反应中应
用广泛。合成反应如下所示,回答下列问题。
Ⅰ.合成
(1) 合成装置如图所示。在氮气的保护下,向含有双水杨
醛缩乙二胺的乙醇溶液中缓慢滴加醋酸钴的乙醇溶液,加热
回流。A处应安装的仪器是____________(填名称),B处
应安装的仪器是______________(填名称)。装置C的作用
是______。
球形冷凝管
恒压滴液漏斗
液封
(2) 回流 ,沉淀转化为暗红色晶体。回流结束后进行如下操作:
A.停止通氮气
B.停止加热
C.关闭冷凝水
正确的操作顺序为_____(填标号)。充分冷却后将三颈烧瓶中混合物过滤,洗涤并干
燥,得到配合物 。
Ⅱ.载氧量测定
(3) 将质量为的(摩尔质量为 )加入圆底烧瓶中,在恒压滴液漏斗
中加入(配合物在 中可吸氧),按如图所示搭建装置。通入氧气,赶尽体系内
空气。检查装置气密性的操作为先关闭______________,然后调节水平仪的水位至与量
气管水位产生一定液面差。装置不漏气的现象是________________。
活塞1和活塞2
液面差恒定不变
(4) 调整水平仪高度,待量气管水位与水平仪水位齐平时,记录量气管水位的体积刻
度为。将 加入圆底烧瓶,待吸氧反应结束后,再次使量气管水位与水平仪水位齐
平,记录量气管水位的体积刻度为。已知大气压为,氧气的压强为,温度为 。
配合物载氧量 的计算式为______________。
【装置剖析】
实验目的 合成配合物 并测定其载氧量
实验操作 及相关 分析 (2)回流结束后,应先停止加热,然后关闭冷凝水,最后停止通氮气,充
分冷却后将三颈烧瓶中混合物过滤、洗涤、干燥得到配合物。
(3)由实验装置图可知,检查装置气密性的操作为先关闭活塞1和活塞2,
然后调节水平仪的水位至与量气管水位产生一定液面差,若液面差稳定,说
明装置气密性良好
实验计算 (4)由题意可知,的物质的量为 。由理想气体状态方程
知, 吸收氧气的物质的量(【易错提醒】吸收氧气的体积为
,不要思维定式错写成)为 ,则吸收氧气的物质
的量和的物质的量的比值为
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
2025年高考化学考向分析
定量型实验
1.(方式创新)(2023全国乙)元素分析是有机化合物的表征手段之一。按如图实验装
置(部分装置略)对有机化合物进行C、 元素分析。
回答下列问题:
(1) 将装有样品的坩埚和 放入石英管中,先__________________________,而
后将已称重的形管、 与石英管连接,检查____________。依次点燃煤气灯______,进
行实验。
通入排出石英管内的空气
装置气密性
、
(2) 的作用有___________________________________________________________
______________________________________。 的作用是_____________________
(举1例,用化学方程式表示)。
排出装置内空气;作为氧化剂,将有机物氧化为和;将生成的和赶入、装置中被完全吸收
(3) 和中的试剂分别是___、___(填标号)。和 中的试剂不可调换,理由是
__________________________________。
A.
B.
C.碱石灰
D.
A
C
碱石灰会同时吸收水蒸气和二氧化碳
(4) 坩埚中样品 反应完全后,应进行操作:_____________________________
_________________________________________________________。取下和 管称重。
熄灭处煤气灯,继续通入一段时间,然后熄灭处煤气灯,待石英管冷却至室温,停止通入
(5) 若样品为,实验结束后,管增重,管增重 。质
谱测得该有机物的相对分子质量为118,其分子式为________。
【解析】 (1)将装有样品的坩埚和放入石英管中,先通入 排出石英管内的空
气,避免原先石英管内的、干扰实验测定。再将已称重的形管、 与石英管
连接,然后检查装置气密性。若坩埚内的有机物不完全燃烧生成,后面的 可作
为氧化剂,在高温条件下将再氧化为,为了达到该目的,应先点燃 处酒精灯后
再点燃处酒精灯,保证生成的可以完全被氧化为。(2)实验中 的作用:①可
以排出装置内空气;②作为氧化剂,将有机物氧化为和;③持续通入的 ,可
以将生成的和吹送到、装置中,使其完全被吸收,提高实验的准确度。
作为氧化剂,将可能生成的氧化为,其化学方程式为 。
(3)有机物燃烧后生成的用吸收,用碱石灰吸收,其中 管
装、管装碱石灰,二者不可调换,这是因为碱石灰能同时吸收和 ,若碱
石灰放在前面,增加的重量既有又有,则无法判定原有机物中所含C、 的物质
的量,也就无法确定有机物分子式。(4)坩埚中样品反应完全后,先关闭 处煤气灯
(处煤气灯先不关闭,保证能全被氧化为),由于装置内仍有残留的和 ,
因此要继续通入一段时间,将和吹送至、装置中,接着熄灭 处煤气灯,
待石英管冷却至室温,再停止通入 。
(5)管装有无水,用来吸收生成的,因此增重量即为 的质量,据此可计
算原有机物中原子的物质的量; 管
装有碱石灰,用来吸收生成的,因此增重量为 的质量,据此可计算原有机物中C
原子的物质的量;有机物中 元素的质量为
,其物质的量
;该有机物中C、、 三种元素原子的物质的量
比为,最简式为 (相对分子质量为59),经质
谱测得该有机物的相对分子质量为118,则其分子式为 。
2.(2022北京)煤中硫的存在形态分为有机
硫和无机硫 、硫化物及微量单质硫
等 。库仑滴定法是常用的快速检测煤中全
硫含量的方法,其主要过程如图所示。
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体中主要含、、、 、
。
(1) 煤样需研磨成细小粉末,目的是__________________________________________
_______________。
(2) 高温下,煤中的完全转化为 ,该反应的化学方程式为
___________________________________。
增大固体与空气的接触面积,加快反应速率,使煤粉完全燃烧
(3) 通过干燥装置后,待测气体进入库仑测硫
仪进行测定。
已知:库仑测硫仪中电解原理示意图如下。检测
前,电解质溶液中 保持定值时,电解池不工
① 在电解池中发生反应的离子方程式为___________________________________。
② 测硫仪工作时电解池阳极的电极反应式为_______________。
作。待测气体进入电解池后,溶解并将 还
原,测硫仪便立即自动进行电解,到 又回到
原定值时,测定结束。通过测定电解消耗的电量可以求得煤中含硫量。
(4) 煤样为,电解消耗的电量为 库仑。
煤样中硫的质量分数为_______。
已知:电解中转移 电子所消耗的电量
为96 500库仑。
(5) 条件控制和误差分析。
① 测定过程中,需要控制电解质溶液的。当时,非电解生成的 使测得的全
硫含量偏小,生成 的离子方程式为_____________________________。
② 管式炉中煤样燃烧时会有少量 产生,使测得的全硫含量______(填“偏大”或“偏
小”),该测量结果可进行校正。
偏小
【解析】 (3)①根据题目信息,气体进入电解池后,溶解并将还原成, 在
水溶液中被氧化成,离子方程式为 。②与
外接电源正极相接的为电解池阳极,在阳极被氧化成 ,电极反应式为
。(4)由与 反应的离子方程式,以及测硫仪工作时电解池的阳极
电极反应式,可以得到关系式,电解消耗的电量为 库仑,则
,因此 ,则煤样中硫的质量分数为
。(5)①当时,非电解生成的 使测得的全硫含量偏小,说
明在时溶液有其他反应会生成,推知应该是待测气体中的将氧化成 。②
煤燃烧时有产生,说明硫元素没有全部转化为,测定过程中,溶解到水中的
减少,与反应所生成的会偏少,电解时需要生成的 会偏少,则转移电子数偏
小,导致测得全硫含量结果偏小。
3.(2020天津)为测定 溶液的浓度,甲、乙两同学设计了两个方案。回答下列问
题:
Ⅰ.甲方案
实验原理:
实验步骤:
(1) 判断 沉淀完全的操作及现象为_____
__________________________________________。
向上层清液中继续滴加溶液,无白色沉淀生成
(2) 步骤②判断沉淀是否洗净所选用的试剂为____________。
(3) 步骤③灼烧时盛装样品的仪器名称为______。
(4) 固体质量为,则____ 。
溶液
坩埚
(5) 若步骤①从烧杯中转移沉淀时未洗涤烧杯,
则测得 ______(填“偏高”“偏低”或“无
影响”)。
偏低
Ⅱ.乙方案
实验原理:
实验步骤:
①按如图连接方式安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、 中加入图示的试剂
④调整D、 中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录
⑤将 溶液滴入A中并搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动管,保持D、 中两液面相平,读数并记录
⑦处理数据
(6) 步骤②为________________。
检查装置气密性
(7) 步骤⑥需保证体系恢复到室温的原因是___(填序号)。
.反应热受温度影响
(8) 粉质量为,若测得体积为,已知实验条件下 ,则
_ _________ (列出计算表达式)。
.气体密度受温度影响
.反应速率受温度影响
(9) 若步骤 管液面高于D管,未调液面即读数,则
测得 ______(填“偏高”“偏低”或“无影响”)。
偏高
(10) 是否能用同样的装置和方法测定 溶液的浓度:____(填“是”或“否”)。
否
【解析】 原理对接 甲方案的测定原理是将 转化
为,然后称量出 的质量,再根据关系式
求出 的物质的量。因此实验中需
要准确地获得的质量。乙方案的原理是根据锌能与、 反应,先用足量的锌
与一定量的 溶液反应,然后用足量的稀硫酸与锌反应,测量出生成的氢气的体积,
由此计算出与硫酸反应消耗掉的锌的量,最后再根据与 溶液反应的锌的量求出
的物质的量,最后求出 溶液的物质的量浓度。
(1)加入溶液后,若已经完全沉淀,则向上层清液中继续加入 溶液时
就不会产生新的沉淀,故相应的检验方法是向上层清液中加入 溶液,没有白色沉
淀出现,说明沉淀完全。(2)沉淀中所含有的杂质为、 ,可用
溶液检验最后一次洗涤液中是否含有 的方法来
达到目的。(3)灼烧固体时通常在坩埚中进行。(4)
的物质的量是,由“ ”守恒可知
,
。(5)
由于烧杯内壁会沾有一定量 ,因此若不洗涤烧杯,
会导致损失,由此计算出的 的量少于理论
值,从而导致测量出的 溶液浓度偏低。(6)由于
实验涉及气体,故装置连接好后应检查装置的气密性。
(7)由于气体密度受温度影响,故要想准确测量氢气
的体积,必须保证反应前后体系温度相等,故答案为 。
(8)消耗的锌的物质的量为 ,生成的
,因此与反应的 的物质的
量为 ,故
。(9)当 管液面高于D
管时,说明C、D中气体压强大于大气压,这样测量出
的气体体积值偏小,由 的计算表达式知测量出
的 偏高。(10)比镁活泼的金属都与水反应,
故不能用此方法、此装置测定 溶液的浓度。
1.(2023陕西名校二联)碳酸锰 是制造高性能
磁性材料的主要原料。实验室以 为原料制备少
量并研究其性质,制备 的装置如图1所示。
已知: 难溶于水、乙醇,在干燥空气中稳定,
开始分解。 请回答下列问题:
(1) 仪器B的名称为______________。
恒压滴液漏斗
(2) 在烧瓶中加入一定量的 固体粉末,滴加硫
酸酸化的 溶液,其反应的离子方程式为________
________________________________________________,
反应过程中 随时间的变化曲线如图2所示,则
反应产生的对反应具有催化作用
(3) 反应一段时间,当装置A中的溶液由紫色变为无色时,再滴加 溶液,充
分反应生成。生成 的离子方程式为_________________________________
____________________________________________________________________________。
(4) 实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再__________,即得
到干燥的 固体。用乙醇洗涤的优点是____________________________。
低温烘干
防止潮湿的被空气氧化
时 迅速增大的原因是___________________________________。
(5) 在空气中加热 固体,随着温度的升高,残留固体的质量变化如图3所示,
则A点的成分为______(填化学式), 反应的化学方程式为___________________
___________________________________________________________________________。
【装置剖析】
【热重曲线分析】
实验 目的 制备少量 并研究其性质
实验 操作 及相 关分 析 (2)反应过程中随时间的变化曲线如题图2所示,时 迅
速增大,其原因是反应产生的 对反应具有催化作用。
(4)在开始分解,故反应制备的 用乙醇洗涤后,应低温
烘干,得到干燥的固体。 难溶于水、乙醇,在干燥空气中稳定,
结合易被氧化可知,用乙醇洗涤的优点是防止潮湿的 被空气氧化
2.(2023山东济南一中等名校三模)碳酸钐(摩尔质量为 )为
难溶于水的白色粉末,可用于治疗高磷酸盐血症。回答下列问题:
Ⅰ.实验室通过将和通入溶液中制备水合碳酸钐
(1) 装置的连接顺序是 __,___ (填接口标号)。
(2) 实验有不足之处,改进办法是____________________________________________
_______________。
在甲与丙(或与)之间接一个盛有饱和碳酸氢钠溶液的洗气瓶
(3) 生成水合碳酸钐的化学方程式为______
________________________________________
_____________________________________。
(4) 若氨气过量,溶液碱性太强会生成副产物 ,反应的化学方程式为
___________________________________________________。
Ⅱ.碳酸钐质量分数的测定:
准确称取产品试样,溶于稀盐酸中,加入 缓冲溶液,
加入紫脲酸铵混合指示剂,用 标准溶液滴定至
呈蓝紫色,消耗溶液 。
(5) 产品中碳酸钐的质量分数 _______。
Ⅲ.测定 中结晶水的含量:
下图为测定分解产物的实验装置,将装置A称重,记为 。将提纯
后的样品装入装置A中,再次将装置A称重,记为 ,将装有试剂的装置C称重,记
为 。按下图连接好装置进行实验。
实验步骤:
①打开、和,缓缓通入 ;
②数分钟后关闭____,打开____,点燃酒精喷灯,加热装置A中样品;
③一段时间后,熄灭酒精喷灯,打开,通入数分钟后,冷却到室温,关闭和 ,
称量装置A。重复上述操作步骤,直至装置A恒重,记为(此时装置A中为 )。
称重装置C,记为 。
(6) 实验步骤②中关闭________,打开____(填写止水夹标号)。
、
(7) 计算中结晶水数目_ __________________(用含、 、
的代数式表示)。
【装置剖析】
实验目的 制备水合碳酸钐 ,并进行定量测定
实验计算及 相关分析 (5)根据 得出
,
(7)
________________________________________________________________________________________________________
3.(图像创新)(2023安徽、云南等四省联考)醋酸钴与双水杨醛缩乙二胺形成的配合
物 具有可逆载氧能力,能模拟金属蛋白的载氧作用,在催化氧化反应中应
用广泛。合成反应如下所示,回答下列问题。
Ⅰ.合成
(1) 合成装置如图所示。在氮气的保护下,向含有双水杨
醛缩乙二胺的乙醇溶液中缓慢滴加醋酸钴的乙醇溶液,加热
回流。A处应安装的仪器是____________(填名称),B处
应安装的仪器是______________(填名称)。装置C的作用
是______。
球形冷凝管
恒压滴液漏斗
液封
(2) 回流 ,沉淀转化为暗红色晶体。回流结束后进行如下操作:
A.停止通氮气
B.停止加热
C.关闭冷凝水
正确的操作顺序为_____(填标号)。充分冷却后将三颈烧瓶中混合物过滤,洗涤并干
燥,得到配合物 。
Ⅱ.载氧量测定
(3) 将质量为的(摩尔质量为 )加入圆底烧瓶中,在恒压滴液漏斗
中加入(配合物在 中可吸氧),按如图所示搭建装置。通入氧气,赶尽体系内
空气。检查装置气密性的操作为先关闭______________,然后调节水平仪的水位至与量
气管水位产生一定液面差。装置不漏气的现象是________________。
活塞1和活塞2
液面差恒定不变
(4) 调整水平仪高度,待量气管水位与水平仪水位齐平时,记录量气管水位的体积刻
度为。将 加入圆底烧瓶,待吸氧反应结束后,再次使量气管水位与水平仪水位齐
平,记录量气管水位的体积刻度为。已知大气压为,氧气的压强为,温度为 。
配合物载氧量 的计算式为______________。
【装置剖析】
实验目的 合成配合物 并测定其载氧量
实验操作 及相关 分析 (2)回流结束后,应先停止加热,然后关闭冷凝水,最后停止通氮气,充
分冷却后将三颈烧瓶中混合物过滤、洗涤、干燥得到配合物。
(3)由实验装置图可知,检查装置气密性的操作为先关闭活塞1和活塞2,
然后调节水平仪的水位至与量气管水位产生一定液面差,若液面差稳定,说
明装置气密性良好
实验计算 (4)由题意可知,的物质的量为 。由理想气体状态方程
知, 吸收氧气的物质的量(【易错提醒】吸收氧气的体积为
,不要思维定式错写成)为 ,则吸收氧气的物质
的量和的物质的量的比值为
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
