探究型实验 -2025年高考化学考向分析(共46张PPT)
文档属性
| 名称 | 探究型实验 -2025年高考化学考向分析(共46张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-27 19:35:11 | ||
图片预览











文档简介
(共46张PPT)
2025年高考化学考向分析
探究型实验
1.(2023北京)资料显示,可以将氧化为。某小组同学设计实验探究被 氧
化的产物及铜元素的价态。
已知:易溶于溶液,发生反应(红棕色);和 氧化性几乎相同。
(1) 将等体积的溶液加入到铜粉和 的固体混合物中,振荡。
实验记录如下:
实验现象
实验Ⅰ 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉
转化为白色沉淀,溶液仍为淡红色
实验Ⅱ 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转
化为白色沉淀,溶液仍为红棕色
实验Ⅲ 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉
完全溶解,溶液为深红棕色
① 初始阶段,被氧化的反应速率:实验Ⅰ___(填“ ”“ ”或“ ”)实验Ⅱ。
② 实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有 (蓝色)或
(无色),进行以下实验探究:
步骤.取实验Ⅲ的深红棕色溶液,加入 ,多次萃取、分液。
步骤 .取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤 的目的是__________________________。
ⅱ.查阅资料,, (无色)容易被空气氧化。用
离子方程式解释步骤 的溶液中发生的变化:
____________________________________________________________________________
_________________________________。
除去,防止干扰后续实验
、
③ 结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,实验Ⅰ中铜被氧化的化学方程
式是___________________________________________。分别取实验Ⅰ和Ⅱ充分反应后的
固体,洗涤后得到白色沉淀,加入浓 溶液,________________________________
(填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是________________
_______________________________________。
(或)
白色沉淀逐渐溶解,溶液变为无色
铜与碘的反应为可逆反应(或浓度小未能氧化全部的)
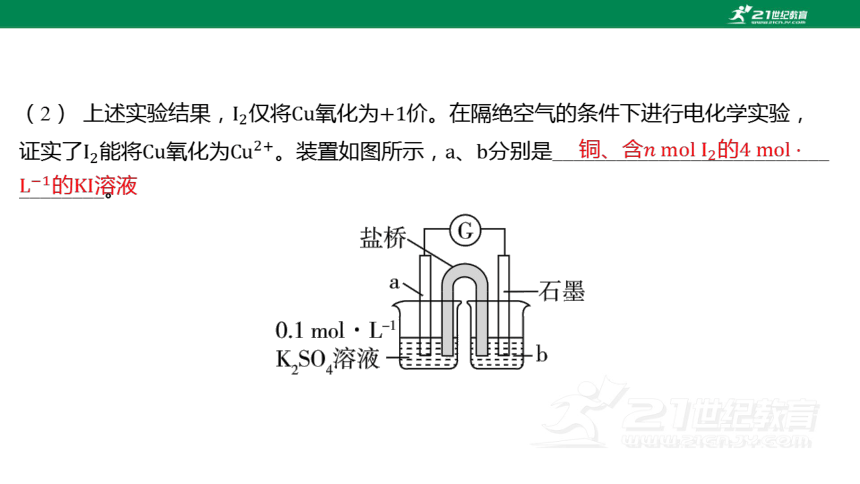
(2) 上述实验结果,仅将氧化为 价。在隔绝空气的条件下进行电化学实验,
证实了能将氧化为。装置如图所示,、 分别是__________________________
________。
铜、含的的溶液
(3) 运用氧化还原反应规律,分析在上述实验中被 氧化的产物中价态不同的原因:
____________________________________________________________________________
____________________________________________________________________________
__________________________ 。
在实验Ⅰ、实验Ⅱ、实验Ⅲ中可以进一步与结合生成沉淀或, 浓
度减小使得氧化性增强,发生反应 和
【解析】
实验目的 探究被 氧化的产物及铜元素的价态
实验原理 (1)或
实验现象 及相关 分析 (1)①在水中溶解度很小,主要被 氧化,实验Ⅰ与实验Ⅱ相比,实验
Ⅱ中浓度比较大,则平衡正向移动,的浓度较大,与 接触
更加充分,与的反应速率增大,故被氧化的反应速率:实验Ⅰ 实验
Ⅱ。
实验现象 及相关 分析 ②实验Ⅲ所得深红棕色溶液中存在平衡,加入萃取, 浓
度减小,平衡逆向移动, 浓度减小,防止干扰后续实验。分
液后溶液无色,则以 的形式存在,加入浓氨水后,溶液颜色变浅
蓝色,并逐渐加深,结合 无色且易被空气氧化的信息可知,
先转化为,无色的 被氧化为蓝色的
,离子方程式为
、
。
续表
实验现象 及相关 分析 ③由题干信息可知,实验Ⅰ中可被和氧化为 ,化学方程式为
、,加入浓 溶液,发生反应
,故产生白色沉淀溶解,溶液变为无色的现象;观察到
少量红色的铜,说明实验Ⅰ和实验Ⅱ中碘和铜均未完全反应,则说明铜和碘
的反应为可逆反应,或浓度小,未能氧化全部的
实验试剂 及相关 分析 (2)通过原电池装置证实可以将氧化为,则铜作负极,因为 在
水中溶解度很小,由已知信息可知,的氧化性和 几乎相同,则正极的电
解质溶液可以是含的的 溶液(【点拨】设置实验探究
验证,以实验Ⅲ为对照组选择烧杯 中的试剂。)
续表
实验结论 及相关 分析 (3)含的的溶液与铜组成的原电池装置中,将 氧
化为;而在实验Ⅲ中将氧化为价,这是由于可以进一步与
结合生成沉淀或,浓度减小使得 氧化性增强,发生反应
和
续表
2.(2021北京)某小组实验验证“ ”为可逆反应并测定其平衡常数。
(1) 实验验证
实验Ⅰ.将的溶液和的溶液 等体积
混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ.向少量粉中加入的溶液 ,固体完全溶解。
① 取Ⅰ中沉淀,加入浓硝酸,证实沉淀为 。现象是______________________________
___。
灰黑色固体溶解,产生红棕色气体
② Ⅱ中溶液选用,不选用 的原因是____________________________
___________________。
综合上述实验,证实“ ”为可逆反应。
防止酸性条件下,氧化,干扰实验结果
③ 小组同学采用电化学装置从平衡移动角度进行验证。补全电化学装置示意图,写出
操作步骤及现象:____________________________________________________________
____________________________________________________________________________。
闭合开关,观察到电流计指针偏转后归零,往左侧烧杯中滴加较浓的或溶液,电流计指针反向偏转,表明平衡发生了移动(合理即可)
铂/石墨电极
酸性溶液或酸性溶液或二者的酸性混合溶液
溶液
(2) 测定平衡常数
实验Ⅲ.一定温度下,待实验Ⅰ中反应达到平衡状态时,取 上层清液,用
标准溶液滴定,至出现稳定的浅红色时消耗标准溶液 。
资料:(白色) ;
(红色) 。
① 滴定过程中 的作用是__________。
② 测得平衡常数 _ _____________。
作指示剂
(3) 思考问题
① 取实验Ⅰ的浊液测定,会使所测 值______(填 “偏高”“偏低”或“不受影响”)。
② 不用实验Ⅱ中清液测定 的原因是____________________________________________
___。
偏低
完全反应,无法判断体系是否达到化学平衡状态
【解析】 (1)①由于 能与浓硝酸发生反应
,故当观察到的现象为灰黑色固体溶解,产
生红棕色气体,即可证实灰黑色固体是。②由于酸性条件下,能氧化 ,从而
干扰实验,故实验Ⅱ不能使用 溶液。③由题图可知,利用原电池原理证明反应
为可逆反应,两电极反应可能分别为 、
或、,故另一个电极必须是与 或
不反应的材料,可用石墨或者铂电极,左侧烧杯中电解质溶液必须含有 或者
,可采用酸性溶液或酸性 溶液或二者的酸性混合溶液,右侧烧杯中
电解质溶液必须含有,故可用 溶液。组装好仪器后,加入电解质溶液,闭合
开关 ,装置产生电流,电流从哪边流入,指针则向哪个方向偏转,根据左侧烧杯中所
加试剂的不同,电流方向可能不同,因此可能观察到的现象为 电极逐渐溶解,灵敏
电流计指针向左偏转,一段时间后指针归零,说明此时反应达到平衡,再向左侧烧杯中
滴加较浓的 溶液,灵敏电流计指针向右偏转,表明平衡发生了移动;另一种现象
为 电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应
达到平衡,再向左侧烧杯中滴加较浓的溶液, 电极上固体逐渐减少,灵敏
电流计指针向左偏转,表明平衡发生了移动。(2)①根据已知信息可知,当溶液中
完全反应后,才能发生反应并呈现出特殊颜色,故 起指示剂作用。②根据
滴定实验可得上层清液中,则与反应的 为
,根据离子方程式可知,参与反应的与生成的 均为
,实验Ⅰ将的溶液与等体积的 溶液混
合,反应前初始的 ,因此反应达平衡后,剩余的
,故该反应的平衡
常数 。
(3)①若取实验Ⅰ所得浊液测定浓度,则与 反应导致
平衡逆向移动,测得的平衡体系中偏大,即 偏大,
故测得的值将偏低。②实验Ⅱ中 完全溶解,无法判断体系是否达到化学平衡状态,
故不用实验Ⅱ所得清液测定 。
3.(2023湖南长沙适应性考试)某化学兴趣小组为了探究在相同条件下, 的还原性
是否强于 ,进行了如下三个实验。
【实验1】通过和在溶液中的反应比较和 的还原性强弱。实验操作
与现象如下:
在避光处,向溶液中缓慢加入 溶液至过量,
搅拌,充分反应后,冰水浴冷却,过滤后得到翠绿色溶液和翠绿色晶体,并留存翠绿色
溶液待用。
已知:Ⅰ.草酸 为二元弱酸。
Ⅱ.三水三草酸合铁酸钾 为翠绿色晶体,光照易分解。其水溶液中
存在: 。
(1) 实验室配制 溶液时若不加盐酸一起进行配制,常常得到红褐色的液体,请
用离子方程式说明原因:_____________________________。
(2) 取实验1中少量晶体洗净,配成溶液,滴加 溶液,不变红,继续加入硫酸,
溶液变红,说明晶体中含有 价的铁元素,加硫酸后溶液变红的原因是_____________
____________________________________________________________________________
____________________________。
溶液中存在平衡:,加入硫酸后,与反应使平衡正向移动,增大,遇溶液变红
(3) 经检验,翠绿色晶体为 。为了确认实验1中是否发生了氧化
还原反应,取少量翠绿色溶液,向其中滴加___(填标号),未见明显现象。
A.少量 溶液
B.少量 溶液
C.少量 溶液
该小组据此判断氧化还原反应没有发生,请简述未发生氧化还原反应的原因:________
____________________________________________________________________________
___________。
B
与生成稳定的,和的浓度降低,的氧化性和的还原性减弱
【实验2】通过比较与、 反应的难易,判断二者还原性的强弱。实验操
作与现象如下:
①向溶液中加入 溶液,过滤,立即产
生黄色沉淀;
②洗涤①中的黄色沉淀(已知: 为黄色固体,微溶于水,可溶于强酸),
向其中加入过量的 溶液,振荡,静置,反应剧烈放热,产生大量的红褐色沉淀
和无色气体;
③待充分反应后,向其中加入稀硫酸,调节 约为4,得到翠绿色溶液。
(4) 证明 被氧化的实验现象是____________________________________________
________________。
②中产生大量红褐色沉淀(或③中得到翠绿色溶液,答一点即可)
(5) 以上现象能否说明 没有被氧化。请判断并说明理由:____________________
___________________________________________________________________________。
否;有价的碳的化合物生成,才能说明被氧化,以上现象无法判断是否有价的碳的化合物生成
【实验3】利用电化学装置进行实验,其装置如图:
(6) 用溶液、溶液和其他试剂,设计如图装置进行实验,比较 和
的还原性强弱,一段时间后,该小组依据实验所观察到的现象做出了 比
还原性强的实验结论。则下列实验现象描述能支持这一结论的有______(填标号)。
ACD
A.电流表指针发生偏转
B.取左侧烧杯内溶液滴加氢氧化钠溶液,出现红褐色沉淀
C.取左侧烧杯内溶液滴加 溶液,有蓝色沉淀生成
D.右侧烧杯的电极附近有无色气泡生成,经实验,该气体能使澄清石灰水变浑浊
【解析】 (1)溶液中的易水解:,
使液体呈红褐色。(2)由已知Ⅱ,运用平衡移动原理可解释原因。(3)若 被
还原,则溶液中出现,加入 溶液会出现深蓝色沉淀。(4)
为黄色固体,向其中加入过量的 溶液,产生大量的红褐色沉淀
,说明将氧化了;③中得到翠绿色溶液,说明存在 ,也
可以说明将 氧化了。(6)若图示装置构成原电池,即正极发生反应
,负极发生反应 ,则可得出题中结论。
电流表指针发生偏转,说明有电子转移,发生了氧化还原反应。 取左侧烧杯内溶
液滴加氢氧化钠溶液,出现红褐色沉淀,不能确定是否被还原为 。
取左侧烧杯内溶液滴加 溶液,有蓝色沉淀生成,说明溶液中存在
。 右侧烧杯的电极附近有无色气泡生成,经实验,该气体能使澄清石灰水变
浑浊,说明产生的气体是, 被氧化。
1.(2023辽宁省实验中学检测)是强氧化剂,除了能与、 反应外,还可与其
他还原剂如、C发生反应,某化学课外兴趣小组为探究与 的反应情况,设计如
图所示装置进行相关实验。
(1) 此装置中,怎样检查除启普发生器之外的装置的气密性 ______________________
____________________________________________________________________________
______________________________________________________。
打开活塞,关闭活塞,将球形干燥管的尖端连接橡皮管,橡皮管的另一端放入盛有水的水槽中,微热试管,水槽内有气泡逸出,停止加热,橡皮管内形成一段水柱,则装置气密性良好
(2) 实验开始时,先打开、 ,并制取氢气,一段时间后,再点燃酒精灯加热,目的是
______________________________。
排尽装置内的空气,防止发生爆炸
(3) 该装置中,碱石灰的作用是___________________。
吸收及干燥氢气
(4) 实际实验过程中观察到 熔化后,很快变成白色粉末。但干燥管内无水硫酸铜
并未变成蓝色。则与 反应的化学方程式为______________________。
(5) 出于实验安全考虑,实验结束时___(填标号)。
B
A.应先关闭活塞 ,然后移去酒精灯
B.应先移去酒精灯,然后关闭活塞
C.A和B都可以
(6) 制取 时由于设备密封性不好而进入了
少量空气,导致制得的产品中含有 杂质。
某学生设计了以下实验方案来测定该产品中
的质量分数:
该氧化钠产品中 的质量分数为_____。
【解析】 (1)此装置中,检查除启普发生器之外的装
置的气密性(【解题关键】检验装置气密性时要整个
装置形成密闭体系),操作为打开活塞,关闭活塞 ,将
球形干燥管的尖端连接橡皮管,橡皮管的另一端放入盛
有水的水槽中,微热试管,水槽内有气泡逸出,停止加热, 橡皮管内形成一段水柱,则装置气
密性良好。(2)实验开始时,先打开、 ,并制取氢气,一段时间后,再点燃酒精灯加热,可
排尽装置内的空气,防止发生爆炸。(3)由于氢气中混有 和水蒸气,需除去,故碱石灰
用于吸收 及干燥氢气。(4)干燥管内无水硫酸铜并未变成蓝色,表明没有水生成,则
与 反应的化学方
程式为 。(5)出于实验安全
考虑,在加热过程中,应防止空气进入试管,则实验结束
时,应先移去酒精灯,然后关闭活塞。(6) 产品
在氧气中充分燃烧,被氧化为,质量由
增重至,则参加反应的 的质量为
,由关系式 ,得
,该氧化
钠产品中 的质量分数为
。
2.(2023湖南湘潭模拟)铜是生活中常见的金属,以铜为原料进行如下实验。回答下列
问题:
Ⅰ.制备
(1) 利用铜与浓硫酸反应制备 ,下列
装置适宜的是___(填装置标号),该装置
内发生反应的化学方程式为______________
_________________________________。
B
(2) 反应后,发生装置中有黑色物质生成,
发生副反应生成了黑色固体、
溶液颜色呈灰蓝色,原因是____________________________________。
Ⅱ.探究温度对铜与过氧化氢反应速率的影响
向溶液中滴加 硫酸溶液,将光洁无锈的铜丝置于其中,
铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为 ,查阅资料
发现是催化 分解的结果。
(3) 写出生成 的离子方程式:________________________________。
(4) 学习小组提出猜想:升高温度, 催化能力增强。该小组设计如下实验验证猜想。
① 小组同学认为实验 的结果不能证明猜想成立,理由是______________________
___。
温度升高促进的分解
② 为进一步验证猜想,补充实验 的方案(填写表中横线处)。小组同学结合实验
,判断猜想成立,依据是____。
实验 序号 溶液/ 溶液/ 水/ 水浴温度/ 内生成 的平
均速率/
1 10 1 1 20 2.4
2 10 1 1 30 9
3 10 1 1 40 90
4 10 0 2 20
10
实验 序号 溶液/ 溶液/ 水/ 水浴温度/ 内生成 的平
均速率/
5 ___ ___ ____ ________________ ________________ ________________ ________________
6 10 0 2 40
0
2
30
实验组生成的平均速率随温度升高的增加程度比对照组大
续表
【解析】
实验 目的 以铜为原料制备 ,并探究温度对铜与过氧化氢反应速率的影响
实验 原理 (1)制备 ;
(3)铜与过氧化氢反应:
实验 装置 (1)反应物为铜(固体)与浓硫酸(液体),反应条件为加热,应选用固液
加热装置,装置A无加热装置(【拓展】装置A为简易的启普发生器,用于块
状固体与液体在不加热条件下制备难溶于反应液的气体),装置C为固固加热
装置,应选装置B
实验现 象及相 关分析 (2)反应后,发生装置中有黑色物质生成,溶液颜色呈灰蓝色,这是因为发
生了副反应,生成了黑色固体、
实验结 论及相 关分析 (4)①实验1、2、3中加入溶液、 溶液、水的体积相同,水浴温
度不同,水浴温度越高,内生成 的平均速率越大,但由于温度升高会
加快过氧化氢的分解,则实验1、2、3的结果不能说明升高温度, 催化能
力增强.
②由实验1、4,实验3、6可知实验中、水浴温度相同,加入 溶
液的体积不同,(【点拨】探究某个因素对反应速率的影响时,多采用控制
变量法,一般需设计对照实验)得出实验2、5也是一组对照实验,则实验5中
应加入溶液、溶液、 水,水浴温
度为;升高温度,催化能力增强的依据是实验组生成 的平均
速率随温度升高的增加程度比对照组 大
续表
3.(2023广东深圳模拟)某学习小组在实验室进行了有关碘化铅 的实验探究。回
答下列问题:
Ⅰ.制备 悬浊液
(1) 溶液和溶液反应会产生金黄色的 沉淀,形成美丽的“黄金雨”。
① 溶液在空气中久置会变质,其原因是__________________________________。
② 生成 的化学方程式为________________________________。充分反应后,经一
系列操作得到纯净的固体,向其中加入蒸馏水,得到 悬浊液。
具有还原性,会被空气中的氧化
Ⅱ.探究浓度对 沉淀溶解平衡的影响
【查阅资料】ⅰ.温度一定时,强电解质稀溶
液的电导率随溶液中离子浓度的增大而增大;
时, 饱和溶液的电导率为
。
(2) 稀释对沉淀溶解平衡的影响:时,向 悬浊液中加入一定体积的蒸
馏水,通过图甲所示装置测定电导率,并得到电导率随时间变化的曲线(图乙)。
① 实验装置中仪器 的名称为____________。
② 由电导率变化曲线可知,实验中通过仪器 加入蒸馏水的方式是___(填标号)。
酸式滴定管
B
A.连续逐滴加入 B.分三次快速加入 C.一次性快速加入
③ 图乙中,____________________段(用字母表示,任写一段)表示 达到沉淀溶
解平衡状态; 段溶液的电导率逐渐增大的原因是__________________,溶液中离子浓
度不断增大。
(或或或)
固体不断溶解
(3) 对沉淀溶解平衡的影响:时,将悬浊液静置后,取
上层清液(即饱和溶液) 于烧杯中,另取蒸馏水于相
同规格的烧杯中进行对比实验,再分别向其中加入 溶液。实验数据记录如
表:
累计加入的 溶液的体积/ 电导率/ 饱和溶液 蒸馏水
0 368 4
0.50
1.00
① 上述实验过程中,增大饱和溶液中 的浓度,可观察到的实验现象是_________
_______。
② 利用蒸馏水进行对比实验时,所取蒸馏水的体积为_____ 。
③ 表格数据______(填“大于”“小于”或“等于”),说明增大 的浓度,
沉淀溶解平衡向生成沉淀的方向移动。
产生金黄色沉淀
200
小于
【装置剖析】
实验目的 制备悬浊液并探究 沉淀溶解平衡的影响因素
实验原理 (1)②
实验现象及相 关分析 (3)①增大饱和溶液中 的浓度,平衡
逆向移动,可观察到溶液中产生金黄色
沉淀
实验探究及相 关分析 (3)②为保证变量唯一,所取蒸馏水的体积应与所取上层清液的体
积相同,即 。
③增大的浓度, 沉淀溶解平衡向生成沉淀的方向移动,导致上
层清液中浓度的增加量小于蒸馏水中 浓度的增加量,故上层清液
的电导率的变化量小于蒸馏水的电导率的变化量,则 小于
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
2025年高考化学考向分析
探究型实验
1.(2023北京)资料显示,可以将氧化为。某小组同学设计实验探究被 氧
化的产物及铜元素的价态。
已知:易溶于溶液,发生反应(红棕色);和 氧化性几乎相同。
(1) 将等体积的溶液加入到铜粉和 的固体混合物中,振荡。
实验记录如下:
实验现象
实验Ⅰ 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉
转化为白色沉淀,溶液仍为淡红色
实验Ⅱ 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转
化为白色沉淀,溶液仍为红棕色
实验Ⅲ 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉
完全溶解,溶液为深红棕色
① 初始阶段,被氧化的反应速率:实验Ⅰ___(填“ ”“ ”或“ ”)实验Ⅱ。
② 实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有 (蓝色)或
(无色),进行以下实验探究:
步骤.取实验Ⅲ的深红棕色溶液,加入 ,多次萃取、分液。
步骤 .取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤 的目的是__________________________。
ⅱ.查阅资料,, (无色)容易被空气氧化。用
离子方程式解释步骤 的溶液中发生的变化:
____________________________________________________________________________
_________________________________。
除去,防止干扰后续实验
、
③ 结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,实验Ⅰ中铜被氧化的化学方程
式是___________________________________________。分别取实验Ⅰ和Ⅱ充分反应后的
固体,洗涤后得到白色沉淀,加入浓 溶液,________________________________
(填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是________________
_______________________________________。
(或)
白色沉淀逐渐溶解,溶液变为无色
铜与碘的反应为可逆反应(或浓度小未能氧化全部的)
(2) 上述实验结果,仅将氧化为 价。在隔绝空气的条件下进行电化学实验,
证实了能将氧化为。装置如图所示,、 分别是__________________________
________。
铜、含的的溶液
(3) 运用氧化还原反应规律,分析在上述实验中被 氧化的产物中价态不同的原因:
____________________________________________________________________________
____________________________________________________________________________
__________________________ 。
在实验Ⅰ、实验Ⅱ、实验Ⅲ中可以进一步与结合生成沉淀或, 浓
度减小使得氧化性增强,发生反应 和
【解析】
实验目的 探究被 氧化的产物及铜元素的价态
实验原理 (1)或
实验现象 及相关 分析 (1)①在水中溶解度很小,主要被 氧化,实验Ⅰ与实验Ⅱ相比,实验
Ⅱ中浓度比较大,则平衡正向移动,的浓度较大,与 接触
更加充分,与的反应速率增大,故被氧化的反应速率:实验Ⅰ 实验
Ⅱ。
实验现象 及相关 分析 ②实验Ⅲ所得深红棕色溶液中存在平衡,加入萃取, 浓
度减小,平衡逆向移动, 浓度减小,防止干扰后续实验。分
液后溶液无色,则以 的形式存在,加入浓氨水后,溶液颜色变浅
蓝色,并逐渐加深,结合 无色且易被空气氧化的信息可知,
先转化为,无色的 被氧化为蓝色的
,离子方程式为
、
。
续表
实验现象 及相关 分析 ③由题干信息可知,实验Ⅰ中可被和氧化为 ,化学方程式为
、,加入浓 溶液,发生反应
,故产生白色沉淀溶解,溶液变为无色的现象;观察到
少量红色的铜,说明实验Ⅰ和实验Ⅱ中碘和铜均未完全反应,则说明铜和碘
的反应为可逆反应,或浓度小,未能氧化全部的
实验试剂 及相关 分析 (2)通过原电池装置证实可以将氧化为,则铜作负极,因为 在
水中溶解度很小,由已知信息可知,的氧化性和 几乎相同,则正极的电
解质溶液可以是含的的 溶液(【点拨】设置实验探究
验证,以实验Ⅲ为对照组选择烧杯 中的试剂。)
续表
实验结论 及相关 分析 (3)含的的溶液与铜组成的原电池装置中,将 氧
化为;而在实验Ⅲ中将氧化为价,这是由于可以进一步与
结合生成沉淀或,浓度减小使得 氧化性增强,发生反应
和
续表
2.(2021北京)某小组实验验证“ ”为可逆反应并测定其平衡常数。
(1) 实验验证
实验Ⅰ.将的溶液和的溶液 等体积
混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ.向少量粉中加入的溶液 ,固体完全溶解。
① 取Ⅰ中沉淀,加入浓硝酸,证实沉淀为 。现象是______________________________
___。
灰黑色固体溶解,产生红棕色气体
② Ⅱ中溶液选用,不选用 的原因是____________________________
___________________。
综合上述实验,证实“ ”为可逆反应。
防止酸性条件下,氧化,干扰实验结果
③ 小组同学采用电化学装置从平衡移动角度进行验证。补全电化学装置示意图,写出
操作步骤及现象:____________________________________________________________
____________________________________________________________________________。
闭合开关,观察到电流计指针偏转后归零,往左侧烧杯中滴加较浓的或溶液,电流计指针反向偏转,表明平衡发生了移动(合理即可)
铂/石墨电极
酸性溶液或酸性溶液或二者的酸性混合溶液
溶液
(2) 测定平衡常数
实验Ⅲ.一定温度下,待实验Ⅰ中反应达到平衡状态时,取 上层清液,用
标准溶液滴定,至出现稳定的浅红色时消耗标准溶液 。
资料:(白色) ;
(红色) 。
① 滴定过程中 的作用是__________。
② 测得平衡常数 _ _____________。
作指示剂
(3) 思考问题
① 取实验Ⅰ的浊液测定,会使所测 值______(填 “偏高”“偏低”或“不受影响”)。
② 不用实验Ⅱ中清液测定 的原因是____________________________________________
___。
偏低
完全反应,无法判断体系是否达到化学平衡状态
【解析】 (1)①由于 能与浓硝酸发生反应
,故当观察到的现象为灰黑色固体溶解,产
生红棕色气体,即可证实灰黑色固体是。②由于酸性条件下,能氧化 ,从而
干扰实验,故实验Ⅱ不能使用 溶液。③由题图可知,利用原电池原理证明反应
为可逆反应,两电极反应可能分别为 、
或、,故另一个电极必须是与 或
不反应的材料,可用石墨或者铂电极,左侧烧杯中电解质溶液必须含有 或者
,可采用酸性溶液或酸性 溶液或二者的酸性混合溶液,右侧烧杯中
电解质溶液必须含有,故可用 溶液。组装好仪器后,加入电解质溶液,闭合
开关 ,装置产生电流,电流从哪边流入,指针则向哪个方向偏转,根据左侧烧杯中所
加试剂的不同,电流方向可能不同,因此可能观察到的现象为 电极逐渐溶解,灵敏
电流计指针向左偏转,一段时间后指针归零,说明此时反应达到平衡,再向左侧烧杯中
滴加较浓的 溶液,灵敏电流计指针向右偏转,表明平衡发生了移动;另一种现象
为 电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应
达到平衡,再向左侧烧杯中滴加较浓的溶液, 电极上固体逐渐减少,灵敏
电流计指针向左偏转,表明平衡发生了移动。(2)①根据已知信息可知,当溶液中
完全反应后,才能发生反应并呈现出特殊颜色,故 起指示剂作用。②根据
滴定实验可得上层清液中,则与反应的 为
,根据离子方程式可知,参与反应的与生成的 均为
,实验Ⅰ将的溶液与等体积的 溶液混
合,反应前初始的 ,因此反应达平衡后,剩余的
,故该反应的平衡
常数 。
(3)①若取实验Ⅰ所得浊液测定浓度,则与 反应导致
平衡逆向移动,测得的平衡体系中偏大,即 偏大,
故测得的值将偏低。②实验Ⅱ中 完全溶解,无法判断体系是否达到化学平衡状态,
故不用实验Ⅱ所得清液测定 。
3.(2023湖南长沙适应性考试)某化学兴趣小组为了探究在相同条件下, 的还原性
是否强于 ,进行了如下三个实验。
【实验1】通过和在溶液中的反应比较和 的还原性强弱。实验操作
与现象如下:
在避光处,向溶液中缓慢加入 溶液至过量,
搅拌,充分反应后,冰水浴冷却,过滤后得到翠绿色溶液和翠绿色晶体,并留存翠绿色
溶液待用。
已知:Ⅰ.草酸 为二元弱酸。
Ⅱ.三水三草酸合铁酸钾 为翠绿色晶体,光照易分解。其水溶液中
存在: 。
(1) 实验室配制 溶液时若不加盐酸一起进行配制,常常得到红褐色的液体,请
用离子方程式说明原因:_____________________________。
(2) 取实验1中少量晶体洗净,配成溶液,滴加 溶液,不变红,继续加入硫酸,
溶液变红,说明晶体中含有 价的铁元素,加硫酸后溶液变红的原因是_____________
____________________________________________________________________________
____________________________。
溶液中存在平衡:,加入硫酸后,与反应使平衡正向移动,增大,遇溶液变红
(3) 经检验,翠绿色晶体为 。为了确认实验1中是否发生了氧化
还原反应,取少量翠绿色溶液,向其中滴加___(填标号),未见明显现象。
A.少量 溶液
B.少量 溶液
C.少量 溶液
该小组据此判断氧化还原反应没有发生,请简述未发生氧化还原反应的原因:________
____________________________________________________________________________
___________。
B
与生成稳定的,和的浓度降低,的氧化性和的还原性减弱
【实验2】通过比较与、 反应的难易,判断二者还原性的强弱。实验操
作与现象如下:
①向溶液中加入 溶液,过滤,立即产
生黄色沉淀;
②洗涤①中的黄色沉淀(已知: 为黄色固体,微溶于水,可溶于强酸),
向其中加入过量的 溶液,振荡,静置,反应剧烈放热,产生大量的红褐色沉淀
和无色气体;
③待充分反应后,向其中加入稀硫酸,调节 约为4,得到翠绿色溶液。
(4) 证明 被氧化的实验现象是____________________________________________
________________。
②中产生大量红褐色沉淀(或③中得到翠绿色溶液,答一点即可)
(5) 以上现象能否说明 没有被氧化。请判断并说明理由:____________________
___________________________________________________________________________。
否;有价的碳的化合物生成,才能说明被氧化,以上现象无法判断是否有价的碳的化合物生成
【实验3】利用电化学装置进行实验,其装置如图:
(6) 用溶液、溶液和其他试剂,设计如图装置进行实验,比较 和
的还原性强弱,一段时间后,该小组依据实验所观察到的现象做出了 比
还原性强的实验结论。则下列实验现象描述能支持这一结论的有______(填标号)。
ACD
A.电流表指针发生偏转
B.取左侧烧杯内溶液滴加氢氧化钠溶液,出现红褐色沉淀
C.取左侧烧杯内溶液滴加 溶液,有蓝色沉淀生成
D.右侧烧杯的电极附近有无色气泡生成,经实验,该气体能使澄清石灰水变浑浊
【解析】 (1)溶液中的易水解:,
使液体呈红褐色。(2)由已知Ⅱ,运用平衡移动原理可解释原因。(3)若 被
还原,则溶液中出现,加入 溶液会出现深蓝色沉淀。(4)
为黄色固体,向其中加入过量的 溶液,产生大量的红褐色沉淀
,说明将氧化了;③中得到翠绿色溶液,说明存在 ,也
可以说明将 氧化了。(6)若图示装置构成原电池,即正极发生反应
,负极发生反应 ,则可得出题中结论。
电流表指针发生偏转,说明有电子转移,发生了氧化还原反应。 取左侧烧杯内溶
液滴加氢氧化钠溶液,出现红褐色沉淀,不能确定是否被还原为 。
取左侧烧杯内溶液滴加 溶液,有蓝色沉淀生成,说明溶液中存在
。 右侧烧杯的电极附近有无色气泡生成,经实验,该气体能使澄清石灰水变
浑浊,说明产生的气体是, 被氧化。
1.(2023辽宁省实验中学检测)是强氧化剂,除了能与、 反应外,还可与其
他还原剂如、C发生反应,某化学课外兴趣小组为探究与 的反应情况,设计如
图所示装置进行相关实验。
(1) 此装置中,怎样检查除启普发生器之外的装置的气密性 ______________________
____________________________________________________________________________
______________________________________________________。
打开活塞,关闭活塞,将球形干燥管的尖端连接橡皮管,橡皮管的另一端放入盛有水的水槽中,微热试管,水槽内有气泡逸出,停止加热,橡皮管内形成一段水柱,则装置气密性良好
(2) 实验开始时,先打开、 ,并制取氢气,一段时间后,再点燃酒精灯加热,目的是
______________________________。
排尽装置内的空气,防止发生爆炸
(3) 该装置中,碱石灰的作用是___________________。
吸收及干燥氢气
(4) 实际实验过程中观察到 熔化后,很快变成白色粉末。但干燥管内无水硫酸铜
并未变成蓝色。则与 反应的化学方程式为______________________。
(5) 出于实验安全考虑,实验结束时___(填标号)。
B
A.应先关闭活塞 ,然后移去酒精灯
B.应先移去酒精灯,然后关闭活塞
C.A和B都可以
(6) 制取 时由于设备密封性不好而进入了
少量空气,导致制得的产品中含有 杂质。
某学生设计了以下实验方案来测定该产品中
的质量分数:
该氧化钠产品中 的质量分数为_____。
【解析】 (1)此装置中,检查除启普发生器之外的装
置的气密性(【解题关键】检验装置气密性时要整个
装置形成密闭体系),操作为打开活塞,关闭活塞 ,将
球形干燥管的尖端连接橡皮管,橡皮管的另一端放入盛
有水的水槽中,微热试管,水槽内有气泡逸出,停止加热, 橡皮管内形成一段水柱,则装置气
密性良好。(2)实验开始时,先打开、 ,并制取氢气,一段时间后,再点燃酒精灯加热,可
排尽装置内的空气,防止发生爆炸。(3)由于氢气中混有 和水蒸气,需除去,故碱石灰
用于吸收 及干燥氢气。(4)干燥管内无水硫酸铜并未变成蓝色,表明没有水生成,则
与 反应的化学方
程式为 。(5)出于实验安全
考虑,在加热过程中,应防止空气进入试管,则实验结束
时,应先移去酒精灯,然后关闭活塞。(6) 产品
在氧气中充分燃烧,被氧化为,质量由
增重至,则参加反应的 的质量为
,由关系式 ,得
,该氧化
钠产品中 的质量分数为
。
2.(2023湖南湘潭模拟)铜是生活中常见的金属,以铜为原料进行如下实验。回答下列
问题:
Ⅰ.制备
(1) 利用铜与浓硫酸反应制备 ,下列
装置适宜的是___(填装置标号),该装置
内发生反应的化学方程式为______________
_________________________________。
B
(2) 反应后,发生装置中有黑色物质生成,
发生副反应生成了黑色固体、
溶液颜色呈灰蓝色,原因是____________________________________。
Ⅱ.探究温度对铜与过氧化氢反应速率的影响
向溶液中滴加 硫酸溶液,将光洁无锈的铜丝置于其中,
铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为 ,查阅资料
发现是催化 分解的结果。
(3) 写出生成 的离子方程式:________________________________。
(4) 学习小组提出猜想:升高温度, 催化能力增强。该小组设计如下实验验证猜想。
① 小组同学认为实验 的结果不能证明猜想成立,理由是______________________
___。
温度升高促进的分解
② 为进一步验证猜想,补充实验 的方案(填写表中横线处)。小组同学结合实验
,判断猜想成立,依据是____。
实验 序号 溶液/ 溶液/ 水/ 水浴温度/ 内生成 的平
均速率/
1 10 1 1 20 2.4
2 10 1 1 30 9
3 10 1 1 40 90
4 10 0 2 20
10
实验 序号 溶液/ 溶液/ 水/ 水浴温度/ 内生成 的平
均速率/
5 ___ ___ ____ ________________ ________________ ________________ ________________
6 10 0 2 40
0
2
30
实验组生成的平均速率随温度升高的增加程度比对照组大
续表
【解析】
实验 目的 以铜为原料制备 ,并探究温度对铜与过氧化氢反应速率的影响
实验 原理 (1)制备 ;
(3)铜与过氧化氢反应:
实验 装置 (1)反应物为铜(固体)与浓硫酸(液体),反应条件为加热,应选用固液
加热装置,装置A无加热装置(【拓展】装置A为简易的启普发生器,用于块
状固体与液体在不加热条件下制备难溶于反应液的气体),装置C为固固加热
装置,应选装置B
实验现 象及相 关分析 (2)反应后,发生装置中有黑色物质生成,溶液颜色呈灰蓝色,这是因为发
生了副反应,生成了黑色固体、
实验结 论及相 关分析 (4)①实验1、2、3中加入溶液、 溶液、水的体积相同,水浴温
度不同,水浴温度越高,内生成 的平均速率越大,但由于温度升高会
加快过氧化氢的分解,则实验1、2、3的结果不能说明升高温度, 催化能
力增强.
②由实验1、4,实验3、6可知实验中、水浴温度相同,加入 溶
液的体积不同,(【点拨】探究某个因素对反应速率的影响时,多采用控制
变量法,一般需设计对照实验)得出实验2、5也是一组对照实验,则实验5中
应加入溶液、溶液、 水,水浴温
度为;升高温度,催化能力增强的依据是实验组生成 的平均
速率随温度升高的增加程度比对照组 大
续表
3.(2023广东深圳模拟)某学习小组在实验室进行了有关碘化铅 的实验探究。回
答下列问题:
Ⅰ.制备 悬浊液
(1) 溶液和溶液反应会产生金黄色的 沉淀,形成美丽的“黄金雨”。
① 溶液在空气中久置会变质,其原因是__________________________________。
② 生成 的化学方程式为________________________________。充分反应后,经一
系列操作得到纯净的固体,向其中加入蒸馏水,得到 悬浊液。
具有还原性,会被空气中的氧化
Ⅱ.探究浓度对 沉淀溶解平衡的影响
【查阅资料】ⅰ.温度一定时,强电解质稀溶
液的电导率随溶液中离子浓度的增大而增大;
时, 饱和溶液的电导率为
。
(2) 稀释对沉淀溶解平衡的影响:时,向 悬浊液中加入一定体积的蒸
馏水,通过图甲所示装置测定电导率,并得到电导率随时间变化的曲线(图乙)。
① 实验装置中仪器 的名称为____________。
② 由电导率变化曲线可知,实验中通过仪器 加入蒸馏水的方式是___(填标号)。
酸式滴定管
B
A.连续逐滴加入 B.分三次快速加入 C.一次性快速加入
③ 图乙中,____________________段(用字母表示,任写一段)表示 达到沉淀溶
解平衡状态; 段溶液的电导率逐渐增大的原因是__________________,溶液中离子浓
度不断增大。
(或或或)
固体不断溶解
(3) 对沉淀溶解平衡的影响:时,将悬浊液静置后,取
上层清液(即饱和溶液) 于烧杯中,另取蒸馏水于相
同规格的烧杯中进行对比实验,再分别向其中加入 溶液。实验数据记录如
表:
累计加入的 溶液的体积/ 电导率/ 饱和溶液 蒸馏水
0 368 4
0.50
1.00
① 上述实验过程中,增大饱和溶液中 的浓度,可观察到的实验现象是_________
_______。
② 利用蒸馏水进行对比实验时,所取蒸馏水的体积为_____ 。
③ 表格数据______(填“大于”“小于”或“等于”),说明增大 的浓度,
沉淀溶解平衡向生成沉淀的方向移动。
产生金黄色沉淀
200
小于
【装置剖析】
实验目的 制备悬浊液并探究 沉淀溶解平衡的影响因素
实验原理 (1)②
实验现象及相 关分析 (3)①增大饱和溶液中 的浓度,平衡
逆向移动,可观察到溶液中产生金黄色
沉淀
实验探究及相 关分析 (3)②为保证变量唯一,所取蒸馏水的体积应与所取上层清液的体
积相同,即 。
③增大的浓度, 沉淀溶解平衡向生成沉淀的方向移动,导致上
层清液中浓度的增加量小于蒸馏水中 浓度的增加量,故上层清液
的电导率的变化量小于蒸馏水的电导率的变化量,则 小于
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
