7.3溶液浓稀的表示 课件(共32张PPT)-九年级化学科粤版(2025)下册
文档属性
| 名称 | 7.3溶液浓稀的表示 课件(共32张PPT)-九年级化学科粤版(2025)下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-31 15:43:37 | ||
图片预览









文档简介
(共32张PPT)
第七单元 溶液
7.3 溶液浓稀的表示
九下化学 KY
1.知道溶质质量分数可以表示浓度;能从定量的视角,说明溶质质
量分数的含义。
2.能进行溶质质量分数的简单计算。
3.能根据需要配制一定溶质质量分数的溶液。
4.理解溶解度与溶质质量分数的区别与联系。
1.溶液浓稀的判断
(1)溶液颜色的深浅
可以通过颜色的深浅粗略判断有色溶液(如硫酸铜溶液)的浓稀程
度。比如不同浓度的硫酸铜溶液,颜色越深则浓度越大。
(2)浓度
想要准确地判断有色或无色溶液的浓稀,就涉及溶液浓稀的定量表示,
即浓度的问题。在溶液中,浓度是指一定量的溶液中所含溶质的量。
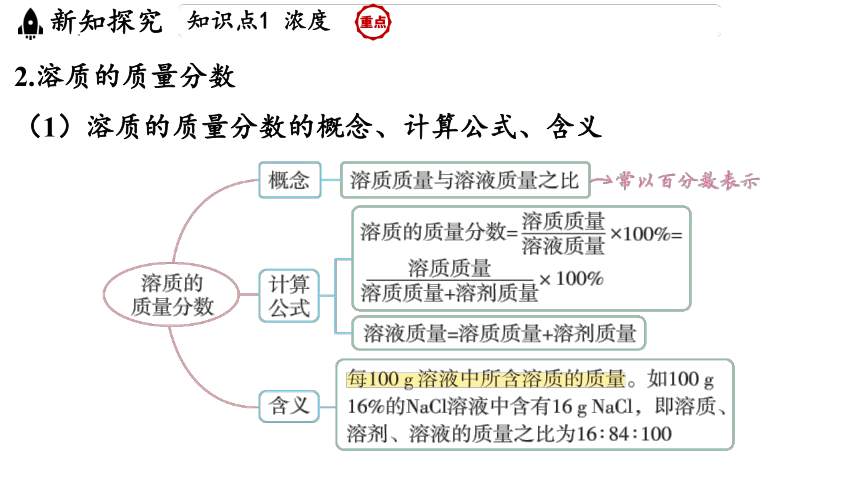
2.溶质的质量分数
(1)溶质的质量分数的概念、计算公式、含义
特别提醒
对溶液中溶质的质量分数的理解
1.溶液具有均一性,故溶液中各部分溶质的质量分数都相等;溶液
具有稳定性,一瓶溶液长期放置,只要外界条件不变,其溶质的质
量分数不变。
2.运用溶质的质量分数表示溶液浓度时,必须分清溶质质量、溶剂
质量与溶液质量。
(2)不饱和溶液中溶质的质量分数与溶质质量、溶剂质量、溶液
质量之间的关系
溶质质量 溶剂质量 溶液质量 溶质的质量分数
不变 增加 增加 减小
不变 减少 减少 增大
增加 不变 增加 增大
减少 不变 减少 减小
典例1 国以农为本,农以种为先,盐水选种是古人的
智慧结晶。现有一瓶溶质质量分数为 的食盐水,关于该食盐水
的说法正确的是( )
B
A. B.
C. D.
[解析] “溶质质量分数为的食盐水”的含义为每 该溶液中
含溶质,即 ,则
,
。故选B。
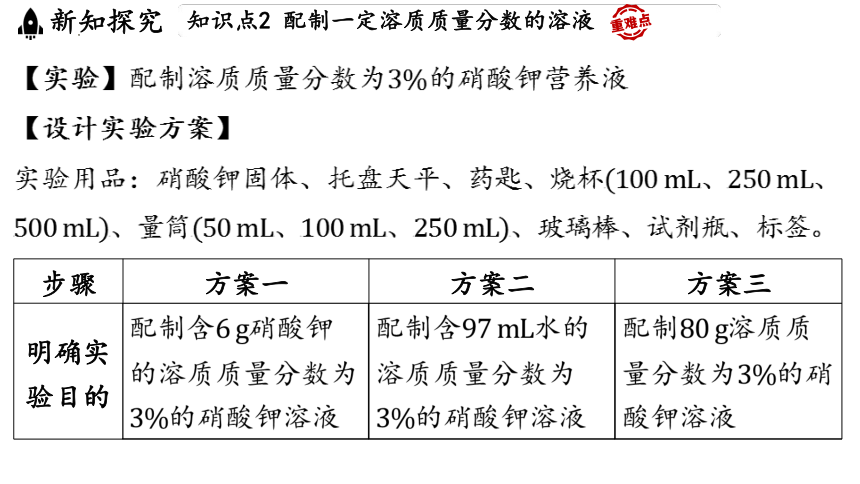
【设计实验方案】
实验用品:硝酸钾固体、托盘天平、药匙、烧杯
步骤 方案一 方案二 方案三
明确实 验目的 配制含 硝酸钾 的溶质质量分数为 的硝酸钾溶液 配制含 水的 溶质质量分数为 的硝酸钾溶液 配制 溶质质
量分数为 的硝
酸钾溶液
【实验】配制溶质质量分数为 的硝酸钾营养液
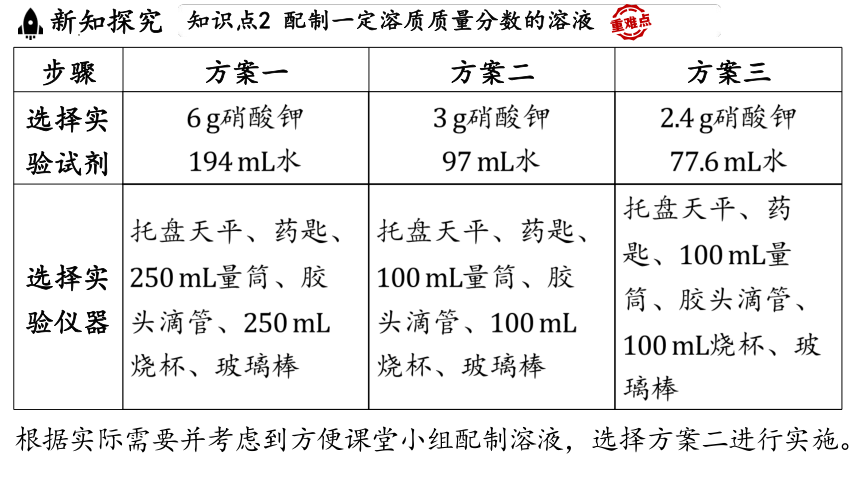
步骤 方案一 方案二 方案三
选择实 验试剂 硝酸钾 水 硝酸钾 水 硝酸钾
水
选择实 验仪器 托盘天平、药匙、 量筒、胶 头滴管、 烧杯、玻璃棒 托盘天平、药匙、 量筒、胶 头滴管、 烧杯、玻璃棒 托盘天平、药
匙、 量
筒、胶头滴管、
烧杯、玻
璃棒
根据实际需要并考虑到方便课堂小组配制溶液,选择方案二进行实施。
【实施实验方案】
1.计算:根据实际需要计算出所需的硝酸钾的质量和水的体积。
2.称量:用托盘天平称量所需质量的硝酸钾,倒入烧杯中;用
3.溶解:将量筒里的水注入盛有硝酸钾的烧杯中,并用玻璃棒搅拌
使硝酸钾充分溶解。
4.装瓶:把上述硝酸钾溶液装入贴有试剂名称和溶质质量分数标签
的试剂瓶中,盖好瓶塞,放到指定的试剂柜中。
水的密度为
【反思与交流】
1.(1)固体称量操作要点:
相等的称量纸,调节天平平衡,准备进行称量;③先将游码调整到
所需硝酸钾的质量的刻度,然后逐渐添加硝酸钾直到天平平衡;④
称量完毕,砝码、游码还归原位。
(2)液体量取操作要点:视线要与量筒内液体凹液面的最低处保
持水平。
(3)倾倒操作要点:将量筒中的水沿烧杯壁倒入烧杯中,切勿洒出。
(4)搅拌操作要点:搅拌时玻璃棒不要碰烧杯壁和烧杯底。
2.当我们配制一定溶质质量分数的溶液时,要根据实际需要选择溶
质和溶剂的质量。如家用土培绿萝所需的溶质质量分数为 的
硝酸钾营养液1次用量为 ,1周约使用1次。使用时,取
配制的溶质质量分数为 的硝酸钾溶液,加入水
(加入的水量约为所取溶液的9倍),混合均匀后使用。
归纳总结
配制一定溶质质量分数溶液的误差分析
根据溶质质量分数
溶质质量偏大或溶剂质量偏小
溶质质量偏小或溶剂质量偏大
误差原因 影响
溶质 质量 溶剂质量 溶质质量
分数
试剂含杂质 偏小 不变 偏小
称量 试剂与 砝码放反 未使用游码 不变 不变 不变
使用游码 偏小 不变 偏小
称量前天平未调平衡 指针偏右 偏大 不变 偏大
指针偏左 偏小 不变 偏小
量取 仰视读数 不变 偏大 偏小
俯视读数 不变 偏小 偏大
误差原因 影响
溶质 质量 溶剂质量 溶质质量
分数
溶解 称量好的溶质未全部转移至烧杯中 偏小 不变 偏小
往烧杯中倒水时,有少量水溅出 不变 偏小 偏大
溶解用的烧杯未干燥 不变 偏大 偏小
装瓶 少量溶液溅出 同比例减小 不变
试剂瓶事先用水洗涤,未干燥 不变 偏大 偏小
典例2 实验室要配制溶质质量分数为 的氯化钠溶液,某同
学按如图步骤进行实验,请回答下列问题:
(1)本实验中需要氯化钠____、水_____ 水的密度近似看作
。量取水时应选择____(填“10”“50”或“100”) 的量
筒。
2.5
47.5
50
(2)将水倒入盛有氯化钠的烧杯中后,用玻璃棒进行搅拌,其目
的是__________。
(3)以上步骤中有错误的是_______(填字母)。以上错误均导致
所配溶液的溶质质量分数______(填“大于”“小于”或“等于”) 。
加速溶解
A、B
小于
[解析] 步骤A操作错误,砝码和试剂的位置放反了,且使用了游码,
会导致试剂的实际质量偏小,使所配溶液的溶质质量分数小于 。
步骤B操作错误,仰视读数,导致量取的水的实际体积偏大,使所
配溶液的溶质质量分数小于 。
1. 溶液稀释和增浓(无溶质析出)的计算
方法 依据 公式 公式中字母的含义
稀释 ①加溶 剂 (水) 稀释前后 溶液中溶 质的质量 不变 (水) :原溶液的质量
%:原溶液的溶质质
量分数
方法 依据 公式 公式中字母的含义
稀释 ②与同 种溶质 的稀溶 液混合 混合后溶 液的总质 量 两溶液 的质量之 和; (稀) (稀) (稀) %:稀释或浓缩后的
溶质质量分数
(稀):加入的稀
溶液的溶质质量分数
方法 依据 公式 公式中字母的含义
增浓 (无溶 质析 出) ①与同种 溶质的浓 溶液混合 混合后溶 液中溶质 的质量 两溶液中 溶质的质 量之和 (稀):加入的稀
溶液的质量
加入的浓
溶液的溶质质量分
数
方法 依据 公式 公式中字母的含义
增浓 (无溶 质析 出) ②蒸发 溶剂 蒸发溶剂 前后,溶 质的质量 不变 (水) (浓):加入的浓
溶液的质量
方法 依据 公式 公式中字母的
含义
增浓 (无 溶质 析 出) ③加同种 溶质 增加溶质后,溶 液中溶质的质量 原溶液中溶质 的质量 增加的 溶质的质量 (质) (质)] (水):加
入的或蒸发掉
的水的质量
方法 依据 公式 公式中字母的
含义
增浓 (无 溶质 析 出) ③加同种 溶质 增加溶质前后溶 剂的质量不变 (质) (质) 加
入的溶质的质
量
典例3 兴趣小组制作叶脉书签需要用 的氢氧化钠溶液,实验室
有的氢氧化钠溶液 ,需要加水( )
D
A. B. C. D.
[解析] 设需要加入水的质量为 ,根据溶液稀释前后溶质的质量不
变,则,解得 。
典例4 现有溶质质量分数为 的食盐溶液,要使溶液的溶质
质量分数增加一倍。下列操作正确的是( )
C
A.加入食盐
B.加入水
C.蒸发掉水
D.加入溶质质量分数为 的食盐溶液
[解析]
向溶液中加水,即稀释溶液,所得溶液的溶质质量分数减小,B错误。
2.溶质的质量分数与化学方程式的综合计算
(1)在溶液中发生化学反应时,参加反应的一般是溶液中的溶质。
所以利用化学方程式列有关反应物、生成物的质量比时,要以溶质
的质量列比例,而不能用溶液的质量列比例。
示 例 将足量的石灰石与 的稀盐酸充分反应,求能生成
多少克二氧化碳气体?
在计算时不能将 稀盐酸直接代入化学方程式计算,应先计算出稀盐酸中溶质 的质量:,将 代入化学方程式进行计算。
(2)求反应中消耗的溶液的溶质质量分数。根据化学方程式计算
出参加反应的溶质的质量,然后进行溶质质量分数的计算。
(3)求反应后所得溶液中溶质的质量分数。首先确定所得溶液的
溶质(一般是反应生成的能溶于水的物质);然后求出所得溶液的
质量,根据质量守恒定律:所得溶液的质量 反应物(溶液)的质
量总和-生成气体的质量-生成沉淀的质量。
(1) 的值为____。
0.4
[解析] 由图像可知,锌完全反应生成氢气, 锌完全反
应,则 。
典例5 为测定某稀硫酸中溶质的质量分数,向盛有 该稀硫酸的
烧杯中,分三次加入一定质量的锌粉,
生成气体的质量与加入锌粉质量的关
系如图所示。请计算:
(2)该稀硫酸中溶质的质量分数。
解:设该稀硫酸中溶质的质量为 。
该稀硫酸中溶质的质量分数为
答:该稀硫酸中溶质的质量分数为 。
第七单元 溶液
7.3 溶液浓稀的表示
九下化学 KY
1.知道溶质质量分数可以表示浓度;能从定量的视角,说明溶质质
量分数的含义。
2.能进行溶质质量分数的简单计算。
3.能根据需要配制一定溶质质量分数的溶液。
4.理解溶解度与溶质质量分数的区别与联系。
1.溶液浓稀的判断
(1)溶液颜色的深浅
可以通过颜色的深浅粗略判断有色溶液(如硫酸铜溶液)的浓稀程
度。比如不同浓度的硫酸铜溶液,颜色越深则浓度越大。
(2)浓度
想要准确地判断有色或无色溶液的浓稀,就涉及溶液浓稀的定量表示,
即浓度的问题。在溶液中,浓度是指一定量的溶液中所含溶质的量。
2.溶质的质量分数
(1)溶质的质量分数的概念、计算公式、含义
特别提醒
对溶液中溶质的质量分数的理解
1.溶液具有均一性,故溶液中各部分溶质的质量分数都相等;溶液
具有稳定性,一瓶溶液长期放置,只要外界条件不变,其溶质的质
量分数不变。
2.运用溶质的质量分数表示溶液浓度时,必须分清溶质质量、溶剂
质量与溶液质量。
(2)不饱和溶液中溶质的质量分数与溶质质量、溶剂质量、溶液
质量之间的关系
溶质质量 溶剂质量 溶液质量 溶质的质量分数
不变 增加 增加 减小
不变 减少 减少 增大
增加 不变 增加 增大
减少 不变 减少 减小
典例1 国以农为本,农以种为先,盐水选种是古人的
智慧结晶。现有一瓶溶质质量分数为 的食盐水,关于该食盐水
的说法正确的是( )
B
A. B.
C. D.
[解析] “溶质质量分数为的食盐水”的含义为每 该溶液中
含溶质,即 ,则
,
。故选B。
【设计实验方案】
实验用品:硝酸钾固体、托盘天平、药匙、烧杯
步骤 方案一 方案二 方案三
明确实 验目的 配制含 硝酸钾 的溶质质量分数为 的硝酸钾溶液 配制含 水的 溶质质量分数为 的硝酸钾溶液 配制 溶质质
量分数为 的硝
酸钾溶液
【实验】配制溶质质量分数为 的硝酸钾营养液
步骤 方案一 方案二 方案三
选择实 验试剂 硝酸钾 水 硝酸钾 水 硝酸钾
水
选择实 验仪器 托盘天平、药匙、 量筒、胶 头滴管、 烧杯、玻璃棒 托盘天平、药匙、 量筒、胶 头滴管、 烧杯、玻璃棒 托盘天平、药
匙、 量
筒、胶头滴管、
烧杯、玻
璃棒
根据实际需要并考虑到方便课堂小组配制溶液,选择方案二进行实施。
【实施实验方案】
1.计算:根据实际需要计算出所需的硝酸钾的质量和水的体积。
2.称量:用托盘天平称量所需质量的硝酸钾,倒入烧杯中;用
3.溶解:将量筒里的水注入盛有硝酸钾的烧杯中,并用玻璃棒搅拌
使硝酸钾充分溶解。
4.装瓶:把上述硝酸钾溶液装入贴有试剂名称和溶质质量分数标签
的试剂瓶中,盖好瓶塞,放到指定的试剂柜中。
水的密度为
【反思与交流】
1.(1)固体称量操作要点:
相等的称量纸,调节天平平衡,准备进行称量;③先将游码调整到
所需硝酸钾的质量的刻度,然后逐渐添加硝酸钾直到天平平衡;④
称量完毕,砝码、游码还归原位。
(2)液体量取操作要点:视线要与量筒内液体凹液面的最低处保
持水平。
(3)倾倒操作要点:将量筒中的水沿烧杯壁倒入烧杯中,切勿洒出。
(4)搅拌操作要点:搅拌时玻璃棒不要碰烧杯壁和烧杯底。
2.当我们配制一定溶质质量分数的溶液时,要根据实际需要选择溶
质和溶剂的质量。如家用土培绿萝所需的溶质质量分数为 的
硝酸钾营养液1次用量为 ,1周约使用1次。使用时,取
配制的溶质质量分数为 的硝酸钾溶液,加入水
(加入的水量约为所取溶液的9倍),混合均匀后使用。
归纳总结
配制一定溶质质量分数溶液的误差分析
根据溶质质量分数
溶质质量偏大或溶剂质量偏小
溶质质量偏小或溶剂质量偏大
误差原因 影响
溶质 质量 溶剂质量 溶质质量
分数
试剂含杂质 偏小 不变 偏小
称量 试剂与 砝码放反 未使用游码 不变 不变 不变
使用游码 偏小 不变 偏小
称量前天平未调平衡 指针偏右 偏大 不变 偏大
指针偏左 偏小 不变 偏小
量取 仰视读数 不变 偏大 偏小
俯视读数 不变 偏小 偏大
误差原因 影响
溶质 质量 溶剂质量 溶质质量
分数
溶解 称量好的溶质未全部转移至烧杯中 偏小 不变 偏小
往烧杯中倒水时,有少量水溅出 不变 偏小 偏大
溶解用的烧杯未干燥 不变 偏大 偏小
装瓶 少量溶液溅出 同比例减小 不变
试剂瓶事先用水洗涤,未干燥 不变 偏大 偏小
典例2 实验室要配制溶质质量分数为 的氯化钠溶液,某同
学按如图步骤进行实验,请回答下列问题:
(1)本实验中需要氯化钠____、水_____ 水的密度近似看作
。量取水时应选择____(填“10”“50”或“100”) 的量
筒。
2.5
47.5
50
(2)将水倒入盛有氯化钠的烧杯中后,用玻璃棒进行搅拌,其目
的是__________。
(3)以上步骤中有错误的是_______(填字母)。以上错误均导致
所配溶液的溶质质量分数______(填“大于”“小于”或“等于”) 。
加速溶解
A、B
小于
[解析] 步骤A操作错误,砝码和试剂的位置放反了,且使用了游码,
会导致试剂的实际质量偏小,使所配溶液的溶质质量分数小于 。
步骤B操作错误,仰视读数,导致量取的水的实际体积偏大,使所
配溶液的溶质质量分数小于 。
1. 溶液稀释和增浓(无溶质析出)的计算
方法 依据 公式 公式中字母的含义
稀释 ①加溶 剂 (水) 稀释前后 溶液中溶 质的质量 不变 (水) :原溶液的质量
%:原溶液的溶质质
量分数
方法 依据 公式 公式中字母的含义
稀释 ②与同 种溶质 的稀溶 液混合 混合后溶 液的总质 量 两溶液 的质量之 和; (稀) (稀) (稀) %:稀释或浓缩后的
溶质质量分数
(稀):加入的稀
溶液的溶质质量分数
方法 依据 公式 公式中字母的含义
增浓 (无溶 质析 出) ①与同种 溶质的浓 溶液混合 混合后溶 液中溶质 的质量 两溶液中 溶质的质 量之和 (稀):加入的稀
溶液的质量
加入的浓
溶液的溶质质量分
数
方法 依据 公式 公式中字母的含义
增浓 (无溶 质析 出) ②蒸发 溶剂 蒸发溶剂 前后,溶 质的质量 不变 (水) (浓):加入的浓
溶液的质量
方法 依据 公式 公式中字母的
含义
增浓 (无 溶质 析 出) ③加同种 溶质 增加溶质后,溶 液中溶质的质量 原溶液中溶质 的质量 增加的 溶质的质量 (质) (质)] (水):加
入的或蒸发掉
的水的质量
方法 依据 公式 公式中字母的
含义
增浓 (无 溶质 析 出) ③加同种 溶质 增加溶质前后溶 剂的质量不变 (质) (质) 加
入的溶质的质
量
典例3 兴趣小组制作叶脉书签需要用 的氢氧化钠溶液,实验室
有的氢氧化钠溶液 ,需要加水( )
D
A. B. C. D.
[解析] 设需要加入水的质量为 ,根据溶液稀释前后溶质的质量不
变,则,解得 。
典例4 现有溶质质量分数为 的食盐溶液,要使溶液的溶质
质量分数增加一倍。下列操作正确的是( )
C
A.加入食盐
B.加入水
C.蒸发掉水
D.加入溶质质量分数为 的食盐溶液
[解析]
向溶液中加水,即稀释溶液,所得溶液的溶质质量分数减小,B错误。
2.溶质的质量分数与化学方程式的综合计算
(1)在溶液中发生化学反应时,参加反应的一般是溶液中的溶质。
所以利用化学方程式列有关反应物、生成物的质量比时,要以溶质
的质量列比例,而不能用溶液的质量列比例。
示 例 将足量的石灰石与 的稀盐酸充分反应,求能生成
多少克二氧化碳气体?
在计算时不能将 稀盐酸直接代入化学方程式计算,应先计算出稀盐酸中溶质 的质量:,将 代入化学方程式进行计算。
(2)求反应中消耗的溶液的溶质质量分数。根据化学方程式计算
出参加反应的溶质的质量,然后进行溶质质量分数的计算。
(3)求反应后所得溶液中溶质的质量分数。首先确定所得溶液的
溶质(一般是反应生成的能溶于水的物质);然后求出所得溶液的
质量,根据质量守恒定律:所得溶液的质量 反应物(溶液)的质
量总和-生成气体的质量-生成沉淀的质量。
(1) 的值为____。
0.4
[解析] 由图像可知,锌完全反应生成氢气, 锌完全反
应,则 。
典例5 为测定某稀硫酸中溶质的质量分数,向盛有 该稀硫酸的
烧杯中,分三次加入一定质量的锌粉,
生成气体的质量与加入锌粉质量的关
系如图所示。请计算:
(2)该稀硫酸中溶质的质量分数。
解:设该稀硫酸中溶质的质量为 。
该稀硫酸中溶质的质量分数为
答:该稀硫酸中溶质的质量分数为 。
