8.2常见的酸和碱课件(共56张PPT)-九年级化学科粤版(2025)下册
文档属性
| 名称 | 8.2常见的酸和碱课件(共56张PPT)-九年级化学科粤版(2025)下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-31 00:00:00 | ||
图片预览








文档简介
(共56张PPT)
第八单元 常见的酸、碱、盐
8.2 常见的酸和碱
九下化学 KY
1.了解浓硫酸的吸水性、脱水性和强腐蚀性,学习浓硫酸稀释的实
验方法。
2.以盐酸、硫酸、氢氧化钠和氢氧化钙为例,通过实验探究认识酸、
碱的主要性质和用途。
3.知道可以通过物质类别认识具体物质的性质,了解通过物质的共
性认识一类物质性质的方法。
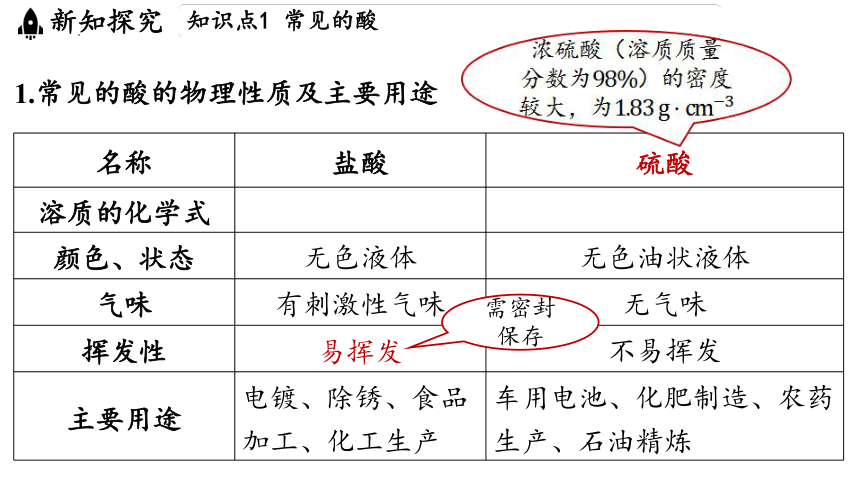
1.常见的酸的物理性质及主要用途
名称 盐酸 硫酸
溶质的化学式
颜色、状态 无色液体 无色油状液体
气味 有刺激性气味 无气味
挥发性 易挥发 不易挥发
主要用途 电镀、除锈、食品 加工、化工生产 车用电池、化肥制造、农药
生产、石油精炼
浓硫酸(溶质质量分数为 )的密度较大,为
需密封保存
知识链接
通常所说的“三酸”是指盐酸、硫酸、硝酸。其中硝酸是无色液体,
易挥发,具有强腐蚀性,是重要的化工原料。硝酸见光易分解,
需密封保存在棕色试剂瓶中。
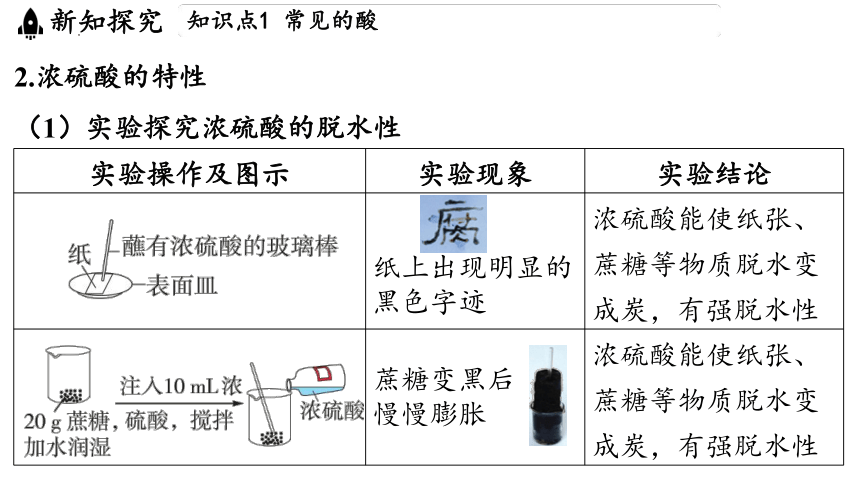
2.浓硫酸的特性
(1)实验探究浓硫酸的脱水性
实验操作及图示 实验现象 实验结论
______________________________________________________________ __________________ 纸上出现明显的黑色字迹 浓硫酸能使纸张、蔗糖等物质脱水变成炭,有强脱水性
蔗糖变黑后 慢慢膨胀 浓硫酸能使纸张、蔗糖等物质脱水变成炭,有强脱水性
(2)强腐蚀性
浓硫酸是危险品,保管和使用都要格外小心,应密封保存在专用的
试剂柜中。如果皮肤不慎沾上浓硫酸,应立即用大量水冲洗,然后
涂上
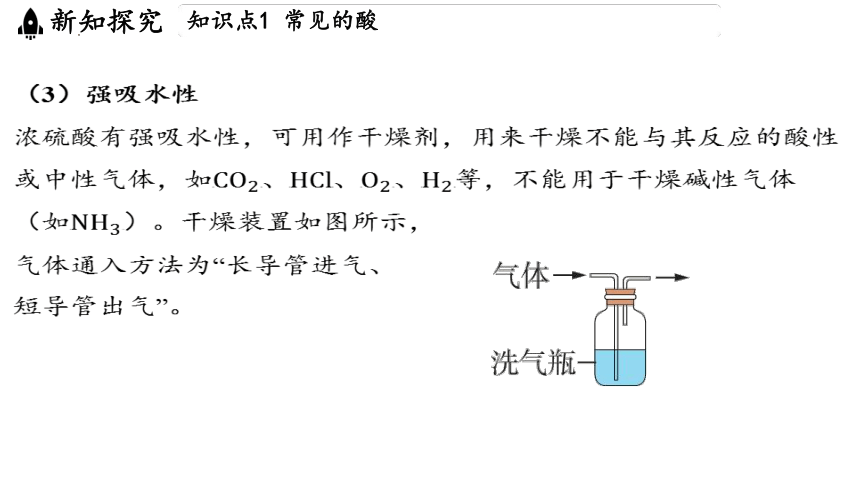
(3)强吸水性
浓硫酸有强吸水性,可用作干燥剂,用来干燥不能与其反应的酸性
或中性气体,如
(如
气体通入方法为“长导管进气、
短导管出气”。
特别提醒
浓硫酸吸水性与脱水性的区别
浓硫酸的吸水性和脱水性不同,吸水性是指能吸收物质中所含的水
分,属于物理性质;脱水性是指能将组成原物质的氢元素和氧元素
按水的组成比脱去,使物质炭化(这种作用叫脱水作用),属于化
学性质。
教材深挖
敞口放置在空气中的浓盐酸和浓硫酸的比较
物质 浓盐酸 浓硫酸
性质 挥发性 吸水性
不同点 溶质质量 减少 不变
溶剂质量 不变 增大
溶液质量 减少 增大
相同点 溶质质量分数 减小
典例1 下列有关浓盐酸和浓硫酸的叙述正确的是( )
C
A.浓盐酸和浓硫酸都有挥发性
B.浓盐酸和浓硫酸都有吸水性
C.浓盐酸和浓硫酸敞口放置溶质质量分数都变小
D.浓盐酸和浓硫酸都能作干燥剂
[解析] 浓盐酸具有挥发性,浓硫酸不具有挥发性; 浓盐
酸不具有吸水性,浓硫酸具有吸水性; 浓盐酸具有挥发性,挥
发出溶质氯化氢气体,溶质的质量减小,溶质的质量分数减小,浓
硫酸具有吸水性,溶液中溶剂的质量增加,溶质质量不变,溶质的
质量分数也减小; 浓盐酸不具有吸水性,不能作干燥剂;浓
硫酸具有吸水性,可用作干燥剂。
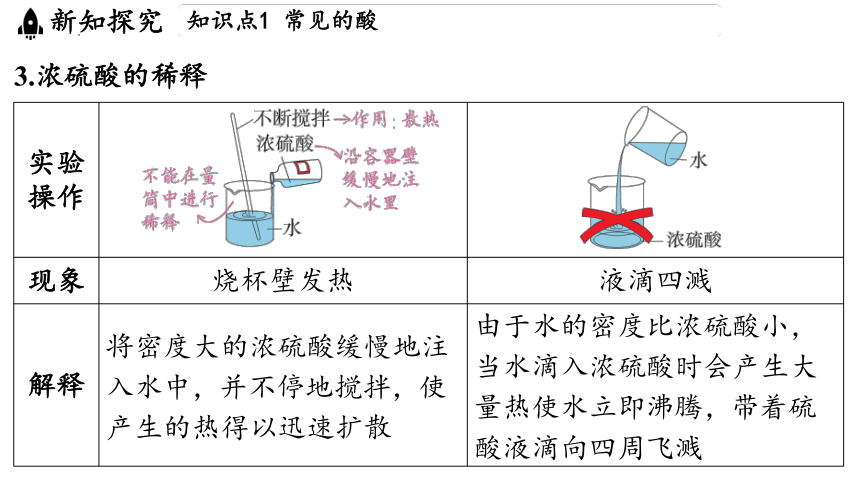
3.浓硫酸的稀释
实验 操作 ______________________________________________________________________________ ____________________________________________
现象 烧杯壁发热 液滴四溅
解释 将密度大的浓硫酸缓慢地注入水中,并不停地搅拌,使产生的热得以迅速扩散 由于水的密度比浓硫酸小,当水滴入浓硫酸时会产生大量热使水立即沸腾,带着硫酸液滴向四周飞溅
特别提醒
若将稀硫酸沾到皮肤或衣服上,也应立即用大量水冲洗,因为若不
及时冲洗,时间长了,水分蒸发后,稀硫酸会变成浓硫酸,会有很
强的腐蚀性。
典例2 某实验小组同学准备制取氢气,实验室只有 的浓硫酸,小
强用的量筒量取了 浓硫酸,准备在量筒里加水稀释,小刚
见了马上制止了小强。指出上述已完成的和未完成的实验操作中:
(1)存在的错误有________________________________;_______
_____________;________________。
(2)可能造成的后果有_____________________________________
_____________________________(答出一点即可)。
使用的量筒量取浓硫酸
在量筒内稀释浓硫酸
往浓硫酸中加水
量取浓硫酸的体积误差大(或使量筒炸裂或液滴向四周飞溅,合理即可)
[解析] 量取浓硫酸应选择或 的量筒;量筒只能用
于量取液体,不能用于稀释溶液;稀释浓硫酸时,应将浓硫酸沿容
器壁缓慢注入水中,并用玻璃棒不断搅拌,否则可能导致液滴向四
周飞溅。
稀酸有许多相似的性质。例如,能使紫色石蕊溶液变红色,但不能
使无色酚酞溶液变色。这是稀酸的化学共性之一。
探究稀酸的其他化学共性
【目的】认识稀酸的化学性质。
【提出问题】稀酸具有哪些化学共性?
【形成假设】除指示剂外,稀酸还可能与金属、金属氧化物、盐等
物质发生反应,因为1.3节学习了氧化铜与稀硫酸的反应、6.2节学
习了较活泼金属能与稀酸发生置换反应、5.3节学习了碳酸钙与稀
盐酸的反应。
【实验验证】
1.稀酸与较活泼金属的反应
回顾 第六单元6.2节,较活泼金属能与稀酸发生置换反应:
结论 稀酸能够和较活泼金属反应,生成盐(由金属离子和酸根
离子构成的化合物)和氢气,可表示为:
酸+金属→ 盐+ 氢气
活动性在氢之前
硝酸的性质较特殊,它与金属发生反应时,一般不生成氢气,而是生成氮氧化物等,故无此共性
拓展培优
由铵根离子
2.稀酸与某些金属氧化物的反应
回 顾 第一单元1.3节[实验1-13],稀硫酸滴入装有氧化铜的试管
中,生成蓝色溶液:
实 验 选择合适的反应物进行实验,
观察现象。
备选试剂:稀盐酸、稀硫酸、
氧化铜、锈铁钉(铁锈的主要
成分为Fe2O3 )
编号 酸 金属氧化物 现象与化学方程式
实验 记录 ① 稀硫酸 氧化铜 现象:黑色固体消失,溶液变为
蓝色;
化学方程式:
② 稀硫酸 氧化铁 现象:铁锈消失,溶液变为黄
色;
化学方程式:
编号 酸 金属氧化物 现象与化学方程式
实验 记录 ③ 稀盐酸 氧化铁 现象:铁锈消失,溶液变为黄
色;
化学方程式:
实验 结论 稀酸的化学共性:酸金属氧化物 盐 水
特别提醒
铁与稀盐酸、稀硫酸、硫酸铜溶液发生置换反应,生成物中铁元素
的化合价均为
稀硫酸发生反应,生成物中铁元素的化合价均为
3.稀酸与盐的反应
回顾 第五单元5.3节,实验室用稀盐酸与石灰石制取二氧化碳:
_________________________________________________________________________________________________________________________________
实验 选择合适的反应物与稀酸溶液反应,
观察现象。
备选试剂:稀盐酸、稀硫酸、
碳酸钾溶液、碳酸钠溶液
编号 酸 加入试剂 现象与化学方程式
实验 记录 ① 稀盐 酸 碳酸钾溶 液 现象:有气泡产生;
化学方程式:
② 稀盐 酸 碳酸钠溶 液 现象:有气泡产生;
化学方程式:
编号 酸 加入试剂 现象与化学方程式
实验 记录 ③ 稀硫 酸 碳酸钾溶 液 现象:有气泡产生;
化学方程式:
④ 稀硫 酸 碳酸钠溶 液 现象:有气泡产生;
化学方程式:
实验 结论 稀酸的化学相似性:酸+盐→新酸+新盐
归纳总结
酸的化学性质
典例3 如图表示化学反应中溶液的颜色变化。下列叙述不正确的
是( )
C
A.若是稀盐酸, 可能是紫色石蕊溶液
B.若是稀盐酸, 可能是氧化铁
C.若是稀硫酸, 不可能是单质
D.若是稀硫酸, 不可能是单质
[解析] 若是稀盐酸, 可能是紫色石蕊溶液,因为稀盐酸显
酸性,能使紫色石蕊溶液变红;若是稀盐酸, 可能是氧化
铁,因为稀盐酸能和氧化铁反应生成黄色的氯化铁溶液;若
是稀硫酸,可能是单质,如 是单质铁时,铁能和稀硫酸反应生成
浅绿色的硫酸亚铁溶液,铁能与蓝色的 溶液反应生成浅绿色
的溶液;若是稀硫酸, 不可能是单质,因为稀硫酸和
反应生成蓝色溶液,蓝色溶液中含有铜离子,而稀硫酸不能和铜
反应。
1.两种重要的碱的物理性质及主要用途
名称 化学式 物理性质 主要用途
氢氧 化钙 白色粉末状固体,微 溶于水,溶解度随温 度的升高而减小 作建筑材料,制漂白粉,处理污水,改良酸性土壤,配制农药波尔多液
氢氧 化钠 白色固体,易潮解,易溶于水,且溶于水时放热 制肥皂、洗涤剂,用于
造纸、纺织工业、炼制
石油
此外,常见的碱还有氢氧化钾、氨水 等。
物理变化
2.氢氧化钙和氢氧化钠
(1)氢氧化钙
①氢氧化钙的俗名叫熟石灰或消石灰。用来检验
就是氢氧化钙的水溶液。熟石灰因其既实用又便宜,可以用来制作
建筑材料。
②氢氧化钙的制取
.高温煅烧石灰石得到生石灰:
;
.生石灰再与水反应转变成熟石灰,该反应放出大量的热,
甚至能将放在石灰中的生鸡蛋煮熟: 。
主要成分是
工业上制取 的原理
氧化钙能与水反应,因此氧化钙常用作干燥剂,广泛用于食品等行业
实验操作 实验现象 实验结论
.取少量固体氢氧化钠放在表面皿上,暴露在空气中一段时间 一段时间后氢氧化钠表面变潮湿 氢氧化钠易潮
解
.取少量固体氢氧化钠放在试管 中,加水振荡,观察它的水溶性,并用手触摸试管外壁,感觉温度变化情况 氢氧化钠逐渐 溶解,试管外 壁温度升高 氢氧化钠可溶
于水,且溶于
水的过程中放
出热量
(2)氢氧化钠
①氢氧化钠俗称苛性钠、火碱或烧碱。
②观察活动:氢氧化钠的潮解性和水溶性。
③氢氧化钠有强烈的腐蚀性,使用时要小心,实验时最好戴防护眼
镜。如果氢氧化钠不慎沾到皮肤上,应立即用大量水冲洗,然后再
涂上硼酸溶液。
特别提醒
氢氧化钠的潮解性
1.氢氧化钠具有潮解性(氢氧化钠暴露在空气中容易吸收水分,表
面变潮湿并逐渐溶解),称量时应放在烧杯内;敞口放置会使物质
的总质量增加,因此需要密封保存。
2.氢氧化钠可作干燥剂,但只能干燥中性和碱性气体,如氧气、氢
气、一氧化碳、氨气等,不能干燥酸性气体,如二氧化碳、二氧化
硫和氯化氢等。
典例4 下列有关氢氧化钙、氢氧化钠的说法错误的是( )
B
A.用托盘天平称量它们的质量时,要将它们放在烧杯内称量
B.都具有吸水性,可作气体干燥剂
C.氢氧化钠易溶于水,氢氧化钙微溶于水
D.工业上通常以生石灰和水为原料制取氢氧化钙
[解析] 氢氧化钠易吸水潮解,可作某些气体的干燥剂;氢氧化钙
没有吸水性,不能作气体干燥剂。
3.气体的干燥
(1)干燥剂的选择原则
干燥剂的选择应根据被干燥气体的性质和干燥剂的性质而定,其原
则是干燥剂只能吸收被干燥气体中的水分,而不能与被干燥气体发
生反应。
(2)常见气体干燥剂的选择
干燥剂 可干燥的气体 不可干燥的气 体 干燥装
置
酸性 浓硫酸 中性气体:、 、 、 等 碱性气体: 洗气瓶
酸性气体: 、 、 等
干燥剂 可干燥的气体 不可干燥的气体 干燥装
置
碱性 固体氢氧化钠、氧化钙 中性气体:、 、 、 等 酸性气体: 、 、 等 干燥管
碱性气体:
中性 无水氯化钙 除 以外的所有气体 干燥管
典例5 如图是气体 的干燥(干燥剂是碱石灰)、收集、尾气吸收
装置,该气体可能具有的物理性质是( )
D
A.能与干燥剂反应,密度比空气大,极易溶于水
B.不与干燥剂反应,密度比空气小,极易溶于水
C.密度比空气大,难溶于水
D.密度比空气小,极易溶于水
[解析]
碱也有许多相似的化学性质。例如,碱溶液能使紫色石蕊溶液变蓝
色,使无色酚酞溶液变红色。这是碱的化学共性之一。
特别提醒
碱可分为可溶性碱和不溶性碱,只有可溶性碱才能使指示剂变色,
例如,在氢氧化铜中滴入酚酞溶液,酚酞溶液不变色。
探究碱的其他化学共性
【目的】认识碱的化学性质。
【提出问题】碱具有哪些化学共性?
【形成假设】碱溶液能与某些非金属氧化物、盐溶液发生反应。因
为5.3节学习了用澄清石灰水检验二氧化碳,4.2节学习了氢氧化钠
溶液与硫酸铜溶液反应。
【实验验证】
1.碱溶液与某些非金属氧化物的反应
回顾 第五单元5.3节,实验室用澄清石灰水检验二氧化碳:
实验 两支充满二氧化碳的试管,一支倒插入水中,另一支倒插
入氢氧化钠溶液中,摆动试管
实验 记录 现象:倒插入氢氧化钠溶液中的试管内液面比倒插入水中
的试管内液面上升得高;
右图实验中反应的化学方程式:
实验 结论 碱的化学共性:碱非金属氧化物 盐 水
【分析解释】
实验中倒插入水中的试管内液面上升的高度远低于倒插入氢氧化钠
溶液中的试管内液面高度,说明与 溶液发生了反应。
还可设计如下实验说明二者发生了反应:取相同体积的两个软塑料
瓶,通入相同体积的二氧化碳,然后再加入相同体积的蒸馏水和氢
氧化钠溶液,振荡反应后,观察软塑料瓶的变化,加入氢氧化钠溶
液的软塑料瓶变瘪程度大于加入蒸馏水的软塑料瓶,说明二氧化碳
减少的多,从而证明与 溶液发生了反应。
【反思评价】
因为溶液与 反应没有沉淀等明显现象,因此实验室不用
溶液检验 ,而用澄清石灰水。
特别提醒
1.氢氧化钠、氢氧化钙等碱能与空气中的
氢氧化钙都应密封保存。
2.氢氧化钠与二氧化硫能发生反应:
有二氧化硫的废气。
3.氢氧化钠变质生成的碳酸钠溶液显碱性。
2.碱溶液与盐溶液的反应
回顾 第四单元4.2节[实验4-3],氢氧化钠溶液与硫酸铜溶液反
应:
实验 向碱溶液中加入合适的试剂,观察现象
备选试剂:氢氧化钠溶液、氢氧化钙溶液、氯化铁溶液、
硫酸铜溶液、碳酸钠溶液
编号 碱溶液 加入试剂 现象与化学方程式
实 验 记 录 ① 氢氧化 钠溶液 氯化铁溶 液 现象:产生红褐色沉淀;
化学方程式:
② 氢氧化 钙溶液 硫酸铜溶 液 现象:产生蓝色沉淀;
化学方程式:
配制农药波尔多液的原理
编号 碱溶液 加入试剂 现象与化学方程式
实验 记录 ③ 氢氧化钙溶液 碳酸钠溶 液 现象:产生白色沉淀;
化学方程式:
实验 结论 碱的化学共性:碱盐 新碱 新盐
都能溶于水
至少有一种沉淀
归纳总结
碱的化学性质
典例6 如图1所示,连接好装置和气压传感器。气
密性良好的烧瓶内充满 ,分别用注射器向烧瓶中迅速注入等量
的水、饱和石灰水和 的氢氧化钠溶液,关闭活塞,一段时间后
再振荡烧瓶,观察传感器所示的气压变化如图2所示。下列说法
错误的是( )
A.曲线2代表加入的是水
B.吸收用 溶液较合适
C. 段气压增大的原因之一是液体的添加使气体体积缩小
D.曲线1中 段气压“急速”减少的原因是振荡烧瓶使瓶内气体迅速
反应
√
[解析] 曲线2代表加入的是饱和石灰水,A错误。对比曲线3和曲线
2可知,等体积的溶液和饱和石灰水,溶液吸收 较
多,所以吸收用 溶液比用饱和石灰水效果好,B正确。
段呈现上升趋势可能是由于注射器中的液体迅速注入烧瓶,导
致气体的体积缩小,气压增大,而 段“急速”下降的原因可能为
振荡烧瓶后,会加速反应进行,使瓶内气压急速减小,C、D正确。
第八单元 常见的酸、碱、盐
8.2 常见的酸和碱
九下化学 KY
1.了解浓硫酸的吸水性、脱水性和强腐蚀性,学习浓硫酸稀释的实
验方法。
2.以盐酸、硫酸、氢氧化钠和氢氧化钙为例,通过实验探究认识酸、
碱的主要性质和用途。
3.知道可以通过物质类别认识具体物质的性质,了解通过物质的共
性认识一类物质性质的方法。
1.常见的酸的物理性质及主要用途
名称 盐酸 硫酸
溶质的化学式
颜色、状态 无色液体 无色油状液体
气味 有刺激性气味 无气味
挥发性 易挥发 不易挥发
主要用途 电镀、除锈、食品 加工、化工生产 车用电池、化肥制造、农药
生产、石油精炼
浓硫酸(溶质质量分数为 )的密度较大,为
需密封保存
知识链接
通常所说的“三酸”是指盐酸、硫酸、硝酸。其中硝酸是无色液体,
易挥发,具有强腐蚀性,是重要的化工原料。硝酸见光易分解,
需密封保存在棕色试剂瓶中。
2.浓硫酸的特性
(1)实验探究浓硫酸的脱水性
实验操作及图示 实验现象 实验结论
______________________________________________________________ __________________ 纸上出现明显的黑色字迹 浓硫酸能使纸张、蔗糖等物质脱水变成炭,有强脱水性
蔗糖变黑后 慢慢膨胀 浓硫酸能使纸张、蔗糖等物质脱水变成炭,有强脱水性
(2)强腐蚀性
浓硫酸是危险品,保管和使用都要格外小心,应密封保存在专用的
试剂柜中。如果皮肤不慎沾上浓硫酸,应立即用大量水冲洗,然后
涂上
(3)强吸水性
浓硫酸有强吸水性,可用作干燥剂,用来干燥不能与其反应的酸性
或中性气体,如
(如
气体通入方法为“长导管进气、
短导管出气”。
特别提醒
浓硫酸吸水性与脱水性的区别
浓硫酸的吸水性和脱水性不同,吸水性是指能吸收物质中所含的水
分,属于物理性质;脱水性是指能将组成原物质的氢元素和氧元素
按水的组成比脱去,使物质炭化(这种作用叫脱水作用),属于化
学性质。
教材深挖
敞口放置在空气中的浓盐酸和浓硫酸的比较
物质 浓盐酸 浓硫酸
性质 挥发性 吸水性
不同点 溶质质量 减少 不变
溶剂质量 不变 增大
溶液质量 减少 增大
相同点 溶质质量分数 减小
典例1 下列有关浓盐酸和浓硫酸的叙述正确的是( )
C
A.浓盐酸和浓硫酸都有挥发性
B.浓盐酸和浓硫酸都有吸水性
C.浓盐酸和浓硫酸敞口放置溶质质量分数都变小
D.浓盐酸和浓硫酸都能作干燥剂
[解析] 浓盐酸具有挥发性,浓硫酸不具有挥发性; 浓盐
酸不具有吸水性,浓硫酸具有吸水性; 浓盐酸具有挥发性,挥
发出溶质氯化氢气体,溶质的质量减小,溶质的质量分数减小,浓
硫酸具有吸水性,溶液中溶剂的质量增加,溶质质量不变,溶质的
质量分数也减小; 浓盐酸不具有吸水性,不能作干燥剂;浓
硫酸具有吸水性,可用作干燥剂。
3.浓硫酸的稀释
实验 操作 ______________________________________________________________________________ ____________________________________________
现象 烧杯壁发热 液滴四溅
解释 将密度大的浓硫酸缓慢地注入水中,并不停地搅拌,使产生的热得以迅速扩散 由于水的密度比浓硫酸小,当水滴入浓硫酸时会产生大量热使水立即沸腾,带着硫酸液滴向四周飞溅
特别提醒
若将稀硫酸沾到皮肤或衣服上,也应立即用大量水冲洗,因为若不
及时冲洗,时间长了,水分蒸发后,稀硫酸会变成浓硫酸,会有很
强的腐蚀性。
典例2 某实验小组同学准备制取氢气,实验室只有 的浓硫酸,小
强用的量筒量取了 浓硫酸,准备在量筒里加水稀释,小刚
见了马上制止了小强。指出上述已完成的和未完成的实验操作中:
(1)存在的错误有________________________________;_______
_____________;________________。
(2)可能造成的后果有_____________________________________
_____________________________(答出一点即可)。
使用的量筒量取浓硫酸
在量筒内稀释浓硫酸
往浓硫酸中加水
量取浓硫酸的体积误差大(或使量筒炸裂或液滴向四周飞溅,合理即可)
[解析] 量取浓硫酸应选择或 的量筒;量筒只能用
于量取液体,不能用于稀释溶液;稀释浓硫酸时,应将浓硫酸沿容
器壁缓慢注入水中,并用玻璃棒不断搅拌,否则可能导致液滴向四
周飞溅。
稀酸有许多相似的性质。例如,能使紫色石蕊溶液变红色,但不能
使无色酚酞溶液变色。这是稀酸的化学共性之一。
探究稀酸的其他化学共性
【目的】认识稀酸的化学性质。
【提出问题】稀酸具有哪些化学共性?
【形成假设】除指示剂外,稀酸还可能与金属、金属氧化物、盐等
物质发生反应,因为1.3节学习了氧化铜与稀硫酸的反应、6.2节学
习了较活泼金属能与稀酸发生置换反应、5.3节学习了碳酸钙与稀
盐酸的反应。
【实验验证】
1.稀酸与较活泼金属的反应
回顾 第六单元6.2节,较活泼金属能与稀酸发生置换反应:
结论 稀酸能够和较活泼金属反应,生成盐(由金属离子和酸根
离子构成的化合物)和氢气,可表示为:
酸+金属→ 盐+ 氢气
活动性在氢之前
硝酸的性质较特殊,它与金属发生反应时,一般不生成氢气,而是生成氮氧化物等,故无此共性
拓展培优
由铵根离子
2.稀酸与某些金属氧化物的反应
回 顾 第一单元1.3节[实验1-13],稀硫酸滴入装有氧化铜的试管
中,生成蓝色溶液:
实 验 选择合适的反应物进行实验,
观察现象。
备选试剂:稀盐酸、稀硫酸、
氧化铜、锈铁钉(铁锈的主要
成分为Fe2O3 )
编号 酸 金属氧化物 现象与化学方程式
实验 记录 ① 稀硫酸 氧化铜 现象:黑色固体消失,溶液变为
蓝色;
化学方程式:
② 稀硫酸 氧化铁 现象:铁锈消失,溶液变为黄
色;
化学方程式:
编号 酸 金属氧化物 现象与化学方程式
实验 记录 ③ 稀盐酸 氧化铁 现象:铁锈消失,溶液变为黄
色;
化学方程式:
实验 结论 稀酸的化学共性:酸金属氧化物 盐 水
特别提醒
铁与稀盐酸、稀硫酸、硫酸铜溶液发生置换反应,生成物中铁元素
的化合价均为
稀硫酸发生反应,生成物中铁元素的化合价均为
3.稀酸与盐的反应
回顾 第五单元5.3节,实验室用稀盐酸与石灰石制取二氧化碳:
_________________________________________________________________________________________________________________________________
实验 选择合适的反应物与稀酸溶液反应,
观察现象。
备选试剂:稀盐酸、稀硫酸、
碳酸钾溶液、碳酸钠溶液
编号 酸 加入试剂 现象与化学方程式
实验 记录 ① 稀盐 酸 碳酸钾溶 液 现象:有气泡产生;
化学方程式:
② 稀盐 酸 碳酸钠溶 液 现象:有气泡产生;
化学方程式:
编号 酸 加入试剂 现象与化学方程式
实验 记录 ③ 稀硫 酸 碳酸钾溶 液 现象:有气泡产生;
化学方程式:
④ 稀硫 酸 碳酸钠溶 液 现象:有气泡产生;
化学方程式:
实验 结论 稀酸的化学相似性:酸+盐→新酸+新盐
归纳总结
酸的化学性质
典例3 如图表示化学反应中溶液的颜色变化。下列叙述不正确的
是( )
C
A.若是稀盐酸, 可能是紫色石蕊溶液
B.若是稀盐酸, 可能是氧化铁
C.若是稀硫酸, 不可能是单质
D.若是稀硫酸, 不可能是单质
[解析] 若是稀盐酸, 可能是紫色石蕊溶液,因为稀盐酸显
酸性,能使紫色石蕊溶液变红;若是稀盐酸, 可能是氧化
铁,因为稀盐酸能和氧化铁反应生成黄色的氯化铁溶液;若
是稀硫酸,可能是单质,如 是单质铁时,铁能和稀硫酸反应生成
浅绿色的硫酸亚铁溶液,铁能与蓝色的 溶液反应生成浅绿色
的溶液;若是稀硫酸, 不可能是单质,因为稀硫酸和
反应生成蓝色溶液,蓝色溶液中含有铜离子,而稀硫酸不能和铜
反应。
1.两种重要的碱的物理性质及主要用途
名称 化学式 物理性质 主要用途
氢氧 化钙 白色粉末状固体,微 溶于水,溶解度随温 度的升高而减小 作建筑材料,制漂白粉,处理污水,改良酸性土壤,配制农药波尔多液
氢氧 化钠 白色固体,易潮解,易溶于水,且溶于水时放热 制肥皂、洗涤剂,用于
造纸、纺织工业、炼制
石油
此外,常见的碱还有氢氧化钾、氨水 等。
物理变化
2.氢氧化钙和氢氧化钠
(1)氢氧化钙
①氢氧化钙的俗名叫熟石灰或消石灰。用来检验
就是氢氧化钙的水溶液。熟石灰因其既实用又便宜,可以用来制作
建筑材料。
②氢氧化钙的制取
.高温煅烧石灰石得到生石灰:
;
.生石灰再与水反应转变成熟石灰,该反应放出大量的热,
甚至能将放在石灰中的生鸡蛋煮熟: 。
主要成分是
工业上制取 的原理
氧化钙能与水反应,因此氧化钙常用作干燥剂,广泛用于食品等行业
实验操作 实验现象 实验结论
.取少量固体氢氧化钠放在表面皿上,暴露在空气中一段时间 一段时间后氢氧化钠表面变潮湿 氢氧化钠易潮
解
.取少量固体氢氧化钠放在试管 中,加水振荡,观察它的水溶性,并用手触摸试管外壁,感觉温度变化情况 氢氧化钠逐渐 溶解,试管外 壁温度升高 氢氧化钠可溶
于水,且溶于
水的过程中放
出热量
(2)氢氧化钠
①氢氧化钠俗称苛性钠、火碱或烧碱。
②观察活动:氢氧化钠的潮解性和水溶性。
③氢氧化钠有强烈的腐蚀性,使用时要小心,实验时最好戴防护眼
镜。如果氢氧化钠不慎沾到皮肤上,应立即用大量水冲洗,然后再
涂上硼酸溶液。
特别提醒
氢氧化钠的潮解性
1.氢氧化钠具有潮解性(氢氧化钠暴露在空气中容易吸收水分,表
面变潮湿并逐渐溶解),称量时应放在烧杯内;敞口放置会使物质
的总质量增加,因此需要密封保存。
2.氢氧化钠可作干燥剂,但只能干燥中性和碱性气体,如氧气、氢
气、一氧化碳、氨气等,不能干燥酸性气体,如二氧化碳、二氧化
硫和氯化氢等。
典例4 下列有关氢氧化钙、氢氧化钠的说法错误的是( )
B
A.用托盘天平称量它们的质量时,要将它们放在烧杯内称量
B.都具有吸水性,可作气体干燥剂
C.氢氧化钠易溶于水,氢氧化钙微溶于水
D.工业上通常以生石灰和水为原料制取氢氧化钙
[解析] 氢氧化钠易吸水潮解,可作某些气体的干燥剂;氢氧化钙
没有吸水性,不能作气体干燥剂。
3.气体的干燥
(1)干燥剂的选择原则
干燥剂的选择应根据被干燥气体的性质和干燥剂的性质而定,其原
则是干燥剂只能吸收被干燥气体中的水分,而不能与被干燥气体发
生反应。
(2)常见气体干燥剂的选择
干燥剂 可干燥的气体 不可干燥的气 体 干燥装
置
酸性 浓硫酸 中性气体:、 、 、 等 碱性气体: 洗气瓶
酸性气体: 、 、 等
干燥剂 可干燥的气体 不可干燥的气体 干燥装
置
碱性 固体氢氧化钠、氧化钙 中性气体:、 、 、 等 酸性气体: 、 、 等 干燥管
碱性气体:
中性 无水氯化钙 除 以外的所有气体 干燥管
典例5 如图是气体 的干燥(干燥剂是碱石灰)、收集、尾气吸收
装置,该气体可能具有的物理性质是( )
D
A.能与干燥剂反应,密度比空气大,极易溶于水
B.不与干燥剂反应,密度比空气小,极易溶于水
C.密度比空气大,难溶于水
D.密度比空气小,极易溶于水
[解析]
碱也有许多相似的化学性质。例如,碱溶液能使紫色石蕊溶液变蓝
色,使无色酚酞溶液变红色。这是碱的化学共性之一。
特别提醒
碱可分为可溶性碱和不溶性碱,只有可溶性碱才能使指示剂变色,
例如,在氢氧化铜中滴入酚酞溶液,酚酞溶液不变色。
探究碱的其他化学共性
【目的】认识碱的化学性质。
【提出问题】碱具有哪些化学共性?
【形成假设】碱溶液能与某些非金属氧化物、盐溶液发生反应。因
为5.3节学习了用澄清石灰水检验二氧化碳,4.2节学习了氢氧化钠
溶液与硫酸铜溶液反应。
【实验验证】
1.碱溶液与某些非金属氧化物的反应
回顾 第五单元5.3节,实验室用澄清石灰水检验二氧化碳:
实验 两支充满二氧化碳的试管,一支倒插入水中,另一支倒插
入氢氧化钠溶液中,摆动试管
实验 记录 现象:倒插入氢氧化钠溶液中的试管内液面比倒插入水中
的试管内液面上升得高;
右图实验中反应的化学方程式:
实验 结论 碱的化学共性:碱非金属氧化物 盐 水
【分析解释】
实验中倒插入水中的试管内液面上升的高度远低于倒插入氢氧化钠
溶液中的试管内液面高度,说明与 溶液发生了反应。
还可设计如下实验说明二者发生了反应:取相同体积的两个软塑料
瓶,通入相同体积的二氧化碳,然后再加入相同体积的蒸馏水和氢
氧化钠溶液,振荡反应后,观察软塑料瓶的变化,加入氢氧化钠溶
液的软塑料瓶变瘪程度大于加入蒸馏水的软塑料瓶,说明二氧化碳
减少的多,从而证明与 溶液发生了反应。
【反思评价】
因为溶液与 反应没有沉淀等明显现象,因此实验室不用
溶液检验 ,而用澄清石灰水。
特别提醒
1.氢氧化钠、氢氧化钙等碱能与空气中的
氢氧化钙都应密封保存。
2.氢氧化钠与二氧化硫能发生反应:
有二氧化硫的废气。
3.氢氧化钠变质生成的碳酸钠溶液显碱性。
2.碱溶液与盐溶液的反应
回顾 第四单元4.2节[实验4-3],氢氧化钠溶液与硫酸铜溶液反
应:
实验 向碱溶液中加入合适的试剂,观察现象
备选试剂:氢氧化钠溶液、氢氧化钙溶液、氯化铁溶液、
硫酸铜溶液、碳酸钠溶液
编号 碱溶液 加入试剂 现象与化学方程式
实 验 记 录 ① 氢氧化 钠溶液 氯化铁溶 液 现象:产生红褐色沉淀;
化学方程式:
② 氢氧化 钙溶液 硫酸铜溶 液 现象:产生蓝色沉淀;
化学方程式:
配制农药波尔多液的原理
编号 碱溶液 加入试剂 现象与化学方程式
实验 记录 ③ 氢氧化钙溶液 碳酸钠溶 液 现象:产生白色沉淀;
化学方程式:
实验 结论 碱的化学共性:碱盐 新碱 新盐
都能溶于水
至少有一种沉淀
归纳总结
碱的化学性质
典例6 如图1所示,连接好装置和气压传感器。气
密性良好的烧瓶内充满 ,分别用注射器向烧瓶中迅速注入等量
的水、饱和石灰水和 的氢氧化钠溶液,关闭活塞,一段时间后
再振荡烧瓶,观察传感器所示的气压变化如图2所示。下列说法
错误的是( )
A.曲线2代表加入的是水
B.吸收用 溶液较合适
C. 段气压增大的原因之一是液体的添加使气体体积缩小
D.曲线1中 段气压“急速”减少的原因是振荡烧瓶使瓶内气体迅速
反应
√
[解析] 曲线2代表加入的是饱和石灰水,A错误。对比曲线3和曲线
2可知,等体积的溶液和饱和石灰水,溶液吸收 较
多,所以吸收用 溶液比用饱和石灰水效果好,B正确。
段呈现上升趋势可能是由于注射器中的液体迅速注入烧瓶,导
致气体的体积缩小,气压增大,而 段“急速”下降的原因可能为
振荡烧瓶后,会加速反应进行,使瓶内气压急速减小,C、D正确。
