8.3酸和碱反应 课件(共40张PPT)-九年级化学科粤版(2025)下册
文档属性
| 名称 | 8.3酸和碱反应 课件(共40张PPT)-九年级化学科粤版(2025)下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-31 00:00:00 | ||
图片预览











文档简介
(共40张PPT)
第八单元 常见的酸、碱、盐
8.3 酸和碱反应
九下化学 KY
1.认识酸、碱的组成,知道酸和碱在溶液中分别产生了氢离子和氢
氧根离子。
2.理解中和反应的原理和实质,联系前两节所学,系统归纳酸、碱
各自的主要化学性质。
3.明确复分解反应是两种化合物相互交换成分的反应。
4.了解中和反应在生产、生活中的应用。
1.探究溶液的导电性
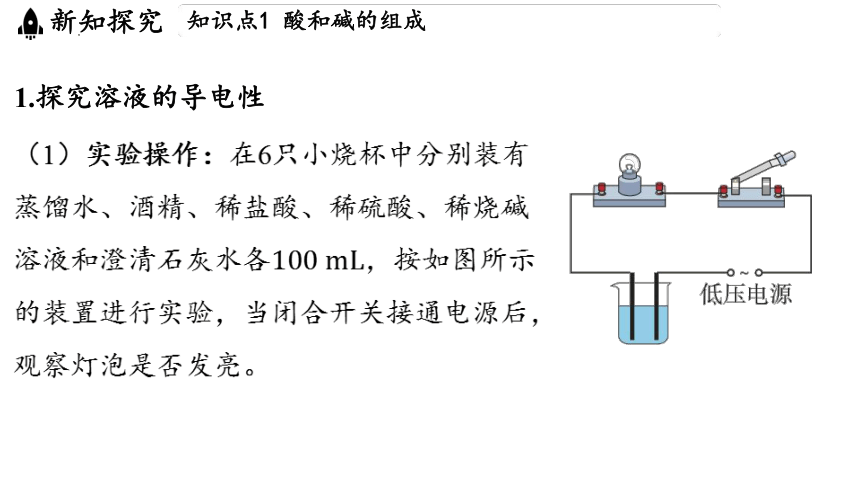
(1)实验操作:在6只小烧杯中分别装有
蒸馏水、酒精、稀盐酸、稀硫酸、稀烧碱
溶液和澄清石灰水各 ,按如图所示
的装置进行实验,当闭合开关接通电源后,
观察灯泡是否发亮。
(2)实验现象
试剂 蒸馏水 酒精 稀盐酸 稀硫酸 稀烧碱溶液 澄清石灰水
灯泡亮否 不亮 不亮 亮 亮 亮 亮
(3)实验结论
蒸馏水和酒精不导电,
稀盐酸、稀硫酸、稀烧碱溶液和澄清石灰水能够导电。
以分子形式存在
存在可自由移动的带电微观粒子——离子
(4)实验分析
蒸馏水、酒精不导电,是因为液体中没有带电微观粒子;酸溶液和
碱溶液能够导电,是因为溶液中存在可自由移动的带电微观粒子。
特别提醒
有带电微观粒子的物质不一定能导电,如氢氧化钠固体等不能导电,
有带电微观粒子且其能够自由移动的物质才能导电。
(1)如图1所示,酸溶于水后,能解离出可自由移动的 和酸根离
子,不同的酸溶液中都含有相同的 ,故酸具有一些相似的化学性质。
(2)如图2所示,碱溶于水后,能解离出可自由移动的金属离子和
,不同的碱溶液中都含有相同的 ,故碱具有一些相似的化
学性质。
2.酸和碱的组成
教材深挖
酸、碱、盐的比较
名称 酸 碱 盐
水溶液中 解离出的 离子 和酸根离 子 金属离子(或铵 根离子)和 金属离子(或铵根离
子)和酸根离子
在溶液中以离子的形式存在
名称 酸 碱 盐
特点 阳离子全部 是 阴离子全部是 除金属离子
(或铵根离子)和酸
根离子外,还可能含
有其他离子
举例 、 、 、 、
典例1 分类是化学学习和研究的重要方法之一,
下列分类正确的是( )
C
A.氧化物:、
B.碱:、 (酒精)
C.混合物:盐酸、生理盐水
D.酸:、
[解析] 是由钠、氮、氧三种元素组成的化合物,不属
于氧化物;是酒精的化学式,不属于碱; 盐酸、
生理盐水分别是氯化氢气体、氯化钠的水溶液,均属于混合物;
是由钾离子和碳酸氢根离子构成的化合物,属于盐。
1.实验探究——酸与碱反应
【目的】认识酸与碱的中和反应
【提出问题】在烧杯中加入约 稀氢氧化钠溶液,用滴管慢慢
滴入稀盐酸,观察不到明显现象,但是二者发生了化学反应。
思考:为了能观察到上述两种溶液混合后是否发生了化学反应,可
利用酸碱指示剂等进行观察。
实验 序号 实验设计 发生化学反应的证据 反应的化学方程式
(1) ________________________ 溶液由红色变为无色
【实验设计与实施】
实验用品:稀盐酸、稀硫酸、稀氢氧化钠溶液、澄清石灰水、紫色
石蕊溶液、无色酚酞溶液。
实验 序号 实验设计 发生化学反应 的证据 反应的化学方程式
(2) __________________________ 溶液由无色变 为红色
(3) _________________________ 溶液由红色变 为紫色,又变 为蓝色
实验 序号 实验设计 发生化学反应 的证据 反应的化学方程式
(4) ________________________ 溶液由蓝色变 为紫色,又变 为红色
【解释与结论】
指示剂颜色的变化说明酸溶液与碱溶液发生了化学反应。
典例2 下列各组物质的反应,需要加入酸碱指示剂
才能判断反应是否发生的是( )
C
A.和溶液 B. 和稀硫酸
C.溶液和稀盐酸 D.澄清石灰水和
[解析] 较活泼的铁能够把不如它活泼的铜从硫酸铜溶液中置换出
来,A中能观察到有红色物质析出及溶液颜色发生变化;较活泼的
锌能和稀硫酸反应产生氢气,因此B中能观察到有气泡产生;C中
溶液和稀盐酸反应过程中没有明显的现象,需要加入酸碱指
示剂才能判断反应是否发生;D中二氧化碳能使澄清石灰水变浑浊。
2.中和反应
不属于基本反应类型
2.并不是所有的中和反应都没有明显现象。如难溶性的碱与酸反应,
难溶性的碱会溶解;硫酸与氢氧化钡溶液反应可产生白色沉淀等。
中和反应举例 现象
红褐色固体溶解,生成黄色溶液
蓝色固体溶解,生成蓝色溶液
生成白色沉淀
拓展培优
中和反应的判断依据
1.中和反应是放热反应,这可以作为判断中和反应发生的依据之一。
典例3 下列反应属于中和反应的是( )
D
A.
B.
C.
D.
[解析]
信息技术与化学实验
利用手持技术数字化实验寻找酸碱中和反应发生的证据
对于没有明显现象的酸碱中和反应,还可以运用手持技术数字化实
验,通过
传感器定量测量反应过程中温度的变化,通过分析曲线寻找酸和碱
发生反应的证据。
向稀氢氧化钠溶液中逐滴加入稀盐酸过程中 和温度的变化
变化:点时, ,说明是向碱溶液中滴加酸溶
液;点时, ,酸不足、碱有剩余,溶质为
、;点时, ,酸、碱恰好完全反应,溶质
为;、点时,酸过量,溶质为、 。
温度变化:酸、碱恰好完全反应时,溶液的温度最高,说明中和反
应是放热反应。
典例4 如图是室温下稀硫酸和氢氧化钠溶液反应过程中的 变化
曲线。下列有关说法正确的是( )
C
A.图中 是氢氧化钠
B.图中点对应溶液中的溶质为
C.反应的化学方程式为
D.向图中 点所示溶液中加入铁粉后,有气泡产
生,溶液变为黄色
[解析]
酸和碱的主要化学性质
项目 酸的主要化学性质 碱的主要化学性质
与指示 剂作用 紫色石蕊 使紫色石蕊溶液变红 使紫色石蕊溶液变蓝
无色酚酞 无色酚酞溶液不变色 使无色酚酞溶液变红
酸碱相互反应 酸碱 盐 水
与氧化物反应 酸金属氧化物盐 水 碱非金属氧化物
盐 水
与盐反应 酸盐 新酸 新盐 碱盐 新碱 新盐
与较活泼金属反应 酸较活泼金属盐 氢气
典例5 下列关于 性质的描述中,不属于碱的共性的是( )
B
A.使紫色石蕊溶液变蓝 B.能和碳酸钠反应
C.能和稀硫酸反应 D.能与二氧化碳反应
[解析] 氢氧化钙能和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,而
氢氧化钠不能和碳酸钠反应,因此能和碳酸钠反应不属于碱的共性。
1.复分解反应
四大基本反应类型之一
特别提醒
1.中和反应一定是复分解反应,但复分解反应不一定是中和反应,
复分解反应包含中和反应。
2.两种化合物反应生成另外两种化合物的反应不一定是复分解反应,
如非金属氧化物
交换成分的条件。
2.四大基本反应类型的比较
基本反应 类型 概念 表达式 特点
化合反应 由两种或两种以上的物质生 成另一种物质的反应 多变一
分解反应 由一种物质生成两种或两种 以上其他物质的反应 一变多
基本反应 类型 概念 表达式 特点
置换反应 由一种单质与一种化合物生 成另一种单质与另一种化合 物的反应 一换一
复分解反 应 由两种化合物互相交换成 分,生成另外两种化合物的 反应 互交换,
价不变
典例6 分析、推理是化学的科学思维之一,但要
具体问题具体分析,下列分析推理不正确的是( )
C
A.碱溶液显碱性,酸溶液显酸性,但盐溶液不一定显中性
B.中和反应生成盐和水,生成盐和水的反应不一定是中和反应
C.复分解反应的反应物是两种化合物,有两种化合物参与的反应一
定是复分解反应
D.复分解反应的特征是“互交换,价不变”,所以复分解反应一定没
有化合价的变化
[解析] 复分解反应的反应物是两种化合物,但有两种化合物参与
的反应不一定是复分解反应,如 不
是复分解反应,因为其不符合互相交换成分的条件,C不正确。
领域 目的 具体应用及反应原理
农业 改良酸性或碱 性土壤 若土壤显酸性,可向土壤中加入适量的熟
石灰,中和土壤的酸性
工业 处理工厂显酸 性或碱性的废 水,避免造成 水体污染 用熟石灰中和硫酸厂的污水
(含硫酸等),反应的化学方程式为
领域 目的 具体应用及反应原理
医药 调节 体液 的酸 碱性 (1)人被一些蚊虫叮咬后(蚊虫能分泌出蚁
酸),可在叮咬处涂抹弱碱性的肥皂水、稀氨水或
清凉油,以减轻疼痛;
(2)有胃病的人常常胃酸(主要成分是盐酸)过
多,可以口服碱性胃药(某些胃药的有效成分是氢
氧化铝),以中和胃中过多的胃酸,反应的化学方
程式为
特别提醒
使用。
拓展培优
酸雨的形成及危害
1.酸雨的形成:部分非金属氧化物能跟水化合生成酸。例如,
产生的烟气中含有二氧化硫和氮氧化物,排放到空气中经过化学作
用形成酸雾,然后随雨水降下,使雨水的酸性增强,当雨水的
拓展培优
酸雨的形成及危害
2.酸雨的危害:酸雨的危害性很大,如影响人类健康,使森林大面
积枯死,使湖水酸化、鱼类死亡,使农作物生长受到影响而减产,
使名胜古迹、建筑物腐蚀损坏等。
典例7 中和反应在生产、生活中应用广泛。下列应用的主要原理
不涉及中和反应的是( )
A
A.生石灰用于加热即热食品
B.氢氧化镁用于治疗胃酸过多
C.熟石灰用于处理硫酸厂排出的废水
D.硼酸用于处理皮肤上沾有的碱
[解析] A项涉及的化学反应是生石灰与水反应生成氢氧化钙,该反
应的反应物是金属氧化物和水,不属于中和反应;B、C、D项中涉
及的反应都是酸和碱反应生成盐和水,都属于中和反应。
第八单元 常见的酸、碱、盐
8.3 酸和碱反应
九下化学 KY
1.认识酸、碱的组成,知道酸和碱在溶液中分别产生了氢离子和氢
氧根离子。
2.理解中和反应的原理和实质,联系前两节所学,系统归纳酸、碱
各自的主要化学性质。
3.明确复分解反应是两种化合物相互交换成分的反应。
4.了解中和反应在生产、生活中的应用。
1.探究溶液的导电性
(1)实验操作:在6只小烧杯中分别装有
蒸馏水、酒精、稀盐酸、稀硫酸、稀烧碱
溶液和澄清石灰水各 ,按如图所示
的装置进行实验,当闭合开关接通电源后,
观察灯泡是否发亮。
(2)实验现象
试剂 蒸馏水 酒精 稀盐酸 稀硫酸 稀烧碱溶液 澄清石灰水
灯泡亮否 不亮 不亮 亮 亮 亮 亮
(3)实验结论
蒸馏水和酒精不导电,
稀盐酸、稀硫酸、稀烧碱溶液和澄清石灰水能够导电。
以分子形式存在
存在可自由移动的带电微观粒子——离子
(4)实验分析
蒸馏水、酒精不导电,是因为液体中没有带电微观粒子;酸溶液和
碱溶液能够导电,是因为溶液中存在可自由移动的带电微观粒子。
特别提醒
有带电微观粒子的物质不一定能导电,如氢氧化钠固体等不能导电,
有带电微观粒子且其能够自由移动的物质才能导电。
(1)如图1所示,酸溶于水后,能解离出可自由移动的 和酸根离
子,不同的酸溶液中都含有相同的 ,故酸具有一些相似的化学性质。
(2)如图2所示,碱溶于水后,能解离出可自由移动的金属离子和
,不同的碱溶液中都含有相同的 ,故碱具有一些相似的化
学性质。
2.酸和碱的组成
教材深挖
酸、碱、盐的比较
名称 酸 碱 盐
水溶液中 解离出的 离子 和酸根离 子 金属离子(或铵 根离子)和 金属离子(或铵根离
子)和酸根离子
在溶液中以离子的形式存在
名称 酸 碱 盐
特点 阳离子全部 是 阴离子全部是 除金属离子
(或铵根离子)和酸
根离子外,还可能含
有其他离子
举例 、 、 、 、
典例1 分类是化学学习和研究的重要方法之一,
下列分类正确的是( )
C
A.氧化物:、
B.碱:、 (酒精)
C.混合物:盐酸、生理盐水
D.酸:、
[解析] 是由钠、氮、氧三种元素组成的化合物,不属
于氧化物;是酒精的化学式,不属于碱; 盐酸、
生理盐水分别是氯化氢气体、氯化钠的水溶液,均属于混合物;
是由钾离子和碳酸氢根离子构成的化合物,属于盐。
1.实验探究——酸与碱反应
【目的】认识酸与碱的中和反应
【提出问题】在烧杯中加入约 稀氢氧化钠溶液,用滴管慢慢
滴入稀盐酸,观察不到明显现象,但是二者发生了化学反应。
思考:为了能观察到上述两种溶液混合后是否发生了化学反应,可
利用酸碱指示剂等进行观察。
实验 序号 实验设计 发生化学反应的证据 反应的化学方程式
(1) ________________________ 溶液由红色变为无色
【实验设计与实施】
实验用品:稀盐酸、稀硫酸、稀氢氧化钠溶液、澄清石灰水、紫色
石蕊溶液、无色酚酞溶液。
实验 序号 实验设计 发生化学反应 的证据 反应的化学方程式
(2) __________________________ 溶液由无色变 为红色
(3) _________________________ 溶液由红色变 为紫色,又变 为蓝色
实验 序号 实验设计 发生化学反应 的证据 反应的化学方程式
(4) ________________________ 溶液由蓝色变 为紫色,又变 为红色
【解释与结论】
指示剂颜色的变化说明酸溶液与碱溶液发生了化学反应。
典例2 下列各组物质的反应,需要加入酸碱指示剂
才能判断反应是否发生的是( )
C
A.和溶液 B. 和稀硫酸
C.溶液和稀盐酸 D.澄清石灰水和
[解析] 较活泼的铁能够把不如它活泼的铜从硫酸铜溶液中置换出
来,A中能观察到有红色物质析出及溶液颜色发生变化;较活泼的
锌能和稀硫酸反应产生氢气,因此B中能观察到有气泡产生;C中
溶液和稀盐酸反应过程中没有明显的现象,需要加入酸碱指
示剂才能判断反应是否发生;D中二氧化碳能使澄清石灰水变浑浊。
2.中和反应
不属于基本反应类型
2.并不是所有的中和反应都没有明显现象。如难溶性的碱与酸反应,
难溶性的碱会溶解;硫酸与氢氧化钡溶液反应可产生白色沉淀等。
中和反应举例 现象
红褐色固体溶解,生成黄色溶液
蓝色固体溶解,生成蓝色溶液
生成白色沉淀
拓展培优
中和反应的判断依据
1.中和反应是放热反应,这可以作为判断中和反应发生的依据之一。
典例3 下列反应属于中和反应的是( )
D
A.
B.
C.
D.
[解析]
信息技术与化学实验
利用手持技术数字化实验寻找酸碱中和反应发生的证据
对于没有明显现象的酸碱中和反应,还可以运用手持技术数字化实
验,通过
传感器定量测量反应过程中温度的变化,通过分析曲线寻找酸和碱
发生反应的证据。
向稀氢氧化钠溶液中逐滴加入稀盐酸过程中 和温度的变化
变化:点时, ,说明是向碱溶液中滴加酸溶
液;点时, ,酸不足、碱有剩余,溶质为
、;点时, ,酸、碱恰好完全反应,溶质
为;、点时,酸过量,溶质为、 。
温度变化:酸、碱恰好完全反应时,溶液的温度最高,说明中和反
应是放热反应。
典例4 如图是室温下稀硫酸和氢氧化钠溶液反应过程中的 变化
曲线。下列有关说法正确的是( )
C
A.图中 是氢氧化钠
B.图中点对应溶液中的溶质为
C.反应的化学方程式为
D.向图中 点所示溶液中加入铁粉后,有气泡产
生,溶液变为黄色
[解析]
酸和碱的主要化学性质
项目 酸的主要化学性质 碱的主要化学性质
与指示 剂作用 紫色石蕊 使紫色石蕊溶液变红 使紫色石蕊溶液变蓝
无色酚酞 无色酚酞溶液不变色 使无色酚酞溶液变红
酸碱相互反应 酸碱 盐 水
与氧化物反应 酸金属氧化物盐 水 碱非金属氧化物
盐 水
与盐反应 酸盐 新酸 新盐 碱盐 新碱 新盐
与较活泼金属反应 酸较活泼金属盐 氢气
典例5 下列关于 性质的描述中,不属于碱的共性的是( )
B
A.使紫色石蕊溶液变蓝 B.能和碳酸钠反应
C.能和稀硫酸反应 D.能与二氧化碳反应
[解析] 氢氧化钙能和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,而
氢氧化钠不能和碳酸钠反应,因此能和碳酸钠反应不属于碱的共性。
1.复分解反应
四大基本反应类型之一
特别提醒
1.中和反应一定是复分解反应,但复分解反应不一定是中和反应,
复分解反应包含中和反应。
2.两种化合物反应生成另外两种化合物的反应不一定是复分解反应,
如非金属氧化物
交换成分的条件。
2.四大基本反应类型的比较
基本反应 类型 概念 表达式 特点
化合反应 由两种或两种以上的物质生 成另一种物质的反应 多变一
分解反应 由一种物质生成两种或两种 以上其他物质的反应 一变多
基本反应 类型 概念 表达式 特点
置换反应 由一种单质与一种化合物生 成另一种单质与另一种化合 物的反应 一换一
复分解反 应 由两种化合物互相交换成 分,生成另外两种化合物的 反应 互交换,
价不变
典例6 分析、推理是化学的科学思维之一,但要
具体问题具体分析,下列分析推理不正确的是( )
C
A.碱溶液显碱性,酸溶液显酸性,但盐溶液不一定显中性
B.中和反应生成盐和水,生成盐和水的反应不一定是中和反应
C.复分解反应的反应物是两种化合物,有两种化合物参与的反应一
定是复分解反应
D.复分解反应的特征是“互交换,价不变”,所以复分解反应一定没
有化合价的变化
[解析] 复分解反应的反应物是两种化合物,但有两种化合物参与
的反应不一定是复分解反应,如 不
是复分解反应,因为其不符合互相交换成分的条件,C不正确。
领域 目的 具体应用及反应原理
农业 改良酸性或碱 性土壤 若土壤显酸性,可向土壤中加入适量的熟
石灰,中和土壤的酸性
工业 处理工厂显酸 性或碱性的废 水,避免造成 水体污染 用熟石灰中和硫酸厂的污水
(含硫酸等),反应的化学方程式为
领域 目的 具体应用及反应原理
医药 调节 体液 的酸 碱性 (1)人被一些蚊虫叮咬后(蚊虫能分泌出蚁
酸),可在叮咬处涂抹弱碱性的肥皂水、稀氨水或
清凉油,以减轻疼痛;
(2)有胃病的人常常胃酸(主要成分是盐酸)过
多,可以口服碱性胃药(某些胃药的有效成分是氢
氧化铝),以中和胃中过多的胃酸,反应的化学方
程式为
特别提醒
使用。
拓展培优
酸雨的形成及危害
1.酸雨的形成:部分非金属氧化物能跟水化合生成酸。例如,
产生的烟气中含有二氧化硫和氮氧化物,排放到空气中经过化学作
用形成酸雾,然后随雨水降下,使雨水的酸性增强,当雨水的
拓展培优
酸雨的形成及危害
2.酸雨的危害:酸雨的危害性很大,如影响人类健康,使森林大面
积枯死,使湖水酸化、鱼类死亡,使农作物生长受到影响而减产,
使名胜古迹、建筑物腐蚀损坏等。
典例7 中和反应在生产、生活中应用广泛。下列应用的主要原理
不涉及中和反应的是( )
A
A.生石灰用于加热即热食品
B.氢氧化镁用于治疗胃酸过多
C.熟石灰用于处理硫酸厂排出的废水
D.硼酸用于处理皮肤上沾有的碱
[解析] A项涉及的化学反应是生石灰与水反应生成氢氧化钙,该反
应的反应物是金属氧化物和水,不属于中和反应;B、C、D项中涉
及的反应都是酸和碱反应生成盐和水,都属于中和反应。
