1.1.2分散系及其分类 课件(共14张ppt)高中化学 人教版 必修一
文档属性
| 名称 | 1.1.2分散系及其分类 课件(共14张ppt)高中化学 人教版 必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 12.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-29 09:44:18 | ||
图片预览





文档简介
(共14张PPT)
第三节 物质的分散系
第一章 物质的分类及计量
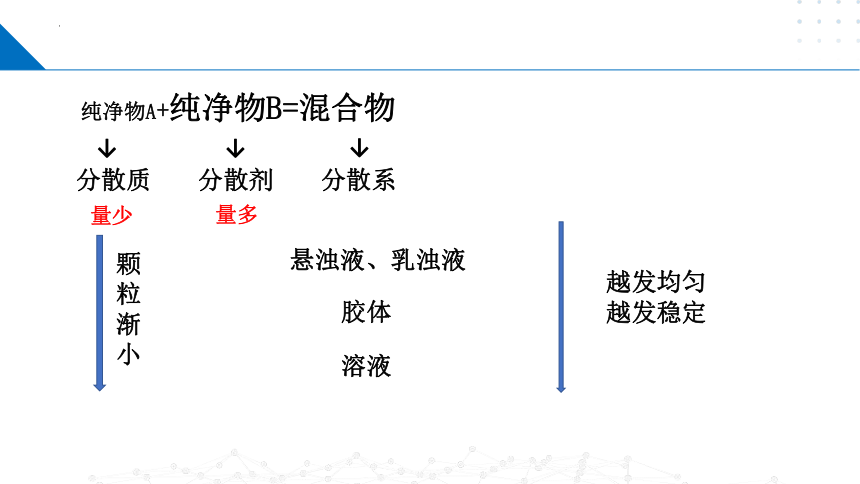
纯净物A+纯净物B=混合物
分散质
分散剂
分散系
→
→
→
量少
量多
溶液
悬浊液、乳浊液
胶体
颗粒渐小
越发均匀
越发稳定
根据分散剂的不同,可分为液溶胶、气溶胶和固溶胶
液溶胶:Fe(OH)3(胶体)
气溶胶:云、雾
固溶胶:有色玻璃
Fe(OH)3(胶体)的制备
实验1 向100ml小烧杯中加入40ml蒸馏水,逐滴加入5-6滴FeCl3饱和溶液,观察现象
实验2 向100ml小烧杯中加入40ml蒸馏水,加热至沸腾,向沸水中逐滴加入5-6滴FeCl3饱和溶液,观察现象
实验3 向100ml小烧杯中加入1ml稀NaOH溶液,加蒸馏水稀释至约40ml,逐滴加入5-6滴FeCl3饱和溶液,观察现象
不反应,FeCl3溶液只是被稀释,溶液呈淡黄色
观察到到红褐色透明的液体
观察到到红褐色沉淀
Fe(OH)3(胶体)
Fe(OH)3(溶液)
Fe(OH)3(沉淀)
相同的分子
相同的化学性质
不同的聚集程度
不同的物理性质
如何制备Fe(OH)3胶体?
一、物质的分散系
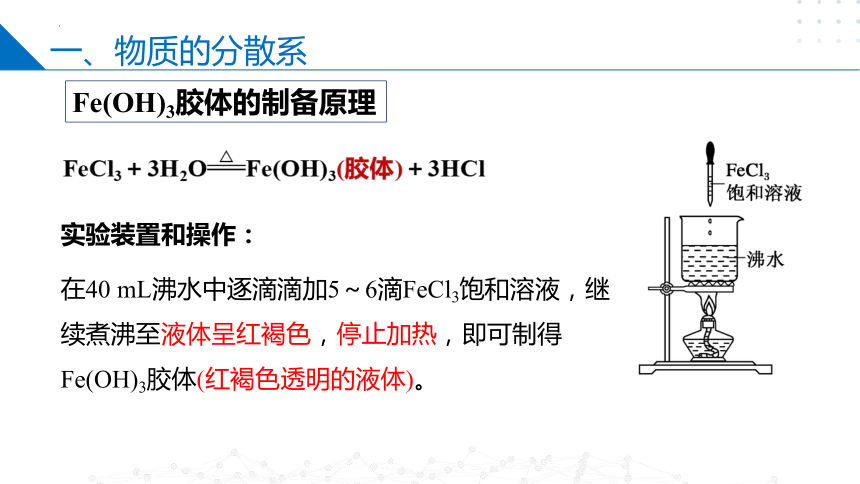
实验装置和操作:
在40 mL沸水中逐滴滴加5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热,即可制得Fe(OH)3胶体(红褐色透明的液体)。
一、物质的分散系
Fe(OH)3胶体的制备原理
FeCl3+3H2OFe(OH)3(胶体)+3HCl
制备胶体实验需要注意:
1、不能用自来水代替蒸馏水,自来水中的离子会使胶体聚沉
2、当溶液呈红褐色时停止加热,否则加热过度会使胶体聚沉
3、边加热边振荡烧杯,但不能用玻璃棒搅拌,否则胶体会沉淀
Fe(OH)3(胶体)能透过滤纸吗?
Fe(OH)3(沉淀)能透过滤纸吗?
更小的“滤纸”孔径?
→
半透膜
过滤
渗析
→
→
分离胶体和溶液
分离浊液中的微粒
如何鉴别胶体和溶液?
一、物质的分散系
当光束通过胶体时,在垂直于光线的方向可以看到一条光亮的通路,该现象称为丁达尔效应
一、物质的分散系
浊液分散系
粒子直径>100nm
胶体分散系
1nm<粒子直径<100nm
溶液分散系
粒子直径<1nm
一、物质的分散系
靠近光源处散射,远端光路变弱或消失
一条光亮的“通路”
谢谢观看
THANKS
第三节 物质的分散系
第一章 物质的分类及计量
纯净物A+纯净物B=混合物
分散质
分散剂
分散系
→
→
→
量少
量多
溶液
悬浊液、乳浊液
胶体
颗粒渐小
越发均匀
越发稳定
根据分散剂的不同,可分为液溶胶、气溶胶和固溶胶
液溶胶:Fe(OH)3(胶体)
气溶胶:云、雾
固溶胶:有色玻璃
Fe(OH)3(胶体)的制备
实验1 向100ml小烧杯中加入40ml蒸馏水,逐滴加入5-6滴FeCl3饱和溶液,观察现象
实验2 向100ml小烧杯中加入40ml蒸馏水,加热至沸腾,向沸水中逐滴加入5-6滴FeCl3饱和溶液,观察现象
实验3 向100ml小烧杯中加入1ml稀NaOH溶液,加蒸馏水稀释至约40ml,逐滴加入5-6滴FeCl3饱和溶液,观察现象
不反应,FeCl3溶液只是被稀释,溶液呈淡黄色
观察到到红褐色透明的液体
观察到到红褐色沉淀
Fe(OH)3(胶体)
Fe(OH)3(溶液)
Fe(OH)3(沉淀)
相同的分子
相同的化学性质
不同的聚集程度
不同的物理性质
如何制备Fe(OH)3胶体?
一、物质的分散系
实验装置和操作:
在40 mL沸水中逐滴滴加5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热,即可制得Fe(OH)3胶体(红褐色透明的液体)。
一、物质的分散系
Fe(OH)3胶体的制备原理
FeCl3+3H2OFe(OH)3(胶体)+3HCl
制备胶体实验需要注意:
1、不能用自来水代替蒸馏水,自来水中的离子会使胶体聚沉
2、当溶液呈红褐色时停止加热,否则加热过度会使胶体聚沉
3、边加热边振荡烧杯,但不能用玻璃棒搅拌,否则胶体会沉淀
Fe(OH)3(胶体)能透过滤纸吗?
Fe(OH)3(沉淀)能透过滤纸吗?
更小的“滤纸”孔径?
→
半透膜
过滤
渗析
→
→
分离胶体和溶液
分离浊液中的微粒
如何鉴别胶体和溶液?
一、物质的分散系
当光束通过胶体时,在垂直于光线的方向可以看到一条光亮的通路,该现象称为丁达尔效应
一、物质的分散系
浊液分散系
粒子直径>100nm
胶体分散系
1nm<粒子直径<100nm
溶液分散系
粒子直径<1nm
一、物质的分散系
靠近光源处散射,远端光路变弱或消失
一条光亮的“通路”
谢谢观看
THANKS
