1.3.1氧化还原反应 课件 (共20张ppt)高中化学 人教版 必修一
文档属性
| 名称 | 1.3.1氧化还原反应 课件 (共20张ppt)高中化学 人教版 必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 10.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-29 10:43:42 | ||
图片预览






文档简介
(共20张PPT)
第1课时
氧化还原反应
第一章
Fe2O3+3CO==2Fe+3CO2属于什么反应类型?
1、Fe2O3+3CO==2Fe+3CO2不属于四种基本类型中的任意一种。
2、Fe2O3→Fe:
失去“O”,属于还原反应
CO→CO2:
获得“O”,属于氧化反应
Fe2O3+3CO==2Fe+3CO2属于氧化还原反应。
3、氧化反应和还原反应是同时进行的——称为氧化还原反应。
问题1
问题2
反应:Fe2O3+3CO==2Fe+3CO2
Fe+CuSO4==FeSO4+Cu
有何关系?
Fe元素的化合价降低,C元素的化合升高
+3
0
+2
+4
0
+2
+2
0
Fe元素的化合价升高,Cu元素的化合降低
1、都有元素化合价的变化。
2、都是氧化反应还原反应。
凡是有元素化合价变化的化学反应称为氧化还原反应。
定义:
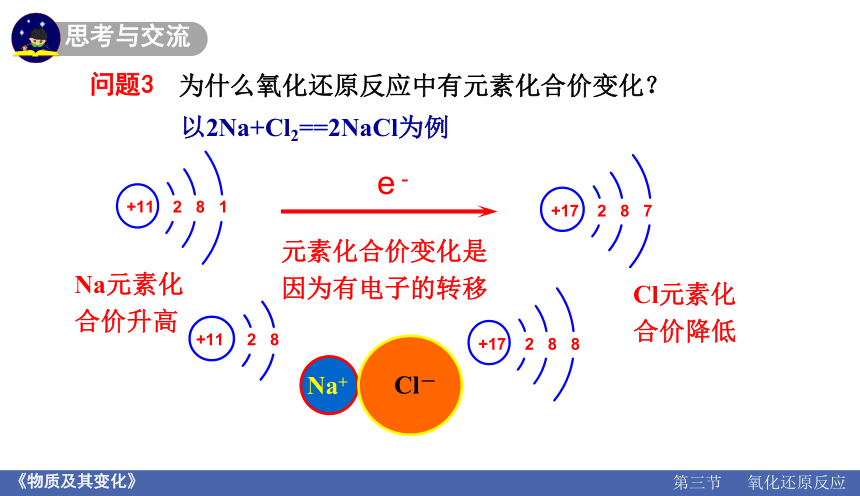
问题3
为什么氧化还原反应中有元素化合价变化?
以2Na+Cl2==2NaCl为例
+11 2 8 1
+17 2 8 7
e -
+11 2 8
+17 2 8 8
Na+
Cl-
Na元素化
合价升高
Cl元素化
合价降低
元素化合价变化是因为有电子的转移
课本P25页科学史话
指出下列反应中的氧化还原反应:
2Na+Cl2==2NaCl
Cu+Cl2==CuCl2
2KClO3==2KCl+3O2↑
CaO+H2O==Ca(OH)2
CaCO3==CaO+CO2
NaOH+HCl==NaCl+H2O
2Al+3Hg2+==2Al3++3Hg
氧化还原反应
氧化还原反应
氧化还原反应
非氧化还原反应
非氧化还原反应
非氧化还原反应
氧化还原反应
2Na + Cl2 === 2NaCl
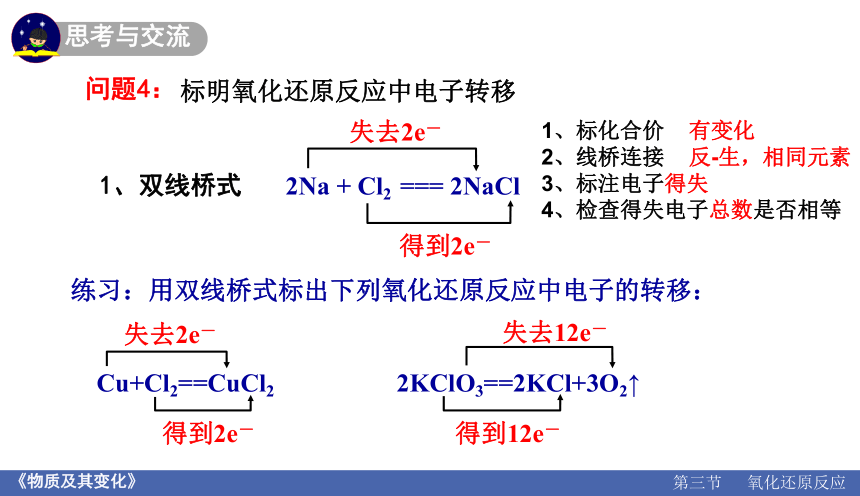
问题4:
标明氧化还原反应中电子转移
失去2e-
得到2e-
1、双线桥式
练习:用双线桥式标出下列氧化还原反应中电子的转移:
Cu+Cl2==CuCl2 2KClO3==2KCl+3O2↑
失去2e-
得到2e-
失去12e-
得到12e-
1、标化合价 有变化
2、线桥连接 反-生,相同元素
3、标注电子得失
4、检查得失电子总数是否相等
2Na + Cl2 === 2NaCl
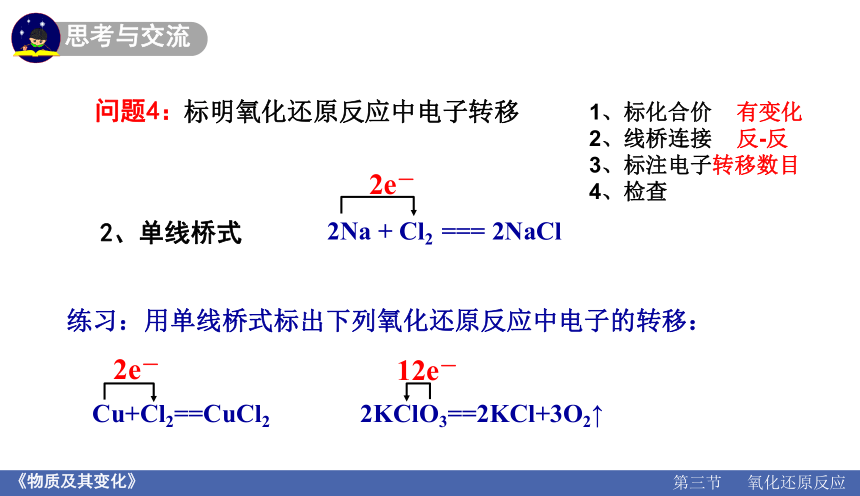
问题4:
标明氧化还原反应中电子转移
2e-
2、单线桥式
练习:用单线桥式标出下列氧化还原反应中电子的转移:
Cu+Cl2==CuCl2 2KClO3==2KCl+3O2↑
2e-
12e-
1、标化合价 有变化
2、线桥连接 反-反
3、标注电子转移数目
4、检查
1、氧化还原反应的判断依据:
化学反应中是否有元素化合价的变化。
2、氧化还原反应的实质:
电子的转移或共用电子对的偏移
3、化合价升高——
化合价降低——
4、氧化反应和还原反应同时进行,且化合价升高总数与化合价降低总数相等,即电子得与失的总数相等。
失去电子/电子对偏离
得到电子/电子对偏向
在Fe2O3+3CO==2Fe+3CO2中
1、Fe2O3→Fe:
失去“O”,属于还原反应
2、CO→CO2:
获得“O”,属于氧化反应
Fe元素的化合价降低
——发生还原反应
化合价降低→得电子→还原反应(被还原)
C元素的化合价升高
——发生氧化反应
化合价升高→失电子→氧化反应(被氧化)
一、基本概念:氧化还原反应中
1、失去电子的物质称为还原剂。
还原剂→失电子→氧化反应(被氧化)
2、得到电子的物质称为氧化剂。
氧化剂→得电子→还原反应(被还原)
3、发生还原反应所生成的物质称为还原产物。
氧化剂→还原产物
4、发生氧化反应所生成的物质称为氧化产物。
还原剂→氧化产物
还原剂+氧化剂===氧化产物+还原产物
化合价升高、失电子、被氧化
化合价降低、得电子、被还原
1、还原剂、氧化剂、氧化产物、还原产物均为一种物质。
2、被氧化是还原剂中的某元素被氧化,被还原是氧化剂中的某元素被还原。
升、失、氧、还(剂)
降、得、还、氧(剂)
二、氧化还原反应与四种基本反应类型关系
1、置换反应中有单质参加和生成
元素的化合价一定变化
2、复分解反应是两种化合物交换成分
元素的化合价一定不变化
3、有些分解反应和化合反应
元素的化合价可能变化
置换反应都是氧化还原反应
复分解反应都不是氧化还原反应
分解反应和化合反应可能是氧化还原反应
氧化还原
反应
置换反应
化合反应
分解反应
复分解反应
第1课时
氧化还原反应
第一章
Fe2O3+3CO==2Fe+3CO2属于什么反应类型?
1、Fe2O3+3CO==2Fe+3CO2不属于四种基本类型中的任意一种。
2、Fe2O3→Fe:
失去“O”,属于还原反应
CO→CO2:
获得“O”,属于氧化反应
Fe2O3+3CO==2Fe+3CO2属于氧化还原反应。
3、氧化反应和还原反应是同时进行的——称为氧化还原反应。
问题1
问题2
反应:Fe2O3+3CO==2Fe+3CO2
Fe+CuSO4==FeSO4+Cu
有何关系?
Fe元素的化合价降低,C元素的化合升高
+3
0
+2
+4
0
+2
+2
0
Fe元素的化合价升高,Cu元素的化合降低
1、都有元素化合价的变化。
2、都是氧化反应还原反应。
凡是有元素化合价变化的化学反应称为氧化还原反应。
定义:
问题3
为什么氧化还原反应中有元素化合价变化?
以2Na+Cl2==2NaCl为例
+11 2 8 1
+17 2 8 7
e -
+11 2 8
+17 2 8 8
Na+
Cl-
Na元素化
合价升高
Cl元素化
合价降低
元素化合价变化是因为有电子的转移
课本P25页科学史话
指出下列反应中的氧化还原反应:
2Na+Cl2==2NaCl
Cu+Cl2==CuCl2
2KClO3==2KCl+3O2↑
CaO+H2O==Ca(OH)2
CaCO3==CaO+CO2
NaOH+HCl==NaCl+H2O
2Al+3Hg2+==2Al3++3Hg
氧化还原反应
氧化还原反应
氧化还原反应
非氧化还原反应
非氧化还原反应
非氧化还原反应
氧化还原反应
2Na + Cl2 === 2NaCl
问题4:
标明氧化还原反应中电子转移
失去2e-
得到2e-
1、双线桥式
练习:用双线桥式标出下列氧化还原反应中电子的转移:
Cu+Cl2==CuCl2 2KClO3==2KCl+3O2↑
失去2e-
得到2e-
失去12e-
得到12e-
1、标化合价 有变化
2、线桥连接 反-生,相同元素
3、标注电子得失
4、检查得失电子总数是否相等
2Na + Cl2 === 2NaCl
问题4:
标明氧化还原反应中电子转移
2e-
2、单线桥式
练习:用单线桥式标出下列氧化还原反应中电子的转移:
Cu+Cl2==CuCl2 2KClO3==2KCl+3O2↑
2e-
12e-
1、标化合价 有变化
2、线桥连接 反-反
3、标注电子转移数目
4、检查
1、氧化还原反应的判断依据:
化学反应中是否有元素化合价的变化。
2、氧化还原反应的实质:
电子的转移或共用电子对的偏移
3、化合价升高——
化合价降低——
4、氧化反应和还原反应同时进行,且化合价升高总数与化合价降低总数相等,即电子得与失的总数相等。
失去电子/电子对偏离
得到电子/电子对偏向
在Fe2O3+3CO==2Fe+3CO2中
1、Fe2O3→Fe:
失去“O”,属于还原反应
2、CO→CO2:
获得“O”,属于氧化反应
Fe元素的化合价降低
——发生还原反应
化合价降低→得电子→还原反应(被还原)
C元素的化合价升高
——发生氧化反应
化合价升高→失电子→氧化反应(被氧化)
一、基本概念:氧化还原反应中
1、失去电子的物质称为还原剂。
还原剂→失电子→氧化反应(被氧化)
2、得到电子的物质称为氧化剂。
氧化剂→得电子→还原反应(被还原)
3、发生还原反应所生成的物质称为还原产物。
氧化剂→还原产物
4、发生氧化反应所生成的物质称为氧化产物。
还原剂→氧化产物
还原剂+氧化剂===氧化产物+还原产物
化合价升高、失电子、被氧化
化合价降低、得电子、被还原
1、还原剂、氧化剂、氧化产物、还原产物均为一种物质。
2、被氧化是还原剂中的某元素被氧化,被还原是氧化剂中的某元素被还原。
升、失、氧、还(剂)
降、得、还、氧(剂)
二、氧化还原反应与四种基本反应类型关系
1、置换反应中有单质参加和生成
元素的化合价一定变化
2、复分解反应是两种化合物交换成分
元素的化合价一定不变化
3、有些分解反应和化合反应
元素的化合价可能变化
置换反应都是氧化还原反应
复分解反应都不是氧化还原反应
分解反应和化合反应可能是氧化还原反应
氧化还原
反应
置换反应
化合反应
分解反应
复分解反应
