1.3电能转化为化学能---电解 第二课时 课件 (共22张PPT) 高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.3电能转化为化学能---电解 第二课时 课件 (共22张PPT) 高二上学期化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 86.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-30 18:33:30 | ||
图片预览







文档简介
(共22张PPT)
(第二课时)
学科:化学
电能转化为化学能—电解
年级:高二
教材版本:鲁科版
CuSO4
学习目标
深入理解电解池的工作原理,包括电极反应、电池反应,电子和离子的移动方向等。
1
掌握粗铜的电解精炼过程,能准确画出装置图,构建精炼池的思维模型。
2
明确电镀的原理、作用和优点,掌握设计简单电镀池的方法。
3
了解电解池在物质转化和能量储存方面的应用。感受化学知识的应用价值。
4
黄金:美丽的色泽
黄金在自然界中并不是以纯净物的形式存在,而是与其他杂质混合在一起。
那么,怎么样才能得到纯净的黄金呢?
【情境导入】
矿石
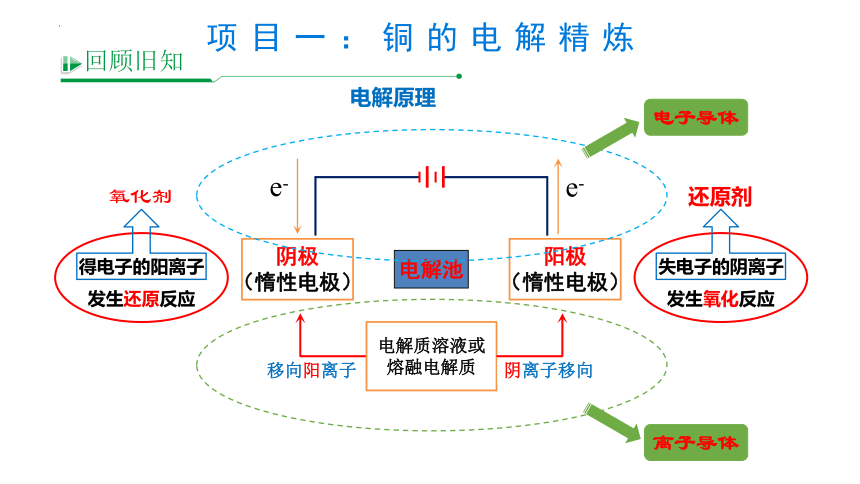
失电子的阴离子
发生氧化反应
还原剂
得电子的阳离子
发生还原反应
氧化剂
e-
e-
电解质溶液或
熔融电解质
阴离子移向
移向阳离子
阴极
(惰性电极)
阳极
(惰性电极)
电解池
电解原理
电子导体
离子导体
回顾旧知
项目一:铜的电解精炼
CuSO4
【问题引导】
现有粗铜和纯铜,如何确定两极材料?
如何选择电解质溶液?
粗铜中杂质(主要为Zn Fe Ni Ag Au )将何去何从?
3
1
2
CuSO4
【小任务】
画出粗铜精炼的装置图
标明阴阳极材料和电解质溶液
写出阴阳极电极反应式
3
1
2
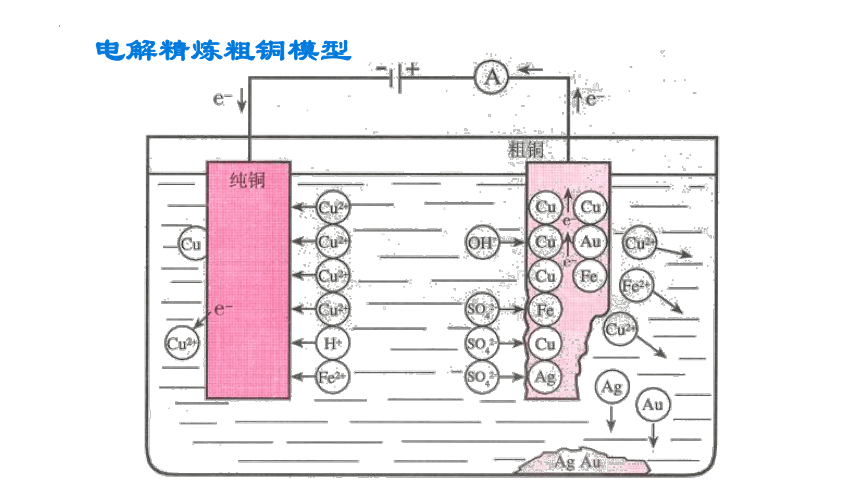
粗铜为阳极,纯铜为阴极,
阳极反应:
阴极反应:
CuSO4溶液为电解质溶液
Zn-2e-=Zn2+
Fe-2e-=Fe2+
Ni -2e-=Ni2+
Cu-2e-=Cu2+
Cu2+ +2e-=Cu
问:
电解完成后,CuSO4溶液的浓度有何变化?
Ag Au
阳极泥
+
纯铜
粗铜
-
CuSO4溶液
阳极泥
电解精炼粗铜模型
包括铁钉、铜片、含有铜离子的电解液、直流包括铁钉、铜片、含有钉、铜片、含有铜离子的电解液、直流电源、导线、烧杯铜离子的电解液、直流电源、导线、烧杯等,电源、导线、烧杯等,
项目二:电镀
光泽
电镀处理
①电镀 :利用电解原理在金属表面镀上一层其他金属或合金的工艺。
②电镀可以提高金属制品的耐腐蚀性和耐磨性,增强美观性。
CuSO4
【小提醒】
选择阴阳极材料
画出铁钉镀铜的装置图
1
2
思考一下,如何组装仪器
3
实验用品:
CuSO4溶液
铁钉、铜片、电池盒、
干电池、导线、烧杯
铁钉镀铜实验
项目二:电镀
电解液(含镀层金属离子)
电镀池模型
阳极
镀层金属
阴极
镀件
我们可以对自己喜欢的物品进行电镀处理。
不仅可以用于物质转化,还可以用于能量储存等。
项目三:电解池的其他应用
1. 物质转化---冶炼金属:
我们以金属钠的冶炼为例
电极材料
离石墨导体
离子导体:
电解总反应:
阳极:
阴极:
石墨或活性电极
熔融的氯化钠
石墨
铁
Cl-
Na+
Na+
Na+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Na+
e-
e-
e-
e-
Na+
Na+
Na+
Na+
2Na++2e-=2Na
发生还原反应
2Cl- - 2e- = Cl2↑
发生氧化反应
阴极
阳极
阳极
工
业
上
制
取
金
属
钠
2. 能量储存---二次电池
铅蓄电池
铅蓄电池→常见的二次电池
放电时
负极(铅):Pb - 2e + SO42- = PbSO
正极(二氧化铅):PbO + 2e + 4H + SO42- = PbSO + 2H2O
总反应:Pb + PbO2 + 2H2SO = 2PbSO +2H2O
阴极(还原反应):PbSO + 2e = Pb + SO42-
阳极(氧化反应):PbSO - 2e + 2H2O = PbO2+ 4H+ + SO42-
总反应:2PbSO + 2H2O = Pb + PbO + 2H2SO
铅蓄电池通过这样的充放电循环,可以反复使用。
充电时
归 纳 总 结
精炼粗铜(提纯)
电镀(金属防护)
以二次电池为例,过程中实现了电能与化学能的相互转化,为我们的生活提供了便利。
能量储存
物质转化
例如冶炼金属。
01
02
03
04
阳极
(镀层金属)
阴极
(镀件)
电解液(含镀层金属离子)
作业设计
请同学们发散思维,思考电解池还有哪些更为丰富和前沿的应用,写一篇简短的文字。
谢谢大家!再见!
(第二课时)
学科:化学
电能转化为化学能—电解
年级:高二
教材版本:鲁科版
CuSO4
学习目标
深入理解电解池的工作原理,包括电极反应、电池反应,电子和离子的移动方向等。
1
掌握粗铜的电解精炼过程,能准确画出装置图,构建精炼池的思维模型。
2
明确电镀的原理、作用和优点,掌握设计简单电镀池的方法。
3
了解电解池在物质转化和能量储存方面的应用。感受化学知识的应用价值。
4
黄金:美丽的色泽
黄金在自然界中并不是以纯净物的形式存在,而是与其他杂质混合在一起。
那么,怎么样才能得到纯净的黄金呢?
【情境导入】
矿石
失电子的阴离子
发生氧化反应
还原剂
得电子的阳离子
发生还原反应
氧化剂
e-
e-
电解质溶液或
熔融电解质
阴离子移向
移向阳离子
阴极
(惰性电极)
阳极
(惰性电极)
电解池
电解原理
电子导体
离子导体
回顾旧知
项目一:铜的电解精炼
CuSO4
【问题引导】
现有粗铜和纯铜,如何确定两极材料?
如何选择电解质溶液?
粗铜中杂质(主要为Zn Fe Ni Ag Au )将何去何从?
3
1
2
CuSO4
【小任务】
画出粗铜精炼的装置图
标明阴阳极材料和电解质溶液
写出阴阳极电极反应式
3
1
2
粗铜为阳极,纯铜为阴极,
阳极反应:
阴极反应:
CuSO4溶液为电解质溶液
Zn-2e-=Zn2+
Fe-2e-=Fe2+
Ni -2e-=Ni2+
Cu-2e-=Cu2+
Cu2+ +2e-=Cu
问:
电解完成后,CuSO4溶液的浓度有何变化?
Ag Au
阳极泥
+
纯铜
粗铜
-
CuSO4溶液
阳极泥
电解精炼粗铜模型
包括铁钉、铜片、含有铜离子的电解液、直流包括铁钉、铜片、含有钉、铜片、含有铜离子的电解液、直流电源、导线、烧杯铜离子的电解液、直流电源、导线、烧杯等,电源、导线、烧杯等,
项目二:电镀
光泽
电镀处理
①电镀 :利用电解原理在金属表面镀上一层其他金属或合金的工艺。
②电镀可以提高金属制品的耐腐蚀性和耐磨性,增强美观性。
CuSO4
【小提醒】
选择阴阳极材料
画出铁钉镀铜的装置图
1
2
思考一下,如何组装仪器
3
实验用品:
CuSO4溶液
铁钉、铜片、电池盒、
干电池、导线、烧杯
铁钉镀铜实验
项目二:电镀
电解液(含镀层金属离子)
电镀池模型
阳极
镀层金属
阴极
镀件
我们可以对自己喜欢的物品进行电镀处理。
不仅可以用于物质转化,还可以用于能量储存等。
项目三:电解池的其他应用
1. 物质转化---冶炼金属:
我们以金属钠的冶炼为例
电极材料
离石墨导体
离子导体:
电解总反应:
阳极:
阴极:
石墨或活性电极
熔融的氯化钠
石墨
铁
Cl-
Na+
Na+
Na+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Na+
e-
e-
e-
e-
Na+
Na+
Na+
Na+
2Na++2e-=2Na
发生还原反应
2Cl- - 2e- = Cl2↑
发生氧化反应
阴极
阳极
阳极
工
业
上
制
取
金
属
钠
2. 能量储存---二次电池
铅蓄电池
铅蓄电池→常见的二次电池
放电时
负极(铅):Pb - 2e + SO42- = PbSO
正极(二氧化铅):PbO + 2e + 4H + SO42- = PbSO + 2H2O
总反应:Pb + PbO2 + 2H2SO = 2PbSO +2H2O
阴极(还原反应):PbSO + 2e = Pb + SO42-
阳极(氧化反应):PbSO - 2e + 2H2O = PbO2+ 4H+ + SO42-
总反应:2PbSO + 2H2O = Pb + PbO + 2H2SO
铅蓄电池通过这样的充放电循环,可以反复使用。
充电时
归 纳 总 结
精炼粗铜(提纯)
电镀(金属防护)
以二次电池为例,过程中实现了电能与化学能的相互转化,为我们的生活提供了便利。
能量储存
物质转化
例如冶炼金属。
01
02
03
04
阳极
(镀层金属)
阴极
(镀件)
电解液(含镀层金属离子)
作业设计
请同学们发散思维,思考电解池还有哪些更为丰富和前沿的应用,写一篇简短的文字。
谢谢大家!再见!
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
