2.1.3 活化能(课件)(共35张PPT)高一化学同步教学课件 习题(人教版2019选择性必修第一册)
文档属性
| 名称 | 2.1.3 活化能(课件)(共35张PPT)高一化学同步教学课件 习题(人教版2019选择性必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 68.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-30 18:34:36 | ||
图片预览






文档简介
(共35张PPT)
第三课时 活化能
第二章 化学反应速率与化学平衡
第一节 化学反应速率
素养要求
1.知道化学反应是有历程的。
2.认识有效碰撞、基元反应活化能对化学反应速率的影响。
3.知道催化剂可以改变反应历程,对调控化学反应速率具有重要意义。
【思考交流】
1
2
3
4
5
什么是化学反应?
化学反应是一步完成的吗?
决定化学反应速率的是哪一步?
影响化学反应速率的因素有哪些?
这些因素为什么影响反应速率?
1
基元反应与反应历程
任务一 基元反应与反应历程
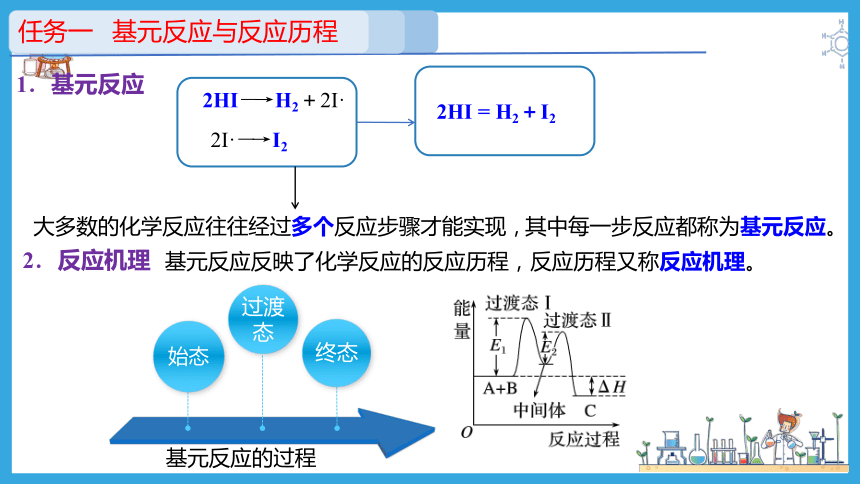
大多数的化学反应往往经过多个反应步骤才能实现,
其中每一步反应都称为基元反应。
2HI―→H2+2I·
2I·―→I2
2HI = H2+I2
1.基元反应
基元反应反映了化学反应的反应历程,反应历程又称反应机理。
2.反应机理
过渡态
终态
始态
基元反应的过程
任务一 基元反应与反应历程
飞秒化学对了解化学反应机理、控制反应进程、充分利用物质和能源等非常重要。
跟踪和检测化学反应中某些寿命极短的过渡态,必须采用10-15~10-12 s的时间分辨技术,可以分辨分子、原子飞秒级变动图像的激光脉冲技术,可以跟踪、观察基元反应的整个过程。
(1)原理:
(2)定义:
(3)意义:
对超快速化学反应的研究称为飞秒(fs,1fs=10﹣15 s)化学。
3.飞秒化学
任务一 基元反应与反应历程
1.由反应物微粒一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现:①Ce4++Mn2+→Ce3++Mn3+;
②Ce4++Mn3+→Ce3++Mn4+;
③Ti++Mn4+→Ti3++Mn2+。
由此可知:
(1)该反应的总反应的方程式为__________________________。
(2)该反应的催化剂是_______。
2Ce4++Ti+= 2Ce3++Ti3+
Mn2+
【典例剖析】
任务一 基元反应与反应历程
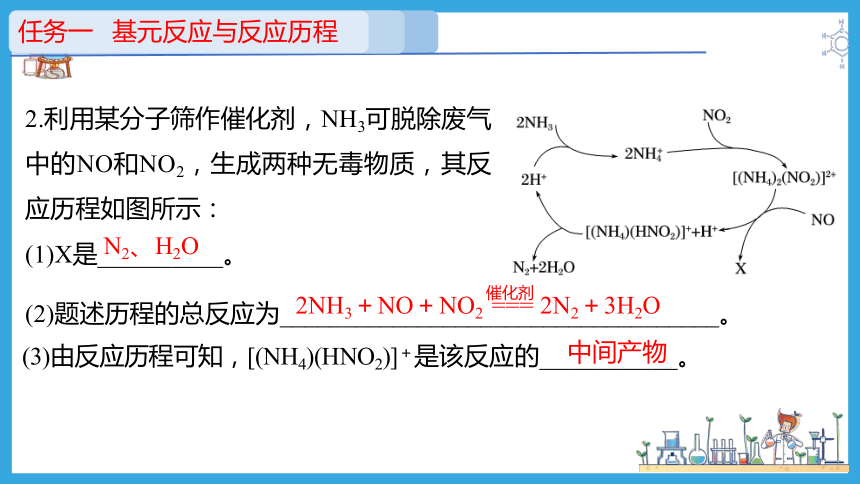
2.利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示:
(1)X是__________。
N2、H2O
(2)题述历程的总反应为___________________________________。
2NH3+NO+NO2 === 2N2+3H2O
催化剂
(3)由反应历程可知,[(NH4)(HNO2)]+是该反应的___________。
中间产物
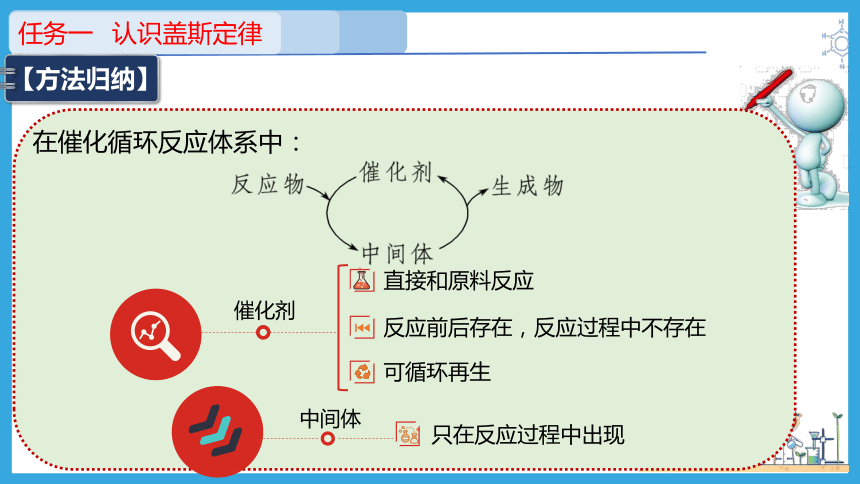
任务一 认识盖斯定律
【方法归纳】
在催化循环反应体系中:
催化剂
直接和原料反应
反应前后存在,反应过程中不存在
中间体
可循环再生
只在反应过程中出现
2
影响反应速率的理论分析
任务二 影响反应速率的理论分析
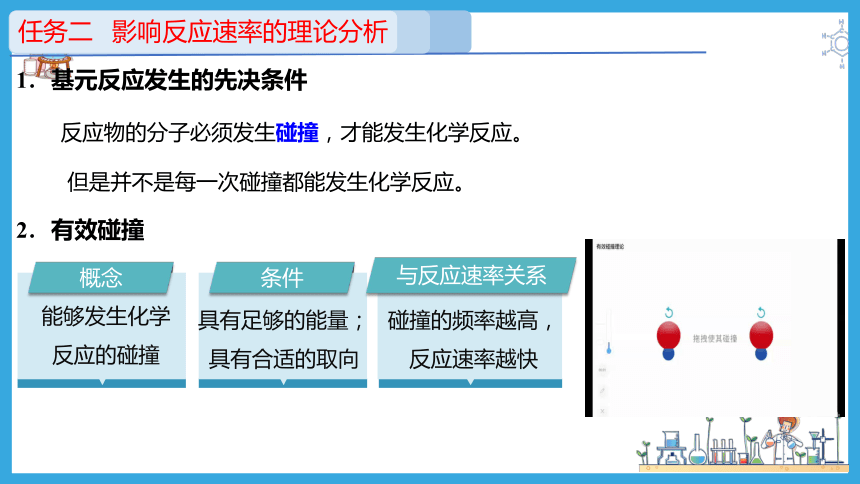
反应物的分子必须发生碰撞,才能发生化学反应。
但是并不是每一次碰撞都能发生化学反应。
2.有效碰撞
概念
能够发生化学反应的碰撞
条件
具有足够的能量;
具有合适的取向
与反应速率关系
碰撞的频率越高,反应速率越快
1.基元反应发生的先决条件
任务二 影响反应速率的理论分析
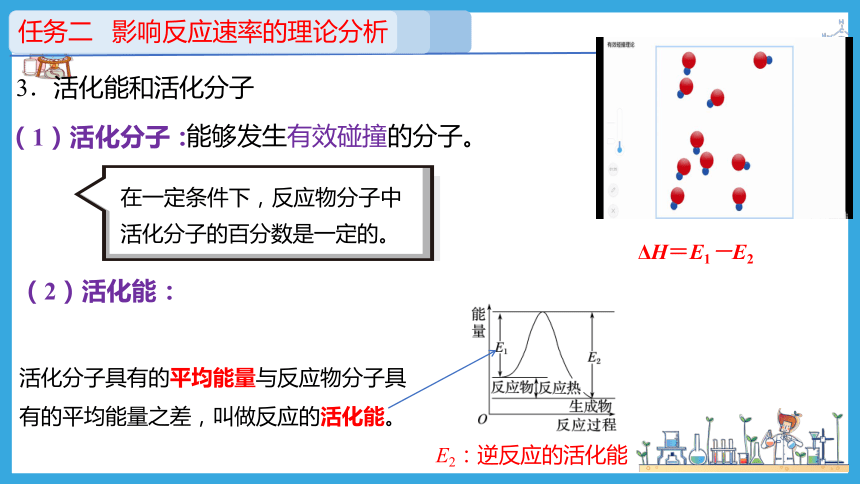
(1)活化分子:
能够发生有效碰撞的分子。
(2)活化能:
活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。
在一定条件下,反应物分子中活化分子的百分数是一定的。
3.活化能和活化分子
E2:逆反应的活化能
ΔH=E1-E2
任务二 影响反应速率的理论分析
反应物浓度增大
单位体积内活化分子数增多
化学反应速率增大
单位时间内有效碰撞次数增加
4.活有效碰撞理论影响化学反应速率因素的解释——浓度
单位体积内活化分子数增多
增大压强
气体体积缩小
反应物浓度增大
单位时间内有效碰撞的次数增加
化学反应速率增大
5.活有效碰撞理论影响化学反应速率因素的解释——压强
任务二 影响反应速率的理论分析
使一部分原来能量较低的分子变成活化分子
活化分子的百分数增大
升高温度
反应物分子的能量增加
单位时间内有效碰撞的次数增加
化学反应速率增大
6.活有效碰撞理论影响化学反应速率因素的解释——温度
任务二 影响反应速率的理论分析
活化分子的百分数增大
使用
催化剂
反应的
活化能降低
更多的反应物分子成为活化分子
单位时间内有效碰撞的次数增加
化学反应速率增大
7.活有效碰撞理论影响化学反应速率因素的解释——催化剂
【归纳总结】
一个反应要发生一般要经历哪些过程?
普通
分子
活化
能
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
反应速率与单位时间、单位体积内分子间有效碰撞次数(有效碰撞频率)有关
外因对速率影响的有效碰撞理论解释
影响 外因 单位体积内 有效碰撞 次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度
增大压强
升高温度
使用催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
【归纳总结】
【注意】还有许多改变化学反应速率的方法:如光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨等。总之,向反应体系输入能量,都有可能改变化学反应速率。
任务二 影响反应速率的理论分析
高效性、
选择性
选用合适的催化剂来调控反应
自身成分、粒径、合成方法等因素;温度(温度过高,催化活性降低)、压强等条件。
催化活性的影响因素:
8.催化剂特点
01
02
03
04
05
扩散
吸附
断键
成键
脱附
活化能越大,反应越难进行
改变温度,活化能大的反应速率改变程度大
活化能(能垒)大的慢反应是决定整个反应速率的关键步骤
9.催化剂与反应历程
概念辨析
(1)当碰撞的分子具有足够的能量和适当的取向时才能发生化学反应( )
(2)活化能大的反应一定是吸热反应 ( )
(3)催化剂能降低反应所需的活化能,ΔH也会发生变化 ( )
(4)活化能越高,反应越难发生,反应速率越慢 ( )
(5)增大反应物的浓度,使活化分子百分数增大,化学反应速率增大 ( )
√
√
【归纳总结】
任务二 影响反应速率的理论分析
(1)同一反应,不同催化剂对该反应的催化效果不同。
(2)同一催化剂,对不同反应催化效果也不同。
(3)催化剂的催化活性还与温度、酸碱度等因素有关,使用催化剂时需选择适宜条件。
对催化剂的选择性的理解
拓展1 图像分析
1.反应速率图像分析
化学反应速率与浓度、压强、温度、催化剂等外界因素有关。
(1)溶液中的反应速率图像分析(如:Zn+H2SO4 = ZnSO4+H2↑)
v-c(H+) 图像 v-T(温度)图像 v-t(时间)图像
说明:开始时,反应放热、温度升高,反应速率增大,后来c(H+)逐渐减小,化学反应速率减小
v-p(压强)图像 v-V(容积)图像 v-t(时间)图像 v-p、T(T1
【提醒】分析图像时特别关注图像中坐标轴、起点、终点、拐点、图像变化趋势等。
拓展1 图像分析
2.反应速率相关量的图像分析
化学反应速率与反应中单位时间内各物质的物质的量浓度变化、质量的变化符合化学方程式中化学计量关系,根据图像中相关量的变化可以间接分析反应速率。如:
(1)物质的量与时间关系图像
【特别关注】
①反应物和生成物的判断;
②反应是否可逆;
③依据各物质的变化量计算化学反应速率或确定化学方程式。
拓展1 图像分析
(2)浓度与时间关系图像
【特别关注】
①起点、终点——计算反应速率;
②斜率——曲线斜率代表反应速率。
拓展1 图像分析
(2022·北京北师大实验中学高二期中)2007年诺贝尔化学奖授予埃特尔以表彰其对于合成氨反应机理的研究,氮气和氢气分子在催化剂表面的部分变化过程如图所示。下列说法不正确的是( )
A.图①→②过程吸热,图②→③过程放热
B.温度、压强、催化剂都能改变反应的ΔH
C.N2在反应过程中三键均发生断裂
D.反应过程中存在—NH—、—NH2等中间产物
B
典例剖析
拓展2 速率常数和速率方程
1.速率常数含义
速率常数(k)是指在给定温度下,反应物浓度皆为1 mol·L-1时的反应速率。在相同的浓度条件下,可用速率常数大小来比较化学反应的反应速率。
(1)含义
基元反应:化学反应速率与反应物浓度(或浓度的次方)成正比,而速率常数是其比例常数,在恒温条件下,速率常数不随反应物浓度的变化而改变。因此,可以应用速率方程求出该温度下任意浓度时的反应速率。
(2)应用
拓展2 速率常数和速率方程
2.速率方程
(1)一定温度下,化学反应速率与反应物浓度以其计量数为指数的幂的乘积成正比。
对于基元反应:aA+bB=gG+hH,则v=kca(A)·cb(B)(其中k为速率常数)
(2)实例:
v=kc(SO2Cl2)
①SO2Cl2 SO2+Cl2
②2NO2 2NO+O2
③2H2+2NO N2+2H2O
v=k·c2(H2)·c2(NO)
v=kc2(NO2)
拓展2 速率常数和速率方程
3.速率常数的影响因素
温度对化学反应速率的影响是显著的,速率常数是温度的函数,同一反应,温度不同,速率常数将有不同的值,但浓度不影响速率常数。
(3)把任意时刻反应物浓度代入速率方程,可得该时刻的反应速率,即瞬时速率。
c(A)/ (mol·L-1) 0.25 0.50 1.00 0.50 1.00 c1
c(B)/(mol·L-1) 0.050 0.050 0.100 0.100 0.200 c2
v/(10-3 mol·L-1·min-1) 1.6 3.2 v1 3.2 v2 4.8
下列说法不正确的是( )
A.上述表格中的c1=0.75、v2=6.4
B.该反应的速率常数k=6.4×10-3 min-1
C.在过量的B存在时,反应掉93.75%的A所需的时间是500 min
D.升温、加入催化剂、缩小容积(加压),使k增大导致反应的瞬时速率加快
D
典例剖析
课堂小结
基元反应与反应历程
影响反应速率的理论分析
催化机理与反应历程
当 堂 练 习
3
任务三 限时训练
1.(2023·沧州部分学校高二月考)下列有关说法正确的是( )
B
2.(2023·重庆九龙坡区高二月考)在体积可变的容器中发生反应:2SO2(g)+O2(g) 2SO3(g),当缩小容器体积使压强增大时,化学反应速率加快,其根本原因是( )
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
D.活化分子百分数不变,但单位体积内活化分子数增加,有效碰撞次数增多
任务三 限时训练
D
任务三 限时训练
3.(2023·牡丹江第一高级中学高二月考)研究
CH3I与氯自由基(用Cl*表示)的反应有助于保护
臭氧层。已知CH3I与Cl*反应有4条可能的反应
路径,如图所示。图中TS表示过渡态,IM表
示中间体。下列说法中错误的是( )
B
任务三 限时训练
4.(2021·河北卷)室温下,某溶液初始时仅溶有M和N且
浓度相等,同时发生以下两个反应:①M+N=X+Y;
②M+N=X+Z。反应①的速率可表示为v1=k1c2(M),
反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。
反应体系中组分M、Z的浓度随时间变化情况如图。下
列说法错误的是( )
A
A.0~30 min时间段内,Y的平均反应速率为6.67×10-3 mol·L-1·min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
第三课时 活化能
第二章 化学反应速率与化学平衡
第一节 化学反应速率
素养要求
1.知道化学反应是有历程的。
2.认识有效碰撞、基元反应活化能对化学反应速率的影响。
3.知道催化剂可以改变反应历程,对调控化学反应速率具有重要意义。
【思考交流】
1
2
3
4
5
什么是化学反应?
化学反应是一步完成的吗?
决定化学反应速率的是哪一步?
影响化学反应速率的因素有哪些?
这些因素为什么影响反应速率?
1
基元反应与反应历程
任务一 基元反应与反应历程
大多数的化学反应往往经过多个反应步骤才能实现,
其中每一步反应都称为基元反应。
2HI―→H2+2I·
2I·―→I2
2HI = H2+I2
1.基元反应
基元反应反映了化学反应的反应历程,反应历程又称反应机理。
2.反应机理
过渡态
终态
始态
基元反应的过程
任务一 基元反应与反应历程
飞秒化学对了解化学反应机理、控制反应进程、充分利用物质和能源等非常重要。
跟踪和检测化学反应中某些寿命极短的过渡态,必须采用10-15~10-12 s的时间分辨技术,可以分辨分子、原子飞秒级变动图像的激光脉冲技术,可以跟踪、观察基元反应的整个过程。
(1)原理:
(2)定义:
(3)意义:
对超快速化学反应的研究称为飞秒(fs,1fs=10﹣15 s)化学。
3.飞秒化学
任务一 基元反应与反应历程
1.由反应物微粒一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现:①Ce4++Mn2+→Ce3++Mn3+;
②Ce4++Mn3+→Ce3++Mn4+;
③Ti++Mn4+→Ti3++Mn2+。
由此可知:
(1)该反应的总反应的方程式为__________________________。
(2)该反应的催化剂是_______。
2Ce4++Ti+= 2Ce3++Ti3+
Mn2+
【典例剖析】
任务一 基元反应与反应历程
2.利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示:
(1)X是__________。
N2、H2O
(2)题述历程的总反应为___________________________________。
2NH3+NO+NO2 === 2N2+3H2O
催化剂
(3)由反应历程可知,[(NH4)(HNO2)]+是该反应的___________。
中间产物
任务一 认识盖斯定律
【方法归纳】
在催化循环反应体系中:
催化剂
直接和原料反应
反应前后存在,反应过程中不存在
中间体
可循环再生
只在反应过程中出现
2
影响反应速率的理论分析
任务二 影响反应速率的理论分析
反应物的分子必须发生碰撞,才能发生化学反应。
但是并不是每一次碰撞都能发生化学反应。
2.有效碰撞
概念
能够发生化学反应的碰撞
条件
具有足够的能量;
具有合适的取向
与反应速率关系
碰撞的频率越高,反应速率越快
1.基元反应发生的先决条件
任务二 影响反应速率的理论分析
(1)活化分子:
能够发生有效碰撞的分子。
(2)活化能:
活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。
在一定条件下,反应物分子中活化分子的百分数是一定的。
3.活化能和活化分子
E2:逆反应的活化能
ΔH=E1-E2
任务二 影响反应速率的理论分析
反应物浓度增大
单位体积内活化分子数增多
化学反应速率增大
单位时间内有效碰撞次数增加
4.活有效碰撞理论影响化学反应速率因素的解释——浓度
单位体积内活化分子数增多
增大压强
气体体积缩小
反应物浓度增大
单位时间内有效碰撞的次数增加
化学反应速率增大
5.活有效碰撞理论影响化学反应速率因素的解释——压强
任务二 影响反应速率的理论分析
使一部分原来能量较低的分子变成活化分子
活化分子的百分数增大
升高温度
反应物分子的能量增加
单位时间内有效碰撞的次数增加
化学反应速率增大
6.活有效碰撞理论影响化学反应速率因素的解释——温度
任务二 影响反应速率的理论分析
活化分子的百分数增大
使用
催化剂
反应的
活化能降低
更多的反应物分子成为活化分子
单位时间内有效碰撞的次数增加
化学反应速率增大
7.活有效碰撞理论影响化学反应速率因素的解释——催化剂
【归纳总结】
一个反应要发生一般要经历哪些过程?
普通
分子
活化
能
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
反应速率与单位时间、单位体积内分子间有效碰撞次数(有效碰撞频率)有关
外因对速率影响的有效碰撞理论解释
影响 外因 单位体积内 有效碰撞 次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度
增大压强
升高温度
使用催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
【归纳总结】
【注意】还有许多改变化学反应速率的方法:如光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨等。总之,向反应体系输入能量,都有可能改变化学反应速率。
任务二 影响反应速率的理论分析
高效性、
选择性
选用合适的催化剂来调控反应
自身成分、粒径、合成方法等因素;温度(温度过高,催化活性降低)、压强等条件。
催化活性的影响因素:
8.催化剂特点
01
02
03
04
05
扩散
吸附
断键
成键
脱附
活化能越大,反应越难进行
改变温度,活化能大的反应速率改变程度大
活化能(能垒)大的慢反应是决定整个反应速率的关键步骤
9.催化剂与反应历程
概念辨析
(1)当碰撞的分子具有足够的能量和适当的取向时才能发生化学反应( )
(2)活化能大的反应一定是吸热反应 ( )
(3)催化剂能降低反应所需的活化能,ΔH也会发生变化 ( )
(4)活化能越高,反应越难发生,反应速率越慢 ( )
(5)增大反应物的浓度,使活化分子百分数增大,化学反应速率增大 ( )
√
√
【归纳总结】
任务二 影响反应速率的理论分析
(1)同一反应,不同催化剂对该反应的催化效果不同。
(2)同一催化剂,对不同反应催化效果也不同。
(3)催化剂的催化活性还与温度、酸碱度等因素有关,使用催化剂时需选择适宜条件。
对催化剂的选择性的理解
拓展1 图像分析
1.反应速率图像分析
化学反应速率与浓度、压强、温度、催化剂等外界因素有关。
(1)溶液中的反应速率图像分析(如:Zn+H2SO4 = ZnSO4+H2↑)
v-c(H+) 图像 v-T(温度)图像 v-t(时间)图像
说明:开始时,反应放热、温度升高,反应速率增大,后来c(H+)逐渐减小,化学反应速率减小
v-p(压强)图像 v-V(容积)图像 v-t(时间)图像 v-p、T(T1
【提醒】分析图像时特别关注图像中坐标轴、起点、终点、拐点、图像变化趋势等。
拓展1 图像分析
2.反应速率相关量的图像分析
化学反应速率与反应中单位时间内各物质的物质的量浓度变化、质量的变化符合化学方程式中化学计量关系,根据图像中相关量的变化可以间接分析反应速率。如:
(1)物质的量与时间关系图像
【特别关注】
①反应物和生成物的判断;
②反应是否可逆;
③依据各物质的变化量计算化学反应速率或确定化学方程式。
拓展1 图像分析
(2)浓度与时间关系图像
【特别关注】
①起点、终点——计算反应速率;
②斜率——曲线斜率代表反应速率。
拓展1 图像分析
(2022·北京北师大实验中学高二期中)2007年诺贝尔化学奖授予埃特尔以表彰其对于合成氨反应机理的研究,氮气和氢气分子在催化剂表面的部分变化过程如图所示。下列说法不正确的是( )
A.图①→②过程吸热,图②→③过程放热
B.温度、压强、催化剂都能改变反应的ΔH
C.N2在反应过程中三键均发生断裂
D.反应过程中存在—NH—、—NH2等中间产物
B
典例剖析
拓展2 速率常数和速率方程
1.速率常数含义
速率常数(k)是指在给定温度下,反应物浓度皆为1 mol·L-1时的反应速率。在相同的浓度条件下,可用速率常数大小来比较化学反应的反应速率。
(1)含义
基元反应:化学反应速率与反应物浓度(或浓度的次方)成正比,而速率常数是其比例常数,在恒温条件下,速率常数不随反应物浓度的变化而改变。因此,可以应用速率方程求出该温度下任意浓度时的反应速率。
(2)应用
拓展2 速率常数和速率方程
2.速率方程
(1)一定温度下,化学反应速率与反应物浓度以其计量数为指数的幂的乘积成正比。
对于基元反应:aA+bB=gG+hH,则v=kca(A)·cb(B)(其中k为速率常数)
(2)实例:
v=kc(SO2Cl2)
①SO2Cl2 SO2+Cl2
②2NO2 2NO+O2
③2H2+2NO N2+2H2O
v=k·c2(H2)·c2(NO)
v=kc2(NO2)
拓展2 速率常数和速率方程
3.速率常数的影响因素
温度对化学反应速率的影响是显著的,速率常数是温度的函数,同一反应,温度不同,速率常数将有不同的值,但浓度不影响速率常数。
(3)把任意时刻反应物浓度代入速率方程,可得该时刻的反应速率,即瞬时速率。
c(A)/ (mol·L-1) 0.25 0.50 1.00 0.50 1.00 c1
c(B)/(mol·L-1) 0.050 0.050 0.100 0.100 0.200 c2
v/(10-3 mol·L-1·min-1) 1.6 3.2 v1 3.2 v2 4.8
下列说法不正确的是( )
A.上述表格中的c1=0.75、v2=6.4
B.该反应的速率常数k=6.4×10-3 min-1
C.在过量的B存在时,反应掉93.75%的A所需的时间是500 min
D.升温、加入催化剂、缩小容积(加压),使k增大导致反应的瞬时速率加快
D
典例剖析
课堂小结
基元反应与反应历程
影响反应速率的理论分析
催化机理与反应历程
当 堂 练 习
3
任务三 限时训练
1.(2023·沧州部分学校高二月考)下列有关说法正确的是( )
B
2.(2023·重庆九龙坡区高二月考)在体积可变的容器中发生反应:2SO2(g)+O2(g) 2SO3(g),当缩小容器体积使压强增大时,化学反应速率加快,其根本原因是( )
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
D.活化分子百分数不变,但单位体积内活化分子数增加,有效碰撞次数增多
任务三 限时训练
D
任务三 限时训练
3.(2023·牡丹江第一高级中学高二月考)研究
CH3I与氯自由基(用Cl*表示)的反应有助于保护
臭氧层。已知CH3I与Cl*反应有4条可能的反应
路径,如图所示。图中TS表示过渡态,IM表
示中间体。下列说法中错误的是( )
B
任务三 限时训练
4.(2021·河北卷)室温下,某溶液初始时仅溶有M和N且
浓度相等,同时发生以下两个反应:①M+N=X+Y;
②M+N=X+Z。反应①的速率可表示为v1=k1c2(M),
反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。
反应体系中组分M、Z的浓度随时间变化情况如图。下
列说法错误的是( )
A
A.0~30 min时间段内,Y的平均反应速率为6.67×10-3 mol·L-1·min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
