3.3.1 盐类水解原理-【精讲课】(共24张PPT)高二化学同步教学优质课件(人教版2019选择性必修1)
文档属性
| 名称 | 3.3.1 盐类水解原理-【精讲课】(共24张PPT)高二化学同步教学优质课件(人教版2019选择性必修1) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-30 00:00:00 | ||
图片预览






文档简介
第三章 第三节 盐类的水解
四川省双流棠湖中学 海棠化学备课组
第1课时 盐类水解原理
1.理解水解反应的本质,能正确判断不同盐溶液的酸碱性(重点)。
2.能正确书写水解反应的化学方程式和离子方程式(重点)。
3.了解溶液中的电荷守恒和元素守恒的含义及简单应用。
核心素养学习目标
创设情境
【问题1】Na2CO3俗称纯碱,经常用于面食制作和油污清洗等,明明是盐,为什么叫纯碱?
【问题2】酸溶液呈酸性,碱溶液呈碱性,那么盐溶液呢?一定呈中性吗?
【问题3】盐溶液的酸碱性与盐的类型之间有什么关系?
Na2CO3溶液呈碱性
盐溶液可能呈中性、酸性、也可能呈碱性
酸
强酸
弱酸
弱碱
强碱
碱
酸+碱 ===盐+水 (中和反应)
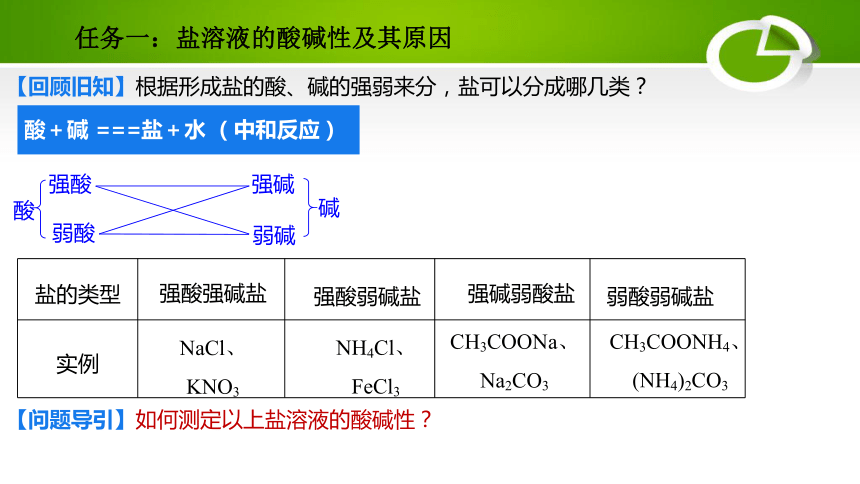
【回顾旧知】根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
盐的类型
实例
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
弱酸弱碱盐
NaCl、
KNO3
NH4Cl、
FeCl3
CH3COONa、Na2CO3
CH3COONH4、(NH4)2CO3
【问题导引】如何测定以上盐溶液的酸碱性?
任务一:盐溶液的酸碱性及其原因
【方法导引】实验室测定溶液pH可用
① pH计
② pH试纸
③酸碱指示剂
Na2CO3的酚酞溶液显红色
测定溶液的pH值
任务一:盐溶液的酸碱性及其原因
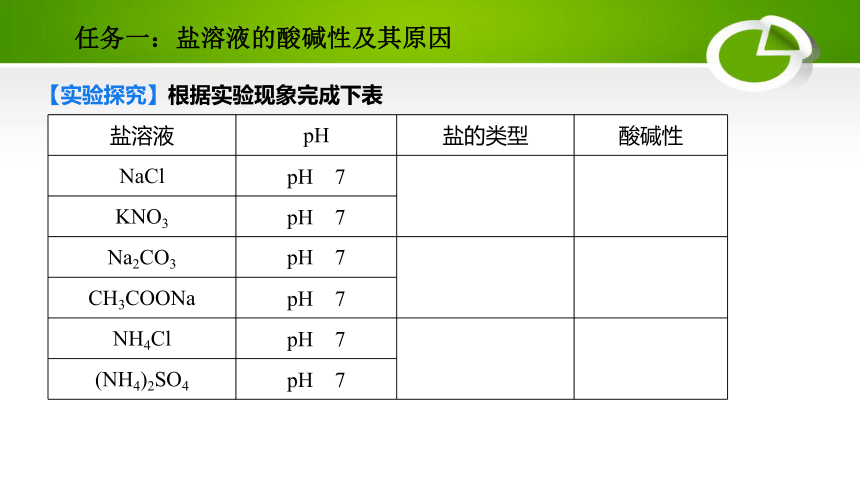
盐溶液
pH
盐的类型
酸碱性
NaCl
pH=7
强酸强碱盐
中性
KNO3
pH=7
Na2CO3
pH>7
强碱弱酸盐
碱性
CH3COONa
pH>7
NH4Cl
pH<7
强酸弱碱盐
酸性
(NH4)2SO4
pH<7
【实验探究】根据实验现象完成下表
任务一:盐溶液的酸碱性及其原因
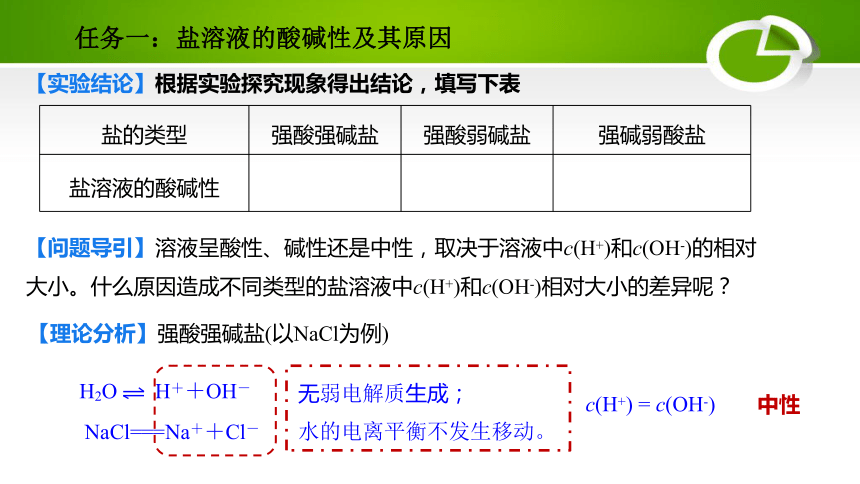
盐的类型
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
盐溶液的酸碱性
中性
酸性
碱性
【问题导引】溶液呈酸性、碱性还是中性,取决于溶液中c(H+)和c(OH-)的相对大小。什么原因造成不同类型的盐溶液中c(H+)和c(OH-)相对大小的差异呢?
【实验结论】根据实验探究现象得出结论,填写下表
【理论分析】强酸强碱盐(以NaCl为例)
H2O H++OH-
NaCl===Na++Cl-
无弱电解质生成;
水的电离平衡不发生移动。
c(H+) = c(OH-)
中性
任务一:盐溶液的酸碱性及其原因
H2O H++OH-
NH4Cl===Cl-+NH4+
?
有弱电解质生成;
水的电离平衡向右移动。
c(H+) > c(OH-)
酸性
【理论分析】强酸弱碱盐(以NH4Cl为例)
NH3·H2O
+
总反应: ????????????++H2O NH3·H2O+H+
?
H2O H++OH-
有弱电解质生成;
水的电离平衡向右移动。
c(OH-)>c(H+)
碱性
【理论分析】强碱弱酸盐(以CH3COONa为例)
CH3COONa ===CH3COO-+Na+
+
CH3COOH
总反应: CH3COO- +H2O CH3COOH+OH-
任务一:盐溶液的酸碱性及其原因
【概念辨析】盐类水解:水溶液中,盐电离出来的离子与水电离出来的H+或OH-结合生成弱电解质的反应。
【条件】盐易溶,且有弱离子。
【实质】生成弱电解质,促进水的电离。
【特点】
特点
Ⅰ. 可逆:
Ⅱ. 吸热:
Ⅲ. 一般很微弱:
且必有弱酸或弱碱生成
盐+水 酸+碱
中和
水解
一般不用“↑”或“↓”;
一般不写“===”,而写“ ”
任务一:盐溶液的酸碱性及其原因
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
弱酸弱碱盐
无弱不水解,同强显中性
中性
谁弱谁水解,谁强显谁性
酸性
谁弱谁水解,谁强显谁性
碱性
都弱都水解,越弱越水解
不确定
【规律总结】盐类水解的规律——判断盐溶液酸碱性的方法
盐类水解的规律
任务一:盐溶液的酸碱性及其原因
盐溶液
水解的离子
酸碱性
Na2SO4
无
中性
Cu(NO3)2
Cu2+
酸性
NaClO
ClO-
碱性
NaHSO4
无
酸性
KAl(SO4)2
Al3+
酸性
NaHCO3
碱性
【应用体验】根据所学知识判断下列盐溶液中水解的离子及溶液的酸碱性
任务一:盐溶液的酸碱性及其原因
【评价训练】1.正误判断
(1)盐类水解的实质是促进水的电离,使水的电离平衡右移
(2)酸式盐溶液可能呈酸性,也可能呈碱性
(3)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同
CH3COO- +H2O CH3COOH + OH-
NH4++H2O NH3·H2O+H+
?
CH3COONa溶液呈碱性,其中OH-全部来自水的电离,
根据水的离子积常数,c(OH-)=10-1410-10 mol·L-1=10-4 mol·L-1。
?
NH4Cl溶液呈酸性,其中H+全部来自水的电离,
c(H+)=10-4 mol·L-1。
酸式盐要根据电离和水解程度分析溶液的酸碱性。
√
√
√
任务一:盐溶液的酸碱性及其原因
【评价训练】2.Na2CO3的水解情况与CH3COONa类似,由于H2CO3是二元酸,Na2CO3的水解复杂一些,请运用CH3COONa的水解情况,分析Na2CO3溶液中存在哪些微粒?
第一步
H2O ? OH- + H+
Na2CO3===2Na++ CO32?
?
+
第二步
生成的HCO3?进一步发生水解
?
CO32?+H2O ? OH-+HCO3?
?
HCO3?
?
HCO3?+H2O ?OH-+H2CO3
?
分子:H2O 、H2CO3
离子: Na+、 ?????????????????、??????????????????、 OH-、 H+
?
任务一:盐溶液的酸碱性及其原因
【评价训练】3.(1)怎样用最简单的方法区别NaCl溶液、NH4Cl溶液和Na2CO3溶液?
(2)怎样证明Na2CO3溶液呈碱性是由CO32?水解引起的?
?
向Na2CO3溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去,可说明Na2CO3溶液呈碱性是由CO32?水解引起的。
?
将三种溶液各取少许于试管中,分别滴入紫色石蕊溶液,溶液不变色的为NaCl溶液,变红色的为NH4Cl溶液,变蓝色的为Na2CO3溶液。
任务一:盐溶液的酸碱性及其原因
【评价训练】4.常温下,某浓度的NH4Cl溶液的pH为4,回答下列问题:
(1)该NH4Cl溶液中含氮元素的微粒有_______________。
(2)该NH4Cl溶液中c水(H+)与pH=4的盐酸中c水(H+)比值为______。
????????????+、????????????·?????????????
?
NH4++H2O NH3·H2O+H+
?
pH=4的NH4Cl溶液中水电离的c水(H+)=10-4 mol·L-1
pH=4的盐酸中水电离的c水(H+)=10-10 mol·L-1
106
任务一:盐溶液的酸碱性及其原因
(2)一般水解程度较小,水解产物很少,通常不生成气体和沉淀,不写“↑”或“↓”,不稳定的生成物如H2CO3、NH3·H2O也不写分解产物。
(4)多元弱碱盐分步水解,但不分步书写方程式,一步书写到位。
(3)多元弱酸盐分步水解,第一步为主,水解方程式通常只写第一步。
阴(阳)离子+H2O ? 弱酸(或弱碱)+OH-(或H+)
(1)盐类水解是可逆反应,反应方程式要写可逆符号“?”。
【方法导引】盐类水解方程式的书写
任务二:盐类水解方程式的书写
【模型搭建】分类书写盐类水解离子方程式
(1)一元弱酸(碱)盐的水解
①NaClO: ;
②(NH4)2SO4: 。
(2)多元弱酸强碱盐(正盐)
①Na2CO3: 、 ;
②Na2S: 、 。
ClO-+H2O HClO+OH-
任务二:盐类水解方程式的书写
(3)多元弱碱强酸盐
AlCl3: 。
(4)弱酸弱碱盐中阴、阳离子水解相互促进
①CH3COONH4: ;
②Al2S3: 。
2.用化学用语表示NaHCO3溶液中可能存在的平衡:
____________________________________________________________;
____________________________________________________________。
Al3++3H2O Al(OH)3+3H+
Al2S3+6H2O===2Al(OH)3↓+3H2S↑
任务二:盐类水解方程式的书写
【评价训练】1.下列属于水解方程式且正确的打“√”,不属于水解方程式或水解方程式错误的打“×”。
CO32?+H2O OH-+HCO3?
?
HS-+H2O OH-+ H2S
×
×
×
√
√
不属于水解方程式
Mg2++2H2O 2H++Mg(OH)2
×
×
任务二:盐类水解方程式的书写
【归纳总结】水解方程式正误判断方法
②单一离子水解要用“ ”连接,一般无“↑”、“↓”;少数水解完全的反应,书写时用“===”连接,可标“↓”或“↑”符号。
③多元弱酸根离子水解分步书写,多元弱碱阳离子水解一步写出。
(1)符不符(是否符合反应事实):
(2)平不平(电荷守恒、元素守恒):
①要注意区分水解和电离过程,防止混淆电离方程式和水解方程式。
①电荷守恒:方程式左右两边离子的电荷总数相等。
②元素守恒:反应前后各元素的原子个数相等。
任务二:盐类水解方程式的书写
任务三:电解质溶液中电荷守恒与元素守恒
如Na2CO3溶液中存在的微粒有______________________________,
其电荷守恒有____________________________________________。
(1)含义:
阳离子所带正电荷总数 =阴离子所带负电荷总数
电解质溶液呈电中性。
(2)应用:
注意:阴阳离子写两边、系数电荷要一致。
Na+、CO32?、H+、OH-、HCO3?
?
c(Na+)+c(H+)=c(OH-)+c(HCO3?)+2c(CO32?)
?
【模型搭建】1.电荷守恒
c(Na+)=2[c(H2CO3)+c(CO32??)+c(HCO3??)]
?
在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化。离子所含的某种元素在变化前后是守恒的,即元素守恒。
则其元素守恒关系有:______________________________________。
如Na2CO3溶液中,由于CO32?水解,含碳微粒有:_________________________________,
?
CO32??、HCO3??、H2CO3
?
n(Na)∶n(C)=2∶1
(1)含义:
【模型搭建】2.元素守恒
(2)应用:
任务三:电解质溶液中电荷守恒与元素守恒
【评价训练】写出下列两种溶液中的电荷守恒及元素守恒
1.CH3COONa溶液中:
(1)电荷守恒:_______________________________________;
(2)元素守恒:_______________________________________;
(3)pH=5的CH3COOH与CH3COONa混合溶液中电荷守恒:
_______________________________________。
2.碳酸氢钠溶液中:
(1)电荷守恒:______________________________________________;
(2)元素守恒:_______________________________________________。
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
c(Na+)=c(CH3COO-)+c(CH3COOH)
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
c(Na+)+c(H+)=c(OH-)+c(HCO3?)+2c(CO32?)
?
c(Na+)=c(HCO3?)+c(CO32?)+c(H2CO3)
?
任务三:电解质溶液中电荷守恒与元素守恒
本课结束
今日作业
第三章 第三节 第1课时 盐类水解原理
四川省双流棠湖中学 海棠化学备课组
第1课时 盐类水解原理
1.理解水解反应的本质,能正确判断不同盐溶液的酸碱性(重点)。
2.能正确书写水解反应的化学方程式和离子方程式(重点)。
3.了解溶液中的电荷守恒和元素守恒的含义及简单应用。
核心素养学习目标
创设情境
【问题1】Na2CO3俗称纯碱,经常用于面食制作和油污清洗等,明明是盐,为什么叫纯碱?
【问题2】酸溶液呈酸性,碱溶液呈碱性,那么盐溶液呢?一定呈中性吗?
【问题3】盐溶液的酸碱性与盐的类型之间有什么关系?
Na2CO3溶液呈碱性
盐溶液可能呈中性、酸性、也可能呈碱性
酸
强酸
弱酸
弱碱
强碱
碱
酸+碱 ===盐+水 (中和反应)
【回顾旧知】根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
盐的类型
实例
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
弱酸弱碱盐
NaCl、
KNO3
NH4Cl、
FeCl3
CH3COONa、Na2CO3
CH3COONH4、(NH4)2CO3
【问题导引】如何测定以上盐溶液的酸碱性?
任务一:盐溶液的酸碱性及其原因
【方法导引】实验室测定溶液pH可用
① pH计
② pH试纸
③酸碱指示剂
Na2CO3的酚酞溶液显红色
测定溶液的pH值
任务一:盐溶液的酸碱性及其原因
盐溶液
pH
盐的类型
酸碱性
NaCl
pH=7
强酸强碱盐
中性
KNO3
pH=7
Na2CO3
pH>7
强碱弱酸盐
碱性
CH3COONa
pH>7
NH4Cl
pH<7
强酸弱碱盐
酸性
(NH4)2SO4
pH<7
【实验探究】根据实验现象完成下表
任务一:盐溶液的酸碱性及其原因
盐的类型
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
盐溶液的酸碱性
中性
酸性
碱性
【问题导引】溶液呈酸性、碱性还是中性,取决于溶液中c(H+)和c(OH-)的相对大小。什么原因造成不同类型的盐溶液中c(H+)和c(OH-)相对大小的差异呢?
【实验结论】根据实验探究现象得出结论,填写下表
【理论分析】强酸强碱盐(以NaCl为例)
H2O H++OH-
NaCl===Na++Cl-
无弱电解质生成;
水的电离平衡不发生移动。
c(H+) = c(OH-)
中性
任务一:盐溶液的酸碱性及其原因
H2O H++OH-
NH4Cl===Cl-+NH4+
?
有弱电解质生成;
水的电离平衡向右移动。
c(H+) > c(OH-)
酸性
【理论分析】强酸弱碱盐(以NH4Cl为例)
NH3·H2O
+
总反应: ????????????++H2O NH3·H2O+H+
?
H2O H++OH-
有弱电解质生成;
水的电离平衡向右移动。
c(OH-)>c(H+)
碱性
【理论分析】强碱弱酸盐(以CH3COONa为例)
CH3COONa ===CH3COO-+Na+
+
CH3COOH
总反应: CH3COO- +H2O CH3COOH+OH-
任务一:盐溶液的酸碱性及其原因
【概念辨析】盐类水解:水溶液中,盐电离出来的离子与水电离出来的H+或OH-结合生成弱电解质的反应。
【条件】盐易溶,且有弱离子。
【实质】生成弱电解质,促进水的电离。
【特点】
特点
Ⅰ. 可逆:
Ⅱ. 吸热:
Ⅲ. 一般很微弱:
且必有弱酸或弱碱生成
盐+水 酸+碱
中和
水解
一般不用“↑”或“↓”;
一般不写“===”,而写“ ”
任务一:盐溶液的酸碱性及其原因
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
弱酸弱碱盐
无弱不水解,同强显中性
中性
谁弱谁水解,谁强显谁性
酸性
谁弱谁水解,谁强显谁性
碱性
都弱都水解,越弱越水解
不确定
【规律总结】盐类水解的规律——判断盐溶液酸碱性的方法
盐类水解的规律
任务一:盐溶液的酸碱性及其原因
盐溶液
水解的离子
酸碱性
Na2SO4
无
中性
Cu(NO3)2
Cu2+
酸性
NaClO
ClO-
碱性
NaHSO4
无
酸性
KAl(SO4)2
Al3+
酸性
NaHCO3
碱性
【应用体验】根据所学知识判断下列盐溶液中水解的离子及溶液的酸碱性
任务一:盐溶液的酸碱性及其原因
【评价训练】1.正误判断
(1)盐类水解的实质是促进水的电离,使水的电离平衡右移
(2)酸式盐溶液可能呈酸性,也可能呈碱性
(3)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同
CH3COO- +H2O CH3COOH + OH-
NH4++H2O NH3·H2O+H+
?
CH3COONa溶液呈碱性,其中OH-全部来自水的电离,
根据水的离子积常数,c(OH-)=10-1410-10 mol·L-1=10-4 mol·L-1。
?
NH4Cl溶液呈酸性,其中H+全部来自水的电离,
c(H+)=10-4 mol·L-1。
酸式盐要根据电离和水解程度分析溶液的酸碱性。
√
√
√
任务一:盐溶液的酸碱性及其原因
【评价训练】2.Na2CO3的水解情况与CH3COONa类似,由于H2CO3是二元酸,Na2CO3的水解复杂一些,请运用CH3COONa的水解情况,分析Na2CO3溶液中存在哪些微粒?
第一步
H2O ? OH- + H+
Na2CO3===2Na++ CO32?
?
+
第二步
生成的HCO3?进一步发生水解
?
CO32?+H2O ? OH-+HCO3?
?
HCO3?
?
HCO3?+H2O ?OH-+H2CO3
?
分子:H2O 、H2CO3
离子: Na+、 ?????????????????、??????????????????、 OH-、 H+
?
任务一:盐溶液的酸碱性及其原因
【评价训练】3.(1)怎样用最简单的方法区别NaCl溶液、NH4Cl溶液和Na2CO3溶液?
(2)怎样证明Na2CO3溶液呈碱性是由CO32?水解引起的?
?
向Na2CO3溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去,可说明Na2CO3溶液呈碱性是由CO32?水解引起的。
?
将三种溶液各取少许于试管中,分别滴入紫色石蕊溶液,溶液不变色的为NaCl溶液,变红色的为NH4Cl溶液,变蓝色的为Na2CO3溶液。
任务一:盐溶液的酸碱性及其原因
【评价训练】4.常温下,某浓度的NH4Cl溶液的pH为4,回答下列问题:
(1)该NH4Cl溶液中含氮元素的微粒有_______________。
(2)该NH4Cl溶液中c水(H+)与pH=4的盐酸中c水(H+)比值为______。
????????????+、????????????·?????????????
?
NH4++H2O NH3·H2O+H+
?
pH=4的NH4Cl溶液中水电离的c水(H+)=10-4 mol·L-1
pH=4的盐酸中水电离的c水(H+)=10-10 mol·L-1
106
任务一:盐溶液的酸碱性及其原因
(2)一般水解程度较小,水解产物很少,通常不生成气体和沉淀,不写“↑”或“↓”,不稳定的生成物如H2CO3、NH3·H2O也不写分解产物。
(4)多元弱碱盐分步水解,但不分步书写方程式,一步书写到位。
(3)多元弱酸盐分步水解,第一步为主,水解方程式通常只写第一步。
阴(阳)离子+H2O ? 弱酸(或弱碱)+OH-(或H+)
(1)盐类水解是可逆反应,反应方程式要写可逆符号“?”。
【方法导引】盐类水解方程式的书写
任务二:盐类水解方程式的书写
【模型搭建】分类书写盐类水解离子方程式
(1)一元弱酸(碱)盐的水解
①NaClO: ;
②(NH4)2SO4: 。
(2)多元弱酸强碱盐(正盐)
①Na2CO3: 、 ;
②Na2S: 、 。
ClO-+H2O HClO+OH-
任务二:盐类水解方程式的书写
(3)多元弱碱强酸盐
AlCl3: 。
(4)弱酸弱碱盐中阴、阳离子水解相互促进
①CH3COONH4: ;
②Al2S3: 。
2.用化学用语表示NaHCO3溶液中可能存在的平衡:
____________________________________________________________;
____________________________________________________________。
Al3++3H2O Al(OH)3+3H+
Al2S3+6H2O===2Al(OH)3↓+3H2S↑
任务二:盐类水解方程式的书写
【评价训练】1.下列属于水解方程式且正确的打“√”,不属于水解方程式或水解方程式错误的打“×”。
CO32?+H2O OH-+HCO3?
?
HS-+H2O OH-+ H2S
×
×
×
√
√
不属于水解方程式
Mg2++2H2O 2H++Mg(OH)2
×
×
任务二:盐类水解方程式的书写
【归纳总结】水解方程式正误判断方法
②单一离子水解要用“ ”连接,一般无“↑”、“↓”;少数水解完全的反应,书写时用“===”连接,可标“↓”或“↑”符号。
③多元弱酸根离子水解分步书写,多元弱碱阳离子水解一步写出。
(1)符不符(是否符合反应事实):
(2)平不平(电荷守恒、元素守恒):
①要注意区分水解和电离过程,防止混淆电离方程式和水解方程式。
①电荷守恒:方程式左右两边离子的电荷总数相等。
②元素守恒:反应前后各元素的原子个数相等。
任务二:盐类水解方程式的书写
任务三:电解质溶液中电荷守恒与元素守恒
如Na2CO3溶液中存在的微粒有______________________________,
其电荷守恒有____________________________________________。
(1)含义:
阳离子所带正电荷总数 =阴离子所带负电荷总数
电解质溶液呈电中性。
(2)应用:
注意:阴阳离子写两边、系数电荷要一致。
Na+、CO32?、H+、OH-、HCO3?
?
c(Na+)+c(H+)=c(OH-)+c(HCO3?)+2c(CO32?)
?
【模型搭建】1.电荷守恒
c(Na+)=2[c(H2CO3)+c(CO32??)+c(HCO3??)]
?
在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化。离子所含的某种元素在变化前后是守恒的,即元素守恒。
则其元素守恒关系有:______________________________________。
如Na2CO3溶液中,由于CO32?水解,含碳微粒有:_________________________________,
?
CO32??、HCO3??、H2CO3
?
n(Na)∶n(C)=2∶1
(1)含义:
【模型搭建】2.元素守恒
(2)应用:
任务三:电解质溶液中电荷守恒与元素守恒
【评价训练】写出下列两种溶液中的电荷守恒及元素守恒
1.CH3COONa溶液中:
(1)电荷守恒:_______________________________________;
(2)元素守恒:_______________________________________;
(3)pH=5的CH3COOH与CH3COONa混合溶液中电荷守恒:
_______________________________________。
2.碳酸氢钠溶液中:
(1)电荷守恒:______________________________________________;
(2)元素守恒:_______________________________________________。
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
c(Na+)=c(CH3COO-)+c(CH3COOH)
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
c(Na+)+c(H+)=c(OH-)+c(HCO3?)+2c(CO32?)
?
c(Na+)=c(HCO3?)+c(CO32?)+c(H2CO3)
?
任务三:电解质溶液中电荷守恒与元素守恒
本课结束
今日作业
第三章 第三节 第1课时 盐类水解原理
