3.3.3 盐类水解的应用-【精讲课】(共16张PPT)高二化学同步教学优质课件(人教版2019选择性必修1)
文档属性
| 名称 | 3.3.3 盐类水解的应用-【精讲课】(共16张PPT)高二化学同步教学优质课件(人教版2019选择性必修1) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-30 00:00:00 | ||
图片预览






文档简介
第三章 第三节 盐类的水解
四川省双流棠湖中学 海棠化学备课组
第3课时 盐类水解的应用
1.了解盐类水解在生产生活、化学实验、科学研究中的应用(重点)。
2.会分析盐溶液的酸碱性及主要微粒浓度的大小关系(难点)。
3.能够对盐类水解的知识进行拓展迁移,解决盐类水解问题。
核心素养学习目标
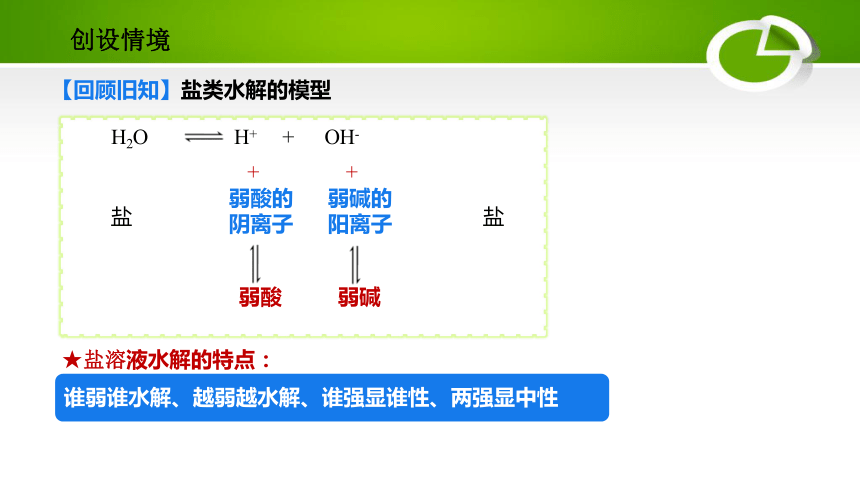
创设情境
H2O H+ + OH-
弱酸的
阴离子
弱碱的
阳离子
+
弱酸
+
弱碱
盐
盐
【回顾旧知】盐类水解的模型
谁弱谁水解、越弱越水解、谁强显谁性、两强显中性
★盐溶液水解的特点:
(3)解释碳酸氢钠溶液显碱性的原因__________________________________
_____________________________________________________________________________________________________________________________________。
【应用1】判断盐溶液的酸碱性
Fe 3++3H2O Fe(OH)3 + 3H +
Fe3+水解使溶液呈酸性。
(2)已知三种弱酸的酸性:HX>HY>HZ,相同浓度的NaX、NaY、NaZ溶液的pH大小关系为 。
pH(NaZ)>pH(NaY)>pH(NaX)
HCO3??+H2O H2CO3+OH-,还存在电离平衡: HCO3? H++ CO32? ,
?
存在HCO3?的水解平衡:
?
(1) Fe2(SO4)3溶液的酸碱性。
HCO3?的水解程度大于其电离程度,溶液中c(OH-)>c(H+),故溶液显碱性
?
Ka(HX)>Ka(HY)>Ka(HZ)
c(OH-):NaZ> NaY> NaX
Kh(X-)< Kh(Y-)< Kh(Z-)
Ka· Kh =Kw
?
任务一:化学实验中与盐类水解有关的问题
(1) NH4Cl溶液中各离子浓度的大小顺序:__________________________。
【应用2】分析盐溶液中各离子浓度的大小关系
水解:NH4++H2O ? NH3·H2O + H+ (次要)
?
电离:NH4Cl === NH4+?+ Cl-(主要)
?
NH4+?、 Cl- 、 H+ 、 OH-
?
一般离子水解程度微弱, H2O电离极微弱
1、分析盐溶液的变化
2、找出盐溶液中存在的离子
3、分清主次,比较离子浓度大小
(2) CHCOONa溶液中各离子浓度的大小顺序:_______________________ ___。
c(Na+)>c(CHCOO-)>c(OH-)>c(H+)
任务一:化学实验中与盐类水解有关的问题
【思考交流】MgO可除去MgCl2溶液中Fe3+,其原理是什么?
Fe3++3H2O ??Fe(OH)3+3H+,
?
加入MgO能和H+反应,使c(H+)减小,水解平衡右移,生成Fe(OH)3沉淀除去。
(2)贮存Na2CO3溶液不能用____玻璃塞,原因是___________________。
Na2CO3水解溶液呈碱性
磨口
CO32??+H2O ? HCO3??+ OH-
?
SiO2 + 2OH- === SiO32? +H2O
?
【应用3】配制或贮存易水解的盐溶液
(1)实验室配制Fe2(SO4)3溶液时,常将Fe2(SO4)3晶体溶于较浓的 中,然后再用水稀释到所需的浓度,目的是_________________________________
___________________。
硫酸
通过增大溶液中H+的浓度来抑制
抑制Fe3+的水解
任务一:化学实验中与盐类水解有关的问题
(1)实验室将MgCl2·6H2O加热脱水制无水MgCl2时,需在HCl气氛中进行(如图所示),
(2)用TiCl4制备TiO2,其反应的化学方程式为_____________________________
,加入大量水,同时加热的目的是_____________________,所得
TiO2·xH2O焙烧得到TiO2。
请解释原因:___________________________________________________
。
TiCl4+(x+2)H2O===TiO2·xH2O↓
+4HCl
MgCl2·6H2O在加热脱水时会发生水解反应:
MgCl2+2H2O ?Mg(OH)2+2HCl,通入HCl可以抑制MgCl2的水解
促使水解趋于完全
【应用4】制备无机化合物
任务一:化学实验中与盐类水解有关的问题
盐
原物质
蒸干灼烧后固体物质
强酸弱碱盐
AlCl3
蒸干得Al(OH)3,灼烧得Al2O3。
CuSO4
蒸干得CuSO4 (s)
【应用5】盐溶液蒸干灼烧后所得产物的判断
受热易分解
Ca(HCO3)2
CaCO3或CaO
NaHCO3
Na2CO3
KMnO4
K2MnO4和MnO2
NH4Cl
分解为NH3和HCl,无固体物质存在
强还原性
Na2SO3
Na2SO4
FeSO4
Fe2 (SO4)3
任务一:化学实验中与盐类水解有关的问题
【评价训练】1.FeCl3饱和溶液,加热蒸干并灼烧,为什么得到的是Fe2O3固体而不是FeCl3固体?
最终反应完全生成Fe(OH)3,Fe(OH)3进一步分解得到Fe2O3
FeCl3 + 3H2O ? Fe(OH)3 + 3HCl
水解吸热,加热可以促进Fe3+的水解,
同时生成的HCl加热后不断挥发,也可促进Fe3+的水解。
2.将Fe2(SO4)3溶液加热蒸干,为什么得到的是Fe2(SO4)3固体而不是Fe2O3固体?
Fe2(SO4)3+6H2O ? 2Fe(OH)3+3H2SO4
H2SO4是难挥发性酸,蒸干过程中浓度增大,其又与Fe(OH)3反应生成了
Fe2(SO4)3,最终得到无水Fe2(SO4)3
任务一:化学实验中与盐类水解有关的问题
【应用1】泡沫灭火器原理
泡沫灭火器中药品的主要成分为NaHCO3与Al2(SO4)3,在使
用时为何能迅速产生大量泡沫灭火?
HCO3? + H2O ? H2CO3 + OH-
?
Al3+ + 3H2O ? Al(OH)3 + 3H+
Al3+ + 3HCO3? === Al(OH)3↓+ 3CO2↑
?
混合后,OH-与H+中和,促进水解,水解平衡向右移动,以致生成大量的CO2, CO2将胶状Al(OH)3吹出可形成泡沫。
混合前:
混合后:
任务二:盐类水解在生产生活中的应用
{5940675A-B579-460E-94D1-54222C63F5DA}实验步骤
向3支试管中分别加入5 mL混有少量泥土的浑浊水,然后向其中的两支试管中分别加入2 mL饱和FeCl3溶液、 2 mL 1 mol/L Al2(SO4)3溶液,振荡。把3支试管放在试管架上,静置5 min,观察并记录现象,同时进行比较。
实验现象
加入盐溶液的两支试管中的浑浊液变得澄清。
理论解释
Al3+、Fe3+易水解生成胶体,胶体具有吸附性,能吸附水中细小的悬浮颗粒聚集成较大的颗粒而沉降
离子
方程式
Al3++3H2O Al(OH)3(胶体)+3H+、
Fe3++3H2O Fe(OH)3(胶体)+3H+
【应用2】铝盐、铁盐的净水
结合离子方程式说明解释铝盐(如明矾)、铁盐(如硫酸铁)的净水原理。
任务二:盐类水解在生产生活中的应用
【应用3】化肥的使用
铵态氮肥与草木灰不能混合使用
【应用4】除锈剂
NH4Cl溶液与ZnCl2溶液可作焊接时的除锈剂
NH4++H2O NH3·H2O+H+
?
Zn2++2H2O Zn(OH)2+2H+
【应用5】热的纯碱去污能力强
(1)纯碱为什么能去油污?
(2)为什么热的纯碱去污能力强?
水解吸热,加热,促进Na2CO3的水解,使溶液中c(OH-)增大,去污能力增强。
油污的主要成分是 物质,溶液碱性越强,酯类物质越易 生成易溶于水的高级脂肪酸盐和甘油而洗去。
CO32?+ H2O ? HCO3?+ OH-
?
酯类
水解
任务二:盐类水解在生产生活中的应用
广义的水解产物判断
广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是参与反应的物质和水分别离解成两部分,再重新组合成新的物质。
拓展延伸
(1)金属氮化物、磷化物
Li3N +3H2O===_______________
Ca3P2+6H2O===_________________
AlP+3H2O===_________________
(2)金属碳化物
CaC2+2H2O===_________________
Al4C3+12H2O===____________________
Mg2C3+4H2O===____________________
3LiOH+NH3↑
3Ca(OH)2+2PH3↑
Al(OH)3↓+PH3↑
Ca(OH)2+C2H2↑
4Al(OH)3↓+3CH4↑
2Mg(OH)2↓+C3H4↑
拓展延伸
(3)卤素互化物
IBr+H2O===___________
IF5+3H2O===__________
(4)非金属元素的卤化物
BCl3+3H2O===_____________
PCl3+3H2O===______________
SiCl4+4H2O===________________
(5)亚硫酰氯(SOCl2)遇到潮湿的空气,立即产生刺激性气味的气体和大量白雾,写出亚硫酰氯与水反应的化学方程式: 。
HIO+HBr
HIO3+5HF
H3BO3+3HCl
H3PO3+3HCl
H4SiO4↓+4HCl
SOCl2+H2O===SO2↑+2HCl
拓展延伸
本课结束
今日作业
第三章 第三节 第2课时 影响盐类水解的因素
四川省双流棠湖中学 海棠化学备课组
第3课时 盐类水解的应用
1.了解盐类水解在生产生活、化学实验、科学研究中的应用(重点)。
2.会分析盐溶液的酸碱性及主要微粒浓度的大小关系(难点)。
3.能够对盐类水解的知识进行拓展迁移,解决盐类水解问题。
核心素养学习目标
创设情境
H2O H+ + OH-
弱酸的
阴离子
弱碱的
阳离子
+
弱酸
+
弱碱
盐
盐
【回顾旧知】盐类水解的模型
谁弱谁水解、越弱越水解、谁强显谁性、两强显中性
★盐溶液水解的特点:
(3)解释碳酸氢钠溶液显碱性的原因__________________________________
_____________________________________________________________________________________________________________________________________。
【应用1】判断盐溶液的酸碱性
Fe 3++3H2O Fe(OH)3 + 3H +
Fe3+水解使溶液呈酸性。
(2)已知三种弱酸的酸性:HX>HY>HZ,相同浓度的NaX、NaY、NaZ溶液的pH大小关系为 。
pH(NaZ)>pH(NaY)>pH(NaX)
HCO3??+H2O H2CO3+OH-,还存在电离平衡: HCO3? H++ CO32? ,
?
存在HCO3?的水解平衡:
?
(1) Fe2(SO4)3溶液的酸碱性。
HCO3?的水解程度大于其电离程度,溶液中c(OH-)>c(H+),故溶液显碱性
?
Ka(HX)>Ka(HY)>Ka(HZ)
c(OH-):NaZ> NaY> NaX
Kh(X-)< Kh(Y-)< Kh(Z-)
Ka· Kh =Kw
?
任务一:化学实验中与盐类水解有关的问题
(1) NH4Cl溶液中各离子浓度的大小顺序:__________________________。
【应用2】分析盐溶液中各离子浓度的大小关系
水解:NH4++H2O ? NH3·H2O + H+ (次要)
?
电离:NH4Cl === NH4+?+ Cl-(主要)
?
NH4+?、 Cl- 、 H+ 、 OH-
?
一般离子水解程度微弱, H2O电离极微弱
1、分析盐溶液的变化
2、找出盐溶液中存在的离子
3、分清主次,比较离子浓度大小
(2) CHCOONa溶液中各离子浓度的大小顺序:_______________________ ___。
c(Na+)>c(CHCOO-)>c(OH-)>c(H+)
任务一:化学实验中与盐类水解有关的问题
【思考交流】MgO可除去MgCl2溶液中Fe3+,其原理是什么?
Fe3++3H2O ??Fe(OH)3+3H+,
?
加入MgO能和H+反应,使c(H+)减小,水解平衡右移,生成Fe(OH)3沉淀除去。
(2)贮存Na2CO3溶液不能用____玻璃塞,原因是___________________。
Na2CO3水解溶液呈碱性
磨口
CO32??+H2O ? HCO3??+ OH-
?
SiO2 + 2OH- === SiO32? +H2O
?
【应用3】配制或贮存易水解的盐溶液
(1)实验室配制Fe2(SO4)3溶液时,常将Fe2(SO4)3晶体溶于较浓的 中,然后再用水稀释到所需的浓度,目的是_________________________________
___________________。
硫酸
通过增大溶液中H+的浓度来抑制
抑制Fe3+的水解
任务一:化学实验中与盐类水解有关的问题
(1)实验室将MgCl2·6H2O加热脱水制无水MgCl2时,需在HCl气氛中进行(如图所示),
(2)用TiCl4制备TiO2,其反应的化学方程式为_____________________________
,加入大量水,同时加热的目的是_____________________,所得
TiO2·xH2O焙烧得到TiO2。
请解释原因:___________________________________________________
。
TiCl4+(x+2)H2O===TiO2·xH2O↓
+4HCl
MgCl2·6H2O在加热脱水时会发生水解反应:
MgCl2+2H2O ?Mg(OH)2+2HCl,通入HCl可以抑制MgCl2的水解
促使水解趋于完全
【应用4】制备无机化合物
任务一:化学实验中与盐类水解有关的问题
盐
原物质
蒸干灼烧后固体物质
强酸弱碱盐
AlCl3
蒸干得Al(OH)3,灼烧得Al2O3。
CuSO4
蒸干得CuSO4 (s)
【应用5】盐溶液蒸干灼烧后所得产物的判断
受热易分解
Ca(HCO3)2
CaCO3或CaO
NaHCO3
Na2CO3
KMnO4
K2MnO4和MnO2
NH4Cl
分解为NH3和HCl,无固体物质存在
强还原性
Na2SO3
Na2SO4
FeSO4
Fe2 (SO4)3
任务一:化学实验中与盐类水解有关的问题
【评价训练】1.FeCl3饱和溶液,加热蒸干并灼烧,为什么得到的是Fe2O3固体而不是FeCl3固体?
最终反应完全生成Fe(OH)3,Fe(OH)3进一步分解得到Fe2O3
FeCl3 + 3H2O ? Fe(OH)3 + 3HCl
水解吸热,加热可以促进Fe3+的水解,
同时生成的HCl加热后不断挥发,也可促进Fe3+的水解。
2.将Fe2(SO4)3溶液加热蒸干,为什么得到的是Fe2(SO4)3固体而不是Fe2O3固体?
Fe2(SO4)3+6H2O ? 2Fe(OH)3+3H2SO4
H2SO4是难挥发性酸,蒸干过程中浓度增大,其又与Fe(OH)3反应生成了
Fe2(SO4)3,最终得到无水Fe2(SO4)3
任务一:化学实验中与盐类水解有关的问题
【应用1】泡沫灭火器原理
泡沫灭火器中药品的主要成分为NaHCO3与Al2(SO4)3,在使
用时为何能迅速产生大量泡沫灭火?
HCO3? + H2O ? H2CO3 + OH-
?
Al3+ + 3H2O ? Al(OH)3 + 3H+
Al3+ + 3HCO3? === Al(OH)3↓+ 3CO2↑
?
混合后,OH-与H+中和,促进水解,水解平衡向右移动,以致生成大量的CO2, CO2将胶状Al(OH)3吹出可形成泡沫。
混合前:
混合后:
任务二:盐类水解在生产生活中的应用
{5940675A-B579-460E-94D1-54222C63F5DA}实验步骤
向3支试管中分别加入5 mL混有少量泥土的浑浊水,然后向其中的两支试管中分别加入2 mL饱和FeCl3溶液、 2 mL 1 mol/L Al2(SO4)3溶液,振荡。把3支试管放在试管架上,静置5 min,观察并记录现象,同时进行比较。
实验现象
加入盐溶液的两支试管中的浑浊液变得澄清。
理论解释
Al3+、Fe3+易水解生成胶体,胶体具有吸附性,能吸附水中细小的悬浮颗粒聚集成较大的颗粒而沉降
离子
方程式
Al3++3H2O Al(OH)3(胶体)+3H+、
Fe3++3H2O Fe(OH)3(胶体)+3H+
【应用2】铝盐、铁盐的净水
结合离子方程式说明解释铝盐(如明矾)、铁盐(如硫酸铁)的净水原理。
任务二:盐类水解在生产生活中的应用
【应用3】化肥的使用
铵态氮肥与草木灰不能混合使用
【应用4】除锈剂
NH4Cl溶液与ZnCl2溶液可作焊接时的除锈剂
NH4++H2O NH3·H2O+H+
?
Zn2++2H2O Zn(OH)2+2H+
【应用5】热的纯碱去污能力强
(1)纯碱为什么能去油污?
(2)为什么热的纯碱去污能力强?
水解吸热,加热,促进Na2CO3的水解,使溶液中c(OH-)增大,去污能力增强。
油污的主要成分是 物质,溶液碱性越强,酯类物质越易 生成易溶于水的高级脂肪酸盐和甘油而洗去。
CO32?+ H2O ? HCO3?+ OH-
?
酯类
水解
任务二:盐类水解在生产生活中的应用
广义的水解产物判断
广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是参与反应的物质和水分别离解成两部分,再重新组合成新的物质。
拓展延伸
(1)金属氮化物、磷化物
Li3N +3H2O===_______________
Ca3P2+6H2O===_________________
AlP+3H2O===_________________
(2)金属碳化物
CaC2+2H2O===_________________
Al4C3+12H2O===____________________
Mg2C3+4H2O===____________________
3LiOH+NH3↑
3Ca(OH)2+2PH3↑
Al(OH)3↓+PH3↑
Ca(OH)2+C2H2↑
4Al(OH)3↓+3CH4↑
2Mg(OH)2↓+C3H4↑
拓展延伸
(3)卤素互化物
IBr+H2O===___________
IF5+3H2O===__________
(4)非金属元素的卤化物
BCl3+3H2O===_____________
PCl3+3H2O===______________
SiCl4+4H2O===________________
(5)亚硫酰氯(SOCl2)遇到潮湿的空气,立即产生刺激性气味的气体和大量白雾,写出亚硫酰氯与水反应的化学方程式: 。
HIO+HBr
HIO3+5HF
H3BO3+3HCl
H3PO3+3HCl
H4SiO4↓+4HCl
SOCl2+H2O===SO2↑+2HCl
拓展延伸
本课结束
今日作业
第三章 第三节 第2课时 影响盐类水解的因素
