3.4.2 沉淀溶解平衡的应用-【精讲课】(共33张PPT)高二化学同步教学优质课件(人教版2019选择性必修1)
文档属性
| 名称 | 3.4.2 沉淀溶解平衡的应用-【精讲课】(共33张PPT)高二化学同步教学优质课件(人教版2019选择性必修1) |

|
|
| 格式 | pptx | ||
| 文件大小 | 116.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-30 18:51:12 | ||
图片预览









文档简介
第2课时 沉淀溶解平衡的应用
第三章 第四节 沉淀溶解平衡
核心素养学习目标
1.了解沉淀的生成、溶解和转化在工、农业生产中的应用,能运用化学平衡理论分析沉淀的生成、溶解和转化。
2.学会从定量的角度分析沉淀的生成与转化的条件。
创设情境
【视频引入】美丽的沉淀
任务一:沉淀的生成
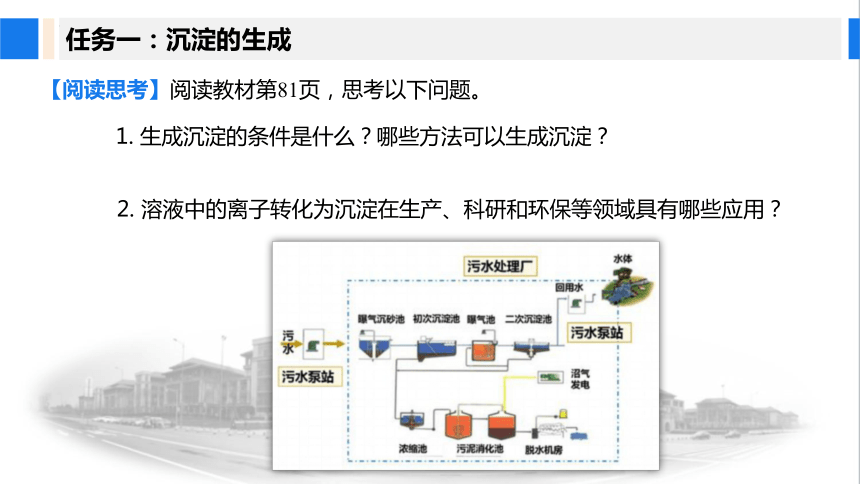
【阅读思考】阅读教材第81页,思考以下问题。
2. 溶液中的离子转化为沉淀在生产、科研和环保等领域具有哪些应用?
1. 生成沉淀的条件是什么?哪些方法可以生成沉淀?
1.沉淀生成的应用
工业废水的处理
无机物的制备和提纯、废水处理等领域。
利用生成沉淀来分离物质或除去某些杂质离子。
锅炉内部水垢的处理
【阅读总结】
应用:
目的:
(1)要使生成沉淀的反应能够发生(Q>Ksp)。
(2)沉淀反应完成后,溶液中剩余离子的浓度能够尽量小。
2.利用生成沉淀分离或除去某些离子的原则
任务一:沉淀的生成
【思考交流】
将4×10-3 mol·L-1的AgNO3溶液与4×10-3 mol·L-1的NaCl溶液等体积混合能否有沉淀析出?[Ksp(AgCl)= 1.8×10-10]
等体积混合后,c(Ag+)= c(Cl-)= 2 ×10-3 mol·L-1
Q (AgCl)= c(Ag+)· c(Cl-)= 4 ×10-6
> Ksp(AgCl)= 1.8×10-10
有沉淀生成
等体积混合后,c(Ag+)= c(Cl-)= 2 ×10-3 mol·L-1
有沉淀生成
任务一:沉淀的生成
【探究学习】沉淀生成的方法
(1)调节pH法
工业原料氯化铵中含有杂质氯化铁,除杂流程如下:
①写出调pH步骤中发生反应的离子方程式:
___________________________________________。
任务一:沉淀的生成
②调pH除铁时,当溶液中c(Fe3+)=10-5 mol·L-1时可认为Fe3+沉淀完全,计算恰好完全沉淀时溶液的pH=________。为使Fe3+完全沉淀,常采取的措施为____________________。
已知:Ksp[Fe(OH)3]≈1×10-39。
= c(Fe3+)· c3(OH-)= 10-5 · c3(OH-)
c(OH-) ≈ 10 -11.3 mol·L-1
2.7
调节溶液的pH大于2.7
增大c(OH-)
Kw=1×10-14 = c(H+)· c(OH-)
c(H+)= 10 -2.7 mol·L-1
pH=-lg c(H+)=-lg 10-2.7=2.7
【探究学习】沉淀生成的方法
(1)调节pH法
任务一:沉淀的生成
③调pH时能否用NaOH溶液,简述理由:_____________________________________________。
不能,引入杂质离子Na+
FeCl3 +3NH3·H2O===Fe(OH)3↓+3NH4Cl
FeCl3 +3NaOH===Fe(OH)3↓+3NaCl
【探究学习】沉淀生成的方法
(1)调节pH法
任务一:沉淀的生成
①工业废水中的Cu2+、Hg2+可选用Na2S、H2S除去的原因是______________________________________________________。
生成的CuS、HgS极难溶,使废水中Cu2+、Hg2+浓度降得很低
②分别写出除杂原理的离子方程式。
H2S除去Cu2+: ;
Na2S除去Hg2+: 。
H2S+Cu2+===CuS↓+2H+
Hg2++S2-===HgS↓
【探究学习】沉淀生成的方法
(2)加沉淀剂法
任务一:沉淀的生成
【归纳总结】化学沉淀法废水处理工艺流程图
任务一:沉淀的生成
(1)要除去溶液中的 ,选择加入可溶性钙盐比钡盐效果好
(2)向MgCl2溶液、AlCl3溶液中分别滴加NaOH溶液至过量,
前者生成白色沉淀,后者先生成沉淀,后沉淀溶解
(3)纳米铁粉可用于除去工业废水中的Hg2+、Pb2+、Cd2+、Cu2+等重金属离子
(4)除去MgCl2溶液中的Fe2+,可直接加入氨水调pH即可
×
√
√
×
【评价训练】1.正误判断
任务一:沉淀的生成
2.已知常温下,CuCO3、Cu(OH)2、CuS的Ksp分别为1.4×10-10、2.2×10-20、6.3×10-36。要除去溶液中的Cu2+,选用下列哪种沉淀剂更好?为什么?
①Na2CO3 ②NaOH ③Na2S
选用Na2S更好。
原因是CuS的Ksp最小,Cu2+沉淀的更完全,溶液中剩余的Cu2+最少。
【评价训练】
任务一:沉淀的生成
3.如果有人误服Ba2+,去医院洗胃时需要用较大量的5%的Na2SO4溶液,已知5%的Na2SO4溶液中SO42??的物质的量浓度近似为0.35 mol·L-1,BaSO4的Ksp为1.1×10-10,试计算5%的Na2SO4溶液能不能有效的除去胃中的Ba2+。
?
c(Ba2+) = ????sp?(BaSO4)????(SO42?)?= 1.1×10-100.35mol·L?1≈3.1×10-10 mol·L-1
?
< 1×10-5 mol·L-1
?
5%的Na2SO4溶液能有效的除去胃中的Ba2+。
【评价练习】
任务一:沉淀的生成
【思维提升】
①一般来说,当溶液中有多种可以沉淀的离子且生成相同类型的沉淀时,越难溶(Ksp越小)的越先沉淀。
②当离子浓度小于1×10-5 mol·L-1时,认为该离子已完全沉淀。
③除杂时不能引入新的杂质离子。
【交流讨论】
石灰岩里不溶性的碳酸钙与水及二氧化碳反应能转化为微溶性的碳酸氢钙。溶有碳酸氢钙的水从溶洞顶向下滴落时,水分蒸发、二氧化碳压强减小及温度的变化都会使二氧化碳溶解量减小,致使碳酸钙沉淀析出。这些沉淀经过千百万年的积聚,渐渐形成了钟乳石、石笋等。请从沉淀溶解平衡的角度解释溶洞的形成。
CaCO3+CO2+H2O===Ca(HCO3)2
Ca(HCO3)2===CaCO3↓+CO2↑+H2O
CaCO3 (s)? Ca2+ (aq) + CO32? (aq)
?
沉淀溶解
+
CO2+H2O
?
2HCO3?
?
沉淀生成
任务二:沉淀的溶解
任务二:沉淀的溶解
根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。
1.沉淀溶解的原理
【阅读总结】阅读教材第82页。
2.应用举例
CaCO3难溶于水,却易溶于盐酸,解释碳酸钙溶于盐酸的原因。
消耗了平衡体系中的CO32? ,使c(CO32? )降低,
溶液中Q(CaCO3)<Ksp(CaCO3),平衡向沉淀溶解的方向移动。
?
水中存在沉淀溶解平衡:CaCO3(s)?Ca2+(aq)+ CO32? (aq),
?
加入盐酸: CO32? +2H+===H2O+CO2↑,
?
{5940675A-B579-460E-94D1-54222C63F5DA}操作
现象
①浑浊;②缓慢澄清;③澄清
理论
分析
Mg(OH)2(s)?Mg2+(aq)+2OH- (aq)
2NH4Cl===2Cl-+2NH4+
?
2HCl === 2Cl-+2H+
+
2H2O
?
2NH3·H2O
+
?
Mg(OH)2(s)不断向沉淀溶解的方向移动,最终完全溶解。
【实验探究】Mg(OH)2沉淀的溶解。
任务二:沉淀的溶解
(1)FeS、Al(OH)3、Cu(OH)2均可溶于盐酸
(2)为了减少BaSO4的损失,洗涤BaSO4沉淀时可用稀硫酸代替水
(3)CaCO3溶解时常用盐酸而不用稀硫酸,是因为稀硫酸不与CaCO3反应
√
√
×
CaSO4微溶,覆盖在表面阻止反应
【评价训练】1.正误判断
任务二:沉淀的溶解
沉淀溶解平衡:
Mg(OH)2(s)?Mg2+(aq)+2OH- (aq)
2NH4Cl===2Cl-+2NH4+
?
+
2NH3·H2O
?
c(OH-)不断减小
Q[Mg(OH)2]<Ksp[Mg(OH)2]
平衡向沉淀溶解的方向移动
直至Mg(OH)2完全溶解
加盐溶液溶解沉淀
【评价训练】2.(1)应用平衡移动原理,解释为什么Mg(OH)2能溶于NH4Cl溶液?
任务二:沉淀的溶解
BaCO3 (s) ? Ba2 +(aq) + CO32??(aq)
?
胃酸中:HCl === Cl? + H+
?
人体重金属中毒
c(CO32?)降低
?
BaSO4 和BaCO3的沉淀溶解平衡分别为:
BaSO4 (s) ? Ba2+(aq) + SO42? (aq)
?
BaCO3的沉淀溶解平衡向右移动
c(Ba2+)增大
SO42?不与H+反应,对沉淀溶解无影响。
?
加酸溶解沉淀
+
CO2+H2O
?
【评价训练】2.(2)BaCO3和BaSO4都难溶于水,在医学上常用BaSO4作钡餐透视, 而不能用BaCO3的原因是什么?
任务二:沉淀的溶解
(1)“沉淀Ⅰ”步骤中发生的反应有___________________、________________。
(2)AgCl可溶于4 mol·L-1的氨水,原因是生成配离子[Ag(NH3)2]+,写出该反应的离子方程式:______________________________________________。
Ag++Cl-===AgCl↓
Ag++I-===AgI↓
AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O
形成配合物溶解沉淀
【评价训练】3.(2023·湖北黄冈高二期中)从含Cl-和I-的混合溶液中得到AgCl和AgI的流程如图:
任务二:沉淀的溶解
(3)已知[Ag(NH3)2]+ Ag++2NH3,“沉淀Ⅱ”步骤中能否用盐酸代替硝酸,简述理由:_______________________________________________________
_________________________________________________________________。
能用盐酸代替硝酸,H+与[Ag(NH3)2]+电离的NH3反应使溶液中c(Ag+)增大,Q(AgCl)>Ksp(AgCl),重新产生AgCl沉淀
任务二:沉淀的溶解
【归纳总结】
任务二:沉淀的溶解
任务三:沉淀的转化
实验
操作
?
实验
现象
有白色沉淀析出
白色沉淀转化为
黄色沉淀
黄色沉淀转化为
黑色沉淀
离子
方程式
Ag++Cl-===AgCl↓
AgCl(s) +I-(aq)
?AgI(s) +Cl-(aq)
2AgI(s) +S2- (aq)
? Ag2S(s) +2I-(aq)
【实验探究】(1)实验探究AgCl、AgI、Ag2S的转化。
【视频导学】
溶解度的大小顺序:AgCl>AgI>Ag2S
Ksp的大小顺序:Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S)
【思考讨论】①通过上述实验,你能比较出AgCl、AgI、Ag2S三者溶解度的大小及Ksp的大小顺序吗?
②已知常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,试应用平衡移动原理解释为什么AgCl能转化成AgI?写出该沉淀转化反应的离子方程式。
I-(aq)+AgCl(s) ? AgI(s)+Cl-(aq)
任务三:沉淀的转化
实验操作
?
实验现象
产生白色沉淀
白色沉淀转化为红褐色沉淀
离子方程式
Mg2++2OH-===Mg(OH)2↓
3Mg(OH)2(s)+2Fe3+ (aq) ? 2Fe(OH)3(s)+3Mg2+(aq)
【实验探究】(2)实验探究Mg(OH)2与Fe(OH)3的转化。
【视频导学】
任务三:沉淀的转化
当向Mg(OH)2沉淀中加入FeCl3溶液时,溶液中OH-与Fe3+的离子积——Q[Fe(OH)3]>Ksp[Fe(OH)3],因此,Fe3+与OH-结合生成Fe(OH)3沉淀,导致Mg(OH)2的沉淀溶解平衡向溶解的方向移动,直至建立新的沉淀溶解平衡:
如果加入足量的FeCl3溶液,上述过程可以继续进行,直至绝大部分Mg(OH)2沉淀转化为Fe(OH)3沉淀。
【思考讨论】已知:Ksp[Mg(OH)2]=5.6×10-12,Ksp[Fe(OH)3]=2.8×10-39,试应用平衡移动原理解释为什么Mg(OH)2能转化成Fe(OH)3?
任务三:沉淀的转化
沉淀溶解平衡的移动。
两种沉淀的溶解度不同。
指将一种难溶物转化为另一种难溶物的过程。
①一般来说,溶解度小的沉淀转化为溶解度更小的沉淀容易实现。
②两者的溶解度差别越大,转化越容易。
③当两种沉淀的溶解度相差不太大时,也可通过提高转化试剂的浓度实现溶解度小的沉淀转化为溶解度较大的沉淀。
【阅读总结】阅读教材第84-85页,归纳沉淀转化的实质与条件。
1、概念:
2、实质:
3、条件:
4、规律:
任务三:沉淀的转化
BaSO4(s)+CO32? (aq) ?BaCO3(aq) + SO42? (aq)
?
增大????(CO32?)浓度,就能满足Q>K,使平衡正向移动。
?
物质
BaSO4
BaCO3
Ksp
1.1×10-10
2.6×10-9
BaSO4(s) ?Ba2+(aq) + SO42? (aq)
?
K =?????(SO42?)????(CO32?)
?
=????(SO42?)·????(Ba2+)????(CO32?)·????(Ba2+)
?
=?????sp(BaSO4)????sp(BaCO3) ≈0.04
?
当Q =?????(SO42?)????(CO32?)?> K = 0.04时反应正向进行
?
CO32?
?
BaCO3(s)
+
?
任务三:沉淀的转化
【思考讨论】向BaSO4的饱和溶液中加入Na2CO3溶液,能否使BaSO4沉淀转化为BaCO3沉淀?[已知Ksp(BaSO4) < Ksp(BaCO3)]
(1)溶解度小的沉淀不能转化为溶解度比其大的沉淀
(2)向AgCl沉淀中加入KI溶液,由白色沉淀转变成黄色沉淀,
是由于Ksp(AgI)(3)可用FeS除去废水中的Hg2+、Ag+等,是因为HgS、Ag2S比FeS更难溶
×
√
√
【评价训练】1.正误判断
任务三:沉淀的转化
(1)锅炉除水垢(含有CaSO4),常温下CaCO3、CaSO4的Ksp分别为3.4×10-9、4.9×10-5,处理流程如下。
①写出沉淀转化Ⅰ的离子方程式:______________________________________________,该温度下转化的平衡常数K=________。
②沉淀溶解Ⅱ的主要化学方程式为________________________________。
1.4×104
CaCO3+2HCl===CaCl2+H2O+CO2↑
【评价训练】2.沉淀转化在工、农业生产中有广泛的应用。
任务三:沉淀的转化
(2)自然界中矿物的转化:各种原生铜的硫化物
CuSO4溶液 铜蓝(CuS)。
氧化、淋滤
渗透、遇闪锌矿(ZnS)和方铅矿(PbS)
上述沉淀转化的方程式为 、
。
(3)难溶性的FeS可用于处理工业废水中的Hg2+等重金属离子,处理Hg2+的离子方程式为 。
CuSO4+ZnS CuS+ZnSO4
CuSO4+PbS CuS+PbSO4
FeS(s)+Hg2+(aq) HgS(s)+Fe2+(aq)
【评价训练】2.沉淀转化在工、农业生产中有广泛的应用。
任务三:沉淀的转化
本课结束
今日作业
第三章 第四节 第2课时
第三章 第四节 沉淀溶解平衡
核心素养学习目标
1.了解沉淀的生成、溶解和转化在工、农业生产中的应用,能运用化学平衡理论分析沉淀的生成、溶解和转化。
2.学会从定量的角度分析沉淀的生成与转化的条件。
创设情境
【视频引入】美丽的沉淀
任务一:沉淀的生成
【阅读思考】阅读教材第81页,思考以下问题。
2. 溶液中的离子转化为沉淀在生产、科研和环保等领域具有哪些应用?
1. 生成沉淀的条件是什么?哪些方法可以生成沉淀?
1.沉淀生成的应用
工业废水的处理
无机物的制备和提纯、废水处理等领域。
利用生成沉淀来分离物质或除去某些杂质离子。
锅炉内部水垢的处理
【阅读总结】
应用:
目的:
(1)要使生成沉淀的反应能够发生(Q>Ksp)。
(2)沉淀反应完成后,溶液中剩余离子的浓度能够尽量小。
2.利用生成沉淀分离或除去某些离子的原则
任务一:沉淀的生成
【思考交流】
将4×10-3 mol·L-1的AgNO3溶液与4×10-3 mol·L-1的NaCl溶液等体积混合能否有沉淀析出?[Ksp(AgCl)= 1.8×10-10]
等体积混合后,c(Ag+)= c(Cl-)= 2 ×10-3 mol·L-1
Q (AgCl)= c(Ag+)· c(Cl-)= 4 ×10-6
> Ksp(AgCl)= 1.8×10-10
有沉淀生成
等体积混合后,c(Ag+)= c(Cl-)= 2 ×10-3 mol·L-1
有沉淀生成
任务一:沉淀的生成
【探究学习】沉淀生成的方法
(1)调节pH法
工业原料氯化铵中含有杂质氯化铁,除杂流程如下:
①写出调pH步骤中发生反应的离子方程式:
___________________________________________。
任务一:沉淀的生成
②调pH除铁时,当溶液中c(Fe3+)=10-5 mol·L-1时可认为Fe3+沉淀完全,计算恰好完全沉淀时溶液的pH=________。为使Fe3+完全沉淀,常采取的措施为____________________。
已知:Ksp[Fe(OH)3]≈1×10-39。
= c(Fe3+)· c3(OH-)= 10-5 · c3(OH-)
c(OH-) ≈ 10 -11.3 mol·L-1
2.7
调节溶液的pH大于2.7
增大c(OH-)
Kw=1×10-14 = c(H+)· c(OH-)
c(H+)= 10 -2.7 mol·L-1
pH=-lg c(H+)=-lg 10-2.7=2.7
【探究学习】沉淀生成的方法
(1)调节pH法
任务一:沉淀的生成
③调pH时能否用NaOH溶液,简述理由:_____________________________________________。
不能,引入杂质离子Na+
FeCl3 +3NH3·H2O===Fe(OH)3↓+3NH4Cl
FeCl3 +3NaOH===Fe(OH)3↓+3NaCl
【探究学习】沉淀生成的方法
(1)调节pH法
任务一:沉淀的生成
①工业废水中的Cu2+、Hg2+可选用Na2S、H2S除去的原因是______________________________________________________。
生成的CuS、HgS极难溶,使废水中Cu2+、Hg2+浓度降得很低
②分别写出除杂原理的离子方程式。
H2S除去Cu2+: ;
Na2S除去Hg2+: 。
H2S+Cu2+===CuS↓+2H+
Hg2++S2-===HgS↓
【探究学习】沉淀生成的方法
(2)加沉淀剂法
任务一:沉淀的生成
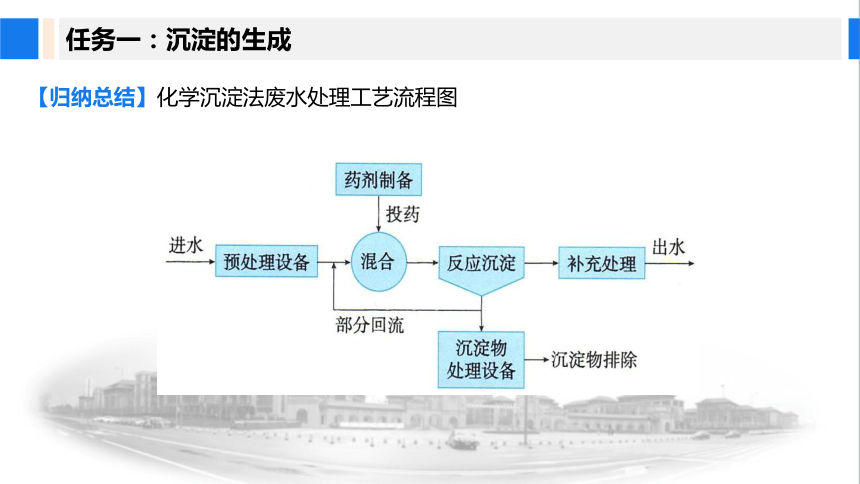
【归纳总结】化学沉淀法废水处理工艺流程图
任务一:沉淀的生成
(1)要除去溶液中的 ,选择加入可溶性钙盐比钡盐效果好
(2)向MgCl2溶液、AlCl3溶液中分别滴加NaOH溶液至过量,
前者生成白色沉淀,后者先生成沉淀,后沉淀溶解
(3)纳米铁粉可用于除去工业废水中的Hg2+、Pb2+、Cd2+、Cu2+等重金属离子
(4)除去MgCl2溶液中的Fe2+,可直接加入氨水调pH即可
×
√
√
×
【评价训练】1.正误判断
任务一:沉淀的生成
2.已知常温下,CuCO3、Cu(OH)2、CuS的Ksp分别为1.4×10-10、2.2×10-20、6.3×10-36。要除去溶液中的Cu2+,选用下列哪种沉淀剂更好?为什么?
①Na2CO3 ②NaOH ③Na2S
选用Na2S更好。
原因是CuS的Ksp最小,Cu2+沉淀的更完全,溶液中剩余的Cu2+最少。
【评价训练】
任务一:沉淀的生成
3.如果有人误服Ba2+,去医院洗胃时需要用较大量的5%的Na2SO4溶液,已知5%的Na2SO4溶液中SO42??的物质的量浓度近似为0.35 mol·L-1,BaSO4的Ksp为1.1×10-10,试计算5%的Na2SO4溶液能不能有效的除去胃中的Ba2+。
?
c(Ba2+) = ????sp?(BaSO4)????(SO42?)?= 1.1×10-100.35mol·L?1≈3.1×10-10 mol·L-1
?
< 1×10-5 mol·L-1
?
5%的Na2SO4溶液能有效的除去胃中的Ba2+。
【评价练习】
任务一:沉淀的生成
【思维提升】
①一般来说,当溶液中有多种可以沉淀的离子且生成相同类型的沉淀时,越难溶(Ksp越小)的越先沉淀。
②当离子浓度小于1×10-5 mol·L-1时,认为该离子已完全沉淀。
③除杂时不能引入新的杂质离子。
【交流讨论】
石灰岩里不溶性的碳酸钙与水及二氧化碳反应能转化为微溶性的碳酸氢钙。溶有碳酸氢钙的水从溶洞顶向下滴落时,水分蒸发、二氧化碳压强减小及温度的变化都会使二氧化碳溶解量减小,致使碳酸钙沉淀析出。这些沉淀经过千百万年的积聚,渐渐形成了钟乳石、石笋等。请从沉淀溶解平衡的角度解释溶洞的形成。
CaCO3+CO2+H2O===Ca(HCO3)2
Ca(HCO3)2===CaCO3↓+CO2↑+H2O
CaCO3 (s)? Ca2+ (aq) + CO32? (aq)
?
沉淀溶解
+
CO2+H2O
?
2HCO3?
?
沉淀生成
任务二:沉淀的溶解
任务二:沉淀的溶解
根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。
1.沉淀溶解的原理
【阅读总结】阅读教材第82页。
2.应用举例
CaCO3难溶于水,却易溶于盐酸,解释碳酸钙溶于盐酸的原因。
消耗了平衡体系中的CO32? ,使c(CO32? )降低,
溶液中Q(CaCO3)<Ksp(CaCO3),平衡向沉淀溶解的方向移动。
?
水中存在沉淀溶解平衡:CaCO3(s)?Ca2+(aq)+ CO32? (aq),
?
加入盐酸: CO32? +2H+===H2O+CO2↑,
?
{5940675A-B579-460E-94D1-54222C63F5DA}操作
现象
①浑浊;②缓慢澄清;③澄清
理论
分析
Mg(OH)2(s)?Mg2+(aq)+2OH- (aq)
2NH4Cl===2Cl-+2NH4+
?
2HCl === 2Cl-+2H+
+
2H2O
?
2NH3·H2O
+
?
Mg(OH)2(s)不断向沉淀溶解的方向移动,最终完全溶解。
【实验探究】Mg(OH)2沉淀的溶解。
任务二:沉淀的溶解
(1)FeS、Al(OH)3、Cu(OH)2均可溶于盐酸
(2)为了减少BaSO4的损失,洗涤BaSO4沉淀时可用稀硫酸代替水
(3)CaCO3溶解时常用盐酸而不用稀硫酸,是因为稀硫酸不与CaCO3反应
√
√
×
CaSO4微溶,覆盖在表面阻止反应
【评价训练】1.正误判断
任务二:沉淀的溶解
沉淀溶解平衡:
Mg(OH)2(s)?Mg2+(aq)+2OH- (aq)
2NH4Cl===2Cl-+2NH4+
?
+
2NH3·H2O
?
c(OH-)不断减小
Q[Mg(OH)2]<Ksp[Mg(OH)2]
平衡向沉淀溶解的方向移动
直至Mg(OH)2完全溶解
加盐溶液溶解沉淀
【评价训练】2.(1)应用平衡移动原理,解释为什么Mg(OH)2能溶于NH4Cl溶液?
任务二:沉淀的溶解
BaCO3 (s) ? Ba2 +(aq) + CO32??(aq)
?
胃酸中:HCl === Cl? + H+
?
人体重金属中毒
c(CO32?)降低
?
BaSO4 和BaCO3的沉淀溶解平衡分别为:
BaSO4 (s) ? Ba2+(aq) + SO42? (aq)
?
BaCO3的沉淀溶解平衡向右移动
c(Ba2+)增大
SO42?不与H+反应,对沉淀溶解无影响。
?
加酸溶解沉淀
+
CO2+H2O
?
【评价训练】2.(2)BaCO3和BaSO4都难溶于水,在医学上常用BaSO4作钡餐透视, 而不能用BaCO3的原因是什么?
任务二:沉淀的溶解
(1)“沉淀Ⅰ”步骤中发生的反应有___________________、________________。
(2)AgCl可溶于4 mol·L-1的氨水,原因是生成配离子[Ag(NH3)2]+,写出该反应的离子方程式:______________________________________________。
Ag++Cl-===AgCl↓
Ag++I-===AgI↓
AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O
形成配合物溶解沉淀
【评价训练】3.(2023·湖北黄冈高二期中)从含Cl-和I-的混合溶液中得到AgCl和AgI的流程如图:
任务二:沉淀的溶解
(3)已知[Ag(NH3)2]+ Ag++2NH3,“沉淀Ⅱ”步骤中能否用盐酸代替硝酸,简述理由:_______________________________________________________
_________________________________________________________________。
能用盐酸代替硝酸,H+与[Ag(NH3)2]+电离的NH3反应使溶液中c(Ag+)增大,Q(AgCl)>Ksp(AgCl),重新产生AgCl沉淀
任务二:沉淀的溶解
【归纳总结】
任务二:沉淀的溶解
任务三:沉淀的转化
实验
操作
?
实验
现象
有白色沉淀析出
白色沉淀转化为
黄色沉淀
黄色沉淀转化为
黑色沉淀
离子
方程式
Ag++Cl-===AgCl↓
AgCl(s) +I-(aq)
?AgI(s) +Cl-(aq)
2AgI(s) +S2- (aq)
? Ag2S(s) +2I-(aq)
【实验探究】(1)实验探究AgCl、AgI、Ag2S的转化。
【视频导学】
溶解度的大小顺序:AgCl>AgI>Ag2S
Ksp的大小顺序:Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S)
【思考讨论】①通过上述实验,你能比较出AgCl、AgI、Ag2S三者溶解度的大小及Ksp的大小顺序吗?
②已知常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,试应用平衡移动原理解释为什么AgCl能转化成AgI?写出该沉淀转化反应的离子方程式。
I-(aq)+AgCl(s) ? AgI(s)+Cl-(aq)
任务三:沉淀的转化
实验操作
?
实验现象
产生白色沉淀
白色沉淀转化为红褐色沉淀
离子方程式
Mg2++2OH-===Mg(OH)2↓
3Mg(OH)2(s)+2Fe3+ (aq) ? 2Fe(OH)3(s)+3Mg2+(aq)
【实验探究】(2)实验探究Mg(OH)2与Fe(OH)3的转化。
【视频导学】
任务三:沉淀的转化
当向Mg(OH)2沉淀中加入FeCl3溶液时,溶液中OH-与Fe3+的离子积——Q[Fe(OH)3]>Ksp[Fe(OH)3],因此,Fe3+与OH-结合生成Fe(OH)3沉淀,导致Mg(OH)2的沉淀溶解平衡向溶解的方向移动,直至建立新的沉淀溶解平衡:
如果加入足量的FeCl3溶液,上述过程可以继续进行,直至绝大部分Mg(OH)2沉淀转化为Fe(OH)3沉淀。
【思考讨论】已知:Ksp[Mg(OH)2]=5.6×10-12,Ksp[Fe(OH)3]=2.8×10-39,试应用平衡移动原理解释为什么Mg(OH)2能转化成Fe(OH)3?
任务三:沉淀的转化
沉淀溶解平衡的移动。
两种沉淀的溶解度不同。
指将一种难溶物转化为另一种难溶物的过程。
①一般来说,溶解度小的沉淀转化为溶解度更小的沉淀容易实现。
②两者的溶解度差别越大,转化越容易。
③当两种沉淀的溶解度相差不太大时,也可通过提高转化试剂的浓度实现溶解度小的沉淀转化为溶解度较大的沉淀。
【阅读总结】阅读教材第84-85页,归纳沉淀转化的实质与条件。
1、概念:
2、实质:
3、条件:
4、规律:
任务三:沉淀的转化
BaSO4(s)+CO32? (aq) ?BaCO3(aq) + SO42? (aq)
?
增大????(CO32?)浓度,就能满足Q>K,使平衡正向移动。
?
物质
BaSO4
BaCO3
Ksp
1.1×10-10
2.6×10-9
BaSO4(s) ?Ba2+(aq) + SO42? (aq)
?
K =?????(SO42?)????(CO32?)
?
=????(SO42?)·????(Ba2+)????(CO32?)·????(Ba2+)
?
=?????sp(BaSO4)????sp(BaCO3) ≈0.04
?
当Q =?????(SO42?)????(CO32?)?> K = 0.04时反应正向进行
?
CO32?
?
BaCO3(s)
+
?
任务三:沉淀的转化
【思考讨论】向BaSO4的饱和溶液中加入Na2CO3溶液,能否使BaSO4沉淀转化为BaCO3沉淀?[已知Ksp(BaSO4) < Ksp(BaCO3)]
(1)溶解度小的沉淀不能转化为溶解度比其大的沉淀
(2)向AgCl沉淀中加入KI溶液,由白色沉淀转变成黄色沉淀,
是由于Ksp(AgI)
×
√
√
【评价训练】1.正误判断
任务三:沉淀的转化
(1)锅炉除水垢(含有CaSO4),常温下CaCO3、CaSO4的Ksp分别为3.4×10-9、4.9×10-5,处理流程如下。
①写出沉淀转化Ⅰ的离子方程式:______________________________________________,该温度下转化的平衡常数K=________。
②沉淀溶解Ⅱ的主要化学方程式为________________________________。
1.4×104
CaCO3+2HCl===CaCl2+H2O+CO2↑
【评价训练】2.沉淀转化在工、农业生产中有广泛的应用。
任务三:沉淀的转化
(2)自然界中矿物的转化:各种原生铜的硫化物
CuSO4溶液 铜蓝(CuS)。
氧化、淋滤
渗透、遇闪锌矿(ZnS)和方铅矿(PbS)
上述沉淀转化的方程式为 、
。
(3)难溶性的FeS可用于处理工业废水中的Hg2+等重金属离子,处理Hg2+的离子方程式为 。
CuSO4+ZnS CuS+ZnSO4
CuSO4+PbS CuS+PbSO4
FeS(s)+Hg2+(aq) HgS(s)+Fe2+(aq)
【评价训练】2.沉淀转化在工、农业生产中有广泛的应用。
任务三:沉淀的转化
本课结束
今日作业
第三章 第四节 第2课时
