4.2.2 电解原理的应用 课件 (共23张PPT) 高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2.2 电解原理的应用 课件 (共23张PPT) 高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 175.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-30 00:00:00 | ||
图片预览




文档简介
(共23张PPT)
高二化学 选择性必修一
第四章 化学反应与电能
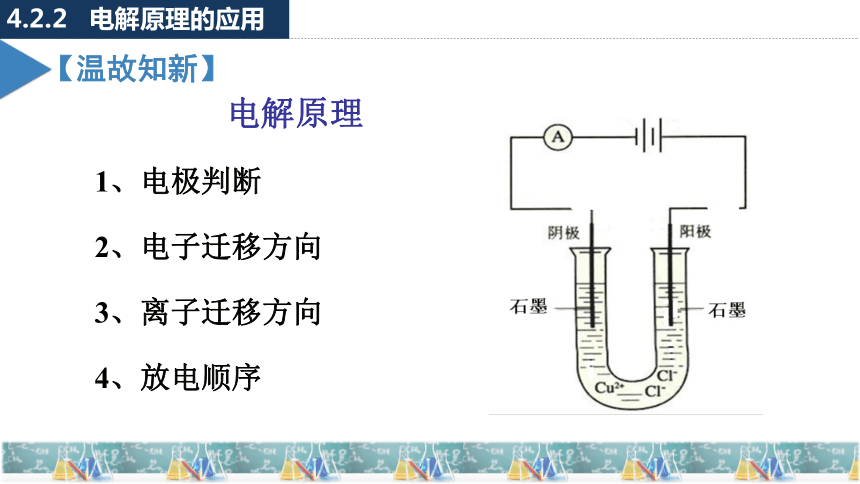
电解池
第二课时 电解原理的应用
4.2.2 电解原理的应用
【温故知新】
电解原理
1、电极判断
2、电子迁移方向
3、离子迁移方向
4、放电顺序
4.2.2 电解原理的应用
【新课导入】(教材P109 资料卡片)
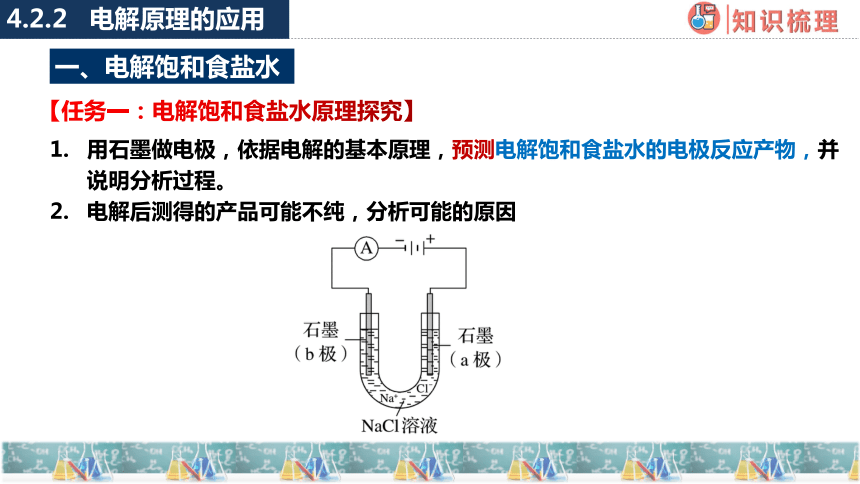
【任务一:电解饱和食盐水原理探究】
4.2.2 电解原理的应用
用石墨做电极,依据电解的基本原理,预测电解饱和食盐水的电极反应产物,并说明分析过程。
电解后测得的产品可能不纯,分析可能的原因
一、电解饱和食盐水
4.2.2 电解原理的应用
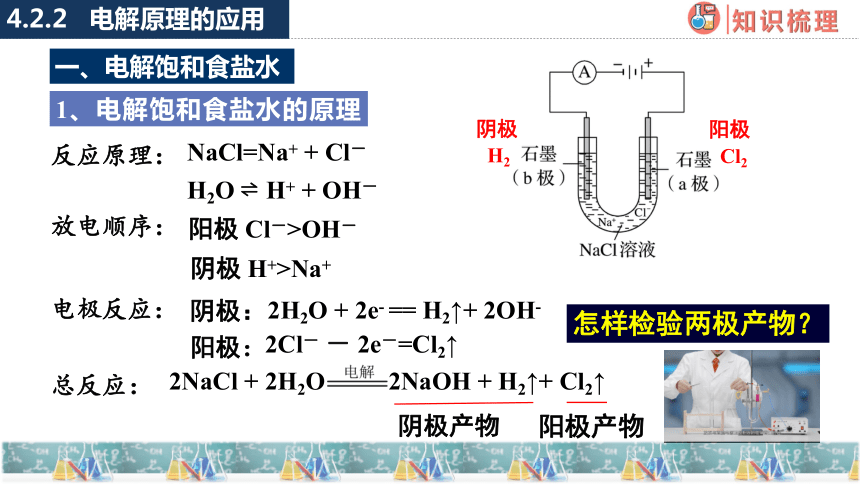
反应原理:
NaCl=Na+ + Cl-
放电顺序:
阳极 Cl->OH-
阴极 H+>Na+
阴极:
阳极:
2Cl- - 2e-=Cl2↑
总反应:
2NaCl + 2H2O 2NaOH + H2↑+ Cl2↑
阴极产物
阳极产物
H2O H+ + OH-
怎样检验两极产物?
电极反应:
1、电解饱和食盐水的原理
一、电解饱和食盐水
H2
阴极
Cl2
阳极
2H+ + 2e- == H2↑
2H2O + 2e- == H2↑+ 2OH-
4.2.2 电解原理的应用
【思考与讨论】
1. 除了上述实验现象外,还发现反应刚开始,阴极出现的红色溶液迅速向阳极扩散,随后变得缓慢,并且很长一段时间后,阳极区附近仍为无色,为什么?
Cl2 +2NaOH == NaCl + NaClO + H2O
(2) 避免生成物H2和Cl2混合
(1) 避免Cl2接触NaOH溶液反应,使产品不纯
混合遇火或遇强光爆炸
2. 电解饱和食盐水要解决的主要问题是什么?
反应开始短时间内
较长时间后
怎样解决?
一、电解饱和食盐水
4.2.2 电解原理的应用
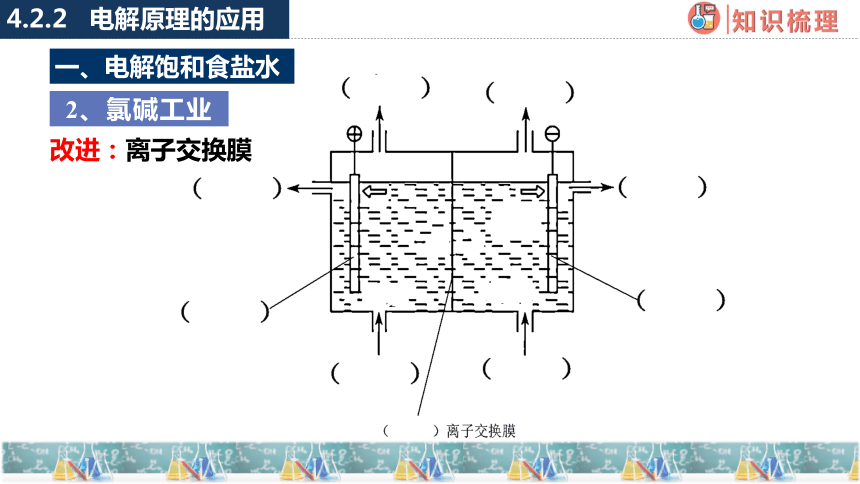
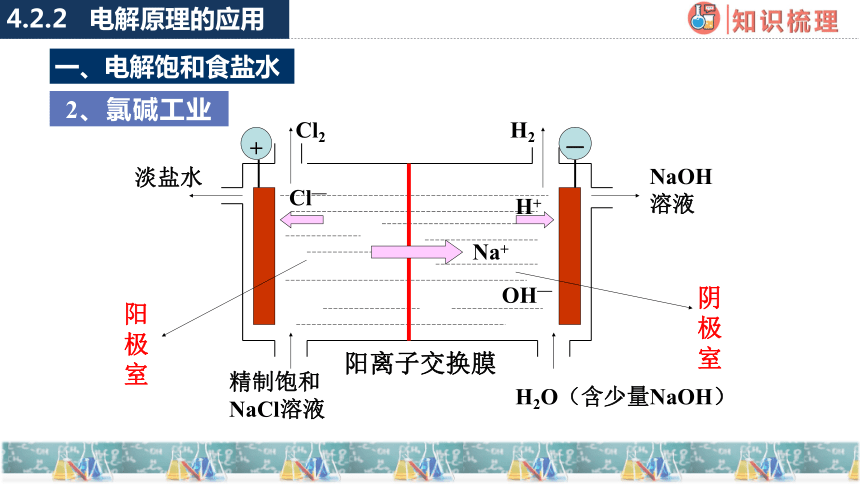
2、氯碱工业
改进:离子交换膜
一、电解饱和食盐水
4.2.2 电解原理的应用
-
+
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳极室
阴极室
2、氯碱工业
一、电解饱和食盐水
4.2.2 电解原理的应用
3、氯碱工业产品及其应用
(1)氯碱工业产品主要有NaOH、Cl2、H2、盐酸、含氯漂白剂等。
(2)以电解饱和食盐水为原理的氯碱工业产品在有机合成、造纸、玻璃、肥皂、纺织、印染、农药、金属冶炼等领域中广泛应用。
4.2.2 电解原理的应用
【应用体验】
如何改进装置,用电极电解饱和氯化钠溶液制备家用环保型消毒液(NaClO溶液)
完成下列填空:
(1)a为电源的 (填“正”“负”“阴”或“阳”,下同)极,c为电解池的 极。
负
阳
(2)d电极的电极反应式: ,电解产生
消毒液的总化学方程式为 。
2H2O+2e-===H2↑+2OH-
为充分混合反应,下端产生Cl2,上端产生NaOH
二、电冶金
4.2.2 电解原理的应用
【任务二:电解熔融氯化钠原理探究】
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
2Cl- - 2e- = Cl2
氧化反应
还原反应
2Na++ 2e- = 2Na
画出通电后熔融氯化钠中的微粒,并标出微粒的运动方向,和电子运动方向。
写出阴极和阳极的电极方程式
二、电冶金
4.2.2 电解原理的应用
使矿石中的金属离子获得电子,从它们的化合物中还原成金属单质的过程
1、金属冶炼:
通式:Mn+ + ne- = M
电解法可以将通常极难被还原的活泼金属从它们的化合物中还原出来,所以是冶炼钠、钙、镁、铝等活泼金属的一种重要方法。
2、电冶金:
想一想:如何实现难还原的活泼金属阳离子的冶炼?
二、电冶金
4.2.2 电解原理的应用
(熔融)
电解
Mg + Cl2↑
MgCl2
阳极:2Cl- - 2e- == Cl2 ↑
阴极:Mg2++ 2e- == Mg
阳极:6O2- - 12e- == 3O2↑
阴极:4Al3++12e- == 4Al
电解
冰晶石
2Al2O3(熔融) 4Al+ 3O2↑
2NaCl(熔融) 2Na + Cl2↑
电解
阳极:2Cl- - 2e- == Cl2 ↑
阴极:2Na++ 2e- ==2 Na
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)
三、粗铜的电解精炼
4.2.2 电解原理的应用
【问题提出】
黄铜矿
粗铜(含有锌、铁、镍、银、金、铂等微量杂质)
一般火法冶炼得到的粗铜中含有多种杂质(如锌、铁、银、金等),这种粗铜的导电性远不能满足电气工业的要求,如果用以制电线,就会大大降低电线的导电能力。因此必须利用电解的方法精炼粗铜。
三、粗铜的电解精炼
4.2.2 电解原理的应用
【任务三:粗铜的电解精炼原理探究】
1. 阳极和阴极材料、电解质溶液分别是?
2. 粗铜中的杂质金属如何除去?
3. 电解精炼后,CuSO4液溶液度何化浓度有何变化?
【知识支持】金属活泼性:锌>铁>镍>铜>银>金
三、粗铜的电解精炼
4.2.2 电解原理的应用
【任务三:粗铜的电解精炼原理探究】
纯铜
粗铜
含杂质(Zn Fe Ni Ag Au 等)
阳极
阴极
粗铜
纯铜
电极材料
电极反应
Cu2+ + 2e- = Cu
CuSO4溶液
Zn-2e- → Zn2+
Fe -2e-→ Fe2+
Ni-2e-→ Ni2+
Cu-2e→ Cu2+
Zn Fe Ni
CuAg Au
阳极泥
阳极泥
阳极上活泼性比铜差的金属不能失去电子,而是以单质的形式沉积于阳极底部,成为阳极泥。可以用来提炼金银等贵重金属
【想一想】电解完后,电解质溶液的浓度____
减小
四、电镀
4.2.2 电解原理的应用
1、电镀:电镀是利用电解原理在某些金属表面镀上一薄层其他金属或合金的加工工艺。
2、目的:使金属增强抗腐蚀能力,增加表面硬度和美观。
镀层金属—通常是一些在空气或溶液中不易发生变化的金属(如铬、镍、银)和合金(如黄铜)
四、电镀
4.2.2 电解原理的应用
【任务四:铁上镀铜实验设计】
如果想在铁制品表面镀上铜,该如何设计实验
【方法引导】在设计电镀装置时,通常需要重点考虑以下两个方面的问题:
1、如何使镀层金属或合金沉积在待镀金属(镀件)表面?
2、电解质溶液应该如何选择?
四、电镀
4.2.2 电解原理的应用
①电极:
阳极——镀层金属
阴极——待镀金属制品
②电镀液:含有镀层金属离子的电解质溶液。
电镀池的构成
【想一想】电解完后,电解质溶液的浓度____
不变
4.2.2 电解原理的应用
导练
1.若要在铜片上镀银时,下列叙述中错误的是
①将铜片接在电源的正极
②将银片接在电源的正极
③在铜片上发生的反应是Ag++e-===Ag
④在银片上发生的反应是2H2O-4e-===O2↑+4H+
⑤可用CuSO4溶液作电解质溶液
⑥可用AgNO3溶液作电解质溶液
A.①③⑥ B.②③⑥
C.①④⑤ D.②③④⑥
铜作阴极与电源负极相连;银作阳极和电源正极相连;电解质溶液为硝酸银溶液;
铜片上反应是Ag++e-===Ag;
银片上反应是Ag-e-===Ag+;
用硫酸铜溶液作电镀液,阴极析出铜;
√
4.2.2 电解原理的应用
【课堂总结】
电解原理的应用
电镀
电冶金
电镀:
电解饱和食盐水
电解精炼铜:
阴极—待镀金属, 阳极—镀层金属
阴极—精铜, 阳极—粗铜
2Cl- - 2e- = Cl2↑
阳极
阴极
2H2O + 2e- = H2↑ + 2OH-
点燃法检验H2
酚酞溶液检验碱性
湿润淀粉KI试纸
检验Cl2
4.2.2 电解原理的应用
【课堂练习】
下列关于图示四个装置的叙述不正确的是( )
A.装置甲是可以在铁钉上镀铜的装置
B.若装置乙为电解精炼铜装置,则X电极为精铜
C.装置丙的a端产生的气体能使湿润的淀粉碘化钾试纸变蓝
D.装置丁接通电源后可以观察到白色沉淀迅速变成灰绿色,最终变红褐色
D
4.2.2 电解原理的应用
【课后拓展】(教材P109 资料卡片)
高二化学 选择性必修一
第四章 化学反应与电能
电解池
第二课时 电解原理的应用
4.2.2 电解原理的应用
【温故知新】
电解原理
1、电极判断
2、电子迁移方向
3、离子迁移方向
4、放电顺序
4.2.2 电解原理的应用
【新课导入】(教材P109 资料卡片)
【任务一:电解饱和食盐水原理探究】
4.2.2 电解原理的应用
用石墨做电极,依据电解的基本原理,预测电解饱和食盐水的电极反应产物,并说明分析过程。
电解后测得的产品可能不纯,分析可能的原因
一、电解饱和食盐水
4.2.2 电解原理的应用
反应原理:
NaCl=Na+ + Cl-
放电顺序:
阳极 Cl->OH-
阴极 H+>Na+
阴极:
阳极:
2Cl- - 2e-=Cl2↑
总反应:
2NaCl + 2H2O 2NaOH + H2↑+ Cl2↑
阴极产物
阳极产物
H2O H+ + OH-
怎样检验两极产物?
电极反应:
1、电解饱和食盐水的原理
一、电解饱和食盐水
H2
阴极
Cl2
阳极
2H+ + 2e- == H2↑
2H2O + 2e- == H2↑+ 2OH-
4.2.2 电解原理的应用
【思考与讨论】
1. 除了上述实验现象外,还发现反应刚开始,阴极出现的红色溶液迅速向阳极扩散,随后变得缓慢,并且很长一段时间后,阳极区附近仍为无色,为什么?
Cl2 +2NaOH == NaCl + NaClO + H2O
(2) 避免生成物H2和Cl2混合
(1) 避免Cl2接触NaOH溶液反应,使产品不纯
混合遇火或遇强光爆炸
2. 电解饱和食盐水要解决的主要问题是什么?
反应开始短时间内
较长时间后
怎样解决?
一、电解饱和食盐水
4.2.2 电解原理的应用
2、氯碱工业
改进:离子交换膜
一、电解饱和食盐水
4.2.2 电解原理的应用
-
+
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳极室
阴极室
2、氯碱工业
一、电解饱和食盐水
4.2.2 电解原理的应用
3、氯碱工业产品及其应用
(1)氯碱工业产品主要有NaOH、Cl2、H2、盐酸、含氯漂白剂等。
(2)以电解饱和食盐水为原理的氯碱工业产品在有机合成、造纸、玻璃、肥皂、纺织、印染、农药、金属冶炼等领域中广泛应用。
4.2.2 电解原理的应用
【应用体验】
如何改进装置,用电极电解饱和氯化钠溶液制备家用环保型消毒液(NaClO溶液)
完成下列填空:
(1)a为电源的 (填“正”“负”“阴”或“阳”,下同)极,c为电解池的 极。
负
阳
(2)d电极的电极反应式: ,电解产生
消毒液的总化学方程式为 。
2H2O+2e-===H2↑+2OH-
为充分混合反应,下端产生Cl2,上端产生NaOH
二、电冶金
4.2.2 电解原理的应用
【任务二:电解熔融氯化钠原理探究】
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
2Cl- - 2e- = Cl2
氧化反应
还原反应
2Na++ 2e- = 2Na
画出通电后熔融氯化钠中的微粒,并标出微粒的运动方向,和电子运动方向。
写出阴极和阳极的电极方程式
二、电冶金
4.2.2 电解原理的应用
使矿石中的金属离子获得电子,从它们的化合物中还原成金属单质的过程
1、金属冶炼:
通式:Mn+ + ne- = M
电解法可以将通常极难被还原的活泼金属从它们的化合物中还原出来,所以是冶炼钠、钙、镁、铝等活泼金属的一种重要方法。
2、电冶金:
想一想:如何实现难还原的活泼金属阳离子的冶炼?
二、电冶金
4.2.2 电解原理的应用
(熔融)
电解
Mg + Cl2↑
MgCl2
阳极:2Cl- - 2e- == Cl2 ↑
阴极:Mg2++ 2e- == Mg
阳极:6O2- - 12e- == 3O2↑
阴极:4Al3++12e- == 4Al
电解
冰晶石
2Al2O3(熔融) 4Al+ 3O2↑
2NaCl(熔融) 2Na + Cl2↑
电解
阳极:2Cl- - 2e- == Cl2 ↑
阴极:2Na++ 2e- ==2 Na
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)
三、粗铜的电解精炼
4.2.2 电解原理的应用
【问题提出】
黄铜矿
粗铜(含有锌、铁、镍、银、金、铂等微量杂质)
一般火法冶炼得到的粗铜中含有多种杂质(如锌、铁、银、金等),这种粗铜的导电性远不能满足电气工业的要求,如果用以制电线,就会大大降低电线的导电能力。因此必须利用电解的方法精炼粗铜。
三、粗铜的电解精炼
4.2.2 电解原理的应用
【任务三:粗铜的电解精炼原理探究】
1. 阳极和阴极材料、电解质溶液分别是?
2. 粗铜中的杂质金属如何除去?
3. 电解精炼后,CuSO4液溶液度何化浓度有何变化?
【知识支持】金属活泼性:锌>铁>镍>铜>银>金
三、粗铜的电解精炼
4.2.2 电解原理的应用
【任务三:粗铜的电解精炼原理探究】
纯铜
粗铜
含杂质(Zn Fe Ni Ag Au 等)
阳极
阴极
粗铜
纯铜
电极材料
电极反应
Cu2+ + 2e- = Cu
CuSO4溶液
Zn-2e- → Zn2+
Fe -2e-→ Fe2+
Ni-2e-→ Ni2+
Cu-2e→ Cu2+
Zn Fe Ni
CuAg Au
阳极泥
阳极泥
阳极上活泼性比铜差的金属不能失去电子,而是以单质的形式沉积于阳极底部,成为阳极泥。可以用来提炼金银等贵重金属
【想一想】电解完后,电解质溶液的浓度____
减小
四、电镀
4.2.2 电解原理的应用
1、电镀:电镀是利用电解原理在某些金属表面镀上一薄层其他金属或合金的加工工艺。
2、目的:使金属增强抗腐蚀能力,增加表面硬度和美观。
镀层金属—通常是一些在空气或溶液中不易发生变化的金属(如铬、镍、银)和合金(如黄铜)
四、电镀
4.2.2 电解原理的应用
【任务四:铁上镀铜实验设计】
如果想在铁制品表面镀上铜,该如何设计实验
【方法引导】在设计电镀装置时,通常需要重点考虑以下两个方面的问题:
1、如何使镀层金属或合金沉积在待镀金属(镀件)表面?
2、电解质溶液应该如何选择?
四、电镀
4.2.2 电解原理的应用
①电极:
阳极——镀层金属
阴极——待镀金属制品
②电镀液:含有镀层金属离子的电解质溶液。
电镀池的构成
【想一想】电解完后,电解质溶液的浓度____
不变
4.2.2 电解原理的应用
导练
1.若要在铜片上镀银时,下列叙述中错误的是
①将铜片接在电源的正极
②将银片接在电源的正极
③在铜片上发生的反应是Ag++e-===Ag
④在银片上发生的反应是2H2O-4e-===O2↑+4H+
⑤可用CuSO4溶液作电解质溶液
⑥可用AgNO3溶液作电解质溶液
A.①③⑥ B.②③⑥
C.①④⑤ D.②③④⑥
铜作阴极与电源负极相连;银作阳极和电源正极相连;电解质溶液为硝酸银溶液;
铜片上反应是Ag++e-===Ag;
银片上反应是Ag-e-===Ag+;
用硫酸铜溶液作电镀液,阴极析出铜;
√
4.2.2 电解原理的应用
【课堂总结】
电解原理的应用
电镀
电冶金
电镀:
电解饱和食盐水
电解精炼铜:
阴极—待镀金属, 阳极—镀层金属
阴极—精铜, 阳极—粗铜
2Cl- - 2e- = Cl2↑
阳极
阴极
2H2O + 2e- = H2↑ + 2OH-
点燃法检验H2
酚酞溶液检验碱性
湿润淀粉KI试纸
检验Cl2
4.2.2 电解原理的应用
【课堂练习】
下列关于图示四个装置的叙述不正确的是( )
A.装置甲是可以在铁钉上镀铜的装置
B.若装置乙为电解精炼铜装置,则X电极为精铜
C.装置丙的a端产生的气体能使湿润的淀粉碘化钾试纸变蓝
D.装置丁接通电源后可以观察到白色沉淀迅速变成灰绿色,最终变红褐色
D
4.2.2 电解原理的应用
【课后拓展】(教材P109 资料卡片)
