6.1.3 电极方程式的书写 化学电源 课件(共24张PPT) 高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.3 电极方程式的书写 化学电源 课件(共24张PPT) 高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 9.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-30 18:58:02 | ||
图片预览







文档简介
第六章 化学反应与能量
第一节 化学反应与能量变化
第三课时 电极反应式的书写
化学电源
6.1.3 电极反应式的书写 化学电源
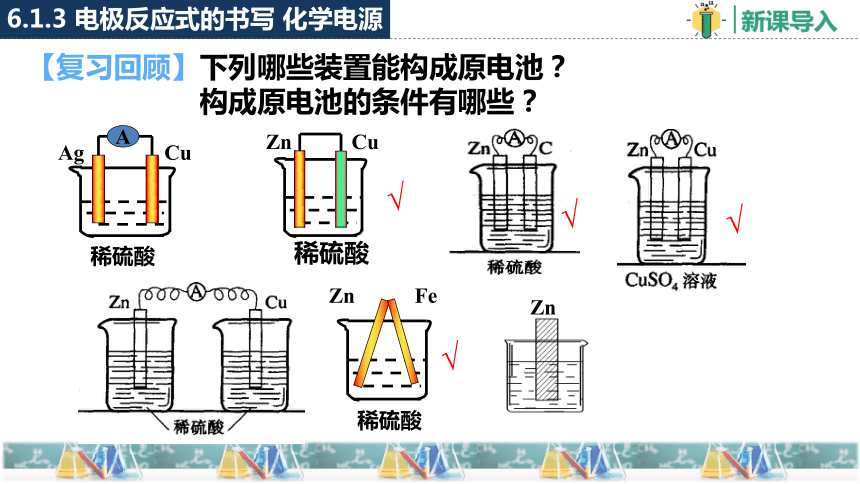
【复习回顾】下列哪些装置能构成原电池?
构成原电池的条件有哪些?
稀硫酸
Ag
Cu
A
稀硫酸
Zn
Cu
稀硫酸
Zn
Fe
Zn
√
√
√
√
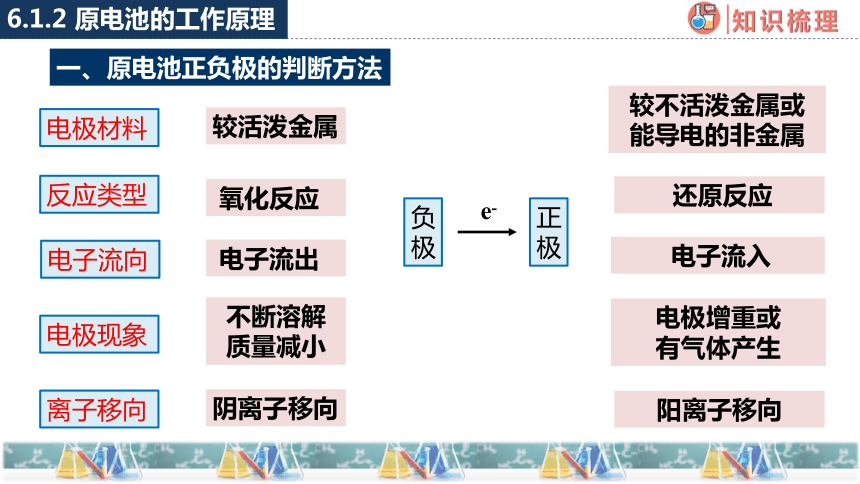
一、原电池正负极的判断方法
6.1.2 原电池的工作原理
电极材料
反应类型
电子流向
电极现象
离子移向
负极
正极
较活泼金属
较不活泼金属或
能导电的非金属
氧化反应
还原反应
电子流出
电子流入
e-
不断溶解
质量减小
电极增重或
有气体产生
阴离子移向
阳离子移向
一、原电池正负极的判断方法
6.1.2 原电池的工作原理
如图所示原电池装置,试判断其电极情况:
(1)若a电极为铝,b电极为锌,X为稀硫酸,则a、b各为什么电极?
a为负极,b为正极。因为铝的活动性大于锌。
(2)若a电极为铝,b电极为锌,X为浓硫酸,则a、b各为什么电极?
a为正极,b为负极。因Al可被浓硫酸钝化而不能继续反应,而锌可以与浓硫酸反应,锌失电子发生氧化反应,故铝电极为正极,锌电极为负极。
注意:在判断原电池正负极时,不要只根据金属活动性的相对强弱还要考虑电解质溶液的特点。
一、原电池正负极的判断方法
6.1.2 原电池的工作原理
(3)若a电极为铜,b电极为石墨,则X是什么才能使该装置构成原电池?
石墨是稳定的电极,一般不发生反应,若使该装置构成原电池,则应使铜作负极,电解质溶液X应与铜发生反应。故可选AgNO3溶液或硝酸溶液或FeCl3溶液等。
6.1.3 电极反应式的书写 化学电源
二、电极反应式的书写
判断正负极写出总反应式及电极反应式
【例题】
负极(铜):Cu - 2e- = Cu2+
正极(银):2Ag+ + 2e- = 2Ag
Cu + 2Ag+ = Cu2+ + 2Ag
Cu
Ag
AgNO3
C
Fe
CuSO4
正极(石墨):Cu2++2e-=Cu
负极(铁):Fe -2e - = Fe2+
Fe + Cu2+=Fe2++ Cu
作差法
6.1.3 电极反应式的书写 化学电源
二、电极反应式的书写
[练习1] 请写出右边原电池的电极反应式。
Mg Al
NaOH溶液
A
2Al + 6H2O + 2 OH- = 2 [Al(OH)4]- + 3H2↑
分析负极反应过程
2Al - 6e- = 2Al3+
2Al3+ + 8OH- =2 [Al(OH)4]-
负 极: 2Al +8OH- -6e- =2 [Al(OH)4]-
正 极:总反应-负极反应:
6H2O +6e- =6OH—+ 3H2↑
总反应:
(-)
(+)
6.1.3 电极反应式的书写 化学电源
二、电极反应式的书写
Mg Al
NaOH溶液
A
(-)
(+)
[练习1] 请写出右边原电池的电极反应式。
四步法
负 极:
Al =[Al(OH)4]-
一步:判断正负极
二步:
三步:
四步:
Al-3e- = [Al(OH)4]-
Al-3e- +4OH- = [Al(OH)4]-
正 极:
2H2O +2e- =2OH—+ H2↑
总反应:
2Al + 6H2O + 2 OH- = 2 [Al(OH)4]- + 3H2↑
×2
×3
6.1.3 电极反应式的书写 化学电源
二、电极反应式的书写
四步法——电极反应式书写方法:
【归纳总结】
判
找
标
配
准确找出电极反应物和电极产物
准确判断电池的正、负极
根据有关元素化合价变化标出电子得失数目
根据环境配平电荷,最后根据原子个数配平电极反应式
6.1.3 电极反应式的书写 化学电源
三、化学电源
无处不在的电池
普通干电池
手机电池
钮扣电池
笔记本电脑专用电池
心脏起搏器电池
氢氧燃料电池
6.1.3 电极反应式的书写 化学电源
三、化学电源
你能将下列电池进行简单的分类吗?
小鹏 P7
锂电池组
宝马
氢燃料电池组
6.1.3 电极反应式的书写 化学电源
三、化学电源
宝马
氢燃料电池组
小鹏 P7
锂电池组
宝马
氢燃料电池组
一次电池
二次电池
燃料电池
宝马
氢燃料电池组
一次电池,也叫做干电池,放电后不可再充电。
常见的一次电池有普通锌锰干电池、纽扣式银锌电池等。
1. 一次电池
6.1.3 电极反应式的书写 化学电源
三、化学电源
1. 一次电池
普通锌锰干电池
石墨棒作正极,氯化铵糊作电解质溶液,锌筒作负极。
总反应
负极
正极
Zn + 2MnO2 + 2NH4+ == Zn2+ + 2MnO(OH) + 2NH3↑
Zn﹣2e- === Zn2+
2MnO2 + 2NH4+ + 2e- === 2MnO(OH) + 2NH3↑
优点:制作简单,便于携带,价格便宜;
缺点:放电时间短,电压下降快;容易漏液(锌外壳变薄)糊状NH4Cl显酸性
6.1.3 电极反应式的书写 化学电源
三、化学电源
1. 一次电池
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 糊
改进
①在外壳套上防腐金属筒或塑料筒制成防漏电池;
②将电池内的电解质NH4Cl换成湿的KOH,并在构造上进行改进,制成碱性锌锰电池。
6.1.3 电极反应式的书写 化学电源
三、化学电源
1. 一次电池
碱性锌锰干电池
电池总反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
负极:Zn + 2OH– – 2e– =Zn(OH)2
正极:2MnO2 + 2H2O +2e– = 2MnOOH + 2OH–
锌粉取代锌筒,KOH取代NH4Cl,增大接触面积
加快反应速率,减少电池内阻,电流大电压高寿命长
0 +4 +3 +2
pH值增大
Zn—MnO2 —KOH
6.1.3 电极反应式的书写 化学电源
三、化学电源
2. 二次电池
放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。这种充电电池属于二次电池,也叫充电电池或蓄电池。
常见的充电电池有铅酸蓄电池、镍氢电池、锂离子电池等。
目前汽车上使用的大多是铅酸蓄电池。
6.1.3 电极反应式的书写 化学电源
三、化学电源
2. 二次电池
铅酸蓄电池
Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
放
电
总反应
负极
?
正极
?
工作原理:
Pb + PbO2 + 2H2SO4 === 2PbSO4 + 2H2O
Pb +?SO42-﹣2e- === PbSO4
?
PbO2 + 4H+ + SO42- + 2e- == PbSO4 + 2H2O
?
6.1.3 电极反应式的书写 化学电源
三、化学电源
2. 二次电池
锂离子电池
6.1.3 电极反应式的书写 化学电源
三、化学电源
以钻酸锂—石墨锂电池为例:
Li1-xCoO2 + LixC6 LiCoO2 + 6C
放电
充电
放
电
总反应
负极
?
正极
?
Li1-xCoO2 + LixC6 === LiCoO2 + 6C
LiC6﹣xe- === 6C + xLi+
Li1-xCoO2 + xLi+ + xe- === LiCoO2
3. 燃料电池
将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置
具有清洁、安全、高效等特点。
燃料电池的能量转化率可以达到80%以上。
6.1.3 电极反应式的书写 化学电源
三、化学电源
3. 燃料电池
电解质
H2SO4溶液
总反应
负极
?
正极
?
2H2 + O2 === 2H2O
2H2 - 4e- === 4H+
O2 + 4H+ + 4e- === 2H2O
氢氧燃料电池
6.1.3 电极反应式的书写 化学电源
三、化学电源
3. 燃料电池
氢氧燃料电池
电解质
KOH溶液
总反应
2H2 + O2 === 2H2O
负极
?
正极
?
2H2 + 4OH- - 4e- === 4H2O
O2 + 2H2O + 4e- === 4OH-
6.1.3 电极反应式的书写 化学电源
三、化学电源
3. 燃料电池
甲烷燃料电池
电解质
电解质溶液为H2SO4
电解质溶液为KOH
总反应
负极
?
正极
?
CH4 + 2O2 === CO2 + 2H2O
CH4 + 2O2 + 2OH- == CO32? + 3H2O
?
CH4 + 2H2O - 8e- === CO2 + 8H+
CH4 + 10OH- - 8e- === CO32? + 7H2O
?
2O2 + 8H+ + 8e- == 4H2O
2O2 + 8e- + 4H2O === 8OH-
6.1.3 电极反应式的书写 化学电源
三、化学电源
6.1.3 电极反应式的书写 化学电源
三、化学电源
①总反应式:
②负极反应式:
③正极反应式:
化学电源中电极反应书写的思维模板
归纳
陌生的化学电源总反应式会给出。
(-)还原剂 - ne- = 氧化产物
(+)氧化剂 + ne- = 还原产物
四步法配平离子方程式
6.1.3 电极反应式的书写 化学电源
【练1】下列化学电池属于高效、环境友好电池的是
A.镍镉电池 B.锌锰电池
C.铅蓄电池 D.氢氧燃料电池
D
6.1.3 电极反应式的书写 化学电源
【练2】普通锌锰干电池的简图如图所示,该电池工作时的总反应为Zn+2NH4+ +2MnO2=[Zn(NH3)2]2++Mn2O3+H2O,关于锌锰干电池的下列说法中正确的是
A.当该电池电压逐渐下降后,能重新充电复原
B.电池工作一段时间后,碳棒会逐渐变细
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.1 mol电子,锌的质量理论上减小3.25 g
D
6.1.3 电极反应式的书写 化学电源
【练3】燃料电池是一种高效、环境友好的发电装置,某氢氧燃料电池的构造示意图如下,该电池工作时,下列说法正确的是
A.O2在b电极上发生氧化反应
B.电解质溶液中OH-向正极移动
C.该装置实现了电能到化学能的转化
D.氢氧燃料电池是一种具有应用前景的绿色电源
D
第一节 化学反应与能量变化
第三课时 电极反应式的书写
化学电源
6.1.3 电极反应式的书写 化学电源
【复习回顾】下列哪些装置能构成原电池?
构成原电池的条件有哪些?
稀硫酸
Ag
Cu
A
稀硫酸
Zn
Cu
稀硫酸
Zn
Fe
Zn
√
√
√
√
一、原电池正负极的判断方法
6.1.2 原电池的工作原理
电极材料
反应类型
电子流向
电极现象
离子移向
负极
正极
较活泼金属
较不活泼金属或
能导电的非金属
氧化反应
还原反应
电子流出
电子流入
e-
不断溶解
质量减小
电极增重或
有气体产生
阴离子移向
阳离子移向
一、原电池正负极的判断方法
6.1.2 原电池的工作原理
如图所示原电池装置,试判断其电极情况:
(1)若a电极为铝,b电极为锌,X为稀硫酸,则a、b各为什么电极?
a为负极,b为正极。因为铝的活动性大于锌。
(2)若a电极为铝,b电极为锌,X为浓硫酸,则a、b各为什么电极?
a为正极,b为负极。因Al可被浓硫酸钝化而不能继续反应,而锌可以与浓硫酸反应,锌失电子发生氧化反应,故铝电极为正极,锌电极为负极。
注意:在判断原电池正负极时,不要只根据金属活动性的相对强弱还要考虑电解质溶液的特点。
一、原电池正负极的判断方法
6.1.2 原电池的工作原理
(3)若a电极为铜,b电极为石墨,则X是什么才能使该装置构成原电池?
石墨是稳定的电极,一般不发生反应,若使该装置构成原电池,则应使铜作负极,电解质溶液X应与铜发生反应。故可选AgNO3溶液或硝酸溶液或FeCl3溶液等。
6.1.3 电极反应式的书写 化学电源
二、电极反应式的书写
判断正负极写出总反应式及电极反应式
【例题】
负极(铜):Cu - 2e- = Cu2+
正极(银):2Ag+ + 2e- = 2Ag
Cu + 2Ag+ = Cu2+ + 2Ag
Cu
Ag
AgNO3
C
Fe
CuSO4
正极(石墨):Cu2++2e-=Cu
负极(铁):Fe -2e - = Fe2+
Fe + Cu2+=Fe2++ Cu
作差法
6.1.3 电极反应式的书写 化学电源
二、电极反应式的书写
[练习1] 请写出右边原电池的电极反应式。
Mg Al
NaOH溶液
A
2Al + 6H2O + 2 OH- = 2 [Al(OH)4]- + 3H2↑
分析负极反应过程
2Al - 6e- = 2Al3+
2Al3+ + 8OH- =2 [Al(OH)4]-
负 极: 2Al +8OH- -6e- =2 [Al(OH)4]-
正 极:总反应-负极反应:
6H2O +6e- =6OH—+ 3H2↑
总反应:
(-)
(+)
6.1.3 电极反应式的书写 化学电源
二、电极反应式的书写
Mg Al
NaOH溶液
A
(-)
(+)
[练习1] 请写出右边原电池的电极反应式。
四步法
负 极:
Al =[Al(OH)4]-
一步:判断正负极
二步:
三步:
四步:
Al-3e- = [Al(OH)4]-
Al-3e- +4OH- = [Al(OH)4]-
正 极:
2H2O +2e- =2OH—+ H2↑
总反应:
2Al + 6H2O + 2 OH- = 2 [Al(OH)4]- + 3H2↑
×2
×3
6.1.3 电极反应式的书写 化学电源
二、电极反应式的书写
四步法——电极反应式书写方法:
【归纳总结】
判
找
标
配
准确找出电极反应物和电极产物
准确判断电池的正、负极
根据有关元素化合价变化标出电子得失数目
根据环境配平电荷,最后根据原子个数配平电极反应式
6.1.3 电极反应式的书写 化学电源
三、化学电源
无处不在的电池
普通干电池
手机电池
钮扣电池
笔记本电脑专用电池
心脏起搏器电池
氢氧燃料电池
6.1.3 电极反应式的书写 化学电源
三、化学电源
你能将下列电池进行简单的分类吗?
小鹏 P7
锂电池组
宝马
氢燃料电池组
6.1.3 电极反应式的书写 化学电源
三、化学电源
宝马
氢燃料电池组
小鹏 P7
锂电池组
宝马
氢燃料电池组
一次电池
二次电池
燃料电池
宝马
氢燃料电池组
一次电池,也叫做干电池,放电后不可再充电。
常见的一次电池有普通锌锰干电池、纽扣式银锌电池等。
1. 一次电池
6.1.3 电极反应式的书写 化学电源
三、化学电源
1. 一次电池
普通锌锰干电池
石墨棒作正极,氯化铵糊作电解质溶液,锌筒作负极。
总反应
负极
正极
Zn + 2MnO2 + 2NH4+ == Zn2+ + 2MnO(OH) + 2NH3↑
Zn﹣2e- === Zn2+
2MnO2 + 2NH4+ + 2e- === 2MnO(OH) + 2NH3↑
优点:制作简单,便于携带,价格便宜;
缺点:放电时间短,电压下降快;容易漏液(锌外壳变薄)糊状NH4Cl显酸性
6.1.3 电极反应式的书写 化学电源
三、化学电源
1. 一次电池
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 糊
改进
①在外壳套上防腐金属筒或塑料筒制成防漏电池;
②将电池内的电解质NH4Cl换成湿的KOH,并在构造上进行改进,制成碱性锌锰电池。
6.1.3 电极反应式的书写 化学电源
三、化学电源
1. 一次电池
碱性锌锰干电池
电池总反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
负极:Zn + 2OH– – 2e– =Zn(OH)2
正极:2MnO2 + 2H2O +2e– = 2MnOOH + 2OH–
锌粉取代锌筒,KOH取代NH4Cl,增大接触面积
加快反应速率,减少电池内阻,电流大电压高寿命长
0 +4 +3 +2
pH值增大
Zn—MnO2 —KOH
6.1.3 电极反应式的书写 化学电源
三、化学电源
2. 二次电池
放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。这种充电电池属于二次电池,也叫充电电池或蓄电池。
常见的充电电池有铅酸蓄电池、镍氢电池、锂离子电池等。
目前汽车上使用的大多是铅酸蓄电池。
6.1.3 电极反应式的书写 化学电源
三、化学电源
2. 二次电池
铅酸蓄电池
Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
放
电
总反应
负极
?
正极
?
工作原理:
Pb + PbO2 + 2H2SO4 === 2PbSO4 + 2H2O
Pb +?SO42-﹣2e- === PbSO4
?
PbO2 + 4H+ + SO42- + 2e- == PbSO4 + 2H2O
?
6.1.3 电极反应式的书写 化学电源
三、化学电源
2. 二次电池
锂离子电池
6.1.3 电极反应式的书写 化学电源
三、化学电源
以钻酸锂—石墨锂电池为例:
Li1-xCoO2 + LixC6 LiCoO2 + 6C
放电
充电
放
电
总反应
负极
?
正极
?
Li1-xCoO2 + LixC6 === LiCoO2 + 6C
LiC6﹣xe- === 6C + xLi+
Li1-xCoO2 + xLi+ + xe- === LiCoO2
3. 燃料电池
将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置
具有清洁、安全、高效等特点。
燃料电池的能量转化率可以达到80%以上。
6.1.3 电极反应式的书写 化学电源
三、化学电源
3. 燃料电池
电解质
H2SO4溶液
总反应
负极
?
正极
?
2H2 + O2 === 2H2O
2H2 - 4e- === 4H+
O2 + 4H+ + 4e- === 2H2O
氢氧燃料电池
6.1.3 电极反应式的书写 化学电源
三、化学电源
3. 燃料电池
氢氧燃料电池
电解质
KOH溶液
总反应
2H2 + O2 === 2H2O
负极
?
正极
?
2H2 + 4OH- - 4e- === 4H2O
O2 + 2H2O + 4e- === 4OH-
6.1.3 电极反应式的书写 化学电源
三、化学电源
3. 燃料电池
甲烷燃料电池
电解质
电解质溶液为H2SO4
电解质溶液为KOH
总反应
负极
?
正极
?
CH4 + 2O2 === CO2 + 2H2O
CH4 + 2O2 + 2OH- == CO32? + 3H2O
?
CH4 + 2H2O - 8e- === CO2 + 8H+
CH4 + 10OH- - 8e- === CO32? + 7H2O
?
2O2 + 8H+ + 8e- == 4H2O
2O2 + 8e- + 4H2O === 8OH-
6.1.3 电极反应式的书写 化学电源
三、化学电源
6.1.3 电极反应式的书写 化学电源
三、化学电源
①总反应式:
②负极反应式:
③正极反应式:
化学电源中电极反应书写的思维模板
归纳
陌生的化学电源总反应式会给出。
(-)还原剂 - ne- = 氧化产物
(+)氧化剂 + ne- = 还原产物
四步法配平离子方程式
6.1.3 电极反应式的书写 化学电源
【练1】下列化学电池属于高效、环境友好电池的是
A.镍镉电池 B.锌锰电池
C.铅蓄电池 D.氢氧燃料电池
D
6.1.3 电极反应式的书写 化学电源
【练2】普通锌锰干电池的简图如图所示,该电池工作时的总反应为Zn+2NH4+ +2MnO2=[Zn(NH3)2]2++Mn2O3+H2O,关于锌锰干电池的下列说法中正确的是
A.当该电池电压逐渐下降后,能重新充电复原
B.电池工作一段时间后,碳棒会逐渐变细
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.1 mol电子,锌的质量理论上减小3.25 g
D
6.1.3 电极反应式的书写 化学电源
【练3】燃料电池是一种高效、环境友好的发电装置,某氢氧燃料电池的构造示意图如下,该电池工作时,下列说法正确的是
A.O2在b电极上发生氧化反应
B.电解质溶液中OH-向正极移动
C.该装置实现了电能到化学能的转化
D.氢氧燃料电池是一种具有应用前景的绿色电源
D
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
