7.3.1 乙醇 课件 高一下学期化学人教版(2019)必修第二册(共30张PPT)
文档属性
| 名称 | 7.3.1 乙醇 课件 高一下学期化学人教版(2019)必修第二册(共30张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 35.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-30 00:00:00 | ||
图片预览









文档简介
(共30张PPT)
第七章 有机化合物
第三节 乙醇和乙酸
第一课时 乙醇
7.3.1 乙醇
白日放歌须纵酒,青春作伴好还乡。
明月几时有,把酒问青天。
借问酒家何处有,牧童遥指杏花村。
何以解忧,唯有杜康。
欢时-----李白说:人生得意须尽欢,莫使金樽空对月。喜时-----杜甫说:白日放歌须纵酒,青春作伴好还乡。离时-----王维说:劝君更尽一杯酒,西出阳关无故人。愁时-----李白说:抽刀断水水更流,举杯消愁愁更愁。
7.3.1 乙醇
中国是最早掌握酿酒技术的国家之一,我国的酒文化源远流长。
7.3.1 乙醇
《本草纲目》——“烧酒非古法也,自元时始创。其法用浓酒和糟,蒸令汽上,用器承取滴露。”
【思考】以下说法或事实体现了乙醇哪些物理性质?
1.病人发烧通常用酒精擦拭全身,用此法降温。
2.衣服上沾上少许汽油用酒精可以去除。
3.酒香不怕巷子深
4.白酒的主要成分是乙醇
7.3.1 乙醇
一、乙醇的物理性质
颜 色:
气 味:
状 态:
密 度:
挥发性:
溶解性:
无色透明
特殊香味
液体
比水小
200C时的密度是0.7893g/cm3
和水可以以任意比互溶,能够溶解多种无机物和有机物
易挥发,沸点78℃
工业制备无水乙醇:用工业酒精与新制生石灰混合再进行蒸馏
7.3.1 乙醇
二、乙醇的分子结构
空间充填模型
分子式
C2H6O
CH3CH2OH C2H5OH
结构简式
球棍模型
H — C—C—O—H
H H
H H
结构式:
7.3.1 乙醇
二、乙醇的分子结构
烃的衍生物
像这样,烃分子中的H原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
C—C H
H
H
H
H
H
CH3CH2Cl
CH3COOH
C—C O H
H
H
H
H
H
醇的官能团:羟基(-OH)
乙醇分子可以看作是乙烷分子里的一个氢原子被羟基所取代的产物
决定有机化合物化学特性的原子或原子团
官能团
7.3.1 乙醇
二、乙醇的分子结构
羟基与氢氧根的比较
—OH OH-
电子式
电性
稳定性 及存在
带一个负电荷的阴离子
电中性
稳定,能独立存在于溶液或离子化合物中
不稳定,不能独立存在,必须和其他“基”或原子相结合
7.3.1 乙醇
二、乙醇的分子结构
物质 CH3Cl CH3CH2OH CH2==CH2 CH≡CH
所含官能团 ________ _______ ________
官能团名称 _______ _____ _________ _________
—OH
碳氯键
羟基
碳碳双键
碳碳三键
特别提醒 烷基(—CnH2n+1,如—CH3、—C2H5等)不是官能团,苯基( )也不是官能团。
7.3.1 乙醇
对点训练一
1.比较乙烷和乙醇的结构,下列说法错误的是
A.分子中的化学键都包括极性键和非极性键
B.分子中都含6个氢原子且6个氢原子的化学环境完全相同
C.乙基与1个氢原子相连就是乙烷分子
D.乙基与1个羟基相连就是乙醇分子
√
7.3.1 乙醇
对点训练一
2.下列物质中含有两种官能团的是
A.氯乙烯(CH2==CHCl)
B.苯乙烯( )
C.丙三醇( )
D.甲苯( )
√
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
7.3.1 乙醇
二、乙醇的分子结构
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O—H键和②C—O键的电子对都向氧原子偏移。
因而,醇在起反应时, ①O—H键和②C—O键容易断裂。
结构决定性质
7.3.1 乙醇
三、乙醇的化学性质
【实验7-4】钠与乙醇或水的的反应
钠与水 钠与乙醇
钠是否浮在液面上
有无声音
有无气泡
剧烈程度
是否熔成小球
反应方程式
剧烈
?
2Na+2H2O=2 NaOH +H2↑
浮在水面
发出嘶嘶声
有
是
7.3.1 乙醇
三、乙醇的化学性质
【实验7-4】钠与乙醇或水的的反应
钠与水 钠与乙醇
钠是否浮在液面上
有无声音
有无气泡
剧烈程度
是否熔成小球
反应方程式
剧烈
缓慢
?
2Na+2H2O=2 NaOH +H2↑
先沉在液体下部
响声很小
有
浮在水面
发出嘶嘶声
有
是
否
7.3.1 乙醇
三、乙醇的化学性质
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
H—C —C—O—H ,
H H
H H
①处O—H键断开
①
每2mol乙醇与足量的Na反应生成
2 —O—H ~ 1 H2
1. 置换反应(与Na反应)
7.3.1 乙醇
三、乙醇的化学性质
想一想:实验现象说明了什么问题
(1)钠浮在水面上,而沉在乙醇中
(3)钠与乙醇的反应速率比钠与水的反应速率慢, 说明羟基上的H原子与水分子中H原子的活泼性:
(2)乙醇与钠反应的性质是由它的什么决定的
[说明] (1)水的密度>钠的密度>乙醇的密度
(2)羟基决定乙醇能和钠反应生成氢气
(3)羟基中的H原子的活泼性:醇<水
官能团决定有机物的性质,连接官能团的其它部分对性质也有所影响。
7.3.1 乙醇
三、乙醇的化学性质
2. 氧化反应
(1)燃烧
发出淡蓝色火焰,并放出大量热
燃烧产物清洁,无污染,可作燃料使用
C2H5OH +3O2 2CO2+3H2O
点燃
酒精燃烧
7.3.1 乙醇
三、乙醇的化学性质
焊接银器、铜器时,表面会生成发黑的氧化膜。工匠师傅说,可以先把银器和铜器在火上烧热,马上蘸一下酒精,铜银会光亮如初。
这其中包含的科学道理是什么呢?
7.3.1 乙醇
三、乙醇的化学性质
2. 氧化反应
实验7-5
把灼热的铜丝插入乙醇中,观察铜丝颜色变化,并小心闻试管中液体产生的气味。
(2)乙醇的催化氧化
7.3.1 乙醇
三、乙醇的化学性质
2. 氧化反应
(2)乙醇的催化氧化
铜丝
变黑
2Cu + O2 2CuO
△
产生刺激性气味
Δ
CH3CH2OH+CuO +Cu
CH3CHO
乙醛
+H2O
总反应方程式:
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
[思考]铜丝在此实验中起什么作用?
资料卡片
乙醛(CH3CHO)毒性是乙醇
的十倍,积累在体内会使人
面红耳赤,神志不清。
氧化反应:有机物“得氧”或“去氢”的反应
还原反应:有机物“得氢”或“去氧”的反应
7.3.1 乙醇
三、乙醇的化学性质
2. 氧化反应
(2)乙醇的催化氧化
Cu
乙醇
乙醛
氧原子
水
H—C—C—O
H
H
H
H
H
H—C—C—O
H
H
H
-----
-----
反应机理
7.3.1 乙醇
三、乙醇的化学性质
2. 氧化反应
(2)被酸性KMnO4 、K2Cr2O7 溶液氧化为乙酸
CH3CH2OH CH3COOH
酸性高锰酸钾溶液
酸性重铬酸钾溶液
应用:交警判断驾驶员是否酒后驾车
K2Cr2O7(橙黄色)
Cr2(SO4)3(蓝绿色)
C2H5OH
7.3.1 乙醇
三、乙醇的化学性质
乙醇在体内的代谢过程
为什么有的人 “干杯万盏皆不醉”,而有的人则“沉醉不知归路 ,熟睡不解残酒” 乙醇在人体内究竟发生了哪些化学变化
7.3.1 乙醇
三、乙醇的化学性质
乙醇的性质 化学反应方程式 键的断裂
1.与钠反应
2.氧化反应 催化氧化
燃烧
与强氧化剂(如KMnO4)反应 乙醇能使酸性高锰酸钾溶液紫色褪去 断①键
断①③键
断①②③④⑤键
2C2H5OH+2Na―→2C2H5ONa+H2↑
总结提升
“结构决定性质, 性质决定用途”
7.3.1 乙醇
四、乙醇的用途
乙 醇
消毒剂(75%的乙醇溶液)体积分数
医药
可以做燃料,提供能量
燃料
化工原料
饮料
可以做溶剂,提取多种有机物、无机物
工业
7.3.1 乙醇
对点训练二
1.(2022·河北邯郸市高一检测)乙醇分子结构中各种化学键如图所示,下列对乙醇的有关说法不正确的是
A.与金属钠反应时断裂①
B.乙醇燃烧时所有键都断裂
C.乙醇在铜催化下和氧气反应键①和③断裂
D.向乙醇的水溶液中滴入几滴酚酞,溶液变红色
√
1.下列有关乙醇的表述正确的是
A.乙醇分子中含有甲基,甲基的电子式为
B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为
D.乙醇分子的空间填充模型为
√
1
2
3
4
5
2.(2022·山东泰安一中高一月考)下列关于乙醇结构与性质的说法正确的是
A.乙醇分子中含有—OH,所以乙醇可溶于水,也可电离出OH-
B.乙醇能电离出H+,所以是电解质
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇分子中羟基上的氢原子不如水中的
氢原子活泼
1
2
3
4
5
√
3.交警检查司机是否饮酒的原理:橙色的酸性K2Cr2O7溶液遇到呼出的乙醇蒸气时迅速变绿(Cr3+)。下列对乙醇的描述与此原理有关的是
A.乙醇易挥发
B.乙醇的密度比水的小
C.乙醇具有还原性
D.乙醇是烃的含氧衍生物
√
乙醇具有还原性,可被酸性K2Cr2O7溶液氧化,溶液由橙色变为绿色;检查时,需要呼出乙醇蒸气,说明乙醇易挥发。
1
2
3
4
5
√
7.3.1 乙醇
本课结束
巩固练习:
7.3.1 乙醇对应课时作业
第七章 有机化合物
第三节 乙醇和乙酸
第一课时 乙醇
7.3.1 乙醇
白日放歌须纵酒,青春作伴好还乡。
明月几时有,把酒问青天。
借问酒家何处有,牧童遥指杏花村。
何以解忧,唯有杜康。
欢时-----李白说:人生得意须尽欢,莫使金樽空对月。喜时-----杜甫说:白日放歌须纵酒,青春作伴好还乡。离时-----王维说:劝君更尽一杯酒,西出阳关无故人。愁时-----李白说:抽刀断水水更流,举杯消愁愁更愁。
7.3.1 乙醇
中国是最早掌握酿酒技术的国家之一,我国的酒文化源远流长。
7.3.1 乙醇
《本草纲目》——“烧酒非古法也,自元时始创。其法用浓酒和糟,蒸令汽上,用器承取滴露。”
【思考】以下说法或事实体现了乙醇哪些物理性质?
1.病人发烧通常用酒精擦拭全身,用此法降温。
2.衣服上沾上少许汽油用酒精可以去除。
3.酒香不怕巷子深
4.白酒的主要成分是乙醇
7.3.1 乙醇
一、乙醇的物理性质
颜 色:
气 味:
状 态:
密 度:
挥发性:
溶解性:
无色透明
特殊香味
液体
比水小
200C时的密度是0.7893g/cm3
和水可以以任意比互溶,能够溶解多种无机物和有机物
易挥发,沸点78℃
工业制备无水乙醇:用工业酒精与新制生石灰混合再进行蒸馏
7.3.1 乙醇
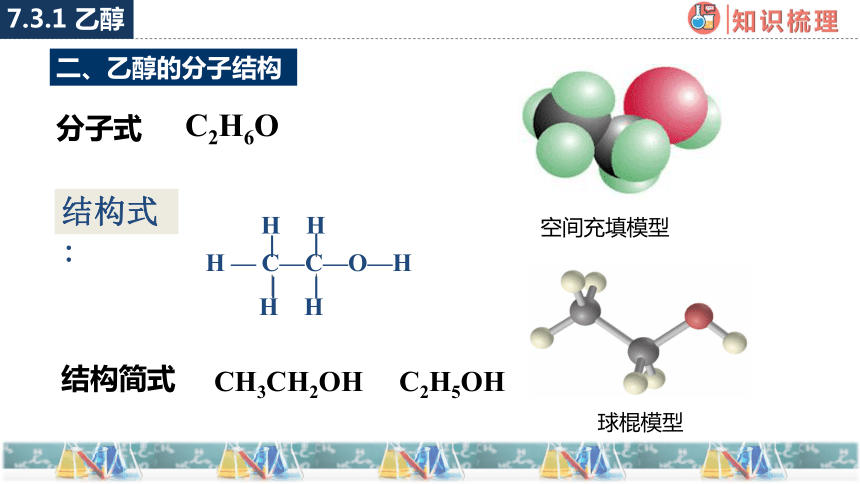
二、乙醇的分子结构
空间充填模型
分子式
C2H6O
CH3CH2OH C2H5OH
结构简式
球棍模型
H — C—C—O—H
H H
H H
结构式:
7.3.1 乙醇
二、乙醇的分子结构
烃的衍生物
像这样,烃分子中的H原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
C—C H
H
H
H
H
H
CH3CH2Cl
CH3COOH
C—C O H
H
H
H
H
H
醇的官能团:羟基(-OH)
乙醇分子可以看作是乙烷分子里的一个氢原子被羟基所取代的产物
决定有机化合物化学特性的原子或原子团
官能团
7.3.1 乙醇
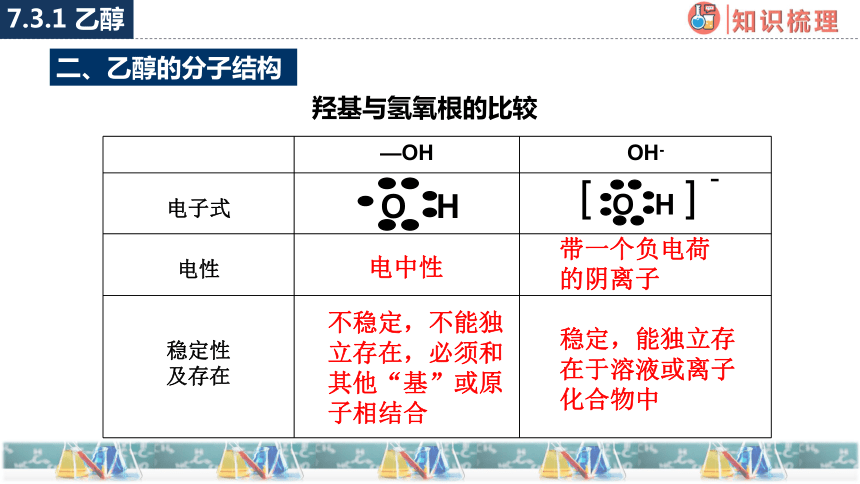
二、乙醇的分子结构
羟基与氢氧根的比较
—OH OH-
电子式
电性
稳定性 及存在
带一个负电荷的阴离子
电中性
稳定,能独立存在于溶液或离子化合物中
不稳定,不能独立存在,必须和其他“基”或原子相结合
7.3.1 乙醇
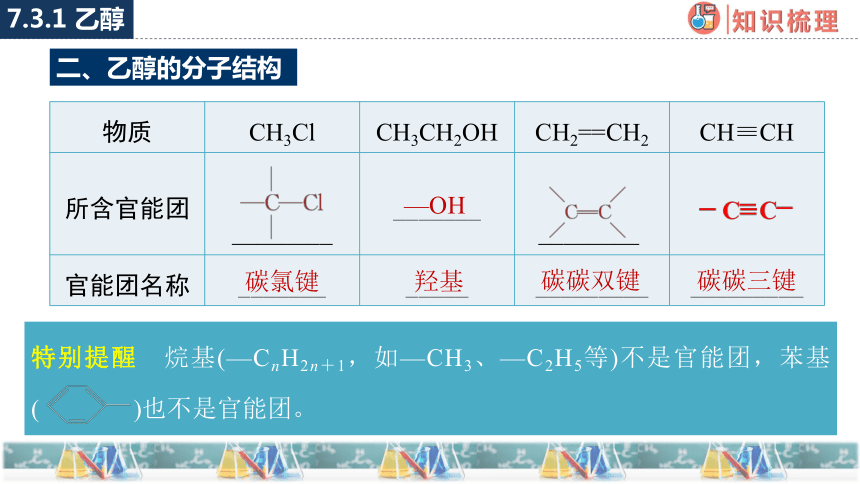
二、乙醇的分子结构
物质 CH3Cl CH3CH2OH CH2==CH2 CH≡CH
所含官能团 ________ _______ ________
官能团名称 _______ _____ _________ _________
—OH
碳氯键
羟基
碳碳双键
碳碳三键
特别提醒 烷基(—CnH2n+1,如—CH3、—C2H5等)不是官能团,苯基( )也不是官能团。
7.3.1 乙醇
对点训练一
1.比较乙烷和乙醇的结构,下列说法错误的是
A.分子中的化学键都包括极性键和非极性键
B.分子中都含6个氢原子且6个氢原子的化学环境完全相同
C.乙基与1个氢原子相连就是乙烷分子
D.乙基与1个羟基相连就是乙醇分子
√
7.3.1 乙醇
对点训练一
2.下列物质中含有两种官能团的是
A.氯乙烯(CH2==CHCl)
B.苯乙烯( )
C.丙三醇( )
D.甲苯( )
√
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
7.3.1 乙醇
二、乙醇的分子结构
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O—H键和②C—O键的电子对都向氧原子偏移。
因而,醇在起反应时, ①O—H键和②C—O键容易断裂。
结构决定性质
7.3.1 乙醇
三、乙醇的化学性质
【实验7-4】钠与乙醇或水的的反应
钠与水 钠与乙醇
钠是否浮在液面上
有无声音
有无气泡
剧烈程度
是否熔成小球
反应方程式
剧烈
?
2Na+2H2O=2 NaOH +H2↑
浮在水面
发出嘶嘶声
有
是
7.3.1 乙醇
三、乙醇的化学性质
【实验7-4】钠与乙醇或水的的反应
钠与水 钠与乙醇
钠是否浮在液面上
有无声音
有无气泡
剧烈程度
是否熔成小球
反应方程式
剧烈
缓慢
?
2Na+2H2O=2 NaOH +H2↑
先沉在液体下部
响声很小
有
浮在水面
发出嘶嘶声
有
是
否
7.3.1 乙醇
三、乙醇的化学性质
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
H—C —C—O—H ,
H H
H H
①处O—H键断开
①
每2mol乙醇与足量的Na反应生成
2 —O—H ~ 1 H2
1. 置换反应(与Na反应)
7.3.1 乙醇
三、乙醇的化学性质
想一想:实验现象说明了什么问题
(1)钠浮在水面上,而沉在乙醇中
(3)钠与乙醇的反应速率比钠与水的反应速率慢, 说明羟基上的H原子与水分子中H原子的活泼性:
(2)乙醇与钠反应的性质是由它的什么决定的
[说明] (1)水的密度>钠的密度>乙醇的密度
(2)羟基决定乙醇能和钠反应生成氢气
(3)羟基中的H原子的活泼性:醇<水
官能团决定有机物的性质,连接官能团的其它部分对性质也有所影响。
7.3.1 乙醇
三、乙醇的化学性质
2. 氧化反应
(1)燃烧
发出淡蓝色火焰,并放出大量热
燃烧产物清洁,无污染,可作燃料使用
C2H5OH +3O2 2CO2+3H2O
点燃
酒精燃烧
7.3.1 乙醇
三、乙醇的化学性质
焊接银器、铜器时,表面会生成发黑的氧化膜。工匠师傅说,可以先把银器和铜器在火上烧热,马上蘸一下酒精,铜银会光亮如初。
这其中包含的科学道理是什么呢?
7.3.1 乙醇
三、乙醇的化学性质
2. 氧化反应
实验7-5
把灼热的铜丝插入乙醇中,观察铜丝颜色变化,并小心闻试管中液体产生的气味。
(2)乙醇的催化氧化
7.3.1 乙醇
三、乙醇的化学性质
2. 氧化反应
(2)乙醇的催化氧化
铜丝
变黑
2Cu + O2 2CuO
△
产生刺激性气味
Δ
CH3CH2OH+CuO +Cu
CH3CHO
乙醛
+H2O
总反应方程式:
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
[思考]铜丝在此实验中起什么作用?
资料卡片
乙醛(CH3CHO)毒性是乙醇
的十倍,积累在体内会使人
面红耳赤,神志不清。
氧化反应:有机物“得氧”或“去氢”的反应
还原反应:有机物“得氢”或“去氧”的反应
7.3.1 乙醇
三、乙醇的化学性质
2. 氧化反应
(2)乙醇的催化氧化
Cu
乙醇
乙醛
氧原子
水
H—C—C—O
H
H
H
H
H
H—C—C—O
H
H
H
-----
-----
反应机理
7.3.1 乙醇
三、乙醇的化学性质
2. 氧化反应
(2)被酸性KMnO4 、K2Cr2O7 溶液氧化为乙酸
CH3CH2OH CH3COOH
酸性高锰酸钾溶液
酸性重铬酸钾溶液
应用:交警判断驾驶员是否酒后驾车
K2Cr2O7(橙黄色)
Cr2(SO4)3(蓝绿色)
C2H5OH
7.3.1 乙醇
三、乙醇的化学性质
乙醇在体内的代谢过程
为什么有的人 “干杯万盏皆不醉”,而有的人则“沉醉不知归路 ,熟睡不解残酒” 乙醇在人体内究竟发生了哪些化学变化
7.3.1 乙醇
三、乙醇的化学性质
乙醇的性质 化学反应方程式 键的断裂
1.与钠反应
2.氧化反应 催化氧化
燃烧
与强氧化剂(如KMnO4)反应 乙醇能使酸性高锰酸钾溶液紫色褪去 断①键
断①③键
断①②③④⑤键
2C2H5OH+2Na―→2C2H5ONa+H2↑
总结提升
“结构决定性质, 性质决定用途”
7.3.1 乙醇
四、乙醇的用途
乙 醇
消毒剂(75%的乙醇溶液)体积分数
医药
可以做燃料,提供能量
燃料
化工原料
饮料
可以做溶剂,提取多种有机物、无机物
工业
7.3.1 乙醇
对点训练二
1.(2022·河北邯郸市高一检测)乙醇分子结构中各种化学键如图所示,下列对乙醇的有关说法不正确的是
A.与金属钠反应时断裂①
B.乙醇燃烧时所有键都断裂
C.乙醇在铜催化下和氧气反应键①和③断裂
D.向乙醇的水溶液中滴入几滴酚酞,溶液变红色
√
1.下列有关乙醇的表述正确的是
A.乙醇分子中含有甲基,甲基的电子式为
B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为
D.乙醇分子的空间填充模型为
√
1
2
3
4
5
2.(2022·山东泰安一中高一月考)下列关于乙醇结构与性质的说法正确的是
A.乙醇分子中含有—OH,所以乙醇可溶于水,也可电离出OH-
B.乙醇能电离出H+,所以是电解质
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇分子中羟基上的氢原子不如水中的
氢原子活泼
1
2
3
4
5
√
3.交警检查司机是否饮酒的原理:橙色的酸性K2Cr2O7溶液遇到呼出的乙醇蒸气时迅速变绿(Cr3+)。下列对乙醇的描述与此原理有关的是
A.乙醇易挥发
B.乙醇的密度比水的小
C.乙醇具有还原性
D.乙醇是烃的含氧衍生物
√
乙醇具有还原性,可被酸性K2Cr2O7溶液氧化,溶液由橙色变为绿色;检查时,需要呼出乙醇蒸气,说明乙醇易挥发。
1
2
3
4
5
√
7.3.1 乙醇
本课结束
巩固练习:
7.3.1 乙醇对应课时作业
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
