第1-4单元复习测试题 (含答案) 2024-2025学年人教版九年级化学上册
文档属性
| 名称 | 第1-4单元复习测试题 (含答案) 2024-2025学年人教版九年级化学上册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-30 16:16:24 | ||
图片预览



文档简介
第1-4单元复习测试题
第I卷 选择题(共40分)
(本题共20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1. 《天工开物》记载的下列造物过程中涉及化学变化的是( )
A. 棉线织布 B. 粮食酿酒
C. 楠木制舟 D. 沙里淘金
2. 下列物质由离子构成的是( )
A. 氮气 B. 氯化钠 C. 水 D. 金刚石
3. 下列变化过程不属于缓慢氧化的是( )
A. 铁钉生锈 B. 食物腐烂
C. 呼吸作用 D. 蜡烛燃烧
4. 人体中含有多种元素,下列属于人体必需微量元素的是( )
A. Mn B. C C. Ca D. N
5. 下列符号表示2个氧分子的是( )
A. 2O B. 2O2 C. 2O2- D. O2
6. 下列实验或事实能证明分子在化学反应中可以再分的是( )
A. 将红墨水滴入清水中
B. 自来水制蒸馏水
C. 分离液态空气得到氧气和氯气
D. 水电解得到氧气和氢气
7. 地壳中含量居第二位,其单质是优良的半导体材料的元素是( )
A. Fe B. Si C. Al D. O
8. 下列说法中不正确的是( )
A. 含氧化合物不一定是氧化物
B. 纯净物一定由同种微粒构成
C. 能分解出氧气的化合物不一定是氧化物
D. 由同种元素组成的物质不一定是单质
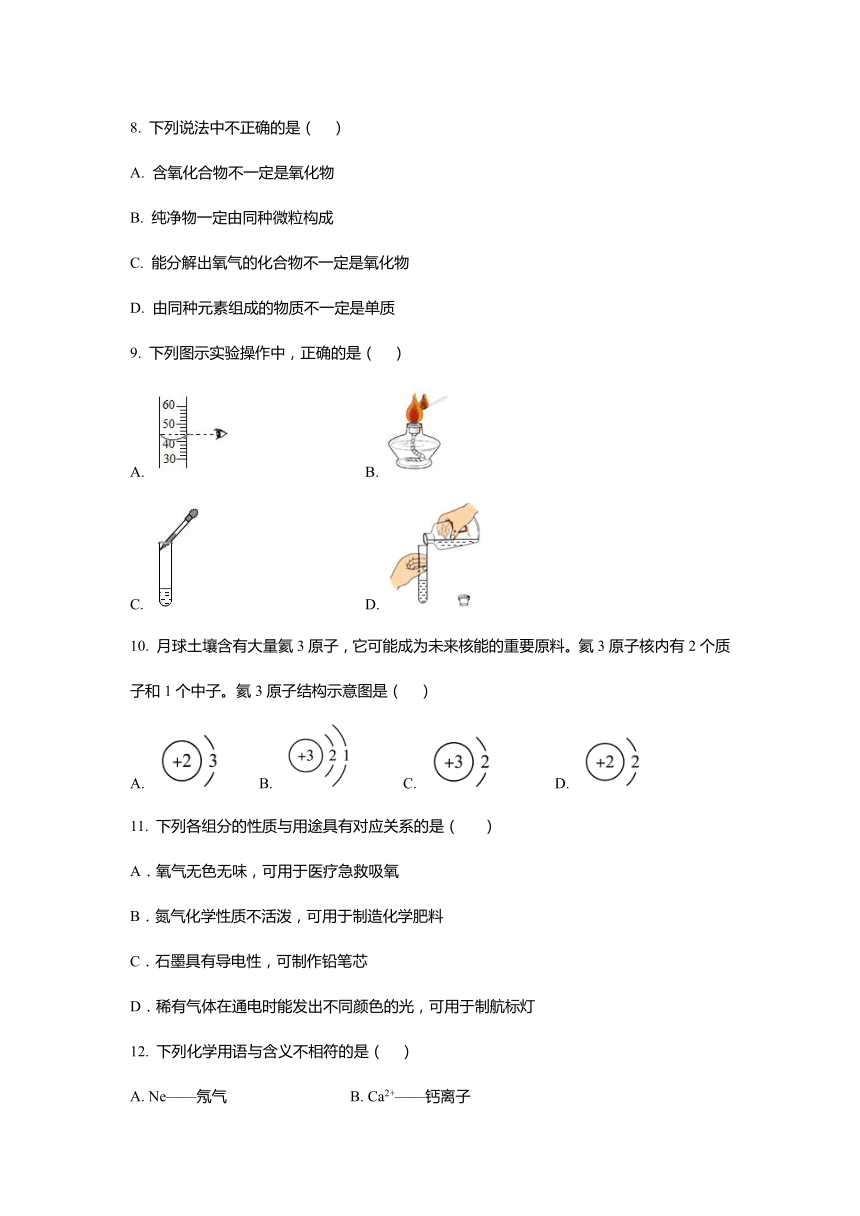
9. 下列图示实验操作中,正确的是( )
A. B.
C. D.
10. 月球土壤含有大量氦3原子,它可能成为未来核能的重要原料。氦3原子核内有2个质子和1个中子。氦3原子结构示意图是( )
A. B. C. D.
11. 下列各组分的性质与用途具有对应关系的是( )
A.氧气无色无味,可用于医疗急救吸氧
B.氮气化学性质不活泼,可用于制造化学肥料
C.石墨具有导电性,可制作铅笔芯
D.稀有气体在通电时能发出不同颜色的光,可用于制航标灯
12. 下列化学用语与含义不相符的是( )
A. Ne——氖气 B. Ca2+——钙离子
C. O2——2个氧原子 D. 2H2O——2个水分子
13. 北京大学生命科学学院蒋争凡教授研究组发现,锰离子是细胞内天然免疫激活剂和警报素。在元素周期表中锰元素的某些信息如图所示,下列有关锰的说法不正确的是( )
A. 原子核外电子数为25
B. 属于金属元素
C. 原子核内中子数为30
D. 相对原子质量为54.94g
14. 某同学为了探究微粒性质,按图示进行实验,并借助传感设备测得U型管a、b中氨气浓度随时间变化的曲线,下列关于该实验的说法中不正确的是( )
A. 曲线X对应的U型管为a
B. 0-1min,氨气浓度为零是因为微粒静止不动
C. 实验证明了微粒运动速率与温度有关
D. 湿棉花的作用是吸收NH3,减少NH3对空气的污染
15. 推理是化学学习中常用的思维方法,下列推理正确的是( )
A.离子是带电的粒子,所以带电的粒子一定是离子
B.元素的种类是由质子数决定的,则质子数相同的微粒一定属于同种元素
C.化学变化伴随有能量变化,所以有能量变化的一定是化学变化
D.化合物中含有不同种元素,所以由不同种元素组成的纯净物一定是化合物
16. 氢气和氧气在Pd基催化剂表面可反应生成过氧化氢,其微观示意图如下。下列说法不正确的是( )
A.生成过氧化氢的 微观过程的顺序是④③①②
B.过程③中,氧分子的结构被破坏
C.该过程可以说明分子可以分解成原子
D.该反应的符号表达式为
17. 桂花的花香清甜浓郁。桂花香气的成分有多种,其中之一是芳樟醇,它的化学式为C10H18O,下列有关芳樟醇的说法正确的是( )
A. 芳樟醇由3种元素组成
B. 芳樟醇属于氧化物
C. 芳樟醇由10个碳原子、18个氢原子和1个氧原子构成
D. 芳樟醇中氢元素的质量分数最小
18. 现有SO3、M、S、H2S四种物质,按硫元素的化合价由高到低排列,其中M这种物质的化学式可以是( )
A. Na2S B. H2SO4 C. H2SO3 D. Na2SO4
19. 下列各组等质量的物质中,含碳量相同的一组是( )
A. 维生素(C6H8O6)和甘油(C3H8O3)
B. 甲烷(CH4)和乙烷(C2H6)
C. 葡萄糖(C6H12O6)和甲醛(HCHO)
D. 甲醇(CH3OH)和乙醇(C4H10O)
20. 我国科研人员将二氧化碳高效合成为可供微生物直接利用的物质X,合成过程中主要物质转化的微现示意图如下,下列说法错误的是( )
A. 催化剂提高了合成速率
B. X的化学式为CH3COOH
C. CO2合成的过程中伴随能量变化
D. 转化过程中碳元素化合价不改变
第II卷 非选择题(共60分)
21. 生活中处处有化学。
(1)现有下列6种物质,请选择相应字母编号填空:
A.金刚石 B. 酒精 C. 葡萄糖酸锌 D. 碳酸氢铵 E. 氮气 F. 镁粉
①实验室最常用的燃料________;
②可预防侏儒症的是_______;
③可用于切割玻璃的是_______;
④农业生产中用作化肥________;
⑤可用于烟花和照明弹的是________;
⑥可用作食品保护气的是________;
(2)厨房味精可以增加膳食的美味。其主要成分为“谷氨酸钠”(化学式是C5H8NO4Na),另外还含有少量NaCl(其他成分不考虑)。则味精属于________(填“混合物”或“纯净物”),味精中至少含有_________种元素(填数字)。
(3)请用化学用语填空:
①海水中含量最多的阳离子_______;
②地壳中含量最多的金属元素________;
③含氧量最高的氧化物________。
(4)空气是由多种成分组成的。
I.从微观角度:用表示氮原子,○表示氧原子。
①用“”表示的微粒是________。
②同温同压下,气体的体积比等于分子数目比。将4体积氮气与1体积氧气混合,其成分可用图3的微观模型表示的是______(填字母编号)。
II.从变化角度:
③常压下,液态氮的沸点_______液态氧的沸点(填“>”或“<”或“=”)。将燃着的木条置于盛满液态空气的集气瓶口,观察到的现象是_______。将该集气瓶放置一段时间后,液态物质剩余约1/10体积,其主要成分是________。
III.从科技的角度
④如图为某种分子筛型家用制氧机工作时气体变化的微观示意图,该制氧机的原理是_______,该变化属于______(填“物理”或“化学”)变化。
(5)食品中的化学
牛奶中富含钙,是膳食中最容易被吸收的钙的来源。如图是某乳业公司纯牛奶包装标签文字说明。
纯牛奶 配料:鲜牛奶 保质期:6个月(4℃) 净含量:230mL/盒 钙含量:(每100mL) 钙≥0.11g
标签中“钙含量”中的钙指的是______(填字母)
碳酸钙 B. 钙元素 C. 钙单质 D. 钙原子
青少年缺钙可能导致______。
若儿童每天至少需要0.6g的钙,假设这些钙有90%来自牛奶,则每人每天要喝______盒这种牛奶。(结果取整数)
22. 某兴趣小组根据如图所示装置进行试验,请你参与并回答:
(1)写出标号仪器的名称:①_______;②________。
(2)实验室选用装置A制取氧气的化学式表达式为________,利用注射器可以检查装置A的气密性。如图E所示,在锥形瓶内装适量的水,使长颈漏斗末端浸没在液面以下,将活塞缓慢向外拉动,若观察到________,则装置不漏气。发生装置还可选用B,相对于A而言,B的优点是________。
(3)用装置C制取氧气,反应的化学式表达式为________;用D装置收集氧气,观察到_________现象停止收集,并将集气瓶在_______(填“水槽外”或“水槽内”)盖上玻璃片,________(填“正放”或“倒放”)实验台上。
(4)实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。甲烷的密度比空气小,不溶于水。选用______装置制取甲烷,收集气体时可选用_______或_______。
(5)确定实验室制取气体的反应原理时,下列因素中不需要考虑的是 (填字母)。
A. 药品易得,且含有要制备气体的组成元素
B. 反应条件易于控制,反应速率适中
C. 操作简便易行,安全可靠,节能环保
D. 所要制取气体是否溶于水
23. 水是生命活动不可缺少的物质。请回答相关的问题。
I.探究水的组成实验
(1)为证明水不是由“水元素”组成的,1785年,拉瓦锡在高温的条件下,用水蒸气与红热的铁反应,将水转化为氢气,同时生成四氧化三铁。模拟实验装置如图1所示。
①该反应的化学式表达式为______。
②加热铁粉前,应先通入水蒸气一段时间,目的是_______。
(2)电解水实验的简易装置如图2所示,b中收集到的气体是________(填化学式);电解水属于________(填基本反应类型);从微观角度看,电解水时,水分解过程中发生改变的是________。
(3)图2测得V(a):V(b)=2:1,要确定水分子中氢氧原子个数比,还需要的数据有 (填字母)。
A. 水的相对分子质量
B. 氢气、氧气的密度
C. 氢原子、氧原子的质量
II.水的净化
化学兴趣小组收集了一瓶浑浊的运河的河水,模拟自来水厂进行水的净化过程。其实验过程如图所示,请回答以下问题。
(4)自来水厂常用明矾作混凝剂,明矾[KAl(SO4)m·12H2O]能作絮凝剂,是因为明矾溶于水后生成具有吸附作用的胶状物氢氧化铝,则m=________,氢氧化铝的化学式为__________。
(5)操作1的名称是________,该操作中所需的玻璃仪器有烧杯、________、玻璃棒。
(6)操作2是吸附。主要除去液体C中一些异味和色素,可选用的物质是________。
(7)判断净化水是硬水还是软水,可加入________鉴别;将净化水煮沸,则加热煮沸除了杀菌消毒之外,还起到的作用是_________;欲使海水转化为淡水,则可采取的方法是________。
III.污水处理
(8)聚合氯化铁可处理污水中的悬浮物质和还原物质。某污水处理厂用聚合氯化铁处理污水的结果如图所示。由图中数据得出污水中投放聚合氯化铁(以Fe/mg·L-1计算)的最佳范围约为______ mg·L-1。
24. 合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
(1)合成塔中的反应必须在高温、高压、催化剂条件下进行,该反应属于_______(填基本反应类型)反应。
(2)生产过程中从合成塔中输出的气体属于_______(填“纯净物”或“混合物”)。
(3)生产过程中可重复循环使用的物质是_______。
(4)根据表中的数据回答问题。
物质 H2 N2 NH3
沸点/℃(1.01×105Pa) -252 -195.8 -33.35
在1.01×105Pa时,欲将NH3与N2、H2分离,最好将温度控制在以下哪个温度
A. -260℃ B. -200℃ C. -35℃ D. 0℃
(5)获得的氨气还可以在一定条件下和二氧化碳反应,合成尿素【化学式为CO(NH2)2】,同时生成水,请写出该反应符号表达式_______。
答案
1-20 BBDAB DBBBD DCDBD BACCD
21.
22.
23.
干扰
24 +H2O
第I卷 选择题(共40分)
(本题共20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1. 《天工开物》记载的下列造物过程中涉及化学变化的是( )
A. 棉线织布 B. 粮食酿酒
C. 楠木制舟 D. 沙里淘金
2. 下列物质由离子构成的是( )
A. 氮气 B. 氯化钠 C. 水 D. 金刚石
3. 下列变化过程不属于缓慢氧化的是( )
A. 铁钉生锈 B. 食物腐烂
C. 呼吸作用 D. 蜡烛燃烧
4. 人体中含有多种元素,下列属于人体必需微量元素的是( )
A. Mn B. C C. Ca D. N
5. 下列符号表示2个氧分子的是( )
A. 2O B. 2O2 C. 2O2- D. O2
6. 下列实验或事实能证明分子在化学反应中可以再分的是( )
A. 将红墨水滴入清水中
B. 自来水制蒸馏水
C. 分离液态空气得到氧气和氯气
D. 水电解得到氧气和氢气
7. 地壳中含量居第二位,其单质是优良的半导体材料的元素是( )
A. Fe B. Si C. Al D. O
8. 下列说法中不正确的是( )
A. 含氧化合物不一定是氧化物
B. 纯净物一定由同种微粒构成
C. 能分解出氧气的化合物不一定是氧化物
D. 由同种元素组成的物质不一定是单质
9. 下列图示实验操作中,正确的是( )
A. B.
C. D.
10. 月球土壤含有大量氦3原子,它可能成为未来核能的重要原料。氦3原子核内有2个质子和1个中子。氦3原子结构示意图是( )
A. B. C. D.
11. 下列各组分的性质与用途具有对应关系的是( )
A.氧气无色无味,可用于医疗急救吸氧
B.氮气化学性质不活泼,可用于制造化学肥料
C.石墨具有导电性,可制作铅笔芯
D.稀有气体在通电时能发出不同颜色的光,可用于制航标灯
12. 下列化学用语与含义不相符的是( )
A. Ne——氖气 B. Ca2+——钙离子
C. O2——2个氧原子 D. 2H2O——2个水分子
13. 北京大学生命科学学院蒋争凡教授研究组发现,锰离子是细胞内天然免疫激活剂和警报素。在元素周期表中锰元素的某些信息如图所示,下列有关锰的说法不正确的是( )
A. 原子核外电子数为25
B. 属于金属元素
C. 原子核内中子数为30
D. 相对原子质量为54.94g
14. 某同学为了探究微粒性质,按图示进行实验,并借助传感设备测得U型管a、b中氨气浓度随时间变化的曲线,下列关于该实验的说法中不正确的是( )
A. 曲线X对应的U型管为a
B. 0-1min,氨气浓度为零是因为微粒静止不动
C. 实验证明了微粒运动速率与温度有关
D. 湿棉花的作用是吸收NH3,减少NH3对空气的污染
15. 推理是化学学习中常用的思维方法,下列推理正确的是( )
A.离子是带电的粒子,所以带电的粒子一定是离子
B.元素的种类是由质子数决定的,则质子数相同的微粒一定属于同种元素
C.化学变化伴随有能量变化,所以有能量变化的一定是化学变化
D.化合物中含有不同种元素,所以由不同种元素组成的纯净物一定是化合物
16. 氢气和氧气在Pd基催化剂表面可反应生成过氧化氢,其微观示意图如下。下列说法不正确的是( )
A.生成过氧化氢的 微观过程的顺序是④③①②
B.过程③中,氧分子的结构被破坏
C.该过程可以说明分子可以分解成原子
D.该反应的符号表达式为
17. 桂花的花香清甜浓郁。桂花香气的成分有多种,其中之一是芳樟醇,它的化学式为C10H18O,下列有关芳樟醇的说法正确的是( )
A. 芳樟醇由3种元素组成
B. 芳樟醇属于氧化物
C. 芳樟醇由10个碳原子、18个氢原子和1个氧原子构成
D. 芳樟醇中氢元素的质量分数最小
18. 现有SO3、M、S、H2S四种物质,按硫元素的化合价由高到低排列,其中M这种物质的化学式可以是( )
A. Na2S B. H2SO4 C. H2SO3 D. Na2SO4
19. 下列各组等质量的物质中,含碳量相同的一组是( )
A. 维生素(C6H8O6)和甘油(C3H8O3)
B. 甲烷(CH4)和乙烷(C2H6)
C. 葡萄糖(C6H12O6)和甲醛(HCHO)
D. 甲醇(CH3OH)和乙醇(C4H10O)
20. 我国科研人员将二氧化碳高效合成为可供微生物直接利用的物质X,合成过程中主要物质转化的微现示意图如下,下列说法错误的是( )
A. 催化剂提高了合成速率
B. X的化学式为CH3COOH
C. CO2合成的过程中伴随能量变化
D. 转化过程中碳元素化合价不改变
第II卷 非选择题(共60分)
21. 生活中处处有化学。
(1)现有下列6种物质,请选择相应字母编号填空:
A.金刚石 B. 酒精 C. 葡萄糖酸锌 D. 碳酸氢铵 E. 氮气 F. 镁粉
①实验室最常用的燃料________;
②可预防侏儒症的是_______;
③可用于切割玻璃的是_______;
④农业生产中用作化肥________;
⑤可用于烟花和照明弹的是________;
⑥可用作食品保护气的是________;
(2)厨房味精可以增加膳食的美味。其主要成分为“谷氨酸钠”(化学式是C5H8NO4Na),另外还含有少量NaCl(其他成分不考虑)。则味精属于________(填“混合物”或“纯净物”),味精中至少含有_________种元素(填数字)。
(3)请用化学用语填空:
①海水中含量最多的阳离子_______;
②地壳中含量最多的金属元素________;
③含氧量最高的氧化物________。
(4)空气是由多种成分组成的。
I.从微观角度:用表示氮原子,○表示氧原子。
①用“”表示的微粒是________。
②同温同压下,气体的体积比等于分子数目比。将4体积氮气与1体积氧气混合,其成分可用图3的微观模型表示的是______(填字母编号)。
II.从变化角度:
③常压下,液态氮的沸点_______液态氧的沸点(填“>”或“<”或“=”)。将燃着的木条置于盛满液态空气的集气瓶口,观察到的现象是_______。将该集气瓶放置一段时间后,液态物质剩余约1/10体积,其主要成分是________。
III.从科技的角度
④如图为某种分子筛型家用制氧机工作时气体变化的微观示意图,该制氧机的原理是_______,该变化属于______(填“物理”或“化学”)变化。
(5)食品中的化学
牛奶中富含钙,是膳食中最容易被吸收的钙的来源。如图是某乳业公司纯牛奶包装标签文字说明。
纯牛奶 配料:鲜牛奶 保质期:6个月(4℃) 净含量:230mL/盒 钙含量:(每100mL) 钙≥0.11g
标签中“钙含量”中的钙指的是______(填字母)
碳酸钙 B. 钙元素 C. 钙单质 D. 钙原子
青少年缺钙可能导致______。
若儿童每天至少需要0.6g的钙,假设这些钙有90%来自牛奶,则每人每天要喝______盒这种牛奶。(结果取整数)
22. 某兴趣小组根据如图所示装置进行试验,请你参与并回答:
(1)写出标号仪器的名称:①_______;②________。
(2)实验室选用装置A制取氧气的化学式表达式为________,利用注射器可以检查装置A的气密性。如图E所示,在锥形瓶内装适量的水,使长颈漏斗末端浸没在液面以下,将活塞缓慢向外拉动,若观察到________,则装置不漏气。发生装置还可选用B,相对于A而言,B的优点是________。
(3)用装置C制取氧气,反应的化学式表达式为________;用D装置收集氧气,观察到_________现象停止收集,并将集气瓶在_______(填“水槽外”或“水槽内”)盖上玻璃片,________(填“正放”或“倒放”)实验台上。
(4)实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。甲烷的密度比空气小,不溶于水。选用______装置制取甲烷,收集气体时可选用_______或_______。
(5)确定实验室制取气体的反应原理时,下列因素中不需要考虑的是 (填字母)。
A. 药品易得,且含有要制备气体的组成元素
B. 反应条件易于控制,反应速率适中
C. 操作简便易行,安全可靠,节能环保
D. 所要制取气体是否溶于水
23. 水是生命活动不可缺少的物质。请回答相关的问题。
I.探究水的组成实验
(1)为证明水不是由“水元素”组成的,1785年,拉瓦锡在高温的条件下,用水蒸气与红热的铁反应,将水转化为氢气,同时生成四氧化三铁。模拟实验装置如图1所示。
①该反应的化学式表达式为______。
②加热铁粉前,应先通入水蒸气一段时间,目的是_______。
(2)电解水实验的简易装置如图2所示,b中收集到的气体是________(填化学式);电解水属于________(填基本反应类型);从微观角度看,电解水时,水分解过程中发生改变的是________。
(3)图2测得V(a):V(b)=2:1,要确定水分子中氢氧原子个数比,还需要的数据有 (填字母)。
A. 水的相对分子质量
B. 氢气、氧气的密度
C. 氢原子、氧原子的质量
II.水的净化
化学兴趣小组收集了一瓶浑浊的运河的河水,模拟自来水厂进行水的净化过程。其实验过程如图所示,请回答以下问题。
(4)自来水厂常用明矾作混凝剂,明矾[KAl(SO4)m·12H2O]能作絮凝剂,是因为明矾溶于水后生成具有吸附作用的胶状物氢氧化铝,则m=________,氢氧化铝的化学式为__________。
(5)操作1的名称是________,该操作中所需的玻璃仪器有烧杯、________、玻璃棒。
(6)操作2是吸附。主要除去液体C中一些异味和色素,可选用的物质是________。
(7)判断净化水是硬水还是软水,可加入________鉴别;将净化水煮沸,则加热煮沸除了杀菌消毒之外,还起到的作用是_________;欲使海水转化为淡水,则可采取的方法是________。
III.污水处理
(8)聚合氯化铁可处理污水中的悬浮物质和还原物质。某污水处理厂用聚合氯化铁处理污水的结果如图所示。由图中数据得出污水中投放聚合氯化铁(以Fe/mg·L-1计算)的最佳范围约为______ mg·L-1。
24. 合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
(1)合成塔中的反应必须在高温、高压、催化剂条件下进行,该反应属于_______(填基本反应类型)反应。
(2)生产过程中从合成塔中输出的气体属于_______(填“纯净物”或“混合物”)。
(3)生产过程中可重复循环使用的物质是_______。
(4)根据表中的数据回答问题。
物质 H2 N2 NH3
沸点/℃(1.01×105Pa) -252 -195.8 -33.35
在1.01×105Pa时,欲将NH3与N2、H2分离,最好将温度控制在以下哪个温度
A. -260℃ B. -200℃ C. -35℃ D. 0℃
(5)获得的氨气还可以在一定条件下和二氧化碳反应,合成尿素【化学式为CO(NH2)2】,同时生成水,请写出该反应符号表达式_______。
答案
1-20 BBDAB DBBBD DCDBD BACCD
21.
22.
23.
干扰
24 +H2O
同课章节目录
