4.1化学式课件(共49张PPT)-九年级化学科粤版上册
文档属性
| 名称 | 4.1化学式课件(共49张PPT)-九年级化学科粤版上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 12.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 11:19:30 | ||
图片预览











文档简介
(共49张PPT)
第四单元 化学式与化学方程式
科粤版 九年级上册
4.1 化学式
第1课时 化学式的意义 单质化学式的书写
第2课时 化合价 化合物化学式的书写及读法
第3课时 化学式的相关计算
1、理解化学式和分子式的含义。
2、初步学会一些简单物质的化学式写法与读法。
目标导航
第1课时 化学式的意义 单质化学式的书写
新课导入
H2O
H2O
标签上“H2O” 这个符号有什么含义
H表示氢元素、O表示氧元素,数字“2” 表示什么呢?
请设计关系图表示出物质、元素、分子、原子之间的关系
讨论与交流
物质
元素
原子
分子
从宏观视角看
从微观视角看
构成
构成
构成
组成
总称
那么怎样用通用的式子来表示物质的组成呢?
(离子)
新课讲授
一、怎样表示物质的组成与构成
1 、化学式:
国际上,用元素符号和数字的组合来表示物质组成的式子。
由于每种纯净物质的组成固定不变,所以表示每种物质组成的化学式只有一个。
—举例—
水和过氧化氢都由氢元素和氧元素组成,它们组成的元素种类虽然都是氢和氧,但分子中的原子个数不一样,H2O和H2O2代表了两种不同的物质。
水分子
(H2O)
过氧化氢分子
(H2O2)
新课讲授
一、怎样表示物质的组成与构成
干冰由二氧化碳分子构成
金刚石由碳原子构成
铜由铜原子构成
氯化钠由钠离子和氯离子构成
由离子或原子直接构成的化合物不存在一个个的分子, 其化学式表示了该物质中各元素原子数的最简比。由分子构成的物质的化学式,又叫分子式,为简便起见,我们在课本上都统一称化学式,不使用分子式的叫法。
你能从化学式表示物质组成与构成的方法中,总结出化学式的含义吗
讨论与交流
水
宏观 微观 符号
金刚石
氯化钠
H2O
Na+
Cl﹣
C
NaCl
化学式可以从宏观和微观的视角表示物质的组成与构成。
新课讲授
一、怎样表示物质的组成与构成
2 、化学式的意义
水的化学式表示的意义
化学式表示某种纯净物和它所含的元素种类
对于由分子构成的物质,还表示该物质的一个分子及构成该分子的原子种类及其个数。
从宏观视角看
从微观视角看
H2O
O
H
H
宏观
微观
表示水这种物质。
表示水由氢元素和氧元素组成。
表示一个水分子。
表示1个水分子由2个氢原子和
1个氧原子构成。
新课讲授
一、怎样表示物质的组成与构成
2 、化学式的意义
如果要表示2个以上的分子,可在化学式前面加上相应的数字。
例如,2H2O表示2个水分子,4O2表示4个氧分子。
化学式前加了数字后,仅表示微观的含义。
检查站
写出下列符号表示的意义。
Cl_______________________________
N2________________________________________________________________________________________________________
2CO2中前面数字“2”表示_____________________________
右下角数字“2”表示__________________________________
①氯元素;②一个氯原子
①氮气;②氮气是由氮元素组成的;
③一个氮分子;④一个氮分子是由两个氮原子构成的。
2个二氧化碳分子
1个二氧化碳分子中含有2个氧原子
氧气(O2)、氯气(Cl2)
氮气(N2)、臭氧(O3)
镁(Mg)、铜(Cu)、汞(Hg)
氦气(He)、氖气(Ne)、氩气(Ar)
新课讲授
二、怎样书写单质的化学式
要写出单质的化学式,首先要通过实验确定单质的组成与构成,然后再按国际通用规则书写。
由单原子构成的单质,化学式用相应的元素符号表示
金属单质的化学式,习惯上用元素符号表示
由分子构成的单质的化学式,要在相应的元素符号的右下角写出分子中所含原子的数目。
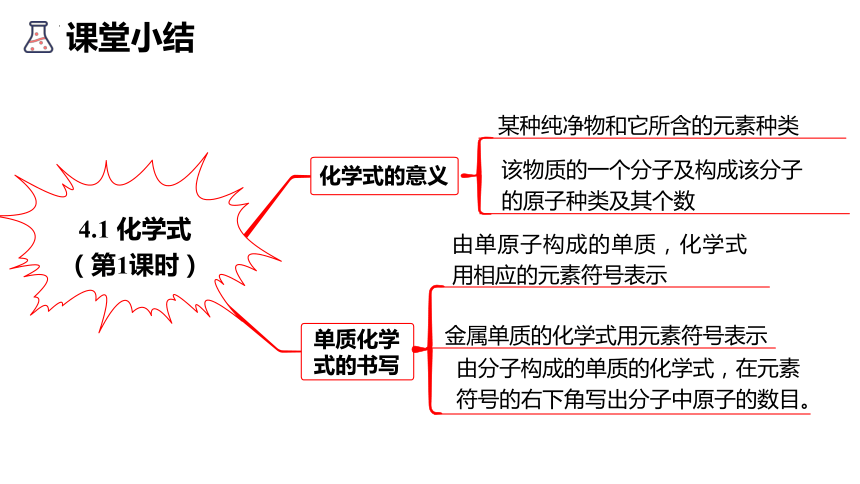
课堂小结
4.1 化学式
(第1课时)
化学式的意义
由单原子构成的单质,化学式用相应的元素符号表示
金属单质的化学式用元素符号表示
由分子构成的单质的化学式,在元素
符号的右下角写出分子中原子的数目。
某种纯净物和它所含的元素种类
该物质的一个分子及构成该分子
的原子种类及其个数
单质化学式的书写
1、下列化学式表示正确的是( )
A.水(H2O) B.氢气(H)
C.氦气(He2) D.铜(Cu3)
A
随堂练习
A、水的化学式为H2O,正确;
B、氢气是由分子构成的单质的化学式,在元素符号的右下角写出分子中原子的数目,应为H2;
C、氦气是由单原子构成的单质,化学式直接用元素符号表示,为He,错误;
D、金属单质的化学式,习惯上用元素符号表示,应为Cu,错误。
2、下列关于过氧化氢(H2O2)的说法正确的是( )
A.过氧化氢是由氢分子和氧分子构成的
B.过氧化氢是由两个氢原子和两个氧原子构成的
C.过氧化氢是由氢元素和氧元素组成的
D.一个过氧化氢分子是由两个氢元素和两个氧元素组成的
C
A、过氧化氢是由过氧化氢分子构成的,错误。
B、1个过氧化氢分子由2个氢原子和2个氧原子构成的,错误。
C、过氧化氢是由氢元素和氧元素组成的,正确。
D、元素是个宏观概念,只讲种类、不讲个数,错误。
.
3、下列符号既可以表示一种物质,又可以表示该物质的一个原子的是( )
A.He B.O2 C.CO2 D.Ba2+
A
A、He属于稀有气体元素,其元素符号即表示氦元素、一个氦原子,还能表示氦气这种物质。符合题意。
B、该符号是氧气的化学式,不是元素符号,不符合题意。
C、该符号是二氧化碳的化学式,不是元素符号,不符合题意。
D、该符号是钡离子的符号,不能表示一种物质,不符合题意。
4、关于O2、CO2、SO2、H2O2四种物质组成的说法,正确的是( )
A.都含有氧元素 B.都含氧分子
C.都是氧化物 D.都是含有2个氧原子
A
A、由CO2、SO2、O2、H2O2的化学式可知,四种物质中均含有氧元素,正确;
B、氧气是由氧分子构成的,CO2、SO2、H2O2分别是由二氧化碳分子、二氧化硫分子、过氧化氢分子构成的,错误;
C、O2是由一种元素组成的纯净物,属于单质,不是氧化物,错误;
D、这些物质都是由分子构成的,而分子是由原子构成的,这些物质的一个分子中才含有2个氧原子,错误。
.
1、认识化合价的概念,知道有正价、负价,记住常见元素的化合价。2、初步学会一些化合物的化学式写法与读法。
目标导航
第2课时 化合价 化合物化学式的书写及读法
新课导入
纯净物可分为单质和化合物,我们已经学会了单质化学式的书写,那么怎样书写化合物的化学式呢?
怎样更快捷的书写
化合物的化学式呢?
常见单质的化学式:Fe Cu Na K
He Ne S C
O2 N2 Cl2
在由不同元素组成的化合物中,各元素的原子个数比都有确定的数值。
不同元素组成的化合物:HCl H2O NH3
分子中的原子的个数比:1 : 1 2 : 1 1 : 3
Cl
﹣1
O
﹣2
N
﹣3
我们各取所需!
H
+1
我要1个氢原子,形成HCl。
H
+1
H
+1
我要2个氢原子,形成H2O。
H
+1
H
+1
H
+1
我要3个氢原子,形成NH3。
我们都有各自的化合价。
元素的化合价特性
新课讲授
三、怎样书写化合物的化学式
1、元素的化合价
不同元素组成化合物时,它们的原子个数比是不同的,显示了这些元素的某种特性,即元素的化合价。
化学上用化合价来确定化合物中原子或离子之间相互结合的数目。
部分常见元素的化合价
— 发现 —
(1)化合价有正价和负价,金属与非金属形成化合物时,金属元素显正价,非金属元素显负价。
(2)氢元素通常显+1价,氧元素通常显-2价,许多非金属元素与氧元素形成化合物时,则显正价。
(3)部分元素可显不同的化合价。
元素名称 元素符号 常见化合价
氢 H +1
钠 Na +1
钾 K +1
银 Ag +1
镁 Mg +2
钙 Ca +2
钡 Ba +2
铁 Fe +2,+3
锌 Zn +2
铜 Cu +2
铝 Al +3
锰 Mn +2,+4,+6,+7
元素名称 元素符号 常见化合价
氯 Cl -1,+1,+5,+7
氧 O ﹣2
硫 S -2,+4,+6
氮 N ﹣3,+2,+3,+4,+5
磷 P ﹣3,+3,+5
部分原子团的化合价
— 发现 —
(4)有一些化合物,常常含有带电的原子团,叫作根,它们常作为一个整体参加反应,如氢氧化钠(NaOH)中的氢氧根(OH-)、硫酸(H2SO4)中的硫酸根(SO42-),它们既可分开计算每种元素的化合价,也可合并计算总的化合价。
名称 符号 化合价
氢氧根 OH﹣ ﹣1
铵根 NH4+ +1
硝酸根 NO3﹣ ﹣1
硫酸根 SO42﹣ ﹣2
碳酸根 CO32﹣ ﹣2
— 发现 —
(5)化合物中各元素正负化合价代数和为0。由于化合价是元素形成化合物时才表现出来的性质,因此,在单质中元素的化合价为0。
【任务】标注下列化合物中各元素的化合价。
H2O CO2 NaCl MgO Al2O3
+4
+1
-2
-2
+1
-1
+2
-2
-2
+3
化合价之歌
快乐化学
新课讲授
三、怎样书写化合物的化学式
2、化合价与化学式
一方面,
根据化合价可以写出化学式。
另一方面,根据化学式可以求出元素的化合价。
(1)根据化合价写出化学式。
步骤 写出水的化学式 练习:请写出氧化铝的化学式
1.写出组成化合物的元素符号,一般来说,正价元素居左,负价元素居右。
2.标出有关元素的化合价。
3.根据化合物中各种元素化合价代数和等于零的原则,确定各元素的原子数目。
4.写出化学式。
H O
H O
+1 -2
因为2×(+1)+1×(-2)= 0,所以氢的原子数为2,氧的原子数为1。
H2O
Al O
Al O
+3 -2
因为2×(+3)+3×(-2)= 0,所以铝的原子数为2,氧的原子数为3。
Al2O3
步骤:
用“十字交叉法”书写化学式
(1)符号:正价前、负价后;
(2)标价
(3)约简
(4)交叉:数字1省略不写。
(5)检查:
化合物中各种元素化合价代数和等于零。
硅的氧化物的化学式。
Si O
+4 -2
2
1
方法导引
检查站
写出下列物质的化学式。
特别需要指出的是,化学式只能表示实际存在的物质的组成。用化合价法则推算化学式,只有在该化学式表示的化合物实际存在时才有意义。不能根据元素化合价凭空臆造物质,随意书写化学式。
物质名称 氧化钠 氧化铜 氧化铝 氧化铁
化学式
Fe2O3
Na2O
CuO
Al2O3
物质名称 氯化钠 氯化铜 氯化铝 氯化铁
化学式
FeCl3
NaCl
CuCl2
AlCl3
友情提示:
氧化铁、氯化铁中铁元素的化合价为+3。
(2)根据化学式求元素的化合价。
例:已知氧化铁的化学式为Fe2O3,其中氧元素为-2价,求氧化铁中铁元素的化合价。
解:根据化合物中各元素的正负化合价代数和为0的原则,
设铁元素的化合价为x,列式:
2·x + 3×( -2 ) = 0
故 x = — = +3
答:在氧化铁(Fe2O3)中,铁元素的化合价为+3。
+6
2
练习:请你求出五氧化二磷(P2O5)中磷元素的化合价:_______
+10
2
解:设磷元素的化合价为x,列式:
2·x + 5×( -2 ) = 0
故 x = —— = +5
+5
还可以根据化合物中各元素的正负化合价代数和为0的原则,求出多于两种元素组成的化合物中某元素的化合价。
请你再求出H2SO4中硫元素的化合价:________。
解:设硫元素的化合价为x,列式:
1×2+ x + 4×( ﹣2 ) = 0
故 x = +6
答: H2SO4中硫元素的化合价为+6。
+6
SO2(二氧化硫)、P2O5( 五氧化二磷)、 CO(一氧化碳) 、CO2 (二氧化碳)
Ca(OH)2 (氢氧化钙)、Na2SO4 (硫酸钠) 、NH4Cl(氯化铵)、 (NH4)2CO3 (碳酸铵)
KCl (氯化钾)、CaO (氧化钙)
由两种元素组成的化合物化学式的读法,通常规定为从右到左读作“某化某”。
有时,还要读出化学式中各元素的原子个数。
含有原子团的化合物,要读出原子团的名称。
新课讲授
四、怎样读化合物的化学式
课堂小结
4.1 化学式
(第2课时)
书写化合物的化学式
根据化合价写出化学式
根据化学式求元素的化合价
读化合物的化学式
从右往左读,读作“某化某”,
右下角数字要读出。
1、下列关于化合价的说法正确的是( )
A.在H2中,氢元素显+1价
B.一种元素只有一种化合价
C.在原子团中各元素的化合价的代数和为0
D .元素的化合价与原子的结构有着密切的关系
D
随堂练习
A、单质中元素的化合价为0, H2属于单质,在H2中,元素显0价,错误;B、一种元素不是只有一种化合价, 如氯元素﹣1、+1、+3、+5、+7等多种化合价,错误;C、在原子团中各元素的化合价的代数和一定不为0,原子团中元素的化合价代数和等于原子团的化合价,错误;D、元素的化合价与原子的结构有着密切的关系,正确。
.
2、偏钛酸钡(BaxTiO3)因其显著地“压电效应”而广泛的应用于超声波发生装置中。已知偏钛酸钡中钛元素的化合价为+4价,则其化学式中x的数值为( )
A、1 B、2 C、3 D、4
A
钡元素显+2价,钛元素显+4价,氧元素显-2价,根据在化合物中正负化合价代数和为0,可得:(+2)×x+(+4)+(-2)×3=0,则x=1。
3、氧化铋是制作防火纸材料之一,其中铋(Bi)元素化合价是+3价,则其化学式为( )
A.BiO B.Bi2O5 C.Bi3O4 D.Bi2O3
D
氧化铋中铋元素的化合价为+3,而氧元素的化合价为-2,依据“化合物中各种元素化合价的代数和等于零”,可确定氧化铋中铋、氧原子的个数比为2:3,其化学式为Bi2O3。
.
4、下列物质的化学式书写正确的是( )
A.氯化钠NaCl2 B.碳酸钾K2CO3
C.氧化镁MgO2 D.氯化锌 ZnCl
B
A、氯化钠中钠元素显+1价,氯元素显-1价,其化学式为NaCl,错误;
B、碳酸钾中钾元素显+1价,碳酸根显-2价,其化学式为K2CO3,正确;
C、氧化镁中镁元素显+2价,氧元素显-2价,其化学式为MgO,错误;
D、氯化锌中锌元素显+2价,氯元素显-1价,其化学式为ZnCl2,错误。
5、某同学书写的试剂标签如图所示,其中错误的是( )
B
A.氧化铁中铁元素显+3价,氧元素显-2价,则氧化铁的化学式为:Fe2O3,故正确;
B.碳酸钠中,钠元素显+1价,碳酸根显-2价,则碳酸钠的化学式为Na2CO3,故错误;
C.氯化铵中,铵根显+1价,氯元素显-1价,则氯化铵的化学式为NH4Cl,
故正确;
D.氢氧化铜中,铜元素显+2价,氢氧根显-1价,则氢氧化铜的化学式为Cu(OH)2,故正确。
.
1、初步学会根据已知的化学式,计算物质的相对分子质量、形成元素的质量比及某一元素的质量分数。
2、通过有关化学式的计算能力的培养,进行实事求是的科学态度的教育。
目标导航
第3课时 化学式的相关计算
新课导入
“庄稼一枝花,全靠肥当家”,化肥使农作物增产,过量施肥会造成浪费,并导致严重的环境污染,如何才能较准确的计算化肥的施用量呢?
根据化肥的种类,分析营养元素,计算化肥中营养元素的质量。
新课讲授
五、怎样根据化学式进行计算
1、计算相对分子质量
化学式中各原子的相对原子质量总和,叫作相对分子质量。
注意:和相对原子质量一样,相对分子质量也是比值,是相对质量。
例:水(H2O)的相对分子质量=1×2+16=18
请练习:碳酸氢铵(NH4HCO3)的相对分子质量=
__________________________
14+1×4+1+12+16×3=79
2、计算化合物中各元素的质量比
例:计算水(H2O)中氢元素和氧元素的质量比。
解:在H2O中,氢和氧的原子个数比为2∶1,
则氢元素的质量:氧元素的质量=(1×2):16 = 1 : 8。
请练习:H2SO4中各元素的质量比为:
_________________________________________________________________
氢元素的质量:硫元素的质量:氧元素的质量=(1×2):32:(16×4)= 1:16:32
化学式可以从定性和定量的视角,明确地表示出物质所含的元素种类及各元素的原子个数最简比,因而可以利用化学式计算组成化合物中各元素的质量比。
化合物中各元素的质量比=“相对原子质量×个数”依次成比例。
3、计算化合物中某一元素的质量分数
例:计算水(H2O)中氧元素的质量分数。
根据化学式,可通过相对分子质量和某一元素的相对原子质量及原子个数,计算化合物中该元素的质量分数,即该元素的质量与组成化合物的各元素质量总和之比。
解:水中氧元素的质量分数
氧元素的相对原子质量×氧原子的个数
水的相对分子质量
=——————————————————×100%
16×1
18
=———×100%
≈ 88.9%
答:水中氧元素的质量分数为88.9%。
某元素的质量分数=—————————————————— ×100%
该原子的相对原子质量×该原子的个数
化合物的相对分子质量
检查站
已知化肥硝酸铵的化学式为NH4NO3,计算:
(1)硝酸铵中氮元素的质量分数;
(2)多少克硝酸铵中含氮元素140g。
解:
(1)NH4NO3中氮元素的质量分数=———×100%=35%
14×2
80
(2)设NH4NO3的质量为x
35% x=140g
x=400g
答:400g硝酸铵中含氮元素140g。
化合物中各元素的质量比
化合物中某元素的质量分数
相对分子质量
“相对原子质量×个数”依次成比例。
=—————————————————— ×100%
该原子的相对原子质量×该原子的个数
化合物的相对分子质量
课堂小结
4.1 化学式
(第3课时)
化学式中各原子的相对原子质量总和
1、某物质的化学式是R(OH )2,相对分子质量为58,则R的相对原子质量为( )
A. 24 B.24g C. 40 g D.40
A
随堂练习
某物质的化学式是R (OH)2,相对分子质量为58,
设R的相对原子质量为x,则:a+(16+1)×2=58,x=24;
相对分子质量单位是1,常省略不写。
2、运动员在赛场上受伤后,常使用氯乙烷(化学式为C2H5Cl)作
应急治疗的局部麻醉剂。氯乙烷中碳、氢元素的质量比为( )A. 2:5 B. 6: 1 C. 2: 1 D. 24:5
D
根据“化合物中各元素质量比=各原子的相对原子质量×原子
个数之比”,进行分析解答。
氯乙烷的化学式为C2H5Cl,氯乙烷中碳、氢元素的质量比为:( 12×2) : ( 1×5) =24 : 5。
.
3、丙氨酸是一种氨基酸,其相对分子质量是89,其中氮元素的质量分数是15.8%,则每个丙氨酸分子中氮原子个数是( )
A.1 B.2 C.3 D.4
A
某元素的质量=物质的质量×该元素的质量分数
一个丙氨酸分子中氮元素的质量为89×15.8%≈14
氮原子的相对原子质量为14
则每个丙氨酸分子中氮原子个数是14÷14=1
4、某种含硫酸亚铁(FeSO4)的药物可于治疗缺铁性贫血,某贫血患者每天要补充1.4g铁元素,服用的药物中含硫酸亚铁的质量是( )
A.3.18g B.6.95g C.10g D.3.8g
D
FeSO4中铁元素的质量分数为 = ——————
某元素的质量=物质的质量×该元素的质量分数
病人需要服用的药物中应含硫酸亚铁的质量= ———
56
56+32+16×4
×100%=36.8%
1.4g
36.8%
≈3.8 g
A、维生素C的相对分子质量是=12×6+1×8+16×6=176,正确;
B、维生素C中氢元素的质量分数为——×100%=4.5%,正确;
C、维生素C中碳、氢、氧元素的质量比(12×6):(1×8):(16×6)=9:1:12,错误;D、一个维生素C分子是由6个碳原子、8个氢原子和6个氧原子构成的,正确。
1×8
176
5、阳信鸭梨,素有“天生甘露”之称,富含糖、维生素C、钙、磷、铁等营养成分。其中维生素C(C6H8O6)具有抗氧化性,强健骨骼和牙齿,增强免疫力,预防感冒等疾病及等作用。下列关于维生素C的说法中错误的是( )
A. 维生素C的相对分子质量是176
B. 维生素C中氢元素的质量分数为4.5%
C. 维生素C中C、H、O三种元素的质量比为3:4:3
D. 一个维生素C分子由6个碳原子、8个氢原子和6个氧原子构成
C
.
第四单元 化学式与化学方程式
科粤版 九年级上册
4.1 化学式
第1课时 化学式的意义 单质化学式的书写
第2课时 化合价 化合物化学式的书写及读法
第3课时 化学式的相关计算
1、理解化学式和分子式的含义。
2、初步学会一些简单物质的化学式写法与读法。
目标导航
第1课时 化学式的意义 单质化学式的书写
新课导入
H2O
H2O
标签上“H2O” 这个符号有什么含义
H表示氢元素、O表示氧元素,数字“2” 表示什么呢?
请设计关系图表示出物质、元素、分子、原子之间的关系
讨论与交流
物质
元素
原子
分子
从宏观视角看
从微观视角看
构成
构成
构成
组成
总称
那么怎样用通用的式子来表示物质的组成呢?
(离子)
新课讲授
一、怎样表示物质的组成与构成
1 、化学式:
国际上,用元素符号和数字的组合来表示物质组成的式子。
由于每种纯净物质的组成固定不变,所以表示每种物质组成的化学式只有一个。
—举例—
水和过氧化氢都由氢元素和氧元素组成,它们组成的元素种类虽然都是氢和氧,但分子中的原子个数不一样,H2O和H2O2代表了两种不同的物质。
水分子
(H2O)
过氧化氢分子
(H2O2)
新课讲授
一、怎样表示物质的组成与构成
干冰由二氧化碳分子构成
金刚石由碳原子构成
铜由铜原子构成
氯化钠由钠离子和氯离子构成
由离子或原子直接构成的化合物不存在一个个的分子, 其化学式表示了该物质中各元素原子数的最简比。由分子构成的物质的化学式,又叫分子式,为简便起见,我们在课本上都统一称化学式,不使用分子式的叫法。
你能从化学式表示物质组成与构成的方法中,总结出化学式的含义吗
讨论与交流
水
宏观 微观 符号
金刚石
氯化钠
H2O
Na+
Cl﹣
C
NaCl
化学式可以从宏观和微观的视角表示物质的组成与构成。
新课讲授
一、怎样表示物质的组成与构成
2 、化学式的意义
水的化学式表示的意义
化学式表示某种纯净物和它所含的元素种类
对于由分子构成的物质,还表示该物质的一个分子及构成该分子的原子种类及其个数。
从宏观视角看
从微观视角看
H2O
O
H
H
宏观
微观
表示水这种物质。
表示水由氢元素和氧元素组成。
表示一个水分子。
表示1个水分子由2个氢原子和
1个氧原子构成。
新课讲授
一、怎样表示物质的组成与构成
2 、化学式的意义
如果要表示2个以上的分子,可在化学式前面加上相应的数字。
例如,2H2O表示2个水分子,4O2表示4个氧分子。
化学式前加了数字后,仅表示微观的含义。
检查站
写出下列符号表示的意义。
Cl_______________________________
N2________________________________________________________________________________________________________
2CO2中前面数字“2”表示_____________________________
右下角数字“2”表示__________________________________
①氯元素;②一个氯原子
①氮气;②氮气是由氮元素组成的;
③一个氮分子;④一个氮分子是由两个氮原子构成的。
2个二氧化碳分子
1个二氧化碳分子中含有2个氧原子
氧气(O2)、氯气(Cl2)
氮气(N2)、臭氧(O3)
镁(Mg)、铜(Cu)、汞(Hg)
氦气(He)、氖气(Ne)、氩气(Ar)
新课讲授
二、怎样书写单质的化学式
要写出单质的化学式,首先要通过实验确定单质的组成与构成,然后再按国际通用规则书写。
由单原子构成的单质,化学式用相应的元素符号表示
金属单质的化学式,习惯上用元素符号表示
由分子构成的单质的化学式,要在相应的元素符号的右下角写出分子中所含原子的数目。
课堂小结
4.1 化学式
(第1课时)
化学式的意义
由单原子构成的单质,化学式用相应的元素符号表示
金属单质的化学式用元素符号表示
由分子构成的单质的化学式,在元素
符号的右下角写出分子中原子的数目。
某种纯净物和它所含的元素种类
该物质的一个分子及构成该分子
的原子种类及其个数
单质化学式的书写
1、下列化学式表示正确的是( )
A.水(H2O) B.氢气(H)
C.氦气(He2) D.铜(Cu3)
A
随堂练习
A、水的化学式为H2O,正确;
B、氢气是由分子构成的单质的化学式,在元素符号的右下角写出分子中原子的数目,应为H2;
C、氦气是由单原子构成的单质,化学式直接用元素符号表示,为He,错误;
D、金属单质的化学式,习惯上用元素符号表示,应为Cu,错误。
2、下列关于过氧化氢(H2O2)的说法正确的是( )
A.过氧化氢是由氢分子和氧分子构成的
B.过氧化氢是由两个氢原子和两个氧原子构成的
C.过氧化氢是由氢元素和氧元素组成的
D.一个过氧化氢分子是由两个氢元素和两个氧元素组成的
C
A、过氧化氢是由过氧化氢分子构成的,错误。
B、1个过氧化氢分子由2个氢原子和2个氧原子构成的,错误。
C、过氧化氢是由氢元素和氧元素组成的,正确。
D、元素是个宏观概念,只讲种类、不讲个数,错误。
.
3、下列符号既可以表示一种物质,又可以表示该物质的一个原子的是( )
A.He B.O2 C.CO2 D.Ba2+
A
A、He属于稀有气体元素,其元素符号即表示氦元素、一个氦原子,还能表示氦气这种物质。符合题意。
B、该符号是氧气的化学式,不是元素符号,不符合题意。
C、该符号是二氧化碳的化学式,不是元素符号,不符合题意。
D、该符号是钡离子的符号,不能表示一种物质,不符合题意。
4、关于O2、CO2、SO2、H2O2四种物质组成的说法,正确的是( )
A.都含有氧元素 B.都含氧分子
C.都是氧化物 D.都是含有2个氧原子
A
A、由CO2、SO2、O2、H2O2的化学式可知,四种物质中均含有氧元素,正确;
B、氧气是由氧分子构成的,CO2、SO2、H2O2分别是由二氧化碳分子、二氧化硫分子、过氧化氢分子构成的,错误;
C、O2是由一种元素组成的纯净物,属于单质,不是氧化物,错误;
D、这些物质都是由分子构成的,而分子是由原子构成的,这些物质的一个分子中才含有2个氧原子,错误。
.
1、认识化合价的概念,知道有正价、负价,记住常见元素的化合价。2、初步学会一些化合物的化学式写法与读法。
目标导航
第2课时 化合价 化合物化学式的书写及读法
新课导入
纯净物可分为单质和化合物,我们已经学会了单质化学式的书写,那么怎样书写化合物的化学式呢?
怎样更快捷的书写
化合物的化学式呢?
常见单质的化学式:Fe Cu Na K
He Ne S C
O2 N2 Cl2
在由不同元素组成的化合物中,各元素的原子个数比都有确定的数值。
不同元素组成的化合物:HCl H2O NH3
分子中的原子的个数比:1 : 1 2 : 1 1 : 3
Cl
﹣1
O
﹣2
N
﹣3
我们各取所需!
H
+1
我要1个氢原子,形成HCl。
H
+1
H
+1
我要2个氢原子,形成H2O。
H
+1
H
+1
H
+1
我要3个氢原子,形成NH3。
我们都有各自的化合价。
元素的化合价特性
新课讲授
三、怎样书写化合物的化学式
1、元素的化合价
不同元素组成化合物时,它们的原子个数比是不同的,显示了这些元素的某种特性,即元素的化合价。
化学上用化合价来确定化合物中原子或离子之间相互结合的数目。
部分常见元素的化合价
— 发现 —
(1)化合价有正价和负价,金属与非金属形成化合物时,金属元素显正价,非金属元素显负价。
(2)氢元素通常显+1价,氧元素通常显-2价,许多非金属元素与氧元素形成化合物时,则显正价。
(3)部分元素可显不同的化合价。
元素名称 元素符号 常见化合价
氢 H +1
钠 Na +1
钾 K +1
银 Ag +1
镁 Mg +2
钙 Ca +2
钡 Ba +2
铁 Fe +2,+3
锌 Zn +2
铜 Cu +2
铝 Al +3
锰 Mn +2,+4,+6,+7
元素名称 元素符号 常见化合价
氯 Cl -1,+1,+5,+7
氧 O ﹣2
硫 S -2,+4,+6
氮 N ﹣3,+2,+3,+4,+5
磷 P ﹣3,+3,+5
部分原子团的化合价
— 发现 —
(4)有一些化合物,常常含有带电的原子团,叫作根,它们常作为一个整体参加反应,如氢氧化钠(NaOH)中的氢氧根(OH-)、硫酸(H2SO4)中的硫酸根(SO42-),它们既可分开计算每种元素的化合价,也可合并计算总的化合价。
名称 符号 化合价
氢氧根 OH﹣ ﹣1
铵根 NH4+ +1
硝酸根 NO3﹣ ﹣1
硫酸根 SO42﹣ ﹣2
碳酸根 CO32﹣ ﹣2
— 发现 —
(5)化合物中各元素正负化合价代数和为0。由于化合价是元素形成化合物时才表现出来的性质,因此,在单质中元素的化合价为0。
【任务】标注下列化合物中各元素的化合价。
H2O CO2 NaCl MgO Al2O3
+4
+1
-2
-2
+1
-1
+2
-2
-2
+3
化合价之歌
快乐化学
新课讲授
三、怎样书写化合物的化学式
2、化合价与化学式
一方面,
根据化合价可以写出化学式。
另一方面,根据化学式可以求出元素的化合价。
(1)根据化合价写出化学式。
步骤 写出水的化学式 练习:请写出氧化铝的化学式
1.写出组成化合物的元素符号,一般来说,正价元素居左,负价元素居右。
2.标出有关元素的化合价。
3.根据化合物中各种元素化合价代数和等于零的原则,确定各元素的原子数目。
4.写出化学式。
H O
H O
+1 -2
因为2×(+1)+1×(-2)= 0,所以氢的原子数为2,氧的原子数为1。
H2O
Al O
Al O
+3 -2
因为2×(+3)+3×(-2)= 0,所以铝的原子数为2,氧的原子数为3。
Al2O3
步骤:
用“十字交叉法”书写化学式
(1)符号:正价前、负价后;
(2)标价
(3)约简
(4)交叉:数字1省略不写。
(5)检查:
化合物中各种元素化合价代数和等于零。
硅的氧化物的化学式。
Si O
+4 -2
2
1
方法导引
检查站
写出下列物质的化学式。
特别需要指出的是,化学式只能表示实际存在的物质的组成。用化合价法则推算化学式,只有在该化学式表示的化合物实际存在时才有意义。不能根据元素化合价凭空臆造物质,随意书写化学式。
物质名称 氧化钠 氧化铜 氧化铝 氧化铁
化学式
Fe2O3
Na2O
CuO
Al2O3
物质名称 氯化钠 氯化铜 氯化铝 氯化铁
化学式
FeCl3
NaCl
CuCl2
AlCl3
友情提示:
氧化铁、氯化铁中铁元素的化合价为+3。
(2)根据化学式求元素的化合价。
例:已知氧化铁的化学式为Fe2O3,其中氧元素为-2价,求氧化铁中铁元素的化合价。
解:根据化合物中各元素的正负化合价代数和为0的原则,
设铁元素的化合价为x,列式:
2·x + 3×( -2 ) = 0
故 x = — = +3
答:在氧化铁(Fe2O3)中,铁元素的化合价为+3。
+6
2
练习:请你求出五氧化二磷(P2O5)中磷元素的化合价:_______
+10
2
解:设磷元素的化合价为x,列式:
2·x + 5×( -2 ) = 0
故 x = —— = +5
+5
还可以根据化合物中各元素的正负化合价代数和为0的原则,求出多于两种元素组成的化合物中某元素的化合价。
请你再求出H2SO4中硫元素的化合价:________。
解:设硫元素的化合价为x,列式:
1×2+ x + 4×( ﹣2 ) = 0
故 x = +6
答: H2SO4中硫元素的化合价为+6。
+6
SO2(二氧化硫)、P2O5( 五氧化二磷)、 CO(一氧化碳) 、CO2 (二氧化碳)
Ca(OH)2 (氢氧化钙)、Na2SO4 (硫酸钠) 、NH4Cl(氯化铵)、 (NH4)2CO3 (碳酸铵)
KCl (氯化钾)、CaO (氧化钙)
由两种元素组成的化合物化学式的读法,通常规定为从右到左读作“某化某”。
有时,还要读出化学式中各元素的原子个数。
含有原子团的化合物,要读出原子团的名称。
新课讲授
四、怎样读化合物的化学式
课堂小结
4.1 化学式
(第2课时)
书写化合物的化学式
根据化合价写出化学式
根据化学式求元素的化合价
读化合物的化学式
从右往左读,读作“某化某”,
右下角数字要读出。
1、下列关于化合价的说法正确的是( )
A.在H2中,氢元素显+1价
B.一种元素只有一种化合价
C.在原子团中各元素的化合价的代数和为0
D .元素的化合价与原子的结构有着密切的关系
D
随堂练习
A、单质中元素的化合价为0, H2属于单质,在H2中,元素显0价,错误;B、一种元素不是只有一种化合价, 如氯元素﹣1、+1、+3、+5、+7等多种化合价,错误;C、在原子团中各元素的化合价的代数和一定不为0,原子团中元素的化合价代数和等于原子团的化合价,错误;D、元素的化合价与原子的结构有着密切的关系,正确。
.
2、偏钛酸钡(BaxTiO3)因其显著地“压电效应”而广泛的应用于超声波发生装置中。已知偏钛酸钡中钛元素的化合价为+4价,则其化学式中x的数值为( )
A、1 B、2 C、3 D、4
A
钡元素显+2价,钛元素显+4价,氧元素显-2价,根据在化合物中正负化合价代数和为0,可得:(+2)×x+(+4)+(-2)×3=0,则x=1。
3、氧化铋是制作防火纸材料之一,其中铋(Bi)元素化合价是+3价,则其化学式为( )
A.BiO B.Bi2O5 C.Bi3O4 D.Bi2O3
D
氧化铋中铋元素的化合价为+3,而氧元素的化合价为-2,依据“化合物中各种元素化合价的代数和等于零”,可确定氧化铋中铋、氧原子的个数比为2:3,其化学式为Bi2O3。
.
4、下列物质的化学式书写正确的是( )
A.氯化钠NaCl2 B.碳酸钾K2CO3
C.氧化镁MgO2 D.氯化锌 ZnCl
B
A、氯化钠中钠元素显+1价,氯元素显-1价,其化学式为NaCl,错误;
B、碳酸钾中钾元素显+1价,碳酸根显-2价,其化学式为K2CO3,正确;
C、氧化镁中镁元素显+2价,氧元素显-2价,其化学式为MgO,错误;
D、氯化锌中锌元素显+2价,氯元素显-1价,其化学式为ZnCl2,错误。
5、某同学书写的试剂标签如图所示,其中错误的是( )
B
A.氧化铁中铁元素显+3价,氧元素显-2价,则氧化铁的化学式为:Fe2O3,故正确;
B.碳酸钠中,钠元素显+1价,碳酸根显-2价,则碳酸钠的化学式为Na2CO3,故错误;
C.氯化铵中,铵根显+1价,氯元素显-1价,则氯化铵的化学式为NH4Cl,
故正确;
D.氢氧化铜中,铜元素显+2价,氢氧根显-1价,则氢氧化铜的化学式为Cu(OH)2,故正确。
.
1、初步学会根据已知的化学式,计算物质的相对分子质量、形成元素的质量比及某一元素的质量分数。
2、通过有关化学式的计算能力的培养,进行实事求是的科学态度的教育。
目标导航
第3课时 化学式的相关计算
新课导入
“庄稼一枝花,全靠肥当家”,化肥使农作物增产,过量施肥会造成浪费,并导致严重的环境污染,如何才能较准确的计算化肥的施用量呢?
根据化肥的种类,分析营养元素,计算化肥中营养元素的质量。
新课讲授
五、怎样根据化学式进行计算
1、计算相对分子质量
化学式中各原子的相对原子质量总和,叫作相对分子质量。
注意:和相对原子质量一样,相对分子质量也是比值,是相对质量。
例:水(H2O)的相对分子质量=1×2+16=18
请练习:碳酸氢铵(NH4HCO3)的相对分子质量=
__________________________
14+1×4+1+12+16×3=79
2、计算化合物中各元素的质量比
例:计算水(H2O)中氢元素和氧元素的质量比。
解:在H2O中,氢和氧的原子个数比为2∶1,
则氢元素的质量:氧元素的质量=(1×2):16 = 1 : 8。
请练习:H2SO4中各元素的质量比为:
_________________________________________________________________
氢元素的质量:硫元素的质量:氧元素的质量=(1×2):32:(16×4)= 1:16:32
化学式可以从定性和定量的视角,明确地表示出物质所含的元素种类及各元素的原子个数最简比,因而可以利用化学式计算组成化合物中各元素的质量比。
化合物中各元素的质量比=“相对原子质量×个数”依次成比例。
3、计算化合物中某一元素的质量分数
例:计算水(H2O)中氧元素的质量分数。
根据化学式,可通过相对分子质量和某一元素的相对原子质量及原子个数,计算化合物中该元素的质量分数,即该元素的质量与组成化合物的各元素质量总和之比。
解:水中氧元素的质量分数
氧元素的相对原子质量×氧原子的个数
水的相对分子质量
=——————————————————×100%
16×1
18
=———×100%
≈ 88.9%
答:水中氧元素的质量分数为88.9%。
某元素的质量分数=—————————————————— ×100%
该原子的相对原子质量×该原子的个数
化合物的相对分子质量
检查站
已知化肥硝酸铵的化学式为NH4NO3,计算:
(1)硝酸铵中氮元素的质量分数;
(2)多少克硝酸铵中含氮元素140g。
解:
(1)NH4NO3中氮元素的质量分数=———×100%=35%
14×2
80
(2)设NH4NO3的质量为x
35% x=140g
x=400g
答:400g硝酸铵中含氮元素140g。
化合物中各元素的质量比
化合物中某元素的质量分数
相对分子质量
“相对原子质量×个数”依次成比例。
=—————————————————— ×100%
该原子的相对原子质量×该原子的个数
化合物的相对分子质量
课堂小结
4.1 化学式
(第3课时)
化学式中各原子的相对原子质量总和
1、某物质的化学式是R(OH )2,相对分子质量为58,则R的相对原子质量为( )
A. 24 B.24g C. 40 g D.40
A
随堂练习
某物质的化学式是R (OH)2,相对分子质量为58,
设R的相对原子质量为x,则:a+(16+1)×2=58,x=24;
相对分子质量单位是1,常省略不写。
2、运动员在赛场上受伤后,常使用氯乙烷(化学式为C2H5Cl)作
应急治疗的局部麻醉剂。氯乙烷中碳、氢元素的质量比为( )A. 2:5 B. 6: 1 C. 2: 1 D. 24:5
D
根据“化合物中各元素质量比=各原子的相对原子质量×原子
个数之比”,进行分析解答。
氯乙烷的化学式为C2H5Cl,氯乙烷中碳、氢元素的质量比为:( 12×2) : ( 1×5) =24 : 5。
.
3、丙氨酸是一种氨基酸,其相对分子质量是89,其中氮元素的质量分数是15.8%,则每个丙氨酸分子中氮原子个数是( )
A.1 B.2 C.3 D.4
A
某元素的质量=物质的质量×该元素的质量分数
一个丙氨酸分子中氮元素的质量为89×15.8%≈14
氮原子的相对原子质量为14
则每个丙氨酸分子中氮原子个数是14÷14=1
4、某种含硫酸亚铁(FeSO4)的药物可于治疗缺铁性贫血,某贫血患者每天要补充1.4g铁元素,服用的药物中含硫酸亚铁的质量是( )
A.3.18g B.6.95g C.10g D.3.8g
D
FeSO4中铁元素的质量分数为 = ——————
某元素的质量=物质的质量×该元素的质量分数
病人需要服用的药物中应含硫酸亚铁的质量= ———
56
56+32+16×4
×100%=36.8%
1.4g
36.8%
≈3.8 g
A、维生素C的相对分子质量是=12×6+1×8+16×6=176,正确;
B、维生素C中氢元素的质量分数为——×100%=4.5%,正确;
C、维生素C中碳、氢、氧元素的质量比(12×6):(1×8):(16×6)=9:1:12,错误;D、一个维生素C分子是由6个碳原子、8个氢原子和6个氧原子构成的,正确。
1×8
176
5、阳信鸭梨,素有“天生甘露”之称,富含糖、维生素C、钙、磷、铁等营养成分。其中维生素C(C6H8O6)具有抗氧化性,强健骨骼和牙齿,增强免疫力,预防感冒等疾病及等作用。下列关于维生素C的说法中错误的是( )
A. 维生素C的相对分子质量是176
B. 维生素C中氢元素的质量分数为4.5%
C. 维生素C中C、H、O三种元素的质量比为3:4:3
D. 一个维生素C分子由6个碳原子、8个氢原子和6个氧原子构成
C
.
同课章节目录
