2025届河南省豫西北教研联盟高三上学期第一次质量检测 化学试题(含答案)
文档属性
| 名称 | 2025届河南省豫西北教研联盟高三上学期第一次质量检测 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 979.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-31 18:31:09 | ||
图片预览



文档简介
豫西北教研联盟2024—2025学年
高三第一次质量检测
化 学
注意事项:
1.考试时间:75分钟 ,总分100分。
2.答题前,考生务必将自己的姓名、考号、考试科目涂写在答题卡上。
可能用到的相对原子质量:H1 N14 O16 S32 Fe56 Co59
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 化学与生产、生活密切相关。下列说法正确的是
A.腈纶织物可广泛用作衣物和床上用品
B.农田使用铵态氮肥要深施覆土,以防止氮肥被氧化
C. 维生素 C、亚硝酸钠均可作为食品添加剂中的营养强化剂
D.在牙膏中添加氟化物可起到预防龋齿作用,原因是氟化物具有氧化性可杀菌
2. 下列物质分类组合正确的是
选项 碱 电解质 混合物 碱性氧化物
A 苛性钾 乙醇 胆矾 Al O
B 纯碱 小苏打 液氯 Mn O
C 烧碱 H O Fe(OH) 胶体 MgO
D 熟石灰 CaCO 水煤气 Na O
3.2024年6月,我国科研人员首次在月壤样本中发现了天然石墨烯,是我国探月工程又一重大发现,石墨烯是只有一个碳原子直径厚度的单层石墨。下列有关说法错误的是
A. 石墨烯与金刚石互为同素异形体
B.石墨烯属于有机物且易溶于水
C.基态碳原子的电子排布式为
D.石墨烯独特的结构使其具有良好的导电性和导热性
4.下列化学用语或图示表达正确的是
A.空间填充模型既可以表示甲烷分子,也可以表示四氯化碳分子
B. NaCl溶液中的水合离子:
C. HClO 的电子式:
D. 聚丙烯的结构简式:
5.设NA 为阿伏加德罗常数的值。下列说法正确的是
A. 1 mol OH 中含有的电子数为9 NA
B.明矾净水时, 的Al 形成的 Al(OH) 胶粒的数目为
晶体中含有的硅氧键数目为2 NA
D.一定条件下,2 mol SO 与1m ol O 充分反应,生成的SO 分子数目小于
6.《礼记·内则》记载:“冠带垢,和灰请漱;衣裳垢,和灰请浣。”古人洗涤衣裳冠带,所用的就是草木灰(主要成分是K CO )浸泡的溶液。下列有关说法错误的是
A. K CO 是强碱弱酸盐,在溶液中水解使溶液呈碱性
B. K CO 中阴离子的空间结构为平面三角形
C. 向 K CO 溶液中加入少量KOH 固体,c(HCO -)与c(K )均增大
D. 在 K CO 溶液中存在:(
7.以CO 为原料可以与环氧丙烷等共聚形成高分子材料——脂肪族聚碳酸酯(PPCLA),合成方程式如下。下列有关说法错误的是
A. CO 分子是只含极性键的非极性分子
B. 的同分异构体中能与 Na反应的只有一种
分子中有2个手性碳原子
D. PPCLA 可发生降解
8.下列实验装置(部分夹持装置略)能达到实验目的的是
A B C D
制备并收集 NH 除去 H S 中混有的少量水蒸气 实验室制备乙烯 由 AlCl 溶液制取无水 AlCl 固体
9.下列事实对应的离子方程式正确的是
A. Cl 制备84 消毒液:
B. 用醋酸和淀粉-KI溶液检验加碘盐中的
C. NaHCO 溶液与少量 Ba(OH) 溶液混合:
D. 盛放 NaOH溶液的试剂瓶不能用玻璃塞 :
10. 短周期主族元素 W、X、Y、Z原子序数依次增大,X的最外层电子数是次外层电子数的3倍,X、Z同主族,Y元素在周期表中非金属性最强,其原子的最外层电子数与W原子的核外电子总数相等。四种元素能组成如图所示化合物,下列说法正确的是
A.原子半径:r(Z)>r(Y)>r(X)>r(W)
B.四种元素中,最高价含氧酸酸性最强的为Y
C.简单气态氢化物的沸点:X>Y>Z
D.第一电离能:Y>X>W
11.下列实验中,实验操作、现象和结论或解释均正确的是
实验操作 实验现象 结论或解释
A 将一团脱脂棉放入干净的试管中,加入几滴90%硫酸,搅成糊状,小火微热,加入新制的 Cu(OH) 悬浊液煮沸 生成砖红色沉淀 纤维素水解生成葡萄糖
B 对甲基苯酚中滴加酸性高锰酸钾溶液 溶液褪色 对甲基苯酚含有羟基
C 反应H (g)+I (g)══2HI(g)达平衡后,缩小容器体积 容器内颜色加深 平衡逆向移动
D 向 CuSO 溶液中加入过量氨水,并振荡 最终得到深蓝色溶液 与 Cu 的配位能力:NH >H O
12. 近期,科学家发现酞菁钴(CoPc)与碳纳米管(CNT)复合(CoPc/CNT)电催化CO 可转化为CH OH,机理路径如下图所示。下列说法正确的是
A. CO 和CH OH分子中的碳原子均为sp 杂化
B. CoPc/CNT 作为催化剂参与反应,反应过程中 Co的化合价没有发生变化
C. 过程的总反应为
D. 电催化过程中涉及极性键与非极性键的断裂与生成
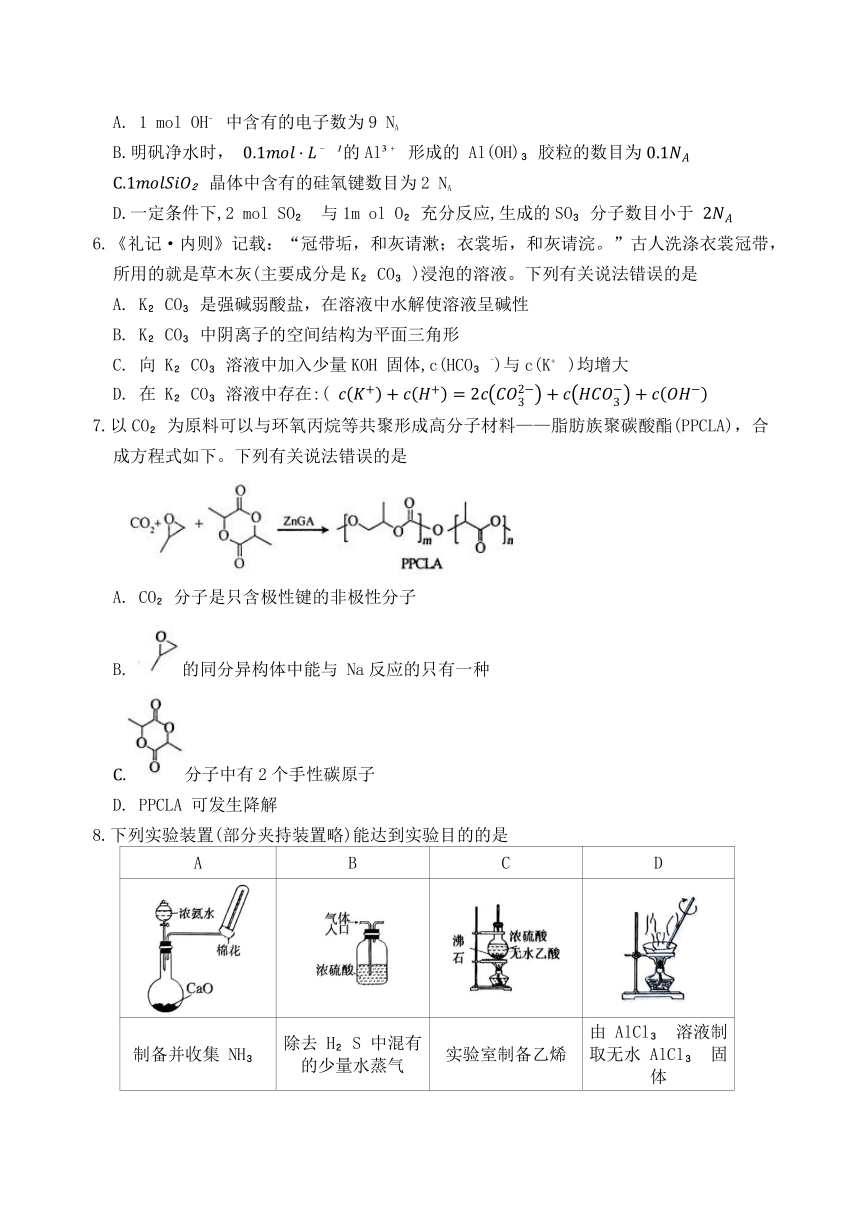
13. 2024年我国科学家开发了一种质子交换膜(PEM)系统,可在γ- Pb催化剂(源自废铅酸电池)上将二氧化碳还原为甲酸,其电解原理如图1所示。同时减少碳酸盐沉淀的生成,有望高效实现CO 向甲酸的转化,CO 转化过程中的pH 与电极电势关系如图2所示。下列有关说法错误的是
A.多孔层可以增大气体与催化剂的接触面积,有利于反应
B.外电路每转移1m ol电子,有1m ol的H 自右侧经过质子交换膜到左侧
C.在pH=2的条件下,可发生
D. pH=12时,可生成碳酸盐沉淀,不利于甲酸的生成
14. 25 ℃下,AgCl、AgBr 和 Ag CrO 的沉淀溶解平衡曲线如下图所示。某实验小组以
K CrO 为指示剂,用AgNO 标准溶液分别滴定含 Cl 水样、含Br 水样。
已知:I. Ag CrO 为砖红色沉淀;
II. 相同条件下 AgCl溶解度大于 AgBr;
III. 25℃时,I
(X 代表Cl 、Br 或(
下列说法错误的是
A. 曲线③为 AgBr沉淀溶解平衡曲线
C. 滴定 Br 达终点时,溶液中
D.反应 的平衡常数
二、非选择题:本题共4小题,共58分。
15.(14分)
硫酸亚铁铵( 为浅绿色晶体,易溶于水,难溶于酒精,在工业领域有广泛的应用,可用于制造染料、肥料、水处理剂、催化剂等。其制备原理为:
实验步骤:
I. 称取2.1g 废铁屑,放入小烧杯中,加入15 mL Na CO 溶液。小火加热约10 min后,用图1倾析法分离出固体,再用蒸馏水把铁屑冲洗洁净,备用。
II. 往盛有洁净铁屑的小烧杯中加入 溶液,再加入0.1g炭黑,于50°C 水浴中加热至不再有气体生成,趁热过滤(如图2所示),收集滤液和洗涤液。
III. 向所得溶液中加入 ,再加入2滴 溶液,经一系列操作后得到浅绿色晶体,称重得到8.7g产品。
请回答下列问题:
(1)硫酸亚铁铵中 Fe元素在周期表中的位置是 。
(2)步骤Ⅰ中加入Na CO 溶液的作用是 ,图1中玻璃棒的作用为 。
(3)步骤Ⅱ中加入炭黑后可观察到产生气泡的速率明显加快,可能的原因是 。
(4)步骤II 中趁热过滤的目的是 。
(5)已知三种盐的溶解度(
温度(℃) FeSO ·7H O (NH ) SO (NH ) Fe(SO ) ·6H O
10 20.0 73.0 17.2
20 26.5 75.4 21.6
30 32.9 78.0 28.1
步骤III中从溶液中得到要经过一系列操作包括 、 、过滤、洗涤、干燥。洗涤时最好选用 (填标号)作洗涤剂。
a.热水 b.冷水 o. 乙醇
在潮湿的空气中易被氧化为 则该反应的化学方程式为 。
(7)为测定所得产品的纯度,现取 ag产品溶于适量水中,加入一定量的硫酸溶液,待冷却后稀释至500mL。取50mL该溶液于锥形瓶中,用酸性高锰酸钾溶液滴定,达滴定终点时记录消耗高锰酸钾溶液的体积为V mL,则产品中 的纯度为 %(用含a、c、V的式子表示)。
16. (15分)
锂离子电池是新能源重要组成部分,废弃锂离子电池的回收利用不仅可以保护环境、节约资源,还可以创造经济效益,对工业可持续发展非常重要。利用SiCl 对废弃的锂离子电池正极材料 进行氯化处理并再生的一种工艺流程如图所示。
已知:
回答下列问题:
(1)LiCoO 中 Co元素的价态是 ;
(2)“烧渣”是 LiCl、CoCl 和 SiO 的混合物,则氯化焙烧过程中的化学方程式为 。“氯化焙烧”后剩余的SiCl 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因为 。
(3)若“沉钴”的pH控制为10.0,则溶液中Co 浓度为 mol L 。
(4)“焙烧”过程中固体残留率(固体残留率=×100%)随温度的变化如图1所示。为了获得纯净的Co O ,则该步骤应该控制的温度为 (填标号)。
a.300~400 ℃ b.500~800℃ c.850~900℃ d. 1 000 ℃以上
(5)钴的氢氧化物加热至290℃时可以完全脱水,所得产物可用于合成钛酸钴。钛酸钴的晶胞结构如图2所示,则该晶体化学式为 。
是钴的一种配合物,含1 mol 该配合物的溶液与足量 溶液能生成 mol AgCl,该配合物中( 的配位数为 。
17.(15分)
乙烯是一种用途广泛的有机化工原料,在现代石油和化学工业中具有举足轻重的作用。由乙烷制乙烯的研究备受关注。回答下列问题:
氧化脱氢反应:
)
①计算反应 的 该反应在 (填“高温”“低温”或“任何温度”)能自发进行。
②我国学者结合实验与计算机模拟结果,研究了不同催化剂下乙烷脱氢阶段反应进程如图1所示(吸附在催化剂表面的粒子用*标注,TS 表示过渡态)。
图1中代表催化性能较好的催化剂的反应历程是 (选填“c”或“d”),其判断依据是 。
(2)乙烷直接脱氢制乙烯的过程中,可能发生多个反应:
i
反应的平衡常数对数值(lgK)与温度的倒数1/T的关系如图2。
①△H 0(填“>”“<”或“=”)。
②仅发生反应i时,C H 的平衡转化率为25.0%,计算反应i的 是以平衡物质的量分数代替平衡浓度计算的平衡常数)。
③水蒸气在乙烷直接脱氢制乙烯中起着重要作用。一定温度下,当总压恒定时,增加水蒸气与乙烷的进料比,可提高乙烷的转化率,其原因是 。
④结合图2,分析工业上一般选择温度在1 000 K左右的可能原因是 。
18.(14分)
丙二酸又称苹果酸,主要用于医药中间体、香料、粘合剂等的生产。根据以丙二酸为原料进行的合成过程回答问题。
(1)A的结构简式是 。
(2)B→C的反应类型是 。
(3)C中所含官能团的名称是 。
(4)下列有关D物质的说法正确的是 (填标号)。
a. D能形成分子内和分子间氢键 b. D可发生取代、氧化和消去反应
c. D分子中所有碳原子可以共面 d. 可用 溶液鉴别D和F
(5)E→F的反应方程式是 。
(6)化合物H的分子式比G多一个CH ,具有六元环结构,既能发生银镜反应又能发生水解反应,核磁共振氢谱图中显示为五组峰且峰面积比为1∶1∶2∶4∶6。则H的可能结构是 。
豫西北教研联盟2024-2025学年高三第一次质量检测参考答案
化 学
一、选择题:共14个小题,每小题3分,共42分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 A C B C D C B A D C D C B B
二、非选择题:共4 小题,共58分。
15.(14分, 除标注外, 每空2分)
(1) 第四周期第VIII族 (1分)
(2) 除去铁屑表面的油污(1分) 引流 (1分)
(3) 铁屑与炭黑和硫酸溶液构成原电池,加快了反应速率(答案合理即可)
(4) 避免FeSO 结晶析出,降低产率; 除去炭黑等不溶性杂质(答案合理即可)
(5) 蒸发浓缩(1分) 冷却结晶(1分) c(1分)
16. (15分, 除标注外, 每空2分)
(1) +3 (1分)
( ↑
(4)b (5) CoTiO (6)2 6
17. (15分, 除标注外, 每空2分)
(1) ①-566.0 低温
②d (1分)
图1中反应的活化能d比c更低,反应速率更快,催化效果更好(答案合理即可)
(2)①> ② (或0.067)
③恒压下,增大水蒸气的量,各组分分压减小,平衡向正反应方向移动,乙烷转化率升高 (答案合理即可)
④反应温度太低,反应速率太慢,乙烷裂解制乙烯反应的化学平衡常数K太小;反应温度太高,副反应增多,容易产生积碳(答案合理即可)18.(14分, 每空2分)
(2) 加成反应
(3) 酯基、羟基
(4) ab(答对一个给1分,多答或答错均不给分)
高三第一次质量检测
化 学
注意事项:
1.考试时间:75分钟 ,总分100分。
2.答题前,考生务必将自己的姓名、考号、考试科目涂写在答题卡上。
可能用到的相对原子质量:H1 N14 O16 S32 Fe56 Co59
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 化学与生产、生活密切相关。下列说法正确的是
A.腈纶织物可广泛用作衣物和床上用品
B.农田使用铵态氮肥要深施覆土,以防止氮肥被氧化
C. 维生素 C、亚硝酸钠均可作为食品添加剂中的营养强化剂
D.在牙膏中添加氟化物可起到预防龋齿作用,原因是氟化物具有氧化性可杀菌
2. 下列物质分类组合正确的是
选项 碱 电解质 混合物 碱性氧化物
A 苛性钾 乙醇 胆矾 Al O
B 纯碱 小苏打 液氯 Mn O
C 烧碱 H O Fe(OH) 胶体 MgO
D 熟石灰 CaCO 水煤气 Na O
3.2024年6月,我国科研人员首次在月壤样本中发现了天然石墨烯,是我国探月工程又一重大发现,石墨烯是只有一个碳原子直径厚度的单层石墨。下列有关说法错误的是
A. 石墨烯与金刚石互为同素异形体
B.石墨烯属于有机物且易溶于水
C.基态碳原子的电子排布式为
D.石墨烯独特的结构使其具有良好的导电性和导热性
4.下列化学用语或图示表达正确的是
A.空间填充模型既可以表示甲烷分子,也可以表示四氯化碳分子
B. NaCl溶液中的水合离子:
C. HClO 的电子式:
D. 聚丙烯的结构简式:
5.设NA 为阿伏加德罗常数的值。下列说法正确的是
A. 1 mol OH 中含有的电子数为9 NA
B.明矾净水时, 的Al 形成的 Al(OH) 胶粒的数目为
晶体中含有的硅氧键数目为2 NA
D.一定条件下,2 mol SO 与1m ol O 充分反应,生成的SO 分子数目小于
6.《礼记·内则》记载:“冠带垢,和灰请漱;衣裳垢,和灰请浣。”古人洗涤衣裳冠带,所用的就是草木灰(主要成分是K CO )浸泡的溶液。下列有关说法错误的是
A. K CO 是强碱弱酸盐,在溶液中水解使溶液呈碱性
B. K CO 中阴离子的空间结构为平面三角形
C. 向 K CO 溶液中加入少量KOH 固体,c(HCO -)与c(K )均增大
D. 在 K CO 溶液中存在:(
7.以CO 为原料可以与环氧丙烷等共聚形成高分子材料——脂肪族聚碳酸酯(PPCLA),合成方程式如下。下列有关说法错误的是
A. CO 分子是只含极性键的非极性分子
B. 的同分异构体中能与 Na反应的只有一种
分子中有2个手性碳原子
D. PPCLA 可发生降解
8.下列实验装置(部分夹持装置略)能达到实验目的的是
A B C D
制备并收集 NH 除去 H S 中混有的少量水蒸气 实验室制备乙烯 由 AlCl 溶液制取无水 AlCl 固体
9.下列事实对应的离子方程式正确的是
A. Cl 制备84 消毒液:
B. 用醋酸和淀粉-KI溶液检验加碘盐中的
C. NaHCO 溶液与少量 Ba(OH) 溶液混合:
D. 盛放 NaOH溶液的试剂瓶不能用玻璃塞 :
10. 短周期主族元素 W、X、Y、Z原子序数依次增大,X的最外层电子数是次外层电子数的3倍,X、Z同主族,Y元素在周期表中非金属性最强,其原子的最外层电子数与W原子的核外电子总数相等。四种元素能组成如图所示化合物,下列说法正确的是
A.原子半径:r(Z)>r(Y)>r(X)>r(W)
B.四种元素中,最高价含氧酸酸性最强的为Y
C.简单气态氢化物的沸点:X>Y>Z
D.第一电离能:Y>X>W
11.下列实验中,实验操作、现象和结论或解释均正确的是
实验操作 实验现象 结论或解释
A 将一团脱脂棉放入干净的试管中,加入几滴90%硫酸,搅成糊状,小火微热,加入新制的 Cu(OH) 悬浊液煮沸 生成砖红色沉淀 纤维素水解生成葡萄糖
B 对甲基苯酚中滴加酸性高锰酸钾溶液 溶液褪色 对甲基苯酚含有羟基
C 反应H (g)+I (g)══2HI(g)达平衡后,缩小容器体积 容器内颜色加深 平衡逆向移动
D 向 CuSO 溶液中加入过量氨水,并振荡 最终得到深蓝色溶液 与 Cu 的配位能力:NH >H O
12. 近期,科学家发现酞菁钴(CoPc)与碳纳米管(CNT)复合(CoPc/CNT)电催化CO 可转化为CH OH,机理路径如下图所示。下列说法正确的是
A. CO 和CH OH分子中的碳原子均为sp 杂化
B. CoPc/CNT 作为催化剂参与反应,反应过程中 Co的化合价没有发生变化
C. 过程的总反应为
D. 电催化过程中涉及极性键与非极性键的断裂与生成
13. 2024年我国科学家开发了一种质子交换膜(PEM)系统,可在γ- Pb催化剂(源自废铅酸电池)上将二氧化碳还原为甲酸,其电解原理如图1所示。同时减少碳酸盐沉淀的生成,有望高效实现CO 向甲酸的转化,CO 转化过程中的pH 与电极电势关系如图2所示。下列有关说法错误的是
A.多孔层可以增大气体与催化剂的接触面积,有利于反应
B.外电路每转移1m ol电子,有1m ol的H 自右侧经过质子交换膜到左侧
C.在pH=2的条件下,可发生
D. pH=12时,可生成碳酸盐沉淀,不利于甲酸的生成
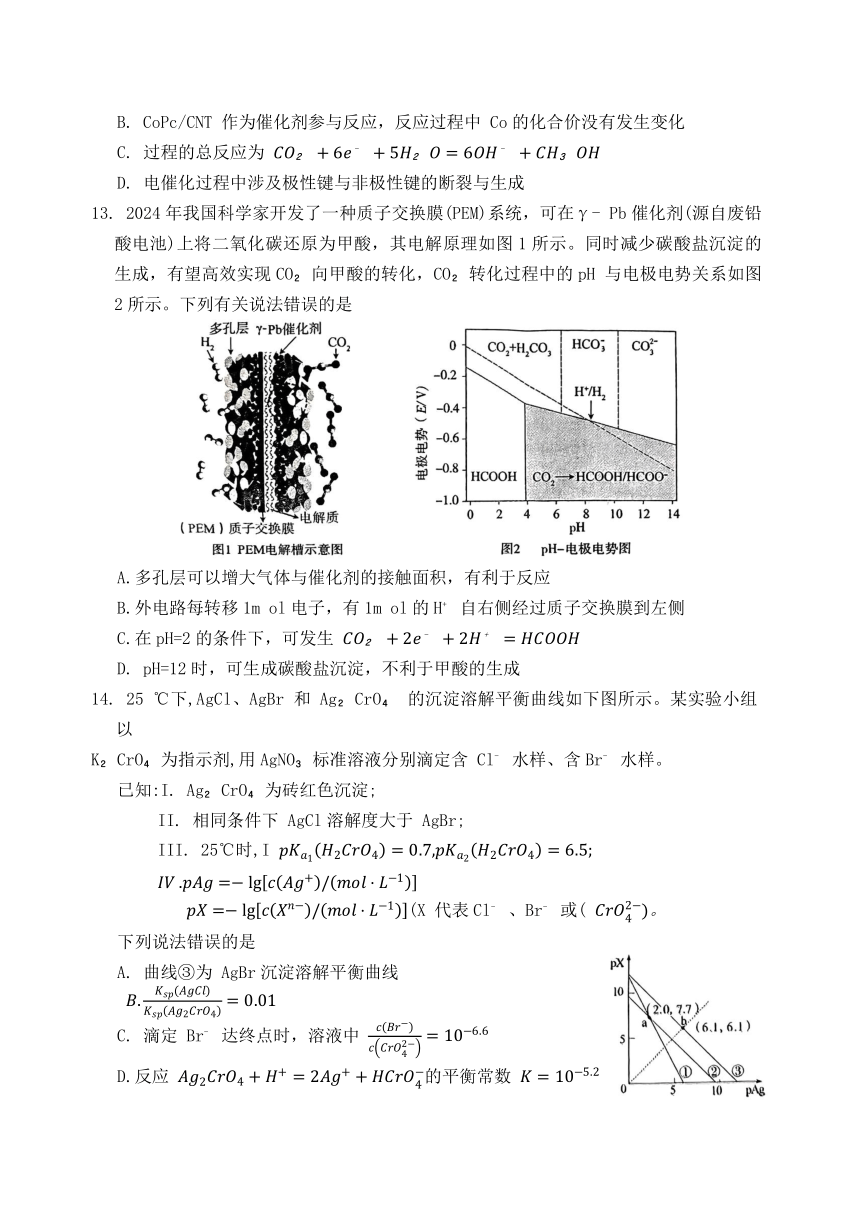
14. 25 ℃下,AgCl、AgBr 和 Ag CrO 的沉淀溶解平衡曲线如下图所示。某实验小组以
K CrO 为指示剂,用AgNO 标准溶液分别滴定含 Cl 水样、含Br 水样。
已知:I. Ag CrO 为砖红色沉淀;
II. 相同条件下 AgCl溶解度大于 AgBr;
III. 25℃时,I
(X 代表Cl 、Br 或(
下列说法错误的是
A. 曲线③为 AgBr沉淀溶解平衡曲线
C. 滴定 Br 达终点时,溶液中
D.反应 的平衡常数
二、非选择题:本题共4小题,共58分。
15.(14分)
硫酸亚铁铵( 为浅绿色晶体,易溶于水,难溶于酒精,在工业领域有广泛的应用,可用于制造染料、肥料、水处理剂、催化剂等。其制备原理为:
实验步骤:
I. 称取2.1g 废铁屑,放入小烧杯中,加入15 mL Na CO 溶液。小火加热约10 min后,用图1倾析法分离出固体,再用蒸馏水把铁屑冲洗洁净,备用。
II. 往盛有洁净铁屑的小烧杯中加入 溶液,再加入0.1g炭黑,于50°C 水浴中加热至不再有气体生成,趁热过滤(如图2所示),收集滤液和洗涤液。
III. 向所得溶液中加入 ,再加入2滴 溶液,经一系列操作后得到浅绿色晶体,称重得到8.7g产品。
请回答下列问题:
(1)硫酸亚铁铵中 Fe元素在周期表中的位置是 。
(2)步骤Ⅰ中加入Na CO 溶液的作用是 ,图1中玻璃棒的作用为 。
(3)步骤Ⅱ中加入炭黑后可观察到产生气泡的速率明显加快,可能的原因是 。
(4)步骤II 中趁热过滤的目的是 。
(5)已知三种盐的溶解度(
温度(℃) FeSO ·7H O (NH ) SO (NH ) Fe(SO ) ·6H O
10 20.0 73.0 17.2
20 26.5 75.4 21.6
30 32.9 78.0 28.1
步骤III中从溶液中得到要经过一系列操作包括 、 、过滤、洗涤、干燥。洗涤时最好选用 (填标号)作洗涤剂。
a.热水 b.冷水 o. 乙醇
在潮湿的空气中易被氧化为 则该反应的化学方程式为 。
(7)为测定所得产品的纯度,现取 ag产品溶于适量水中,加入一定量的硫酸溶液,待冷却后稀释至500mL。取50mL该溶液于锥形瓶中,用酸性高锰酸钾溶液滴定,达滴定终点时记录消耗高锰酸钾溶液的体积为V mL,则产品中 的纯度为 %(用含a、c、V的式子表示)。
16. (15分)
锂离子电池是新能源重要组成部分,废弃锂离子电池的回收利用不仅可以保护环境、节约资源,还可以创造经济效益,对工业可持续发展非常重要。利用SiCl 对废弃的锂离子电池正极材料 进行氯化处理并再生的一种工艺流程如图所示。
已知:
回答下列问题:
(1)LiCoO 中 Co元素的价态是 ;
(2)“烧渣”是 LiCl、CoCl 和 SiO 的混合物,则氯化焙烧过程中的化学方程式为 。“氯化焙烧”后剩余的SiCl 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因为 。
(3)若“沉钴”的pH控制为10.0,则溶液中Co 浓度为 mol L 。
(4)“焙烧”过程中固体残留率(固体残留率=×100%)随温度的变化如图1所示。为了获得纯净的Co O ,则该步骤应该控制的温度为 (填标号)。
a.300~400 ℃ b.500~800℃ c.850~900℃ d. 1 000 ℃以上
(5)钴的氢氧化物加热至290℃时可以完全脱水,所得产物可用于合成钛酸钴。钛酸钴的晶胞结构如图2所示,则该晶体化学式为 。
是钴的一种配合物,含1 mol 该配合物的溶液与足量 溶液能生成 mol AgCl,该配合物中( 的配位数为 。
17.(15分)
乙烯是一种用途广泛的有机化工原料,在现代石油和化学工业中具有举足轻重的作用。由乙烷制乙烯的研究备受关注。回答下列问题:
氧化脱氢反应:
)
①计算反应 的 该反应在 (填“高温”“低温”或“任何温度”)能自发进行。
②我国学者结合实验与计算机模拟结果,研究了不同催化剂下乙烷脱氢阶段反应进程如图1所示(吸附在催化剂表面的粒子用*标注,TS 表示过渡态)。
图1中代表催化性能较好的催化剂的反应历程是 (选填“c”或“d”),其判断依据是 。
(2)乙烷直接脱氢制乙烯的过程中,可能发生多个反应:
i
反应的平衡常数对数值(lgK)与温度的倒数1/T的关系如图2。
①△H 0(填“>”“<”或“=”)。
②仅发生反应i时,C H 的平衡转化率为25.0%,计算反应i的 是以平衡物质的量分数代替平衡浓度计算的平衡常数)。
③水蒸气在乙烷直接脱氢制乙烯中起着重要作用。一定温度下,当总压恒定时,增加水蒸气与乙烷的进料比,可提高乙烷的转化率,其原因是 。
④结合图2,分析工业上一般选择温度在1 000 K左右的可能原因是 。
18.(14分)
丙二酸又称苹果酸,主要用于医药中间体、香料、粘合剂等的生产。根据以丙二酸为原料进行的合成过程回答问题。
(1)A的结构简式是 。
(2)B→C的反应类型是 。
(3)C中所含官能团的名称是 。
(4)下列有关D物质的说法正确的是 (填标号)。
a. D能形成分子内和分子间氢键 b. D可发生取代、氧化和消去反应
c. D分子中所有碳原子可以共面 d. 可用 溶液鉴别D和F
(5)E→F的反应方程式是 。
(6)化合物H的分子式比G多一个CH ,具有六元环结构,既能发生银镜反应又能发生水解反应,核磁共振氢谱图中显示为五组峰且峰面积比为1∶1∶2∶4∶6。则H的可能结构是 。
豫西北教研联盟2024-2025学年高三第一次质量检测参考答案
化 学
一、选择题:共14个小题,每小题3分,共42分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 A C B C D C B A D C D C B B
二、非选择题:共4 小题,共58分。
15.(14分, 除标注外, 每空2分)
(1) 第四周期第VIII族 (1分)
(2) 除去铁屑表面的油污(1分) 引流 (1分)
(3) 铁屑与炭黑和硫酸溶液构成原电池,加快了反应速率(答案合理即可)
(4) 避免FeSO 结晶析出,降低产率; 除去炭黑等不溶性杂质(答案合理即可)
(5) 蒸发浓缩(1分) 冷却结晶(1分) c(1分)
16. (15分, 除标注外, 每空2分)
(1) +3 (1分)
( ↑
(4)b (5) CoTiO (6)2 6
17. (15分, 除标注外, 每空2分)
(1) ①-566.0 低温
②d (1分)
图1中反应的活化能d比c更低,反应速率更快,催化效果更好(答案合理即可)
(2)①> ② (或0.067)
③恒压下,增大水蒸气的量,各组分分压减小,平衡向正反应方向移动,乙烷转化率升高 (答案合理即可)
④反应温度太低,反应速率太慢,乙烷裂解制乙烯反应的化学平衡常数K太小;反应温度太高,副反应增多,容易产生积碳(答案合理即可)18.(14分, 每空2分)
(2) 加成反应
(3) 酯基、羟基
(4) ab(答对一个给1分,多答或答错均不给分)
同课章节目录
