2.3.2 气体摩尔体积 课件(共23张PPT)高中化学 人教版(2019) 必修 第一册
文档属性
| 名称 | 2.3.2 气体摩尔体积 课件(共23张PPT)高中化学 人教版(2019) 必修 第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 554.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 14:15:23 | ||
图片预览



文档简介
(共23张PPT)
第2课时
气体摩尔体积
第二章 第三节 物质的量
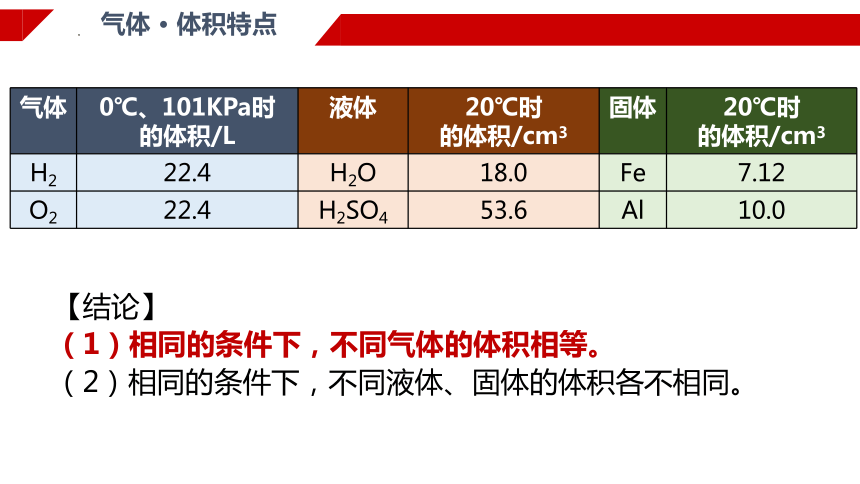
气体 · 体积特点
气体 0℃、101KPa时 的体积/L 液体 20℃时 的体积/cm3 固体 20℃时
的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
【结论】
(1)相同的条件下,不同气体的体积相等。
(2)相同的条件下,不同液体、固体的体积各不相同。
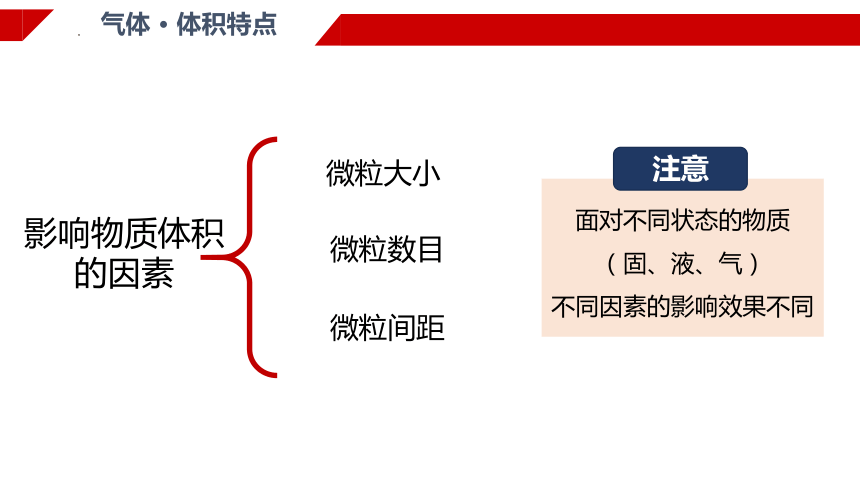
微粒数目
气体 · 体积特点
影响物质体积
的因素
微粒大小
微粒间距
面对不同状态的物质
(固、液、气)
不同因素的影响效果不同
注意
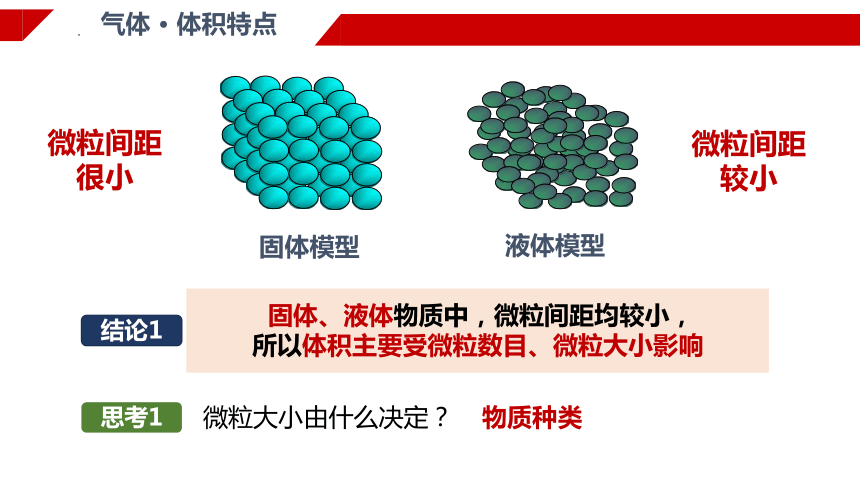
微粒间距
很小
气体 · 体积特点
固体模型
液体模型
微粒间距
较小
固体、液体物质中,微粒间距均较小,
所以体积主要受微粒数目、微粒大小影响
结论1
思考1
微粒大小由什么决定?
物质种类
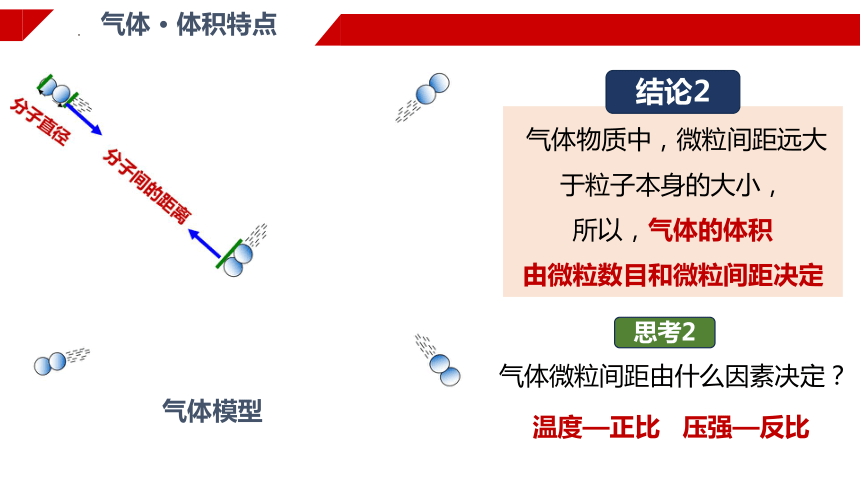
气体 · 体积特点
气体模型
气体物质中,微粒间距远大于粒子本身的大小,
所以,气体的体积
由微粒数目和微粒间距决定
结论2
思考2
气体微粒间距由什么因素决定?
温度—正比 压强—反比
气体 · 体积特点
总结
固体/液体 体积
决定
决定
气体体积
决定
物质种类
温度(T) 压强(P)
决定
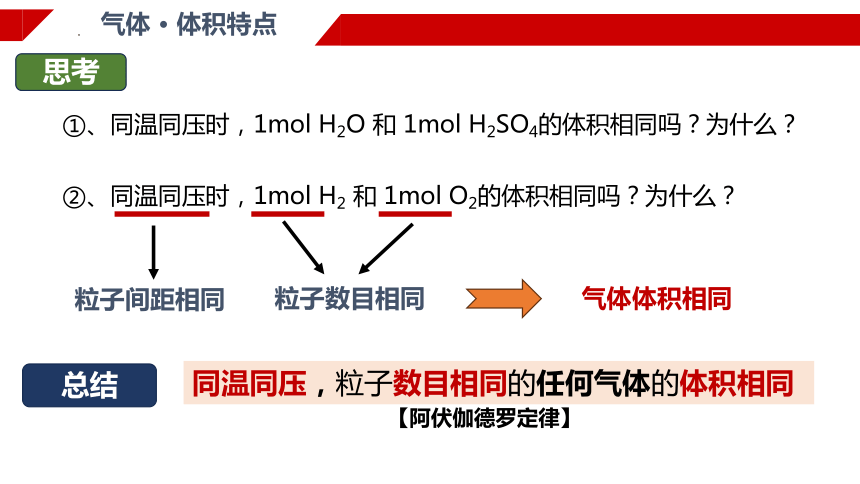
气体 · 体积特点
思考
①、同温同压时,1mol H2O 和 1mol H2SO4的体积相同吗?为什么?
②、同温同压时,1mol H2 和 1mol O2的体积相同吗?为什么?
粒子间距相同
粒子数目相同
气体体积相同
总结
同温同压,粒子数目相同的任何气体的体积相同
【阿伏伽德罗定律】
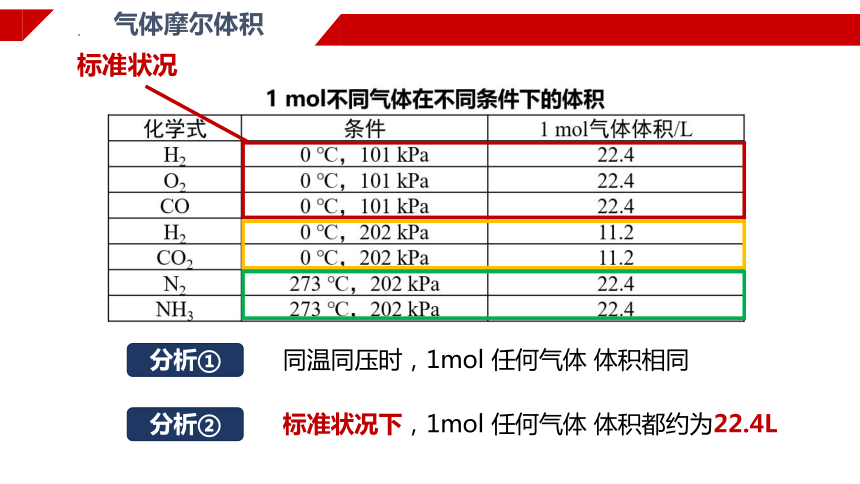
气体摩尔体积
气体摩尔体积
定义:
符号:
单位:
影响因素:
单位物质的量(每1mol )气体的体积
Vm
L·mol-1
气体所处的温度和压强(温正压反)
公式:
n =
气体摩尔体积
同温同压时,1mol 任何气体 体积相同
分析①
标准状况下,1mol 任何气体 体积都约为22.4L
分析②
标准状况
气体摩尔体积
压强升高,气体体积减小
分析③
温度升高,气体体积增大
分析④
1mol气体只有在标况时才有可能是22.4L吗?
思考
不一定
标况 · 气体摩尔体积
标况
0℃,101kPa
Vm= 22.4 L/mol
常温
常压
25℃,101kPa
Vm= 24.5 L/mol
常用的Vm数值
①、Vm的数值取决与温度和压强,只要使用Vm必须指明温度压强
(使用Vm=22.4L/mol 时,必须有“标况”的前提)
②、Vm的使用对象是气体,包括混合气体
③、非标准状况,Vm 也有可能约为22.4 L·mol-1,只要T、P条件适宜
标况 · 气体摩尔体积
注意
提示:【标况下,H2O、酒精、CCl4、SO3、苯、HF 不是气体】
判断下列说法是否正确
标况 · 气体摩尔体积
练习1
①、1 mol CO2 的体积为22.4 L
无标况
②、标准状况下,1 mol H2O 的体积为22.4 L
非气体
③、1 mol CO2 的体积如果是22.4 L ,一定处在标况下
标况下一定是22.4,但22.4不一定在标况下
④、CO2 和O2的混合气体总共1mol,标况下的体积也是22.4 L
√
×
×
×
无论单纯气体,还是混合气体,只要n=1mol,且在标况下,就是22.4L
1. 标准状况下,1mol任何物质的体积都约是22.4L。
×
2. 1mol气体的体积约为22.4L。
3. 标准状况下,1molO2和 N2混合气体的体积约为22.4L。
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
5. 标准状况下,气体的摩尔体积都是22.4L。
6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
标况 · 气体摩尔体积
×
×
×
×
√
判断下列说法是否正确
练习2
(1)标准状况下2 mol H2的体积是多少
(3)标准状况下44.8 L H2中含有的H2分子数是多少?
(2)标准状况下4 g H2的体积是多少?
标况 · 气体摩尔体积
练习3
阿伏伽德罗定律及推论
(1)阿伏加德罗定律:
同温同压,粒子数相同的任何气体都具有相同的体积
(2)特别提示
①阿伏加德罗定律适用于任何气体,包括混合气体,不适用于非气体
②同温、同压、同体积、同分子数,共同存在,相互制约
③T、P、V、N(n)四个条件,“三同定一同”
例:同温同压同体积的气体,其分子数一定相同(物质的量也一定相同)
阿伏伽德罗定律
条件 公式
同温同压
同温同体积
同温同压
同温同压同体积
阿伏伽德罗定律推论
推导过程涉及的公式:
n =
n =
n =
ρ =
阿伏伽德罗定律推论总结
阿伏伽德罗定律
推导过程:
①、同温同压下,求物质的量与气体体积的关系
②、同温同压下,求分子数与气体体积的关系
③、同温同压下,求密度与摩尔质量的关系
④、同温同压同体积下,求质量与摩尔质量的关系
⑤、同温同体积下,求物质的量与压强的关系
【讨论】在一定温度和压强下,并不一定是标准状况,1mol不同的
气体体积是否相同?
在同温同压下,相同分子数的气体,其体积 ;
在同温同压下,体积相同的气体,其分子数 ;
在同温同压下,气体体积的大小与分子数目成 ;
相同
相同
正比
阿伏伽德罗定律
练习1
同温同压下,质量相同的N2、CO2、Cl2、CH4、O 2五种气体所占的体积由大到小 的顺序是( )
CH4、N2、O2、CO2、Cl2
阿伏伽德罗定律
练习2
2.关于同温、同压下等体积的N2O(气体)和CO2的下列叙述中正确的是( )
①质量相同;②所含碳原子数与氮原子数相等;③所含分子数相等 A.①②③ B.②③ C.①② D.①③
D
阿伏伽德罗定律
练习3
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为 。
(2)该气体所含原子总数为 。
(3)该气体在标准状况下的体积为 。
(4)该气体在标准状况下的密度为 。
阿伏伽德罗定律
练习4
第2课时
气体摩尔体积
第二章 第三节 物质的量
气体 · 体积特点
气体 0℃、101KPa时 的体积/L 液体 20℃时 的体积/cm3 固体 20℃时
的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
【结论】
(1)相同的条件下,不同气体的体积相等。
(2)相同的条件下,不同液体、固体的体积各不相同。
微粒数目
气体 · 体积特点
影响物质体积
的因素
微粒大小
微粒间距
面对不同状态的物质
(固、液、气)
不同因素的影响效果不同
注意
微粒间距
很小
气体 · 体积特点
固体模型
液体模型
微粒间距
较小
固体、液体物质中,微粒间距均较小,
所以体积主要受微粒数目、微粒大小影响
结论1
思考1
微粒大小由什么决定?
物质种类
气体 · 体积特点
气体模型
气体物质中,微粒间距远大于粒子本身的大小,
所以,气体的体积
由微粒数目和微粒间距决定
结论2
思考2
气体微粒间距由什么因素决定?
温度—正比 压强—反比
气体 · 体积特点
总结
固体/液体 体积
决定
决定
气体体积
决定
物质种类
温度(T) 压强(P)
决定
气体 · 体积特点
思考
①、同温同压时,1mol H2O 和 1mol H2SO4的体积相同吗?为什么?
②、同温同压时,1mol H2 和 1mol O2的体积相同吗?为什么?
粒子间距相同
粒子数目相同
气体体积相同
总结
同温同压,粒子数目相同的任何气体的体积相同
【阿伏伽德罗定律】
气体摩尔体积
气体摩尔体积
定义:
符号:
单位:
影响因素:
单位物质的量(每1mol )气体的体积
Vm
L·mol-1
气体所处的温度和压强(温正压反)
公式:
n =
气体摩尔体积
同温同压时,1mol 任何气体 体积相同
分析①
标准状况下,1mol 任何气体 体积都约为22.4L
分析②
标准状况
气体摩尔体积
压强升高,气体体积减小
分析③
温度升高,气体体积增大
分析④
1mol气体只有在标况时才有可能是22.4L吗?
思考
不一定
标况 · 气体摩尔体积
标况
0℃,101kPa
Vm= 22.4 L/mol
常温
常压
25℃,101kPa
Vm= 24.5 L/mol
常用的Vm数值
①、Vm的数值取决与温度和压强,只要使用Vm必须指明温度压强
(使用Vm=22.4L/mol 时,必须有“标况”的前提)
②、Vm的使用对象是气体,包括混合气体
③、非标准状况,Vm 也有可能约为22.4 L·mol-1,只要T、P条件适宜
标况 · 气体摩尔体积
注意
提示:【标况下,H2O、酒精、CCl4、SO3、苯、HF 不是气体】
判断下列说法是否正确
标况 · 气体摩尔体积
练习1
①、1 mol CO2 的体积为22.4 L
无标况
②、标准状况下,1 mol H2O 的体积为22.4 L
非气体
③、1 mol CO2 的体积如果是22.4 L ,一定处在标况下
标况下一定是22.4,但22.4不一定在标况下
④、CO2 和O2的混合气体总共1mol,标况下的体积也是22.4 L
√
×
×
×
无论单纯气体,还是混合气体,只要n=1mol,且在标况下,就是22.4L
1. 标准状况下,1mol任何物质的体积都约是22.4L。
×
2. 1mol气体的体积约为22.4L。
3. 标准状况下,1molO2和 N2混合气体的体积约为22.4L。
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
5. 标准状况下,气体的摩尔体积都是22.4L。
6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
标况 · 气体摩尔体积
×
×
×
×
√
判断下列说法是否正确
练习2
(1)标准状况下2 mol H2的体积是多少
(3)标准状况下44.8 L H2中含有的H2分子数是多少?
(2)标准状况下4 g H2的体积是多少?
标况 · 气体摩尔体积
练习3
阿伏伽德罗定律及推论
(1)阿伏加德罗定律:
同温同压,粒子数相同的任何气体都具有相同的体积
(2)特别提示
①阿伏加德罗定律适用于任何气体,包括混合气体,不适用于非气体
②同温、同压、同体积、同分子数,共同存在,相互制约
③T、P、V、N(n)四个条件,“三同定一同”
例:同温同压同体积的气体,其分子数一定相同(物质的量也一定相同)
阿伏伽德罗定律
条件 公式
同温同压
同温同体积
同温同压
同温同压同体积
阿伏伽德罗定律推论
推导过程涉及的公式:
n =
n =
n =
ρ =
阿伏伽德罗定律推论总结
阿伏伽德罗定律
推导过程:
①、同温同压下,求物质的量与气体体积的关系
②、同温同压下,求分子数与气体体积的关系
③、同温同压下,求密度与摩尔质量的关系
④、同温同压同体积下,求质量与摩尔质量的关系
⑤、同温同体积下,求物质的量与压强的关系
【讨论】在一定温度和压强下,并不一定是标准状况,1mol不同的
气体体积是否相同?
在同温同压下,相同分子数的气体,其体积 ;
在同温同压下,体积相同的气体,其分子数 ;
在同温同压下,气体体积的大小与分子数目成 ;
相同
相同
正比
阿伏伽德罗定律
练习1
同温同压下,质量相同的N2、CO2、Cl2、CH4、O 2五种气体所占的体积由大到小 的顺序是( )
CH4、N2、O2、CO2、Cl2
阿伏伽德罗定律
练习2
2.关于同温、同压下等体积的N2O(气体)和CO2的下列叙述中正确的是( )
①质量相同;②所含碳原子数与氮原子数相等;③所含分子数相等 A.①②③ B.②③ C.①② D.①③
D
阿伏伽德罗定律
练习3
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为 。
(2)该气体所含原子总数为 。
(3)该气体在标准状况下的体积为 。
(4)该气体在标准状况下的密度为 。
阿伏伽德罗定律
练习4
