2.2.2 氯气与碱的反应 氯离子的检验 课件(共13张PPT)高中化学 人教版(2019)必修 第一册
文档属性
| 名称 | 2.2.2 氯气与碱的反应 氯离子的检验 课件(共13张PPT)高中化学 人教版(2019)必修 第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 55.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 14:23:14 | ||
图片预览




文档简介
(共13张PPT)
第2课时
氯气与碱反应
Cl-的检验
第二章 第二节 氯及其化合物
1789年,法国化学家贝托莱发现氯水具有漂白性,他提出把氯水的漂白作用应用于漂白工业。
但因为Cl2溶解度不大,且生成的 HClO不稳定,难以保存,使用起来很不方便,效果也不理想。
贝托莱
1748-1822
课前导入
氯水不稳定,虽然可以杀菌、漂白,但很难作为产品投入使用
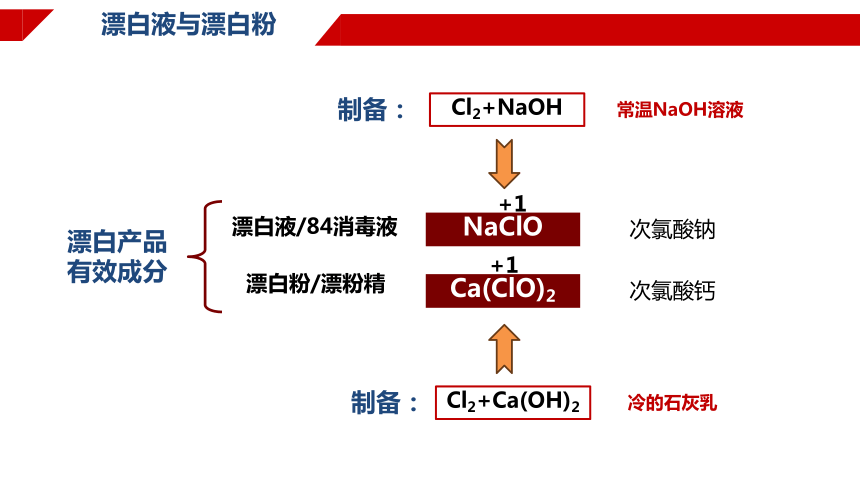
漂白液与漂白粉
漂白产品
有效成分
NaClO
Ca(ClO)2
漂白液/84消毒液
漂白粉/漂粉精
+1
+1
次氯酸钠
次氯酸钙
Cl2+NaOH
Cl2+Ca(OH)2
制备:
制备:
冷的石灰乳
常温NaOH溶液
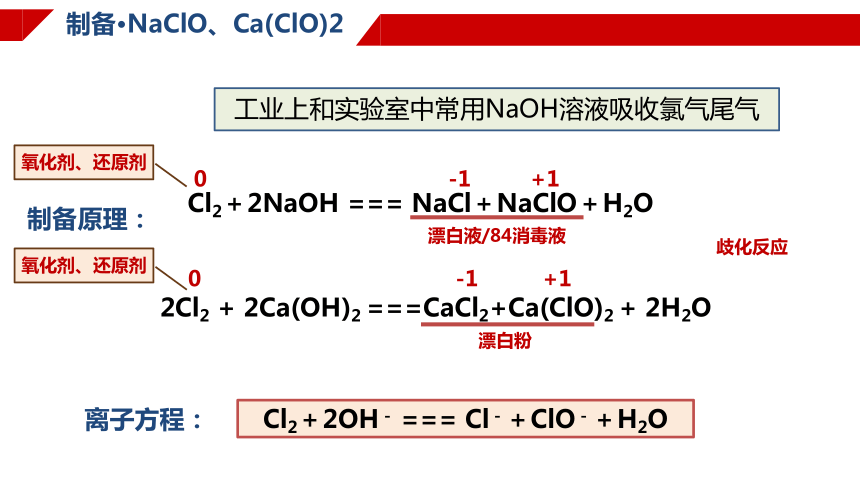
制备·NaClO、Ca(ClO)2
制备原理:
Cl2+2NaOH === NaCl+NaClO+H2O
0
-1
+1
歧化反应
氧化剂、还原剂
2Cl2 + 2Ca(OH)2 ===CaCl2+Ca(ClO)2 + 2H2O
氧化剂、还原剂
0
-1
+1
漂白液/84消毒液
漂白粉
工业上和实验室中常用NaOH溶液吸收氯气尾气
Cl2+2OH- === Cl-+ClO-+H2O
离子方程:
起效与失效原理
成分:NaClO、NaCl
有效成分:NaClO
漂白液/84消毒液
漂白粉/漂粉精
成分:Ca(ClO)2、CaCl2
有效成分: Ca(ClO)2
NaClO+CO2+H2O = NaHCO3+HClO
起效原理
Ca(ClO)2+CO2+H2O= CaCO3↓ +2HClO
失效原理 = 起效原理+HClO分解
2HClO 2HCl+O2 ↑
光照
起效原理
起效与失效原理
漂白粉能用来消毒吗?84消毒液能用来漂白吗?
思考1
可以。二者均可用于漂白和消毒,
都可以与空气中的H2O和CO2反应生成HClO
漂白粉和漂白液的保存有哪些注意事项?
思考2
密封、避光、阴凉处保存
使用时,如何更好的提高漂白液/粉的漂白效率?
思考3
加入酸,或增大漂白液/粉与空气的接触
起效与失效原理
保存不当的漂白粉变质后的成分是什么?如何检验?
思考4
漂白粉变质:
完全变质:CaCl2、CaCO3
部分变质: CaCl2、 Ca(ClO)2 、 CaCO3
检验方法:加入HCl如果有气泡生成则证明发生了变质(生成CaCO3)
使用注意事项
主要成分HCl
主要成分NaClO
84消毒液严禁和盐酸混合使用
2HCl + NaClO == NaCl + Cl2↑+H2O
混合使用生成毒气:Cl2
0
-1
+1
归中反应
2H+ + Cl- + ClO- == Cl2↑+H2O
Cl-的检验
Cl-检验
试液2~3 mL 实验现象 离子方程式
滴入几滴硝酸银溶液 加入少量稀硝酸
①稀HCl ______________ __________ __________________
②NaCl溶液 ______________ __________ __________________
③Na2CO3溶液 ______________ __________ __________ ___________________________
_________________________
生成白色沉淀
沉淀不溶解
沉淀不溶解
沉淀溶解,
有气泡产生
Cl-+Ag+===AgCl↓
Cl-+Ag+===AgCl↓
Ag2CO3+2H+==2Ag++CO2↑+H2O
CO32-+2Ag+===Ag2CO3↓
Cl-检验
生成白色沉淀
生成白色沉淀
检验氯离子的方法:
取少量待测液于试管中,滴加HNO3,然后滴入AgNO3溶液,
(也可答:取少量待测液于试管中,滴加HNO3酸化的AgNO3溶液)
若产生白色沉淀,则待测液中含有Cl-,若无白色沉淀则无Cl-。
Cl-检验
HNO3的作用:
排除CO32- 等离子的干扰
笔记
笔记
第2课时
氯气与碱反应
Cl-的检验
第二章 第二节 氯及其化合物
1789年,法国化学家贝托莱发现氯水具有漂白性,他提出把氯水的漂白作用应用于漂白工业。
但因为Cl2溶解度不大,且生成的 HClO不稳定,难以保存,使用起来很不方便,效果也不理想。
贝托莱
1748-1822
课前导入
氯水不稳定,虽然可以杀菌、漂白,但很难作为产品投入使用
漂白液与漂白粉
漂白产品
有效成分
NaClO
Ca(ClO)2
漂白液/84消毒液
漂白粉/漂粉精
+1
+1
次氯酸钠
次氯酸钙
Cl2+NaOH
Cl2+Ca(OH)2
制备:
制备:
冷的石灰乳
常温NaOH溶液
制备·NaClO、Ca(ClO)2
制备原理:
Cl2+2NaOH === NaCl+NaClO+H2O
0
-1
+1
歧化反应
氧化剂、还原剂
2Cl2 + 2Ca(OH)2 ===CaCl2+Ca(ClO)2 + 2H2O
氧化剂、还原剂
0
-1
+1
漂白液/84消毒液
漂白粉
工业上和实验室中常用NaOH溶液吸收氯气尾气
Cl2+2OH- === Cl-+ClO-+H2O
离子方程:
起效与失效原理
成分:NaClO、NaCl
有效成分:NaClO
漂白液/84消毒液
漂白粉/漂粉精
成分:Ca(ClO)2、CaCl2
有效成分: Ca(ClO)2
NaClO+CO2+H2O = NaHCO3+HClO
起效原理
Ca(ClO)2+CO2+H2O= CaCO3↓ +2HClO
失效原理 = 起效原理+HClO分解
2HClO 2HCl+O2 ↑
光照
起效原理
起效与失效原理
漂白粉能用来消毒吗?84消毒液能用来漂白吗?
思考1
可以。二者均可用于漂白和消毒,
都可以与空气中的H2O和CO2反应生成HClO
漂白粉和漂白液的保存有哪些注意事项?
思考2
密封、避光、阴凉处保存
使用时,如何更好的提高漂白液/粉的漂白效率?
思考3
加入酸,或增大漂白液/粉与空气的接触
起效与失效原理
保存不当的漂白粉变质后的成分是什么?如何检验?
思考4
漂白粉变质:
完全变质:CaCl2、CaCO3
部分变质: CaCl2、 Ca(ClO)2 、 CaCO3
检验方法:加入HCl如果有气泡生成则证明发生了变质(生成CaCO3)
使用注意事项
主要成分HCl
主要成分NaClO
84消毒液严禁和盐酸混合使用
2HCl + NaClO == NaCl + Cl2↑+H2O
混合使用生成毒气:Cl2
0
-1
+1
归中反应
2H+ + Cl- + ClO- == Cl2↑+H2O
Cl-的检验
Cl-检验
试液2~3 mL 实验现象 离子方程式
滴入几滴硝酸银溶液 加入少量稀硝酸
①稀HCl ______________ __________ __________________
②NaCl溶液 ______________ __________ __________________
③Na2CO3溶液 ______________ __________ __________ ___________________________
_________________________
生成白色沉淀
沉淀不溶解
沉淀不溶解
沉淀溶解,
有气泡产生
Cl-+Ag+===AgCl↓
Cl-+Ag+===AgCl↓
Ag2CO3+2H+==2Ag++CO2↑+H2O
CO32-+2Ag+===Ag2CO3↓
Cl-检验
生成白色沉淀
生成白色沉淀
检验氯离子的方法:
取少量待测液于试管中,滴加HNO3,然后滴入AgNO3溶液,
(也可答:取少量待测液于试管中,滴加HNO3酸化的AgNO3溶液)
若产生白色沉淀,则待测液中含有Cl-,若无白色沉淀则无Cl-。
Cl-检验
HNO3的作用:
排除CO32- 等离子的干扰
笔记
笔记
