3.1.3 铁盐和亚铁盐 (性质应用) 课件(共13张PPT)高中化学 人教版(2019)必修 第一册
文档属性
| 名称 | 3.1.3 铁盐和亚铁盐 (性质应用) 课件(共13张PPT)高中化学 人教版(2019)必修 第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 40.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 16:36:43 | ||
图片预览



文档简介
(共13张PPT)
第4课时
铁盐、亚铁盐性质应用
第三章 第1节 铁及其化合物
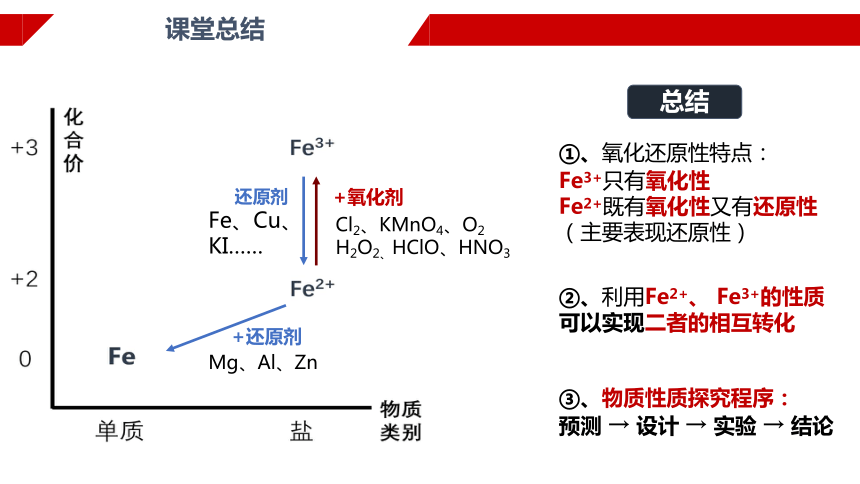
+还原剂
Mg、Al、Zn
Fe、Cu、KI……
还原剂
Cl2、KMnO4、O2
H2O2、HClO、HNO3
+氧化剂
总结
①、氧化还原性特点:
Fe3+只有氧化性
Fe2+既有氧化性又有还原性
(主要表现还原性)
②、利用Fe2+、 Fe3+的性质可以实现二者的相互转化
③、物质性质探究程序:
预测 → 设计 → 实验 → 结论
课堂总结
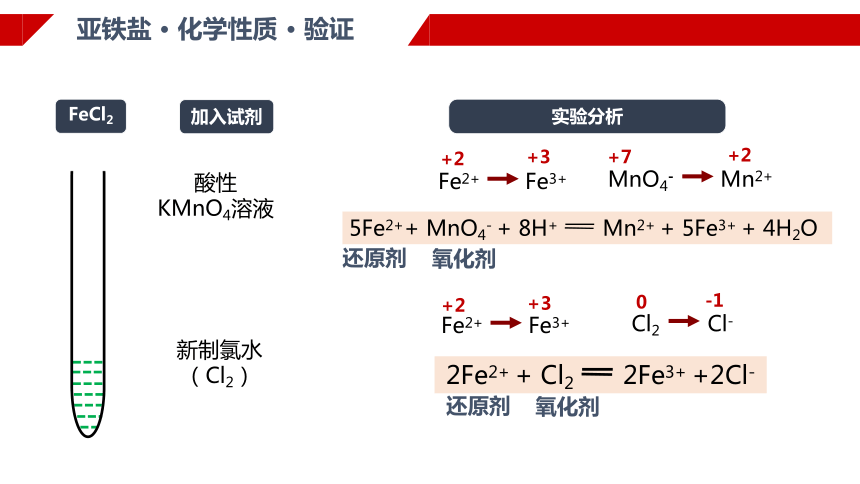
加入试剂
实验分析
新制氯水
(Cl2)
酸性
KMnO4溶液
亚铁盐 · 化学性质 · 验证
Fe2+
Fe3+
Cl2
Cl-
2Fe2+ + Cl2 2Fe3+ +2Cl-
Fe2+
Fe3+
MnO4-
Mn2+
5Fe2++ MnO4- + 8H+ Mn2+ + 5Fe3+ + 4H2O
FeCl2
+7
+2
+2
+3
+2
+3
0
-1
氧化剂
还原剂
氧化剂
还原剂
铁盐 · 化学性质 · 探究
氧化性
FeCl3
+Fe
+KI
(淀粉)
+Cu
Fe3+
Fe2+
Fe
Fe2+
Fe3+
Fe2+
Cu
Cu2+
Fe3+
Fe2+
I-
I2
2Fe3+ + Fe 3Fe2+
2Fe3+ +Cu 2Fe2+ + Cu2+
2Fe3+ + 2I- 2Fe2+ + I2
亚铁盐溶液保存秘籍
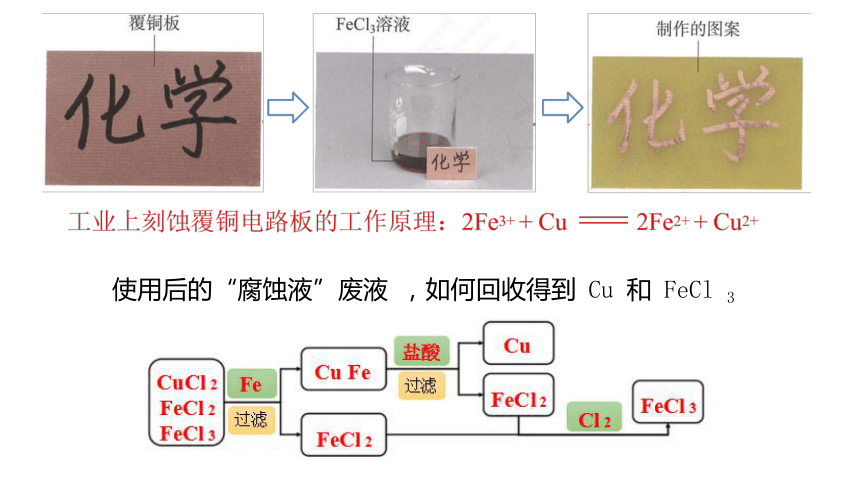
印刷电路板原理
归中反应
铁盐 · 化学性质 · 探究
使用后的“腐蚀液”废液 ,如何回收得到 Cu 和 FeCl 3
举一反三
三、分析题
1、向FeCl3溶液中加入Fe粉
①、若Fe不足,产物溶液中的金属离子有哪些?
②、若Fe过量,产物溶液中的金属离子有哪些?
2Fe3+ + Fe 3Fe2+
答:Fe2+、Fe3+
答:Fe2+
举一反三
三、分析题
2、向FeCl3溶液中加入Zn粉
①、若Zn不足,产物溶液中的金属离子有哪些?
②、若Zn足量,产物溶液中的金属离子有哪些?
2Fe3+ + Zn 2Fe2+ + Zn2+
Fe2+ + Zn Fe + Zn2+
少量Zn:
足量Zn:
答:Fe2+、Zn2+、(Fe3+)
答:Zn2+
加氯水
加铁粉
加铁粉
举一反三
一、判断题
1、向某溶液中滴入KSCN溶液变为红色,可判断该溶液中只含有Fe3+ ( )
2、向某溶液中先加入氯水,后滴入KSCN溶液变为红色,可判断该溶液中含有Fe2+
( )
二、思考题
1、实验室有一瓶久置的FeSO4溶液,如何判断该溶液是否变质?
答:取少量溶液于管中,滴入KSCN,观察有无红色生成
铁盐与亚铁盐·检验
任务5
已知下列溶液可能含有Fe2+或Fe3+,也可能为Fe2+、Fe3+的混合溶液,
如何检验其中含有的金属离子
KSCN
溶液不变红
溶液变红
有Fe3+
无Fe3+
氯水
溶液变红
有Fe2+
溶液不变红
无Fe2+
酸性KMnO4
KMnO4褪色
有Fe2+
KMnO4不褪色
无Fe2+
举一反三
四、探究题
探究某含铁盐溶液价态的过程中:
取少量待测溶液加入试管,滴入KSCN溶液不变色,加入少量氯水后溶液变为红色,继续加入氯水至过量,发现溶液中的红色消失了,这是为什么呢?
2Fe2+ + Cl2 2Fe3+ +2Cl-
Fe3+ + 3SCN- Fe(SCN)3
Cl2 + 2SCN- (SCN)2 + 2Cl-
答:过量的氯水氧化性较强,将SCN-氧化,
破坏了生成的红色物质,因此红色消失
【思考与交流】
1.如何检验补铁剂中的铁元素的存在形式?描述实验操作和现象。
2.补铁剂中的Fe2+在空气中很容易被氧化成Fe3+,影响铁元素在人体中的吸收利用。如何检验补铁剂是否部分变质?
3.为什么补铁剂与维生素C一起服用效果更好?验证补铁剂和维生素C一起服用的科学性。
第4课时
铁盐、亚铁盐性质应用
第三章 第1节 铁及其化合物
+还原剂
Mg、Al、Zn
Fe、Cu、KI……
还原剂
Cl2、KMnO4、O2
H2O2、HClO、HNO3
+氧化剂
总结
①、氧化还原性特点:
Fe3+只有氧化性
Fe2+既有氧化性又有还原性
(主要表现还原性)
②、利用Fe2+、 Fe3+的性质可以实现二者的相互转化
③、物质性质探究程序:
预测 → 设计 → 实验 → 结论
课堂总结
加入试剂
实验分析
新制氯水
(Cl2)
酸性
KMnO4溶液
亚铁盐 · 化学性质 · 验证
Fe2+
Fe3+
Cl2
Cl-
2Fe2+ + Cl2 2Fe3+ +2Cl-
Fe2+
Fe3+
MnO4-
Mn2+
5Fe2++ MnO4- + 8H+ Mn2+ + 5Fe3+ + 4H2O
FeCl2
+7
+2
+2
+3
+2
+3
0
-1
氧化剂
还原剂
氧化剂
还原剂
铁盐 · 化学性质 · 探究
氧化性
FeCl3
+Fe
+KI
(淀粉)
+Cu
Fe3+
Fe2+
Fe
Fe2+
Fe3+
Fe2+
Cu
Cu2+
Fe3+
Fe2+
I-
I2
2Fe3+ + Fe 3Fe2+
2Fe3+ +Cu 2Fe2+ + Cu2+
2Fe3+ + 2I- 2Fe2+ + I2
亚铁盐溶液保存秘籍
印刷电路板原理
归中反应
铁盐 · 化学性质 · 探究
使用后的“腐蚀液”废液 ,如何回收得到 Cu 和 FeCl 3
举一反三
三、分析题
1、向FeCl3溶液中加入Fe粉
①、若Fe不足,产物溶液中的金属离子有哪些?
②、若Fe过量,产物溶液中的金属离子有哪些?
2Fe3+ + Fe 3Fe2+
答:Fe2+、Fe3+
答:Fe2+
举一反三
三、分析题
2、向FeCl3溶液中加入Zn粉
①、若Zn不足,产物溶液中的金属离子有哪些?
②、若Zn足量,产物溶液中的金属离子有哪些?
2Fe3+ + Zn 2Fe2+ + Zn2+
Fe2+ + Zn Fe + Zn2+
少量Zn:
足量Zn:
答:Fe2+、Zn2+、(Fe3+)
答:Zn2+
加氯水
加铁粉
加铁粉
举一反三
一、判断题
1、向某溶液中滴入KSCN溶液变为红色,可判断该溶液中只含有Fe3+ ( )
2、向某溶液中先加入氯水,后滴入KSCN溶液变为红色,可判断该溶液中含有Fe2+
( )
二、思考题
1、实验室有一瓶久置的FeSO4溶液,如何判断该溶液是否变质?
答:取少量溶液于管中,滴入KSCN,观察有无红色生成
铁盐与亚铁盐·检验
任务5
已知下列溶液可能含有Fe2+或Fe3+,也可能为Fe2+、Fe3+的混合溶液,
如何检验其中含有的金属离子
KSCN
溶液不变红
溶液变红
有Fe3+
无Fe3+
氯水
溶液变红
有Fe2+
溶液不变红
无Fe2+
酸性KMnO4
KMnO4褪色
有Fe2+
KMnO4不褪色
无Fe2+
举一反三
四、探究题
探究某含铁盐溶液价态的过程中:
取少量待测溶液加入试管,滴入KSCN溶液不变色,加入少量氯水后溶液变为红色,继续加入氯水至过量,发现溶液中的红色消失了,这是为什么呢?
2Fe2+ + Cl2 2Fe3+ +2Cl-
Fe3+ + 3SCN- Fe(SCN)3
Cl2 + 2SCN- (SCN)2 + 2Cl-
答:过量的氯水氧化性较强,将SCN-氧化,
破坏了生成的红色物质,因此红色消失
【思考与交流】
1.如何检验补铁剂中的铁元素的存在形式?描述实验操作和现象。
2.补铁剂中的Fe2+在空气中很容易被氧化成Fe3+,影响铁元素在人体中的吸收利用。如何检验补铁剂是否部分变质?
3.为什么补铁剂与维生素C一起服用效果更好?验证补铁剂和维生素C一起服用的科学性。
