4.1.2 元素周期表 课件(共17张PPT)高中化学 人教版(2019)必修 第一册
文档属性
| 名称 | 4.1.2 元素周期表 课件(共17张PPT)高中化学 人教版(2019)必修 第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 20.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 16:40:43 | ||
图片预览





文档简介
(共17张PPT)
第2课时
元素周期表
第四章 第2节 原子结构与元素周期表
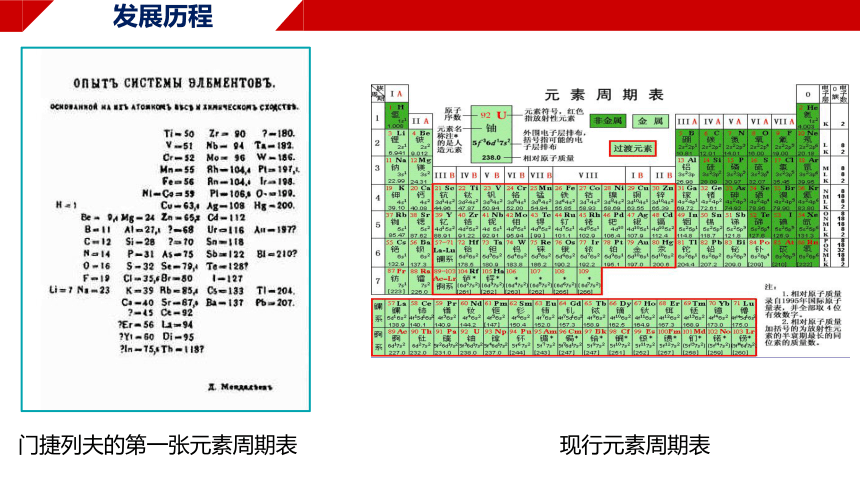
发展历程
诞生
依据
意义
1869年,俄国化学家门捷列夫编制出第一张元素周期表
按相对原子质量由小到大排列,将化学性质相似的元素放在同一纵列
揭示了元素间的内在联系,成为化学发展史上的重要里程碑之一
发展
元素周期表中为未知元素留下的空位先后被填满
现行
编排依据:相对原子质量 → 核电荷数,形成现行的元素周期表
1.元素周期表的发展历程
发展历程
门捷列夫的第一张元素周期表
现行元素周期表
编排原则
2.元素周期表的编排原则
(1)原子序数:按照元素__________________ 给元素编的序号。
(2)原子序数=__________=_______=____________。
(3)横行原则:把___________ 相同的元素,按_______________的顺序从左到右排列。
(4)纵列原则:把不同横行中___________ 相同的元素,按______________的顺序由上而下排列。
在周期表中的顺序
核电荷数
质子数
核外电子数
电子层数目
原子序数递增
最外层电子数
电子层数递增
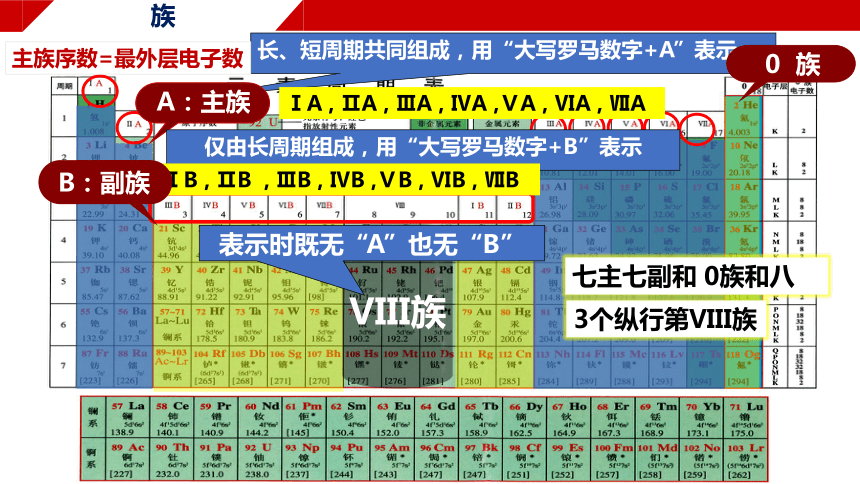
周期
族
基本结构
3.元素周期表的结构
元素周期表有 个横行, 个纵列
每一个横行叫做一个 ,每一个纵列叫做一个 (8、9、10三个纵列为一族)
7
18
周期
族
短周期
长周期
长、短周期共同组成,用“大写罗马数字+A”表示
VIII族
表示时既无“A”也无“B”
0 族
七主七副和 0族和八
3个纵行第VIII族
A:主族
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
主族序数=最外层电子数
族
仅由长周期组成,用“大写罗马数字+B”表示
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
B:副族
族
ⅠA
第Ⅷ族
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
ⅠB
ⅡB
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
0族
卤族元素
(全为非金属)
过渡元素
(全部为金属)
碱土金属元素
(全部为金属)
稀有气体
碱金属元素
所含元素最多的族
1 H氢
1s1
1.008
原子序数
元素名称
价层电子排布
相对原子质量
元素信息
元素符号
小结
练习:指出Si在周期表中的位置,画出硅的原子结构示意图
ⅣA族
三
Si在周期表中的位置为:
第三周期 第ⅣA族
课堂练习
不一定,可能是第ⅡA族,也可能是0族或副族元素。
ⅢB共32种元素。
第六周期ⅢB为镧系,共15种元素;
第七周期ⅢB为锕系,共15种元素,比四、五周期多出14种元素。
最外层电子数是2的元素一定为第ⅡA族的元素吗?
问题1
在现行周期表中第四、五、六、七周期均有18列,为什么第四、五周期各有18种元素,而第六、七周期各有32种元素?
问题2
含有元素种类最多的族是哪一族?
问题3
第二、三周期差1,
第四、五周期差11【原因是中间隔10格过渡元素】
第六、七周期差25【原因是中间隔10格过渡元素,且ⅢB一格为15种元素】。
同周期的第ⅡA、ⅢA元素间原子序数差值可能为多少?并说明原因。
问题4
举一反三
[易错警示] 元素周期表认知中的几个误区
误区1:最外层只有1个电子的元素一定是ⅠA元素。
分析:最外层只有1个电子的元素可能是ⅠB元素如Cu、Ag、Au;也可能是ⅥB族的Cr、Mo 。
误区2:最外层只有2个电子的元素一定ⅡA族元素。
分析:最外层只有2个电子的元素可能是氦,也可能是ⅡB族元素,如:Zn、Cd等,以及Sc(ⅢB)、Ti(ⅣB)等过渡元素。
误区3:第8、9、10列是ⅧB族。
分析:规定第8、9、10列为Ⅷ族,而不是ⅧB族。
误区提示
难点突破
判断元素在周期表中所处位置
方法一:原子结构定位法
原理:电子层数=周期序数;最外层电子数=主族序数(仅限主族元素)
方法练习
【例1】科学家用钙离子撞击放射性元素锫(Bk),产生了质子数为117的超重元素Ts。Ts的原子结构示意图如下,试判断它在元素周期表中的位置。
第七周期,第VIIA族
注意书写格式!
难点突破
判断元素在周期表中所处位置
方法二:0族定位法
第一步:比大小,定周期
找到最接近的0族元素,比它小在同周期,比它大在下周期。
如32号元素,32<36,其应在第四周期。
第二步:求差值,定族数
①、找到最接近的0族元素算差值
②、小从7A倒数、大从1A正数(短周期1A-7A;长周期12主、34副)
例题:求21号元素位置
推算原子序数为34、56、88、82的元素在周期表中的位置。
34号:
53号:
88号:
82号:
第四周期第ⅥA族
第五周期第ⅦA 族
第七周期第ⅡA 族
第六周期第ⅣA 族
方法练习
第2课时
元素周期表
第四章 第2节 原子结构与元素周期表
发展历程
诞生
依据
意义
1869年,俄国化学家门捷列夫编制出第一张元素周期表
按相对原子质量由小到大排列,将化学性质相似的元素放在同一纵列
揭示了元素间的内在联系,成为化学发展史上的重要里程碑之一
发展
元素周期表中为未知元素留下的空位先后被填满
现行
编排依据:相对原子质量 → 核电荷数,形成现行的元素周期表
1.元素周期表的发展历程
发展历程
门捷列夫的第一张元素周期表
现行元素周期表
编排原则
2.元素周期表的编排原则
(1)原子序数:按照元素__________________ 给元素编的序号。
(2)原子序数=__________=_______=____________。
(3)横行原则:把___________ 相同的元素,按_______________的顺序从左到右排列。
(4)纵列原则:把不同横行中___________ 相同的元素,按______________的顺序由上而下排列。
在周期表中的顺序
核电荷数
质子数
核外电子数
电子层数目
原子序数递增
最外层电子数
电子层数递增
周期
族
基本结构
3.元素周期表的结构
元素周期表有 个横行, 个纵列
每一个横行叫做一个 ,每一个纵列叫做一个 (8、9、10三个纵列为一族)
7
18
周期
族
短周期
长周期
长、短周期共同组成,用“大写罗马数字+A”表示
VIII族
表示时既无“A”也无“B”
0 族
七主七副和 0族和八
3个纵行第VIII族
A:主族
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
主族序数=最外层电子数
族
仅由长周期组成,用“大写罗马数字+B”表示
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
B:副族
族
ⅠA
第Ⅷ族
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
ⅠB
ⅡB
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
0族
卤族元素
(全为非金属)
过渡元素
(全部为金属)
碱土金属元素
(全部为金属)
稀有气体
碱金属元素
所含元素最多的族
1 H氢
1s1
1.008
原子序数
元素名称
价层电子排布
相对原子质量
元素信息
元素符号
小结
练习:指出Si在周期表中的位置,画出硅的原子结构示意图
ⅣA族
三
Si在周期表中的位置为:
第三周期 第ⅣA族
课堂练习
不一定,可能是第ⅡA族,也可能是0族或副族元素。
ⅢB共32种元素。
第六周期ⅢB为镧系,共15种元素;
第七周期ⅢB为锕系,共15种元素,比四、五周期多出14种元素。
最外层电子数是2的元素一定为第ⅡA族的元素吗?
问题1
在现行周期表中第四、五、六、七周期均有18列,为什么第四、五周期各有18种元素,而第六、七周期各有32种元素?
问题2
含有元素种类最多的族是哪一族?
问题3
第二、三周期差1,
第四、五周期差11【原因是中间隔10格过渡元素】
第六、七周期差25【原因是中间隔10格过渡元素,且ⅢB一格为15种元素】。
同周期的第ⅡA、ⅢA元素间原子序数差值可能为多少?并说明原因。
问题4
举一反三
[易错警示] 元素周期表认知中的几个误区
误区1:最外层只有1个电子的元素一定是ⅠA元素。
分析:最外层只有1个电子的元素可能是ⅠB元素如Cu、Ag、Au;也可能是ⅥB族的Cr、Mo 。
误区2:最外层只有2个电子的元素一定ⅡA族元素。
分析:最外层只有2个电子的元素可能是氦,也可能是ⅡB族元素,如:Zn、Cd等,以及Sc(ⅢB)、Ti(ⅣB)等过渡元素。
误区3:第8、9、10列是ⅧB族。
分析:规定第8、9、10列为Ⅷ族,而不是ⅧB族。
误区提示
难点突破
判断元素在周期表中所处位置
方法一:原子结构定位法
原理:电子层数=周期序数;最外层电子数=主族序数(仅限主族元素)
方法练习
【例1】科学家用钙离子撞击放射性元素锫(Bk),产生了质子数为117的超重元素Ts。Ts的原子结构示意图如下,试判断它在元素周期表中的位置。
第七周期,第VIIA族
注意书写格式!
难点突破
判断元素在周期表中所处位置
方法二:0族定位法
第一步:比大小,定周期
找到最接近的0族元素,比它小在同周期,比它大在下周期。
如32号元素,32<36,其应在第四周期。
第二步:求差值,定族数
①、找到最接近的0族元素算差值
②、小从7A倒数、大从1A正数(短周期1A-7A;长周期12主、34副)
例题:求21号元素位置
推算原子序数为34、56、88、82的元素在周期表中的位置。
34号:
53号:
88号:
82号:
第四周期第ⅥA族
第五周期第ⅦA 族
第七周期第ⅡA 族
第六周期第ⅣA 族
方法练习
