4.1.4 原子结构与元素性质(卤族) 课件(共11张PPT)高中化学 人教版(2019)必修 第一册
文档属性
| 名称 | 4.1.4 原子结构与元素性质(卤族) 课件(共11张PPT)高中化学 人教版(2019)必修 第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 16:28:24 | ||
图片预览



文档简介
(共11张PPT)
第4课时
原子结构与元素性质
(卤族元素)
第四章 第1节 元素周期律
卤族元素
F
Cl
Br
I
结构
性质
最外层电子数=7
元素:非金属性
单质:氧化性
相似性
递变性
电子层数增多
原子半径增大
得电子更难
易得e-
元素:非金属性减弱
单质:氧化性减弱
卤族元素
F
Cl
Br
I
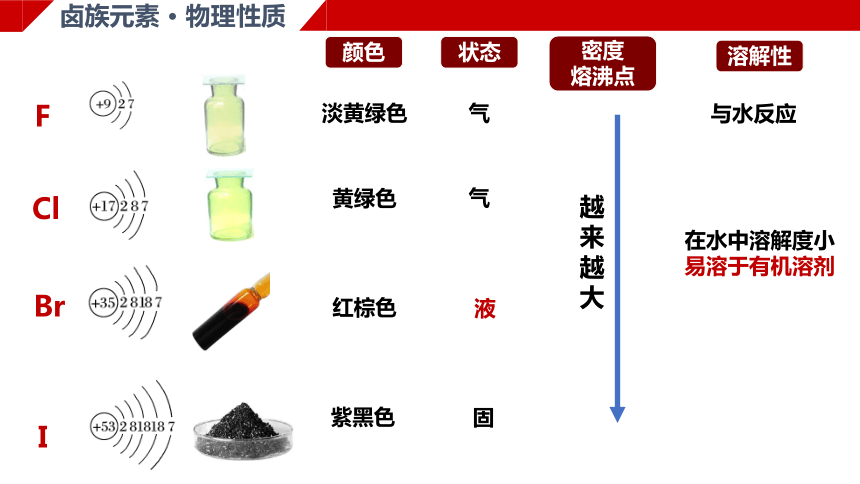
淡黄绿色
黄绿色
红棕色
紫黑色
颜色
状态
气
气
液
固
密度
熔沸点
越来越大
溶解性
与水反应
在水中溶解度小
易溶于有机溶剂
卤族元素 · 物理性质
卤素的特殊性
②、碘为紫黑色固体,易升华,淀粉遇I2变蓝
固体-紫黑色;溶于水-棕黄色;溶于有机溶剂-紫色
①、常温下,Br2是唯一的液态非金属单质,易挥发
③、氟是最活泼的非金属,没有正化合价,
氟单质与盐溶液反应时,先与水反应产生HF和O2
卤族元素 · 物理性质
卤族元素 · 化学性质
卤素单质 反应条件 化学方程式 产物稳定性
F2
Cl2
Br2
I2
①、与H2反应
H2+F2 == 2HF
卤素化学性质的特点:与Cl2相似
暗处
光照/点燃
加热
不断加热
条件变难
HF : 很稳定
HCl : 较稳定
HCl :不如HCl稳定
HI : 不稳定,
一边生成,一边分解
氢化物稳定性减弱
从F2到I2,与H2化合越来越难,生成的氢化物稳定性越来越弱,
元素的非金属性逐渐减弱
卤族元素 · 化学性质
卤素单质 化学方程式
F2
Cl2
Br2
I2
②、与H2O反应
Cl2+H2O == HCl + HClO
Br2+H2O == HBr + HBrO
l2+H2O == Hl + HlO
2F2+2H2O == 4HF + O2↑
F2氧化性过强,可以与水反应置换出O2
卤族元素 · 化学性质
③、卤素单质之间的置换
置换规律:强置换弱(上置换下)
实验操作 实验现象 离子方程式 结论
振荡静置后,溶液由无色变为_____色 单质的氧化性:______________
离子的还原性:
———————
振荡静置后,溶液由无色变为 ___ 色
振荡静置后,溶液由无色变为 ___ 色
橙黄
棕黄
Cl2>Br2>I2
棕黄
Cl-
卤族元素 · 化学性质
卤素单质 化学方程式
F2
Cl2
Br2
I2
④、最高价氧化物的水化物
无正价,无最高价氧化物水化物
HClO4 —— 最强无机酸
HBrO4 —— 强酸
HIO4 —— 中强酸
越来越弱
卤族元素 · 化学性质
非金属性减弱
氧化性减弱
非金属性越强:
①、与H2反应越容易
②、氢化物稳定性越强
③、单质氧化性越强(强可置换弱)
④、离子的还原性越弱
⑤、最高价氧化物水化物的酸性越强
思考:如何证明Cl的非金属性大于Br
【例1】根据Cl2+2Br-===Br2+2Cl-,Br2+2I-===I2+2Br-
可知:单质氧化性:___________,阴离子还原性:____________。
Cl2>Br2>I2
Cl-2F2+2H2O===4HF+O2
(2)氧化性F2>Cl2,那么能否用F2与NaCl溶液反应置换Cl2。
否,F2与H2O先反应,无法置换出Cl2。
【例2】(1)F2通入水中会剧烈反应,且有另一种单质气体生成,请根据氧化还原反应理论书写化学方程式。
卤族元素 · 化学性质
第4课时
原子结构与元素性质
(卤族元素)
第四章 第1节 元素周期律
卤族元素
F
Cl
Br
I
结构
性质
最外层电子数=7
元素:非金属性
单质:氧化性
相似性
递变性
电子层数增多
原子半径增大
得电子更难
易得e-
元素:非金属性减弱
单质:氧化性减弱
卤族元素
F
Cl
Br
I
淡黄绿色
黄绿色
红棕色
紫黑色
颜色
状态
气
气
液
固
密度
熔沸点
越来越大
溶解性
与水反应
在水中溶解度小
易溶于有机溶剂
卤族元素 · 物理性质
卤素的特殊性
②、碘为紫黑色固体,易升华,淀粉遇I2变蓝
固体-紫黑色;溶于水-棕黄色;溶于有机溶剂-紫色
①、常温下,Br2是唯一的液态非金属单质,易挥发
③、氟是最活泼的非金属,没有正化合价,
氟单质与盐溶液反应时,先与水反应产生HF和O2
卤族元素 · 物理性质
卤族元素 · 化学性质
卤素单质 反应条件 化学方程式 产物稳定性
F2
Cl2
Br2
I2
①、与H2反应
H2+F2 == 2HF
卤素化学性质的特点:与Cl2相似
暗处
光照/点燃
加热
不断加热
条件变难
HF : 很稳定
HCl : 较稳定
HCl :不如HCl稳定
HI : 不稳定,
一边生成,一边分解
氢化物稳定性减弱
从F2到I2,与H2化合越来越难,生成的氢化物稳定性越来越弱,
元素的非金属性逐渐减弱
卤族元素 · 化学性质
卤素单质 化学方程式
F2
Cl2
Br2
I2
②、与H2O反应
Cl2+H2O == HCl + HClO
Br2+H2O == HBr + HBrO
l2+H2O == Hl + HlO
2F2+2H2O == 4HF + O2↑
F2氧化性过强,可以与水反应置换出O2
卤族元素 · 化学性质
③、卤素单质之间的置换
置换规律:强置换弱(上置换下)
实验操作 实验现象 离子方程式 结论
振荡静置后,溶液由无色变为_____色 单质的氧化性:______________
离子的还原性:
———————
振荡静置后,溶液由无色变为 ___ 色
振荡静置后,溶液由无色变为 ___ 色
橙黄
棕黄
Cl2>Br2>I2
棕黄
Cl-
卤族元素 · 化学性质
卤素单质 化学方程式
F2
Cl2
Br2
I2
④、最高价氧化物的水化物
无正价,无最高价氧化物水化物
HClO4 —— 最强无机酸
HBrO4 —— 强酸
HIO4 —— 中强酸
越来越弱
卤族元素 · 化学性质
非金属性减弱
氧化性减弱
非金属性越强:
①、与H2反应越容易
②、氢化物稳定性越强
③、单质氧化性越强(强可置换弱)
④、离子的还原性越弱
⑤、最高价氧化物水化物的酸性越强
思考:如何证明Cl的非金属性大于Br
【例1】根据Cl2+2Br-===Br2+2Cl-,Br2+2I-===I2+2Br-
可知:单质氧化性:___________,阴离子还原性:____________。
Cl2>Br2>I2
Cl-
(2)氧化性F2>Cl2,那么能否用F2与NaCl溶液反应置换Cl2。
否,F2与H2O先反应,无法置换出Cl2。
【例2】(1)F2通入水中会剧烈反应,且有另一种单质气体生成,请根据氧化还原反应理论书写化学方程式。
卤族元素 · 化学性质
