6.2.2 化学反应限度 课件 (共13张PPT) 高中化学 人教版(2019)必修第二册
文档属性
| 名称 | 6.2.2 化学反应限度 课件 (共13张PPT) 高中化学 人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 608.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 17:35:36 | ||
图片预览



文档简介
(共13张PPT)
第2课时
化学反应的限度
第六章 第2节 化学反应的速率与限度
环节一 · 感受反应限度
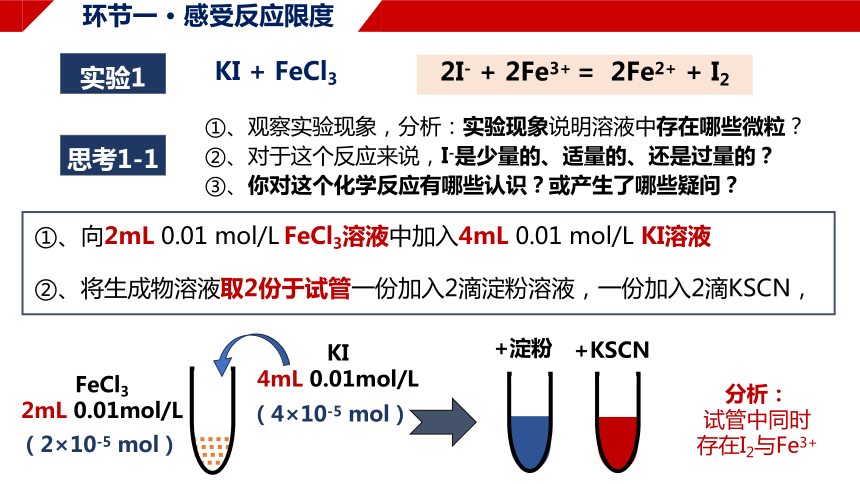
实验1
①、向2mL 0.01 mol/L FeCl3溶液中加入4mL 0.01 mol/L KI溶液
②、将生成物溶液取2份于试管一份加入2滴淀粉溶液,一份加入2滴KSCN,
2I- + 2Fe3+ = 2Fe2+ + I2
KI + FeCl3
FeCl3
2mL 0.01mol/L
KI
4mL 0.01mol/L
分析:
试管中同时
存在I2与Fe3+
思考1-1
①、观察实验现象,分析:实验现象说明溶液中存在哪些微粒?
②、对于这个反应来说,I-是少量的、适量的、还是过量的?
③、你对这个化学反应有哪些认识?或产生了哪些疑问?
(2×10-5 mol)
(4×10-5 mol)
+KSCN
+淀粉
环节一 · 感受反应限度
什么是化学反应的限度?
并非所有的反应都能进行到底,
一个反应在该条件下,能达到的最大程度,就是反应的限度
限度决定了该条件下反应物的最大转化率
(转化量/起始量)
环节二 · 探究 · 反应产生限度的原因
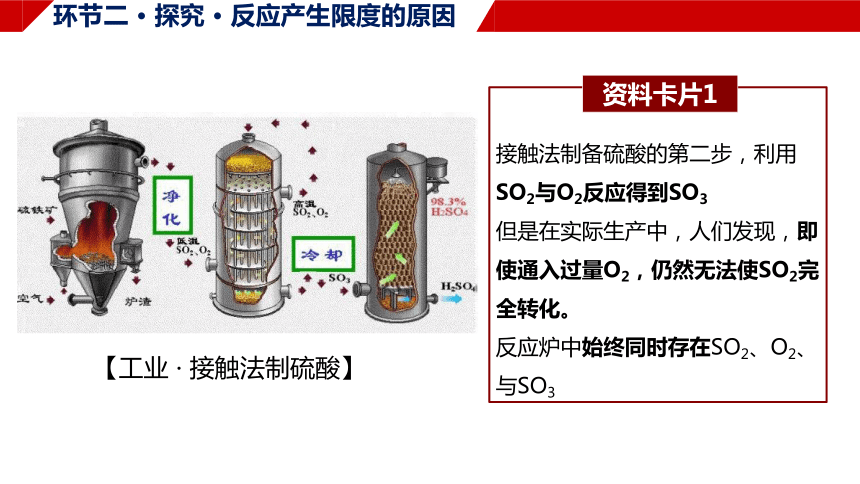
【工业 · 接触法制硫酸】
接触法制备硫酸的第二步,利用SO2与O2反应得到SO3
但是在实际生产中,人们发现,即使通入过量O2,仍然无法使SO2完全转化。
反应炉中始终同时存在SO2、O2、与SO3
资料卡片1
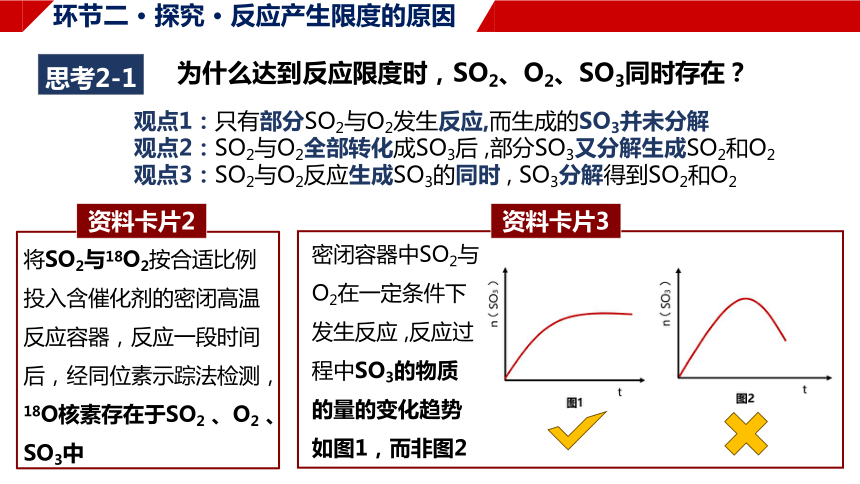
思考2-1
为什么达到反应限度时,SO2、O2、SO3同时存在?
观点1:只有部分SO2与O2发生反应,而生成的SO3并未分解
观点2:SO2与O2全部转化成SO3后 ,部分SO3又分解生成SO2和O2
观点3:SO2与O2反应生成SO3的同时 , SO3分解得到SO2和O2
将SO2与18O2按合适比例投入含催化剂的密闭高温反应容器,反应一段时间后,经同位素示踪法检测,18O核素存在于SO2 、O2 、SO3中
资料卡片2
密闭容器中SO2与O2在一定条件下发生反应 ,反应过程中SO3的物质的量的变化趋势如图1,而非图2
资料卡片3
环节二 · 探究 · 反应产生限度的原因
S
16O
18O
SO2 + 18O2 → SO3
SO3 → SO2+ O2
环节二 · 探究 · 反应产生限度的原因
2SO2 + O2 2SO3
高温
催化剂
可逆反应
同一条件下,同时向正、逆两个方向进行的化学反应
可逆反应中,正反应与逆反应同时进行,均不会进行到底,因此可逆反应存在限度
反应物
生成物
环节二 · 探究 · 反应产生限度的原因
SO2与O2反应生成SO3的同时 ,
SO3分解得到SO2和O2
(可逆反应)
思考3-1
①、该可逆反应何时达到限度
②、达到限度时,各物质浓度有什么特征?
时间(t/min) 0 10 20 30 40 50 60 70
c (SO2) mol/L 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
c (O2) mol/L 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
c (SO3) mol/L 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
SO2 与O2反应 时间-浓度表
资料卡片4
环节三 · 探究 · 化学平衡状态
思考3-2
时间(t/min) 0 10 20 30 40 50 60 70
c (SO2) mol/L 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
c (O2) mol/L 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
c (SO3) mol/L 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
SO2 与O2反应 时间-浓度表
环节三 · 探究 · 化学平衡状态
资料卡片4
化学反应速率与反应物浓度呈正相关
即:一定范围内,浓度越大,反应速率越快
①、正反应速率何时最大?
反应后,正反应速率如何变化
②、逆反应速率何时最小?
反应后,逆反应速率如何变化
反应速率
时间
正反应
逆反应
化学平衡
化学平衡
可逆反应达到限度时,正、逆反应速率相等,各物质浓度不变,
这种状态称之为“化学平衡状态”
环节三 · 探究 · 化学平衡状态
思考3-3
为什么可逆反应到达平衡状态后,各物质的浓度不再变化?
ν(正反应)= ν(逆反应)
反应中各物质的浓度不变
原因
化学平衡状态
判断依据
化学平衡是一种“动态平衡”,并非反应停止
思考3-4
2NO2 N2O4
(红棕色)
(无色)
如何判断该反应达到化学平衡?
实验2
将装有NO2和N2O4混合气体的密封玻璃球分别放入冷水、热水中,观察实验现象,分析NO2、N2O4的浓度
冷水 热水
体系颜色变化
NO2浓度变化
N2O4浓度变化
思考3-5
化学平衡状态可以改变吗?
环节三 · 探究 · 化学平衡状态
总结
①、什么是化学反应限度?
环节三 · 总结 · 化学平衡状态
②、为什么化学反应会有限度?
③、可逆反应达到限度有什么特征?
④、化学平衡状态是否可以改变?
一定条件下,
化学反应能达到的最大程度
可逆反应,在同一条件下,同时双向进行
ν(正反应)= ν(逆反应)
反应中各物质的浓度不变
反应条件改变时,
化学平衡随之改变
化学
平衡
环节四 · 认识 · 化学反应条件的控制
“向空气要面包”的工业——合成氨
19世纪初人口剧增,粮食产量不足成为要命的问题。氮肥对粮食增产至关重要,
自此,“合成氨”引发广泛关注,随着130年的漫长探索,“合成氨”投入工业生产。
目前,合成氨工业常用的催化剂为四氧化三铁,反应温度控制在485℃~515 ℃
资料卡片5
思考4-1
①、合成氨反应中,温度越低,氨气的产率越高,为什么工业生产时选择用500℃左右的高温,而不用更低的反应温度?
②、工业生产时,确定反应条件需要综合考虑哪些因素?
第2课时
化学反应的限度
第六章 第2节 化学反应的速率与限度
环节一 · 感受反应限度
实验1
①、向2mL 0.01 mol/L FeCl3溶液中加入4mL 0.01 mol/L KI溶液
②、将生成物溶液取2份于试管一份加入2滴淀粉溶液,一份加入2滴KSCN,
2I- + 2Fe3+ = 2Fe2+ + I2
KI + FeCl3
FeCl3
2mL 0.01mol/L
KI
4mL 0.01mol/L
分析:
试管中同时
存在I2与Fe3+
思考1-1
①、观察实验现象,分析:实验现象说明溶液中存在哪些微粒?
②、对于这个反应来说,I-是少量的、适量的、还是过量的?
③、你对这个化学反应有哪些认识?或产生了哪些疑问?
(2×10-5 mol)
(4×10-5 mol)
+KSCN
+淀粉
环节一 · 感受反应限度
什么是化学反应的限度?
并非所有的反应都能进行到底,
一个反应在该条件下,能达到的最大程度,就是反应的限度
限度决定了该条件下反应物的最大转化率
(转化量/起始量)
环节二 · 探究 · 反应产生限度的原因
【工业 · 接触法制硫酸】
接触法制备硫酸的第二步,利用SO2与O2反应得到SO3
但是在实际生产中,人们发现,即使通入过量O2,仍然无法使SO2完全转化。
反应炉中始终同时存在SO2、O2、与SO3
资料卡片1
思考2-1
为什么达到反应限度时,SO2、O2、SO3同时存在?
观点1:只有部分SO2与O2发生反应,而生成的SO3并未分解
观点2:SO2与O2全部转化成SO3后 ,部分SO3又分解生成SO2和O2
观点3:SO2与O2反应生成SO3的同时 , SO3分解得到SO2和O2
将SO2与18O2按合适比例投入含催化剂的密闭高温反应容器,反应一段时间后,经同位素示踪法检测,18O核素存在于SO2 、O2 、SO3中
资料卡片2
密闭容器中SO2与O2在一定条件下发生反应 ,反应过程中SO3的物质的量的变化趋势如图1,而非图2
资料卡片3
环节二 · 探究 · 反应产生限度的原因
S
16O
18O
SO2 + 18O2 → SO3
SO3 → SO2+ O2
环节二 · 探究 · 反应产生限度的原因
2SO2 + O2 2SO3
高温
催化剂
可逆反应
同一条件下,同时向正、逆两个方向进行的化学反应
可逆反应中,正反应与逆反应同时进行,均不会进行到底,因此可逆反应存在限度
反应物
生成物
环节二 · 探究 · 反应产生限度的原因
SO2与O2反应生成SO3的同时 ,
SO3分解得到SO2和O2
(可逆反应)
思考3-1
①、该可逆反应何时达到限度
②、达到限度时,各物质浓度有什么特征?
时间(t/min) 0 10 20 30 40 50 60 70
c (SO2) mol/L 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
c (O2) mol/L 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
c (SO3) mol/L 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
SO2 与O2反应 时间-浓度表
资料卡片4
环节三 · 探究 · 化学平衡状态
思考3-2
时间(t/min) 0 10 20 30 40 50 60 70
c (SO2) mol/L 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
c (O2) mol/L 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
c (SO3) mol/L 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
SO2 与O2反应 时间-浓度表
环节三 · 探究 · 化学平衡状态
资料卡片4
化学反应速率与反应物浓度呈正相关
即:一定范围内,浓度越大,反应速率越快
①、正反应速率何时最大?
反应后,正反应速率如何变化
②、逆反应速率何时最小?
反应后,逆反应速率如何变化
反应速率
时间
正反应
逆反应
化学平衡
化学平衡
可逆反应达到限度时,正、逆反应速率相等,各物质浓度不变,
这种状态称之为“化学平衡状态”
环节三 · 探究 · 化学平衡状态
思考3-3
为什么可逆反应到达平衡状态后,各物质的浓度不再变化?
ν(正反应)= ν(逆反应)
反应中各物质的浓度不变
原因
化学平衡状态
判断依据
化学平衡是一种“动态平衡”,并非反应停止
思考3-4
2NO2 N2O4
(红棕色)
(无色)
如何判断该反应达到化学平衡?
实验2
将装有NO2和N2O4混合气体的密封玻璃球分别放入冷水、热水中,观察实验现象,分析NO2、N2O4的浓度
冷水 热水
体系颜色变化
NO2浓度变化
N2O4浓度变化
思考3-5
化学平衡状态可以改变吗?
环节三 · 探究 · 化学平衡状态
总结
①、什么是化学反应限度?
环节三 · 总结 · 化学平衡状态
②、为什么化学反应会有限度?
③、可逆反应达到限度有什么特征?
④、化学平衡状态是否可以改变?
一定条件下,
化学反应能达到的最大程度
可逆反应,在同一条件下,同时双向进行
ν(正反应)= ν(逆反应)
反应中各物质的浓度不变
反应条件改变时,
化学平衡随之改变
化学
平衡
环节四 · 认识 · 化学反应条件的控制
“向空气要面包”的工业——合成氨
19世纪初人口剧增,粮食产量不足成为要命的问题。氮肥对粮食增产至关重要,
自此,“合成氨”引发广泛关注,随着130年的漫长探索,“合成氨”投入工业生产。
目前,合成氨工业常用的催化剂为四氧化三铁,反应温度控制在485℃~515 ℃
资料卡片5
思考4-1
①、合成氨反应中,温度越低,氨气的产率越高,为什么工业生产时选择用500℃左右的高温,而不用更低的反应温度?
②、工业生产时,确定反应条件需要综合考虑哪些因素?
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
