8.1.2 海水资源的开发利用 课件(共18张PPT)高中化学 人教版(2019) 必修 第二册
文档属性
| 名称 | 8.1.2 海水资源的开发利用 课件(共18张PPT)高中化学 人教版(2019) 必修 第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 34.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 00:00:00 | ||
图片预览





文档简介
(共18张PPT)
第2课时
海水资源的开发利用
第八章 第1节 化学与可持续发展
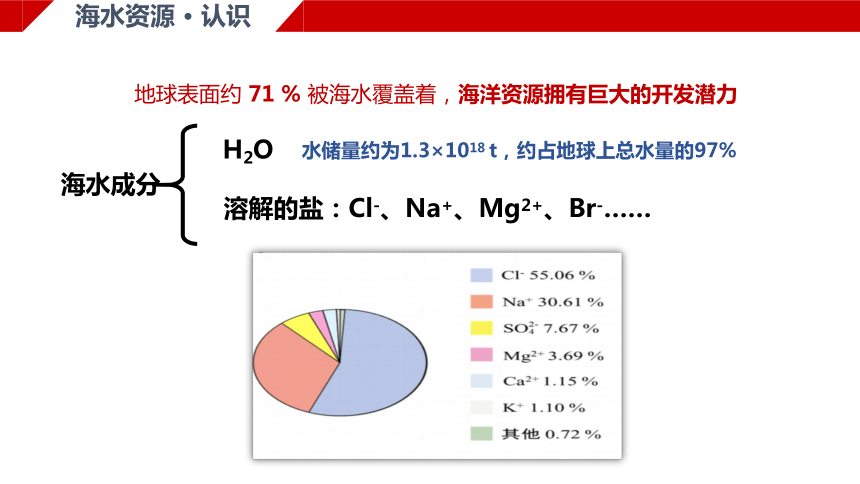
海水资源 · 认识
地球表面约 71 % 被海水覆盖着,海洋资源拥有巨大的开发潜力
海水成分
H2O
水储量约为1.3×1018 t,约占地球上总水量的97%
溶解的盐:Cl-、Na+、Mg2+、Br-……
海水资源 · 开发
海洋资源
开发思路
提取H2O
提取物质
海水淡化
蒸馏法
反渗透法
电渗析法
氯碱工业
金属冶炼
海水提溴
海水制盐
海带提碘
直接利用
利用海水对核反应堆进行循环冷却
潮汐发电
生物资源
侯氏制碱
海水淡化
海水资源 · 淡化
海水资源 · 淡化
酒精灯
蒸馏烧瓶
温度计
冷凝管
牛角管
锥形瓶
沸石
思考
①、蒸馏烧瓶与圆底烧瓶有什么区别?烧瓶加热时是否需要陶土网(石棉网)?
③、温度计的摆放位置有什么特点
④、冷凝管中,冷凝水的方向有什么要求?
②、沸石有什么作用?
海水制盐
海水资源 · 制盐
海水
食盐
蒸发结晶
粗盐提纯
思考
①、如何利用海水制得食盐
海水资源 · 制盐
思考
②、NaCl不仅可作为食盐食用,同时也是重要的化工原料。
结合元素组成进行分析,以NaCl为原料可以制得哪些产品?
NaCl
电解熔融NaCl
侯氏制碱法
电解饱和食盐水
(氯碱工业)
2NaCl(熔融) 2Na+Cl2↑
电解
NaCl+H2O+CO2+NH3 = NaHCO3↓+NH4Cl
2NaHCO3 = Na2CO3+H2O+CO2↑
2NaCl+2H2O H2↑+Cl2↑ +2NaOH
电解
“两气一液 氢氯碱”
▲
海水资源 · 制盐
海水
电厂冷却水
淡水
食盐(NaCl)
纯碱
(Na2CO3)
烧碱
(NaOH)
Cl2
H2
Na
84消毒液
漂白液
HCl
溴
海水提溴
海水资源 · 提溴
Br
地球中99%的溴元素存在于海洋中,因此溴被称为“海洋元素”
溴及其化合物广泛应用于制备镇静剂、抗生素、胶卷、汽油防燥剂等
物理性质特点:
Br2是唯一在常温下为液态的非金属单质
【常温下为易挥发的红棕色液体】
化学性质特点:
Br2作为卤素有较强氧化性;
卤素氧化性:F2>Cl2>Br2>I2
海水资源 · 提溴
思考
①、观察图表,分析溴元素在海水中的存在形式与特点
Br -
所处体系复杂
离子浓度低
海水资源 · 提溴
思考
②、如何将海水中的溴离子(Br -)转化为溴单质(Br2)
Br -
Br2
氧化剂
+Cl2
(液态)
制备
提取
Cl2+2Br - = 2Cl-+Br2
Br2是具有挥发性的红棕色液体,
沸点为58.76℃。
资料卡片1
低浓度溴
原理:蒸馏
海水资源 · 提溴
思考
③、阅读<思考与讨论>,归纳海水提溴的工艺步骤,分析各环节中溴元素发生了哪些形态变化?
工艺步骤 溴元素形态变化 离子方程
氧化
(热空气)吹出
吸收
氧化、蒸馏
Br - → Br2
Br2 (液态)→ Br2(气态)
Br2 (气态)→ Br -(HBr)
Br - → Br2(液态)→ Br2(气态)
④、根据溴元素变化,写出吸收环节主要反应的离子方程
Cl2+2Br - = 2Cl-+Br2
Cl2+2Br - = 2Cl-+Br2
Br2+SO2+2H2O = 4H++SO42-+2Br -
海水资源 · 提溴
思考
⑤、Cl2氧化生成的Br2,为什么要用SO2还原为Br –吸收,再经历二次氧化,
“吸收”这一步有何意义?
Br -
海水
Br2
氧化剂
+Cl2
空气
Br2
热空气
吹出
吸收液Br -
SO2、H2O
吸收
Br2
Cl2氧化
蒸馏
低浓度溴
高浓度溴
富集
(0.0672 g/L)
难以实现
分离空气和Br2;提高溴元素浓度,利于后续蒸馏
海水资源 · 提溴
(30 g/L)
(0.0672 g/L)
物理富集
化学富集
海水资源 · 开发思路
寻找自然资源
化工产品
富集元素
分离提纯
物质转化
第2课时
海水资源的开发利用
第八章 第1节 化学与可持续发展
海水资源 · 认识
地球表面约 71 % 被海水覆盖着,海洋资源拥有巨大的开发潜力
海水成分
H2O
水储量约为1.3×1018 t,约占地球上总水量的97%
溶解的盐:Cl-、Na+、Mg2+、Br-……
海水资源 · 开发
海洋资源
开发思路
提取H2O
提取物质
海水淡化
蒸馏法
反渗透法
电渗析法
氯碱工业
金属冶炼
海水提溴
海水制盐
海带提碘
直接利用
利用海水对核反应堆进行循环冷却
潮汐发电
生物资源
侯氏制碱
海水淡化
海水资源 · 淡化
海水资源 · 淡化
酒精灯
蒸馏烧瓶
温度计
冷凝管
牛角管
锥形瓶
沸石
思考
①、蒸馏烧瓶与圆底烧瓶有什么区别?烧瓶加热时是否需要陶土网(石棉网)?
③、温度计的摆放位置有什么特点
④、冷凝管中,冷凝水的方向有什么要求?
②、沸石有什么作用?
海水制盐
海水资源 · 制盐
海水
食盐
蒸发结晶
粗盐提纯
思考
①、如何利用海水制得食盐
海水资源 · 制盐
思考
②、NaCl不仅可作为食盐食用,同时也是重要的化工原料。
结合元素组成进行分析,以NaCl为原料可以制得哪些产品?
NaCl
电解熔融NaCl
侯氏制碱法
电解饱和食盐水
(氯碱工业)
2NaCl(熔融) 2Na+Cl2↑
电解
NaCl+H2O+CO2+NH3 = NaHCO3↓+NH4Cl
2NaHCO3 = Na2CO3+H2O+CO2↑
2NaCl+2H2O H2↑+Cl2↑ +2NaOH
电解
“两气一液 氢氯碱”
▲
海水资源 · 制盐
海水
电厂冷却水
淡水
食盐(NaCl)
纯碱
(Na2CO3)
烧碱
(NaOH)
Cl2
H2
Na
84消毒液
漂白液
HCl
溴
海水提溴
海水资源 · 提溴
Br
地球中99%的溴元素存在于海洋中,因此溴被称为“海洋元素”
溴及其化合物广泛应用于制备镇静剂、抗生素、胶卷、汽油防燥剂等
物理性质特点:
Br2是唯一在常温下为液态的非金属单质
【常温下为易挥发的红棕色液体】
化学性质特点:
Br2作为卤素有较强氧化性;
卤素氧化性:F2>Cl2>Br2>I2
海水资源 · 提溴
思考
①、观察图表,分析溴元素在海水中的存在形式与特点
Br -
所处体系复杂
离子浓度低
海水资源 · 提溴
思考
②、如何将海水中的溴离子(Br -)转化为溴单质(Br2)
Br -
Br2
氧化剂
+Cl2
(液态)
制备
提取
Cl2+2Br - = 2Cl-+Br2
Br2是具有挥发性的红棕色液体,
沸点为58.76℃。
资料卡片1
低浓度溴
原理:蒸馏
海水资源 · 提溴
思考
③、阅读<思考与讨论>,归纳海水提溴的工艺步骤,分析各环节中溴元素发生了哪些形态变化?
工艺步骤 溴元素形态变化 离子方程
氧化
(热空气)吹出
吸收
氧化、蒸馏
Br - → Br2
Br2 (液态)→ Br2(气态)
Br2 (气态)→ Br -(HBr)
Br - → Br2(液态)→ Br2(气态)
④、根据溴元素变化,写出吸收环节主要反应的离子方程
Cl2+2Br - = 2Cl-+Br2
Cl2+2Br - = 2Cl-+Br2
Br2+SO2+2H2O = 4H++SO42-+2Br -
海水资源 · 提溴
思考
⑤、Cl2氧化生成的Br2,为什么要用SO2还原为Br –吸收,再经历二次氧化,
“吸收”这一步有何意义?
Br -
海水
Br2
氧化剂
+Cl2
空气
Br2
热空气
吹出
吸收液Br -
SO2、H2O
吸收
Br2
Cl2氧化
蒸馏
低浓度溴
高浓度溴
富集
(0.0672 g/L)
难以实现
分离空气和Br2;提高溴元素浓度,利于后续蒸馏
海水资源 · 提溴
(30 g/L)
(0.0672 g/L)
物理富集
化学富集
海水资源 · 开发思路
寻找自然资源
化工产品
富集元素
分离提纯
物质转化
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
