1.2 反应热计算 课件(共24张PPT)高中化学 人教版(2019)选择性必修1
文档属性
| 名称 | 1.2 反应热计算 课件(共24张PPT)高中化学 人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 20.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 18:20:07 | ||
图片预览








文档简介
(共24张PPT)
第二节 反应热的计算
盖斯定律 反应热计算
第一章 化学反应的热效应
反应热的测定装置
在科学研究和工业生产中,常常需要了解反应热。许多反应热可以通过实验直接测定,
难以控制反应的程度不能直接测定反应热
但是有些反应热是无法直接测定的。
策略:利用一些已知反应的反应热来计算它的反应热
盖斯定律 · 意义
化学家盖斯利用自己设计的量热计,测定了大量的反应热。并依据氨水、氢氧化钠、氢氧化钾、石灰分别与硫酸反应的反应热总结出了盖斯定律。1840年,他将这一重大发现公之于众,这对反应热的研究做出重大贡献。
盖斯
盖斯定律 · 意义
盖斯定律:
一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。
盖斯定律
例:假设反应物A变成生成物C,可以有两个途径:
①由A直接变成C,反应热为 H;
②由A先变成B,再由B变成C,每步的反应热分别是 H1、 H2 。
如下图所示:
H
H1
H2
A
B
H = H1 + H2
C
盖斯定律 · 定义
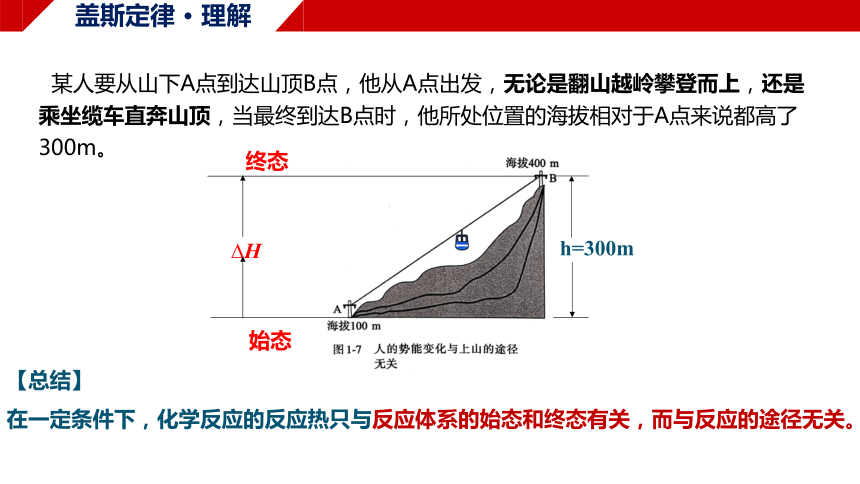
某人要从山下A点到达山顶B点,他从A点出发,无论是翻山越岭攀登而上,还是乘坐缆车直奔山顶,当最终到达B点时,他所处位置的海拔相对于A点来说都高了300m。
h=300m
始态
终态
H
盖斯定律 · 理解
【总结】
在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
利用盖斯定律间接求算反应热
伴随副反应的反应
不容易直接发生的反应
速率很慢的反应
盖斯定律 · 应用
【例题1】根据已知信息,计算C(s)燃烧生成CO2(g)的反应热
盖斯定律 · 应用
求: ③、C(s) +O2(g) = CO2(g) 的焓变 H3
始态
终态
CO2(g)
C(s)
H1
H3
H2
+ O2(g)
CO(g)
①、
②、
方程③与方程①、②有什么关系?
H3 = -110.5+(-283.0)=-393.5kJ/mol
能量
C(s)+O2(g)
CO2(g)
ΔH3
ΔH1
ΔH2
焓变: H3 = H1+ H2
思考
方程:③=①+②
结论:方程与 H的代数关系一致
从方程关系上看:③=_____________________
H3 = H1 - H2
= -393.5kJ/mol - (-283.0kJ/mol)
= -110.5kJ/mol
C(s) + O2(g) = CO(g) H3 =
1
2
【例题2】根据已知信息,计算C(s)燃烧生成CO(g)的反应热
盖斯定律 · 应用
从焓变关系上看: H3 = _____________________
①-②
H1- H2
盖斯定律 · 应用
火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知:
① N2(g) + 2O2(g) = 2NO2(g) ΔH1 = +66.4 kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) ΔH2 = -534 kJ/mol
求 2N2H4(l) + 2NO2(g) = 3N2(g) + 4H2O(g) ΔH =
策略:
当方程较为陌生复杂时,我们优先找到方程之间的关系,再依据方程关系计算焓变
快速阅读以下题目,你的解题思路是什么
如何正确、快速的找到方程关系?
盖斯定律 · 应用
应用思路
明确目标方程
找到方程关系
计算ΔH
方程关系的技巧
①、已知反应里有,但目标反应里没有的物质 — 需要消去的中间产物
目的:消去中间产物,得到目标方程
②、若不同反应里中间产物的系数不同,可将方程整体扩大或缩小,注意ΔH也随之变化
③、根据已知反应与目标反应中的相同物质,确定方程的加减关系:
同侧相加,异侧相减,系数不同,改变倍数
④、减去反应 = 加上逆反应,逆反应前后颠倒, ΔH只变正负,不变数值
盖斯定律 · 应用
【例题3】火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知:
① N2(g) + 2O2(g) = 2NO2(g) ΔH1 = +66.4 kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) ΔH2 = -534 kJ/mol
求 2N2H4(l) + 2NO2(g) = 3N2(g) + 4H2O(g) ΔH =
方程关系: ②×2 - ①
需要消去的中间产物为:O2(g) —— 且①与②为相减的关系,且②需扩大两倍
找到中间产物:
找到已知方程与目标方程的相同物质:
②与目标反应物质同侧,方程②用加法;①与目标方程物质异侧,方程①用减法
确认方程关系,进行方程加减,与目标方程对照检验:
计算ΔH:
ΔH = ΔH2×2- ΔH1
① CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l) Δ H1 = 890.3 kJ/mol
【练习1】计算甲烷不完全燃烧的反应热是多少?
盖斯定律 · 应用
③ CO (g) + O2 (g) = CO2 (g) Δ H3= 283.0 kJ/mol
② CH4 (g) + O2 (g) = CO (g) + 2H2O(l) Δ H2 = ?
与已知反应对比:
反应①与目标反应同侧,用加法
反应②与目标反应异侧,用减法
② = ① - ③
整合方程进行检查,与目标反应一致
需要消去的中间产物为:CO2(g),且①、②中CO2倍数相同
已知:
① H2 (g) + O2 (g) = H2O (l) ΔH1=
② H2O (l) = H2O (g) ΔH2= +44kJ/mol
③ H2 (g) + O2 (g) = H2O (g) ΔH3= 241.8kJ/mol
方程:① = ③ - ②
焓变: H1 = H3- H2
H1 = -241.8-(44)=-285.8kJ/mol
盖斯定律 · 应用
【练习2】
盖斯定律 · 应用
【练习3】已知下列热化学方程式:
①、Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-26.7 kJ·mol-1
②、3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-50.75 kJ·mol-1
③、Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=-36.5 kJ·mol-1
则反应FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变为( )
A.+7.28 kJ·mol-1 B.-7.28 kJ·mol-1 C.+43.68 kJ·mol-1 D.-43.68 kJ·mol-1
A
盖斯定律 · 应用
【练习4】甲烷和水蒸气催化制氢主要有如下两个反应:
①、CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206 kJ/mol
②、CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ/mol
写出CH4与 CO2生成H2和CO的热化学方程式:
__________________________________________________________。
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247 kJ/mol
反应热计算
反应热的计算方法:
①、已知某些反应:用盖斯定律
②、已知键能:ΔH=反应物键能 - 产物键能(前 - 后)
③、已知焓/物质总能力:ΔH=产物总能量 - 反应物总能量(后 - 前)
【例1】已知下列热化学方程式:
① 、CH3COOH(l)+ 2O2(g) ═2CO2(g)+2H2O(l) ΔH1=﹣870.3 kJ/mol
② 、 C (s) + O2(g)═CO2(g) ΔH2=﹣393.5 kJ/mol
③ 、 H2(g) + 1/2O2(g)═H2O(l) ΔH3=﹣285.8 kJ/mol
则反应 2C(s) +2H2(g)+O2(g)=CH3COOH(l)的焓变ΔH 为( )
A.244.15kJ mol﹣1 B.﹣224.15kJ mol﹣1
C.488.3kJ mol﹣1 D.﹣488.3kJ mol﹣1
反应热计算
D
反应热计算
反应热计算
【例2】白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
反应热计算
A
反应热计算
【例3】已知 2O(g)=O2(g) H = - 496 kJ mol -1,结合能量变化示意图。下列说法正确的是( )
A.拆开 1 mol H2(g) 中的化学键需要吸收 932 kJ能量
B.拆开 1 mol H2O(g) 中所有化学键需要吸收 926 kJ能量
C.1 mol H2O(l) 转变为 1mol H2O(g)需要吸收 88 kJ能量
D.2 mol H2(g) 和 1mol O2(g) 反应生成 2 mol H2O(l),共放热 1940 kJ
B
反应热计算
反应热计算
【例4】研究氮的氧化物的性质对于消除城市中汽车尾气的污染具有重要意义。NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。已知下列两反应过程中能量变化如图1、图2所示,则NO2氧化SO2生成SO3(g)的热化学方程式为
_______________________________________________________________。
NO2(g)+SO2(g)=SO3(g)+NO(g) ΔH=-41.8 kJ/mol
反应热计算
反应热比较
反应热的大小比较
【例1】H2(g)+O2(g)===H2O(l) ΔH1=-a kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-b kJ·mol-1
比较大小:|ΔH2| --------- |ΔH1|, ΔH2 --------- ΔH1
且b=----------a。
如果化学计量数加倍,ΔH的绝对值也要加倍
比较ΔH时,注意正负;若为负值,绝对值越大, ΔH越小
>
<
2
反应热比较
反应热的大小比较
【例2】已知:S(g)+O2(g)===SO2(g) ΔH1=-a kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH2=-b kJ·mol-1
比较大小:|ΔH2| --------- |ΔH1|, ΔH2 --------- ΔH1
三状态自身的能量比较:E(g)>E(l)>E(s)
同一反应,反应物或生成物的状态不同,反应热不同
<
>
反应热比较
反应热的大小比较
【例3】 C(s,石墨)+O2(g) == CO2(g) ΔH1=-a kJ·mol-1
C(s,金刚石)+O2(g) == CO2(g) ΔH2=-b kJ·mol-1、
已知: C(s,石墨) == C(s,金刚石) ΔH>0
比较大小:|ΔH2| --------- |ΔH1|, ΔH2 --------- ΔH1
晶体类型不同,产物相同的反应,反应热不同
>
<
①浓硫酸和氢氧化钠固体反应生成1 mol水时,放出的热量一定_____57.3kJ
②醋酸和NaOH溶液反应生成1 mol水时,放出的热量一定______57.3 kJ
③稀硫酸和Ba(OH)2溶液反应生成1 mol水时,反应放出的热量一定______57.3 kJ
>
<
>
(浓硫酸稀释和氢氧化钠固体溶解时都会放出热量)
(醋酸电离会吸热)
(反应生成BaSO4沉淀会放出热量)
反应热比较
反应热的大小比较
ΔH ------ -57.3kJ/mol
<
ΔH ------ -57.3kJ/mol
ΔH ------ -57.3kJ/mol
>
<
【例4】
第二节 反应热的计算
盖斯定律 反应热计算
第一章 化学反应的热效应
反应热的测定装置
在科学研究和工业生产中,常常需要了解反应热。许多反应热可以通过实验直接测定,
难以控制反应的程度不能直接测定反应热
但是有些反应热是无法直接测定的。
策略:利用一些已知反应的反应热来计算它的反应热
盖斯定律 · 意义
化学家盖斯利用自己设计的量热计,测定了大量的反应热。并依据氨水、氢氧化钠、氢氧化钾、石灰分别与硫酸反应的反应热总结出了盖斯定律。1840年,他将这一重大发现公之于众,这对反应热的研究做出重大贡献。
盖斯
盖斯定律 · 意义
盖斯定律:
一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。
盖斯定律
例:假设反应物A变成生成物C,可以有两个途径:
①由A直接变成C,反应热为 H;
②由A先变成B,再由B变成C,每步的反应热分别是 H1、 H2 。
如下图所示:
H
H1
H2
A
B
H = H1 + H2
C
盖斯定律 · 定义
某人要从山下A点到达山顶B点,他从A点出发,无论是翻山越岭攀登而上,还是乘坐缆车直奔山顶,当最终到达B点时,他所处位置的海拔相对于A点来说都高了300m。
h=300m
始态
终态
H
盖斯定律 · 理解
【总结】
在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
利用盖斯定律间接求算反应热
伴随副反应的反应
不容易直接发生的反应
速率很慢的反应
盖斯定律 · 应用
【例题1】根据已知信息,计算C(s)燃烧生成CO2(g)的反应热
盖斯定律 · 应用
求: ③、C(s) +O2(g) = CO2(g) 的焓变 H3
始态
终态
CO2(g)
C(s)
H1
H3
H2
+ O2(g)
CO(g)
①、
②、
方程③与方程①、②有什么关系?
H3 = -110.5+(-283.0)=-393.5kJ/mol
能量
C(s)+O2(g)
CO2(g)
ΔH3
ΔH1
ΔH2
焓变: H3 = H1+ H2
思考
方程:③=①+②
结论:方程与 H的代数关系一致
从方程关系上看:③=_____________________
H3 = H1 - H2
= -393.5kJ/mol - (-283.0kJ/mol)
= -110.5kJ/mol
C(s) + O2(g) = CO(g) H3 =
1
2
【例题2】根据已知信息,计算C(s)燃烧生成CO(g)的反应热
盖斯定律 · 应用
从焓变关系上看: H3 = _____________________
①-②
H1- H2
盖斯定律 · 应用
火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知:
① N2(g) + 2O2(g) = 2NO2(g) ΔH1 = +66.4 kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) ΔH2 = -534 kJ/mol
求 2N2H4(l) + 2NO2(g) = 3N2(g) + 4H2O(g) ΔH =
策略:
当方程较为陌生复杂时,我们优先找到方程之间的关系,再依据方程关系计算焓变
快速阅读以下题目,你的解题思路是什么
如何正确、快速的找到方程关系?
盖斯定律 · 应用
应用思路
明确目标方程
找到方程关系
计算ΔH
方程关系的技巧
①、已知反应里有,但目标反应里没有的物质 — 需要消去的中间产物
目的:消去中间产物,得到目标方程
②、若不同反应里中间产物的系数不同,可将方程整体扩大或缩小,注意ΔH也随之变化
③、根据已知反应与目标反应中的相同物质,确定方程的加减关系:
同侧相加,异侧相减,系数不同,改变倍数
④、减去反应 = 加上逆反应,逆反应前后颠倒, ΔH只变正负,不变数值
盖斯定律 · 应用
【例题3】火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知:
① N2(g) + 2O2(g) = 2NO2(g) ΔH1 = +66.4 kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) ΔH2 = -534 kJ/mol
求 2N2H4(l) + 2NO2(g) = 3N2(g) + 4H2O(g) ΔH =
方程关系: ②×2 - ①
需要消去的中间产物为:O2(g) —— 且①与②为相减的关系,且②需扩大两倍
找到中间产物:
找到已知方程与目标方程的相同物质:
②与目标反应物质同侧,方程②用加法;①与目标方程物质异侧,方程①用减法
确认方程关系,进行方程加减,与目标方程对照检验:
计算ΔH:
ΔH = ΔH2×2- ΔH1
① CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l) Δ H1 = 890.3 kJ/mol
【练习1】计算甲烷不完全燃烧的反应热是多少?
盖斯定律 · 应用
③ CO (g) + O2 (g) = CO2 (g) Δ H3= 283.0 kJ/mol
② CH4 (g) + O2 (g) = CO (g) + 2H2O(l) Δ H2 = ?
与已知反应对比:
反应①与目标反应同侧,用加法
反应②与目标反应异侧,用减法
② = ① - ③
整合方程进行检查,与目标反应一致
需要消去的中间产物为:CO2(g),且①、②中CO2倍数相同
已知:
① H2 (g) + O2 (g) = H2O (l) ΔH1=
② H2O (l) = H2O (g) ΔH2= +44kJ/mol
③ H2 (g) + O2 (g) = H2O (g) ΔH3= 241.8kJ/mol
方程:① = ③ - ②
焓变: H1 = H3- H2
H1 = -241.8-(44)=-285.8kJ/mol
盖斯定律 · 应用
【练习2】
盖斯定律 · 应用
【练习3】已知下列热化学方程式:
①、Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-26.7 kJ·mol-1
②、3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-50.75 kJ·mol-1
③、Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=-36.5 kJ·mol-1
则反应FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变为( )
A.+7.28 kJ·mol-1 B.-7.28 kJ·mol-1 C.+43.68 kJ·mol-1 D.-43.68 kJ·mol-1
A
盖斯定律 · 应用
【练习4】甲烷和水蒸气催化制氢主要有如下两个反应:
①、CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206 kJ/mol
②、CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ/mol
写出CH4与 CO2生成H2和CO的热化学方程式:
__________________________________________________________。
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247 kJ/mol
反应热计算
反应热的计算方法:
①、已知某些反应:用盖斯定律
②、已知键能:ΔH=反应物键能 - 产物键能(前 - 后)
③、已知焓/物质总能力:ΔH=产物总能量 - 反应物总能量(后 - 前)
【例1】已知下列热化学方程式:
① 、CH3COOH(l)+ 2O2(g) ═2CO2(g)+2H2O(l) ΔH1=﹣870.3 kJ/mol
② 、 C (s) + O2(g)═CO2(g) ΔH2=﹣393.5 kJ/mol
③ 、 H2(g) + 1/2O2(g)═H2O(l) ΔH3=﹣285.8 kJ/mol
则反应 2C(s) +2H2(g)+O2(g)=CH3COOH(l)的焓变ΔH 为( )
A.244.15kJ mol﹣1 B.﹣224.15kJ mol﹣1
C.488.3kJ mol﹣1 D.﹣488.3kJ mol﹣1
反应热计算
D
反应热计算
反应热计算
【例2】白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
反应热计算
A
反应热计算
【例3】已知 2O(g)=O2(g) H = - 496 kJ mol -1,结合能量变化示意图。下列说法正确的是( )
A.拆开 1 mol H2(g) 中的化学键需要吸收 932 kJ能量
B.拆开 1 mol H2O(g) 中所有化学键需要吸收 926 kJ能量
C.1 mol H2O(l) 转变为 1mol H2O(g)需要吸收 88 kJ能量
D.2 mol H2(g) 和 1mol O2(g) 反应生成 2 mol H2O(l),共放热 1940 kJ
B
反应热计算
反应热计算
【例4】研究氮的氧化物的性质对于消除城市中汽车尾气的污染具有重要意义。NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。已知下列两反应过程中能量变化如图1、图2所示,则NO2氧化SO2生成SO3(g)的热化学方程式为
_______________________________________________________________。
NO2(g)+SO2(g)=SO3(g)+NO(g) ΔH=-41.8 kJ/mol
反应热计算
反应热比较
反应热的大小比较
【例1】H2(g)+O2(g)===H2O(l) ΔH1=-a kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-b kJ·mol-1
比较大小:|ΔH2| --------- |ΔH1|, ΔH2 --------- ΔH1
且b=----------a。
如果化学计量数加倍,ΔH的绝对值也要加倍
比较ΔH时,注意正负;若为负值,绝对值越大, ΔH越小
>
<
2
反应热比较
反应热的大小比较
【例2】已知:S(g)+O2(g)===SO2(g) ΔH1=-a kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH2=-b kJ·mol-1
比较大小:|ΔH2| --------- |ΔH1|, ΔH2 --------- ΔH1
三状态自身的能量比较:E(g)>E(l)>E(s)
同一反应,反应物或生成物的状态不同,反应热不同
<
>
反应热比较
反应热的大小比较
【例3】 C(s,石墨)+O2(g) == CO2(g) ΔH1=-a kJ·mol-1
C(s,金刚石)+O2(g) == CO2(g) ΔH2=-b kJ·mol-1、
已知: C(s,石墨) == C(s,金刚石) ΔH>0
比较大小:|ΔH2| --------- |ΔH1|, ΔH2 --------- ΔH1
晶体类型不同,产物相同的反应,反应热不同
>
<
①浓硫酸和氢氧化钠固体反应生成1 mol水时,放出的热量一定_____57.3kJ
②醋酸和NaOH溶液反应生成1 mol水时,放出的热量一定______57.3 kJ
③稀硫酸和Ba(OH)2溶液反应生成1 mol水时,反应放出的热量一定______57.3 kJ
>
<
>
(浓硫酸稀释和氢氧化钠固体溶解时都会放出热量)
(醋酸电离会吸热)
(反应生成BaSO4沉淀会放出热量)
反应热比较
反应热的大小比较
ΔH ------ -57.3kJ/mol
<
ΔH ------ -57.3kJ/mol
ΔH ------ -57.3kJ/mol
>
<
【例4】
