2.2.1化学平衡状态及其判定依据 课件(共15张PPT)高中化学 人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.1化学平衡状态及其判定依据 课件(共15张PPT)高中化学 人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 881.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 18:27:08 | ||
图片预览





文档简介
(共15张PPT)
第二节 化学平衡
第1课时 平衡状态与判断依据
第二章 化学反应速率与化学平衡
复习回顾 · 化学平衡
思考1
①、为什么有些化学反应存在平衡状态?
可逆反应同时双向进行,彼此制衡,均不会进行到底,由此产生平衡
化学平衡状态是可逆反应的一种特殊状态,
是在给定条件下能达到的最大程度。
化学反应的限度
化学平衡状态
可逆 反应
化学平衡 · 建立
各物质的起始量/mol 充分反应后各物质的量/mol
N2 H2 NH3 N2 H2 NH3
5 15 0 3 9 4
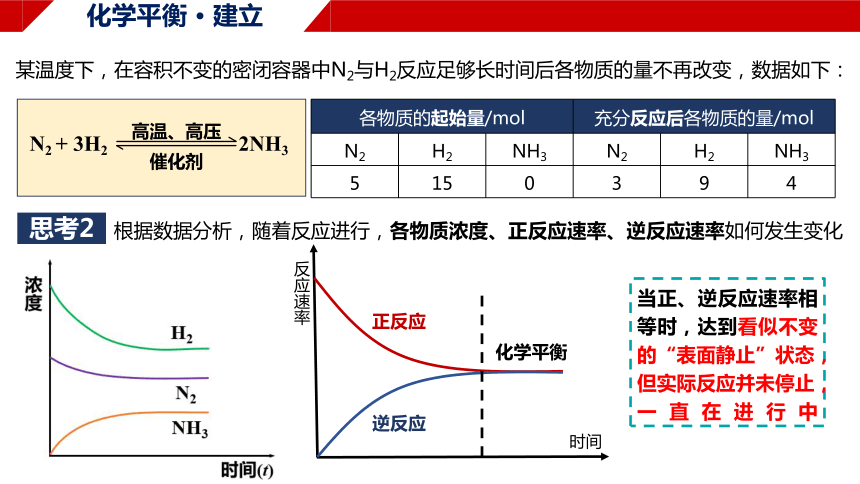
某温度下,在容积不变的密闭容器中N2与H2反应足够长时间后各物质的量不再改变,数据如下:
2NH3
N2 + 3H2
催化剂
高温、高压
根据数据分析,随着反应进行,各物质浓度、正反应速率、逆反应速率如何发生变化
思考2
反应速率
时间
正反应
逆反应
化学平衡
当正、逆反应速率相等时,达到看似不变的“表面静止”状态,但实际反应并未停止,一直在进行中
化学平衡 · 建立
思考3
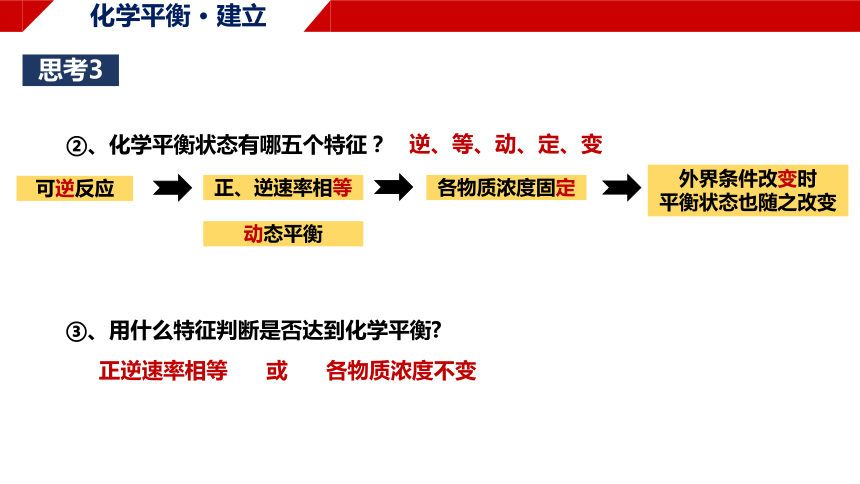
②、化学平衡状态有哪五个特征?
③、用什么特征判断是否达到化学平衡
逆、等、动、定、变
正逆速率相等 或 各物质浓度不变
可逆反应
正、逆速率相等
动态平衡
各物质浓度固定
外界条件改变时
平衡状态也随之改变
直接标志
化学平衡 · 判断
v正=v逆
注意速率的表达
注意生成和消耗
注意方程系数
方法:先看正逆;再看比例
①、3v(N2)=v(H2) ( )
②、2v正(N2) = v逆(NH3) ( )
③、消耗 1 mol N2的同时,生成 2 mol NH3 ( )
④、1 mol H-H键断裂的同时,2molN-H键断裂 ( )
⑤、单位时间内消耗的N2量是消耗NH3量的两倍 ( )
【例1】 ,判断下列描述的反应状态是否达到平衡。
N2 + 3H2 2NH3
化学平衡 · 判断
⑥、用NO2、NO和O2的物质的量浓度变化表示的反应速率之比为2∶2∶1 ( )
无法判断
没有表达清楚正/逆
平衡
①、标示正/逆;②、速率比例关系正确
无法判断
均为正向反应
平衡
消耗1mol H2→正向
消耗2/3mol NH3→逆向
正向
正向
①、有正有逆;②、比例正确
正向
逆向
比例不正确,无法表示正逆速率相等
无法判断
无法判断
速率之比始终等于方程系数比,无法用于判断平衡
化学平衡 · 判断
间接标志
“变量不变”
(浓度、物质的量、质量、压强、体系温度、
物质的量分数、质量分数、体积分数、
颜色、转化率……)
重点:给定的判断依据,在该反应中是否为变量;若为变量,则可以用来判断平衡
常用公式:
P V = n R T
压强
气体
体积
气体
物质的量
常数
体系温度
φ(B) =
nB
n总
M=
m
n
ρ=
m
V
物质的量分数
密度
摩尔质量
相对分子质量
化学平衡 · 判断
情况1:气体“压强/体积问题”
【例2】判断下列反应状态时,是否达到平衡。
气体的n总不变时(看方程系数)
恒温恒容 密闭容器,p总不变时
恒温恒压 密闭容器,V总不变时
P V = n R T
压强
气体
体积
气体
物质的量
常数
体系温度
N2(g) + 3H2(g) 2NH3(g)
H2(g) + I2(g) 2HI(g)
平衡
平衡
平衡
无法判断
无法判断
无法判断
变量
气体体积分数/物质的量分数
φ(B) =
nB
n气总
φ(B)不变时
A(g) + B(g) 2C(g)
φ(B) =
nB
n气总
φ(B) =
1
2
定量
变量
定量
A(s) B(g) + C(g)
化学平衡 · 判断
情况2:气体“分数问题”
单边气体,不用“分数”
【例3】当气体B的体积分数不变时,判断下列反应状态是否达到平衡。
平衡
无法判断
φ(B) =
nB
n气总
化学平衡 · 判断
情况3:气体“平均相对分子质量问题”
M=
m总气体
n总气体
【例4】当气体平均相对分子质量不变时,判断下列反应状态是否达到平衡。
①、2SO2(g)+O2(g) 2SO3(g)
M=
m总
n总
变量
定量
变量
②、2A(g)+ B(s) 2C(g)
M=
m总
n总
变量
定量
变量
④、NH2COONH4(s) 2NH3(g) + CO2(g)
③、H2(g)+I2(g) 2HI(g)
M=
m总
n总
定量
定量
定量
2
3
1
3
M=
×17+ ×44
2
3
1
3
定量
看系数
看状态
化学平衡 · 判断
情况4:气体“密度问题”
【例5】在恒温恒容的密闭容器中,当气体密度不变时,下列反应是否达到平衡?
①、2SO2(g)+O2(g) 2SO3(g)
ρ=
m总
V
定量
定量
定量
②、Ni(s) + 4CO(g) Ni(CO)4(g)
ρ=
m总
V
定量
变量
变量
ρ=
m(总气体)
V
【例6】在恒温恒压的密闭容器中,当气体密度不变时,下列反应是否达到平衡?
①、2SO2(g)+O2(g) 2SO3(g)
②、Ni(s) + 4CO(g) Ni(CO)4(g)
ρ=
m总
V
变量
定量
变量
ρ=
m总
V
变量
变量
变量
(正向-变大)
(正向-变小)
化学平衡 · 判断
情况5:其他问题
,当n(SO2):n(O2):n(SO3)=2:1:2时( )
①、2SO2(g)+O2(g) 2SO3(g)
②、绝热体系下, ,体系温度不变时( )
2SO2(g)+O2(g) 2SO3(g)
不和外界发生热量交换
平衡
无法判断
1、可逆反应2NO2(g) 2NO(g)+O2(g)在恒容密闭容器中进行:
①单位时间内生成n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO和O2的物质的量浓度变化表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的压强不再改变
⑦混合气体的平均相对分子质量不再改变
可说明该反应达到化学平衡状态的是__________。
①④⑥⑦
课堂练习
2.在一定温度下的恒容容器中,发生反应:2A(g)+B(s) C(g)+D(g),
下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2∶1∶1
⑤单位时间内生成n mol C,同时生成n mol D
⑥单位时间内生成n mol D,同时生成2n mol A
A.①②⑤ B.②③⑤
C.②③⑥ D.①③⑥
C
课堂练习
3.在一个绝热的固定容积的密闭容器中,
发生可逆反应mA(g)+nB(g) pC(g)+qD(s),当m、n、p、q为任意整数时,一定可以作为反应达到平衡状态的标志是( )
①体系的压强不再改变
②体系的温度不再改变
③体系的密度不再变化
④各组分质量分数不再改变
A.①②③
B.①②③④
C.②③④
D.③④
C
课堂练习
第二节 化学平衡
第1课时 平衡状态与判断依据
第二章 化学反应速率与化学平衡
复习回顾 · 化学平衡
思考1
①、为什么有些化学反应存在平衡状态?
可逆反应同时双向进行,彼此制衡,均不会进行到底,由此产生平衡
化学平衡状态是可逆反应的一种特殊状态,
是在给定条件下能达到的最大程度。
化学反应的限度
化学平衡状态
可逆 反应
化学平衡 · 建立
各物质的起始量/mol 充分反应后各物质的量/mol
N2 H2 NH3 N2 H2 NH3
5 15 0 3 9 4
某温度下,在容积不变的密闭容器中N2与H2反应足够长时间后各物质的量不再改变,数据如下:
2NH3
N2 + 3H2
催化剂
高温、高压
根据数据分析,随着反应进行,各物质浓度、正反应速率、逆反应速率如何发生变化
思考2
反应速率
时间
正反应
逆反应
化学平衡
当正、逆反应速率相等时,达到看似不变的“表面静止”状态,但实际反应并未停止,一直在进行中
化学平衡 · 建立
思考3
②、化学平衡状态有哪五个特征?
③、用什么特征判断是否达到化学平衡
逆、等、动、定、变
正逆速率相等 或 各物质浓度不变
可逆反应
正、逆速率相等
动态平衡
各物质浓度固定
外界条件改变时
平衡状态也随之改变
直接标志
化学平衡 · 判断
v正=v逆
注意速率的表达
注意生成和消耗
注意方程系数
方法:先看正逆;再看比例
①、3v(N2)=v(H2) ( )
②、2v正(N2) = v逆(NH3) ( )
③、消耗 1 mol N2的同时,生成 2 mol NH3 ( )
④、1 mol H-H键断裂的同时,2molN-H键断裂 ( )
⑤、单位时间内消耗的N2量是消耗NH3量的两倍 ( )
【例1】 ,判断下列描述的反应状态是否达到平衡。
N2 + 3H2 2NH3
化学平衡 · 判断
⑥、用NO2、NO和O2的物质的量浓度变化表示的反应速率之比为2∶2∶1 ( )
无法判断
没有表达清楚正/逆
平衡
①、标示正/逆;②、速率比例关系正确
无法判断
均为正向反应
平衡
消耗1mol H2→正向
消耗2/3mol NH3→逆向
正向
正向
①、有正有逆;②、比例正确
正向
逆向
比例不正确,无法表示正逆速率相等
无法判断
无法判断
速率之比始终等于方程系数比,无法用于判断平衡
化学平衡 · 判断
间接标志
“变量不变”
(浓度、物质的量、质量、压强、体系温度、
物质的量分数、质量分数、体积分数、
颜色、转化率……)
重点:给定的判断依据,在该反应中是否为变量;若为变量,则可以用来判断平衡
常用公式:
P V = n R T
压强
气体
体积
气体
物质的量
常数
体系温度
φ(B) =
nB
n总
M=
m
n
ρ=
m
V
物质的量分数
密度
摩尔质量
相对分子质量
化学平衡 · 判断
情况1:气体“压强/体积问题”
【例2】判断下列反应状态时,是否达到平衡。
气体的n总不变时(看方程系数)
恒温恒容 密闭容器,p总不变时
恒温恒压 密闭容器,V总不变时
P V = n R T
压强
气体
体积
气体
物质的量
常数
体系温度
N2(g) + 3H2(g) 2NH3(g)
H2(g) + I2(g) 2HI(g)
平衡
平衡
平衡
无法判断
无法判断
无法判断
变量
气体体积分数/物质的量分数
φ(B) =
nB
n气总
φ(B)不变时
A(g) + B(g) 2C(g)
φ(B) =
nB
n气总
φ(B) =
1
2
定量
变量
定量
A(s) B(g) + C(g)
化学平衡 · 判断
情况2:气体“分数问题”
单边气体,不用“分数”
【例3】当气体B的体积分数不变时,判断下列反应状态是否达到平衡。
平衡
无法判断
φ(B) =
nB
n气总
化学平衡 · 判断
情况3:气体“平均相对分子质量问题”
M=
m总气体
n总气体
【例4】当气体平均相对分子质量不变时,判断下列反应状态是否达到平衡。
①、2SO2(g)+O2(g) 2SO3(g)
M=
m总
n总
变量
定量
变量
②、2A(g)+ B(s) 2C(g)
M=
m总
n总
变量
定量
变量
④、NH2COONH4(s) 2NH3(g) + CO2(g)
③、H2(g)+I2(g) 2HI(g)
M=
m总
n总
定量
定量
定量
2
3
1
3
M=
×17+ ×44
2
3
1
3
定量
看系数
看状态
化学平衡 · 判断
情况4:气体“密度问题”
【例5】在恒温恒容的密闭容器中,当气体密度不变时,下列反应是否达到平衡?
①、2SO2(g)+O2(g) 2SO3(g)
ρ=
m总
V
定量
定量
定量
②、Ni(s) + 4CO(g) Ni(CO)4(g)
ρ=
m总
V
定量
变量
变量
ρ=
m(总气体)
V
【例6】在恒温恒压的密闭容器中,当气体密度不变时,下列反应是否达到平衡?
①、2SO2(g)+O2(g) 2SO3(g)
②、Ni(s) + 4CO(g) Ni(CO)4(g)
ρ=
m总
V
变量
定量
变量
ρ=
m总
V
变量
变量
变量
(正向-变大)
(正向-变小)
化学平衡 · 判断
情况5:其他问题
,当n(SO2):n(O2):n(SO3)=2:1:2时( )
①、2SO2(g)+O2(g) 2SO3(g)
②、绝热体系下, ,体系温度不变时( )
2SO2(g)+O2(g) 2SO3(g)
不和外界发生热量交换
平衡
无法判断
1、可逆反应2NO2(g) 2NO(g)+O2(g)在恒容密闭容器中进行:
①单位时间内生成n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO和O2的物质的量浓度变化表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的压强不再改变
⑦混合气体的平均相对分子质量不再改变
可说明该反应达到化学平衡状态的是__________。
①④⑥⑦
课堂练习
2.在一定温度下的恒容容器中,发生反应:2A(g)+B(s) C(g)+D(g),
下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2∶1∶1
⑤单位时间内生成n mol C,同时生成n mol D
⑥单位时间内生成n mol D,同时生成2n mol A
A.①②⑤ B.②③⑤
C.②③⑥ D.①③⑥
C
课堂练习
3.在一个绝热的固定容积的密闭容器中,
发生可逆反应mA(g)+nB(g) pC(g)+qD(s),当m、n、p、q为任意整数时,一定可以作为反应达到平衡状态的标志是( )
①体系的压强不再改变
②体系的温度不再改变
③体系的密度不再变化
④各组分质量分数不再改变
A.①②③
B.①②③④
C.②③④
D.③④
C
课堂练习
