3.1.2电离平衡常数 课件(共18张PPT)高中化学 人教版(2019)选择性必修1
文档属性
| 名称 | 3.1.2电离平衡常数 课件(共18张PPT)高中化学 人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 18:41:52 | ||
图片预览






文档简介
(共18张PPT)
第一节 电离平衡
第2课时 电离平衡常数
第三章 水溶液中的离子反应与平衡
电离平衡常数
弱电解质不完全电离
可逆反应
存在电离平衡
平衡常数K
弱酸的电离常数——Ka
弱碱的电离常数——Kb
CH3COOH CH3COO + H+
c(CH3COO )·c(H+)
c(CH3COOH)
Ka=
NH3·H2O NH + OH
+
4
Kb=
c(NH )·c(OH )
c(NH3·H2O)
+
4
【例1】在某温度时,溶质的物质的量浓度为 0.20 mol·L 1的氨水中,达到电离平衡时,
已电离的NH3·H2O为1.7×10 3 mol·L 1,试计算该温度下NH3·H2O的电离常数(Kb)。
c(NH3·H2O)=(0.2 1.7×10 3) mol·L 1 ≈ 0.2 mol·L 1
c(NH3·H2O)
Kb=
c(NH4+ )· c(OH )
=
(1.7×10 3)·(1.7×10 3)
(0.2 1.7×10 3)
0.2
≈
(1.7×10 3)·(1.7×10 3)
起始浓度/(mol·L 1)
变化浓度/(mol·L 1)
平衡浓度/(mol·L 1)
0.2
0
0
1.7×10 3
0.2 1.7×10 3
1.7×10 3
1.7×10 3
1.7×10 3
1.7×10 3
NH3·H2O NH
+
4
+ OH
≈
1.4×10 5
电离平衡常数
忽略水的电离
【例2】在某温度时,溶质的物质的量浓度为 0.10 mol·L 1的一氯乙酸(CH2ClCOOH)溶液中,达到电离平衡时,已电离的CH2ClCOOH为1.1×10 2 mol·L 1,
试计算该温度下CH2ClCOOH的电离常数(Ka)。
c(CH2ClCOOH)=(0.1 1.1×10 2) mol·L 1 = 0.089 mol·L 1
c(CH2ClCOOH)
Ka=
c(CH2ClCOO-)· c(H+)
=
(1.1×10 2)·(1.1×10 2)
(0.1 1.1×10 2)
=
1.4×10 3
起始浓度/(mol·L 1)
变化浓度/(mol·L 1)
平衡浓度/(mol·L 1)
0.1
0
0
1.1×10 2
0.1 1.1×10 2
1.1×10 2
1.1×10 2
1.1×10 2
1.1×10 2
CH2ClCOOH CH2ClCOO- + H+
忽略水的电离
电离平衡常数
已知Ka/Kb,如何计算一元弱酸、弱碱溶液中的H+、OH-的浓度
c(H+) =
cKa
一元弱酸溶液中
c(OH-)=
cKb
一元弱碱溶液中
电离平衡常数的应用
思考
CH3COOH CH3COO + H+
c(CH3COO ) · c(H+)
c(CH3COOH)
Ka=
c(CH3COO ) · c(H+)
Ka· c(CH3COOH)=
c(H+)2
Ka· c(CH3COOH)=
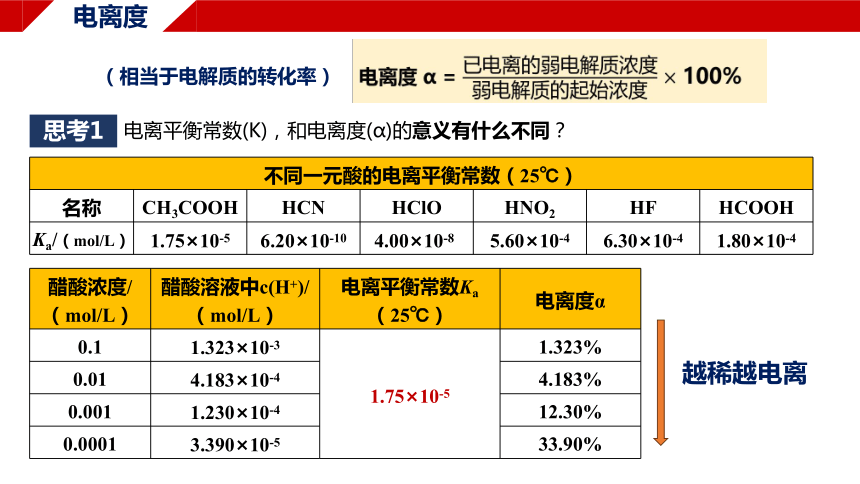
不同一元酸的电离平衡常数(25℃)
名称 CH3COOH HCN HClO HNO2 HF HCOOH
Ka/(mol/L) 1.75×10-5 6.20×10-10 4.00×10-8 5.60×10-4 6.30×10-4 1.80×10-4
醋酸浓度/ (mol/L) 醋酸溶液中c(H+)/(mol/L) 电离平衡常数Ka (25℃) 电离度α
0.1 1.323×10-3 1.75×10-5 1.323%
0.01 4.183×10-4 4.183%
0.001 1.230×10-4 12.30%
0.0001 3.390×10-5 33.90%
电离度 α = 100%
电离度
(相当于电解质的转化率)
思考1
电离平衡常数(K),和电离度(α)的意义有什么不同?
越稀越电离
①、电离平衡常数(K):
用于比较同种类型(同x元酸/同x元碱)、不同弱电解质的电离程度大小,
不受弱电解质浓度的影响
②电离度(α):
用于比较同种弱电解质、不同浓度的电离程度大小。
电离度
思考1
电离平衡常数(K),和电离度(α)的意义有什么不同?
电离平衡常数影响因素
思考2
影响电离平衡常数(K)的因素有哪些?
①、温度:T升K升
(外因)
②、物质本身性质
(内因)
名称 化学式 电离常数(K) 名称 化学式 电离常数(K)
醋酸 CH3COOH Ka=1.75×10-5 亚硝酸 HNO2 Ka=5.60×10-4
氢氰酸 HCN Ka=6.20×10-10 氢氟酸 HF Ka=6.30×10-4
次氯酸 HClO Ka=4.00×10-8 甲酸 HCOOH Ka=1.80×10-4
相同温度下,电离常数由弱电解质的性质决定。
酸性越强、Ka越大; 碱性越强、Kb越大
思路:同一条件下,电离常数越大,酸性(碱性)越强
名称 化学式 电离常数(K) 名称 化学式 电离常数(K)
醋酸 CH3COOH Ka=1.75×10-5 亚硝酸 HNO2 Ka=5.60×10-4
氢氰酸 HCN Ka=6.20×10-10 氢氟酸 HF Ka=6.30×10-4
次氯酸 HClO Ka=4.00×10-8 甲酸 HCOOH Ka=1.80×10-4
酸性:HCOOH > HNO2>HF > CH3COOH> HClO > HCN
电离平衡常数影响因素
【例3】判断下列六种酸的酸性强弱
名称 化学式 电离常数(K) 名称 化学式 电离常数(K)
碳酸 H2CO3 Ka1=4.50×l0-7 亚硫酸 H2SO3 Ka1=1.40×l0-2
Ka2=4.70×10-11 Ka2=6.00×l0-8
草酸 H2C2O4 Ka1=5.60×l0-2 氢硫酸 H2S Ka1=1.10×l0-7
Ka2=1.50×l0-4 Ka2=l.30×10-13
磷酸 H3PO4 Ka1=6.90×l0-3
Ka2=6.20×10-8
Ka3=4.80×l0-13
相同温度下(25℃)多元弱酸的电离常数
电离平衡常数影响因素
思考3
多元弱酸的电离平衡常数,有什么特点?
①、多元弱酸分步电离,电离几步就有几个Ka
②、多元弱酸的各步电离常数中, Ka1>Ka2>Ka3>……
原因:多元弱酸第一步电离出的H+ ; 会抑制第二步的电离。
若 Ka1远远大于Ka2时,
以Ka1代表该多元弱酸的酸性强弱
【例4】向盛有2 mL 1 mol/L 醋酸的试管中滴加1 mol/L Na2CO3溶液,有气泡生成。
由此推测Ka(CH3COOH)与Ka1(H2CO3)的大小关系?
2CH3COOH+Na2CO3 2CH3COONa + CO2↑+ H2O
CH3COOH > H2CO3
Ka(CH3COOH) > Ka1(H2CO3)
生成大量气泡
H2CO3
实验现象:
化学方程式:
酸性强弱:
电离常数大小:
电离平衡常数的应用
思路:“强酸制弱酸”、“谁强谁K大”
1.下列关于电离平衡常数(K)的说法中正确的是 ( )
A.相同条件下,电离平衡常数(K)越小,表示弱电解质电离能力越弱
B.电离平衡常数(K)与温度无关
C.相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同
D.多元弱酸各步电离平衡常数大小关系为Ka1A
2.已知室温时,0.1 mol·L-1某一元酸HA在水中有0.2%发生电离。
下列叙述错误的( )
A.升高温度,溶液的酸性增强
B.该溶液的c(H+)是2×10-4 mol·L-1
C.该一元酸的电离平衡常数约为1×10-7
D.向一元酸HA的溶液中,加水稀释,HA的电离平衡正向移动,但c(H+)减小
C
课堂练习
3.常温下,三种一元酸的电离平衡常数如下表,下列说法正确的是 ( )
A.三种酸的酸性强弱:HCN>CH3COOH>H3PO2
B.反应H3PO2+CH3COO- == CH3COOH+H2PO2-能够发生
C.由电离常数可以判断,H3PO2属于强酸,HCN和CH3COOH属于弱酸
D.等物质的量浓度、等体积的三种酸溶液,与足量锌粉反应,H3PO2产生H2最多
酸 HCN CH3COOH H3PO2
电离常数 5×10-10 1.75×10-5 5.9×10-2
B
课堂练习
第一节 电离平衡
第3课时 电离平衡图像问题
第三章 水溶液中的离子反应与平衡
向两个锥形瓶中各加入0.05g镁条,塞紧橡胶塞,然后用注射器分别注入2 mL 2 mol/L 盐酸、2 mL 2 mol/L醋酸,测得锥形瓶内气体的压强随时间的变化如图所示。
两个反应的速率及其变化有什么特点?如何解释图像?
等浓反应:强酸更快,产量一样
图像问题
①、等浓:强/弱反应
方法:
速率看浓度、产量看总量(n)
盐酸、醋酸溶液与活泼金属反应
等PH反应:强弱一样快,弱酸产量大
②、等PH:强/弱反应
图像问题
t
V(g)
0
HCl
CH3COOH
②、弱酸产量大:
若初始溶液中PH相同,则证明实际上醋酸浓度更大,
所以醋酸反应生成的氢气更多
①、开始同速率:
盐酸和醋酸溶液中的初始c(H+)相等,开始与活泼金属反应产生H2的速率相等。
图像特点
盐酸和醋酸溶液加水稀释
加水稀释相同的倍数,醋酸溶液的pH大。
加水稀释到相同的pH,盐酸加入的水多。
7
0
V(水)
b
a
HCl
CH3COOH
pH
V'
等浓稀释:强酸始终强
③、等浓:强/弱稀释
图像问题
盐酸与醋酸浓度相等,
稀释之前,醋酸电离不完全,PH更高;
随着不断稀释,二者PH无限接近7,
但始终无法达到7
等PH稀释:弱酸后劲足
④、等PH:强/弱稀释
图像问题
7
0
V(水)
b
a
HCl
CH3COOH
pH
V'
盐酸和醋酸溶液加水稀释
稀释过程中:
弱酸电离平衡正移,不断电离H+,
使c(H+)浓度降低的更慢,PH变化更缓
第一节 电离平衡
第2课时 电离平衡常数
第三章 水溶液中的离子反应与平衡
电离平衡常数
弱电解质不完全电离
可逆反应
存在电离平衡
平衡常数K
弱酸的电离常数——Ka
弱碱的电离常数——Kb
CH3COOH CH3COO + H+
c(CH3COO )·c(H+)
c(CH3COOH)
Ka=
NH3·H2O NH + OH
+
4
Kb=
c(NH )·c(OH )
c(NH3·H2O)
+
4
【例1】在某温度时,溶质的物质的量浓度为 0.20 mol·L 1的氨水中,达到电离平衡时,
已电离的NH3·H2O为1.7×10 3 mol·L 1,试计算该温度下NH3·H2O的电离常数(Kb)。
c(NH3·H2O)=(0.2 1.7×10 3) mol·L 1 ≈ 0.2 mol·L 1
c(NH3·H2O)
Kb=
c(NH4+ )· c(OH )
=
(1.7×10 3)·(1.7×10 3)
(0.2 1.7×10 3)
0.2
≈
(1.7×10 3)·(1.7×10 3)
起始浓度/(mol·L 1)
变化浓度/(mol·L 1)
平衡浓度/(mol·L 1)
0.2
0
0
1.7×10 3
0.2 1.7×10 3
1.7×10 3
1.7×10 3
1.7×10 3
1.7×10 3
NH3·H2O NH
+
4
+ OH
≈
1.4×10 5
电离平衡常数
忽略水的电离
【例2】在某温度时,溶质的物质的量浓度为 0.10 mol·L 1的一氯乙酸(CH2ClCOOH)溶液中,达到电离平衡时,已电离的CH2ClCOOH为1.1×10 2 mol·L 1,
试计算该温度下CH2ClCOOH的电离常数(Ka)。
c(CH2ClCOOH)=(0.1 1.1×10 2) mol·L 1 = 0.089 mol·L 1
c(CH2ClCOOH)
Ka=
c(CH2ClCOO-)· c(H+)
=
(1.1×10 2)·(1.1×10 2)
(0.1 1.1×10 2)
=
1.4×10 3
起始浓度/(mol·L 1)
变化浓度/(mol·L 1)
平衡浓度/(mol·L 1)
0.1
0
0
1.1×10 2
0.1 1.1×10 2
1.1×10 2
1.1×10 2
1.1×10 2
1.1×10 2
CH2ClCOOH CH2ClCOO- + H+
忽略水的电离
电离平衡常数
已知Ka/Kb,如何计算一元弱酸、弱碱溶液中的H+、OH-的浓度
c(H+) =
cKa
一元弱酸溶液中
c(OH-)=
cKb
一元弱碱溶液中
电离平衡常数的应用
思考
CH3COOH CH3COO + H+
c(CH3COO ) · c(H+)
c(CH3COOH)
Ka=
c(CH3COO ) · c(H+)
Ka· c(CH3COOH)=
c(H+)2
Ka· c(CH3COOH)=
不同一元酸的电离平衡常数(25℃)
名称 CH3COOH HCN HClO HNO2 HF HCOOH
Ka/(mol/L) 1.75×10-5 6.20×10-10 4.00×10-8 5.60×10-4 6.30×10-4 1.80×10-4
醋酸浓度/ (mol/L) 醋酸溶液中c(H+)/(mol/L) 电离平衡常数Ka (25℃) 电离度α
0.1 1.323×10-3 1.75×10-5 1.323%
0.01 4.183×10-4 4.183%
0.001 1.230×10-4 12.30%
0.0001 3.390×10-5 33.90%
电离度 α = 100%
电离度
(相当于电解质的转化率)
思考1
电离平衡常数(K),和电离度(α)的意义有什么不同?
越稀越电离
①、电离平衡常数(K):
用于比较同种类型(同x元酸/同x元碱)、不同弱电解质的电离程度大小,
不受弱电解质浓度的影响
②电离度(α):
用于比较同种弱电解质、不同浓度的电离程度大小。
电离度
思考1
电离平衡常数(K),和电离度(α)的意义有什么不同?
电离平衡常数影响因素
思考2
影响电离平衡常数(K)的因素有哪些?
①、温度:T升K升
(外因)
②、物质本身性质
(内因)
名称 化学式 电离常数(K) 名称 化学式 电离常数(K)
醋酸 CH3COOH Ka=1.75×10-5 亚硝酸 HNO2 Ka=5.60×10-4
氢氰酸 HCN Ka=6.20×10-10 氢氟酸 HF Ka=6.30×10-4
次氯酸 HClO Ka=4.00×10-8 甲酸 HCOOH Ka=1.80×10-4
相同温度下,电离常数由弱电解质的性质决定。
酸性越强、Ka越大; 碱性越强、Kb越大
思路:同一条件下,电离常数越大,酸性(碱性)越强
名称 化学式 电离常数(K) 名称 化学式 电离常数(K)
醋酸 CH3COOH Ka=1.75×10-5 亚硝酸 HNO2 Ka=5.60×10-4
氢氰酸 HCN Ka=6.20×10-10 氢氟酸 HF Ka=6.30×10-4
次氯酸 HClO Ka=4.00×10-8 甲酸 HCOOH Ka=1.80×10-4
酸性:HCOOH > HNO2>HF > CH3COOH> HClO > HCN
电离平衡常数影响因素
【例3】判断下列六种酸的酸性强弱
名称 化学式 电离常数(K) 名称 化学式 电离常数(K)
碳酸 H2CO3 Ka1=4.50×l0-7 亚硫酸 H2SO3 Ka1=1.40×l0-2
Ka2=4.70×10-11 Ka2=6.00×l0-8
草酸 H2C2O4 Ka1=5.60×l0-2 氢硫酸 H2S Ka1=1.10×l0-7
Ka2=1.50×l0-4 Ka2=l.30×10-13
磷酸 H3PO4 Ka1=6.90×l0-3
Ka2=6.20×10-8
Ka3=4.80×l0-13
相同温度下(25℃)多元弱酸的电离常数
电离平衡常数影响因素
思考3
多元弱酸的电离平衡常数,有什么特点?
①、多元弱酸分步电离,电离几步就有几个Ka
②、多元弱酸的各步电离常数中, Ka1>Ka2>Ka3>……
原因:多元弱酸第一步电离出的H+ ; 会抑制第二步的电离。
若 Ka1远远大于Ka2时,
以Ka1代表该多元弱酸的酸性强弱
【例4】向盛有2 mL 1 mol/L 醋酸的试管中滴加1 mol/L Na2CO3溶液,有气泡生成。
由此推测Ka(CH3COOH)与Ka1(H2CO3)的大小关系?
2CH3COOH+Na2CO3 2CH3COONa + CO2↑+ H2O
CH3COOH > H2CO3
Ka(CH3COOH) > Ka1(H2CO3)
生成大量气泡
H2CO3
实验现象:
化学方程式:
酸性强弱:
电离常数大小:
电离平衡常数的应用
思路:“强酸制弱酸”、“谁强谁K大”
1.下列关于电离平衡常数(K)的说法中正确的是 ( )
A.相同条件下,电离平衡常数(K)越小,表示弱电解质电离能力越弱
B.电离平衡常数(K)与温度无关
C.相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同
D.多元弱酸各步电离平衡常数大小关系为Ka1
2.已知室温时,0.1 mol·L-1某一元酸HA在水中有0.2%发生电离。
下列叙述错误的( )
A.升高温度,溶液的酸性增强
B.该溶液的c(H+)是2×10-4 mol·L-1
C.该一元酸的电离平衡常数约为1×10-7
D.向一元酸HA的溶液中,加水稀释,HA的电离平衡正向移动,但c(H+)减小
C
课堂练习
3.常温下,三种一元酸的电离平衡常数如下表,下列说法正确的是 ( )
A.三种酸的酸性强弱:HCN>CH3COOH>H3PO2
B.反应H3PO2+CH3COO- == CH3COOH+H2PO2-能够发生
C.由电离常数可以判断,H3PO2属于强酸,HCN和CH3COOH属于弱酸
D.等物质的量浓度、等体积的三种酸溶液,与足量锌粉反应,H3PO2产生H2最多
酸 HCN CH3COOH H3PO2
电离常数 5×10-10 1.75×10-5 5.9×10-2
B
课堂练习
第一节 电离平衡
第3课时 电离平衡图像问题
第三章 水溶液中的离子反应与平衡
向两个锥形瓶中各加入0.05g镁条,塞紧橡胶塞,然后用注射器分别注入2 mL 2 mol/L 盐酸、2 mL 2 mol/L醋酸,测得锥形瓶内气体的压强随时间的变化如图所示。
两个反应的速率及其变化有什么特点?如何解释图像?
等浓反应:强酸更快,产量一样
图像问题
①、等浓:强/弱反应
方法:
速率看浓度、产量看总量(n)
盐酸、醋酸溶液与活泼金属反应
等PH反应:强弱一样快,弱酸产量大
②、等PH:强/弱反应
图像问题
t
V(g)
0
HCl
CH3COOH
②、弱酸产量大:
若初始溶液中PH相同,则证明实际上醋酸浓度更大,
所以醋酸反应生成的氢气更多
①、开始同速率:
盐酸和醋酸溶液中的初始c(H+)相等,开始与活泼金属反应产生H2的速率相等。
图像特点
盐酸和醋酸溶液加水稀释
加水稀释相同的倍数,醋酸溶液的pH大。
加水稀释到相同的pH,盐酸加入的水多。
7
0
V(水)
b
a
HCl
CH3COOH
pH
V'
等浓稀释:强酸始终强
③、等浓:强/弱稀释
图像问题
盐酸与醋酸浓度相等,
稀释之前,醋酸电离不完全,PH更高;
随着不断稀释,二者PH无限接近7,
但始终无法达到7
等PH稀释:弱酸后劲足
④、等PH:强/弱稀释
图像问题
7
0
V(水)
b
a
HCl
CH3COOH
pH
V'
盐酸和醋酸溶液加水稀释
稀释过程中:
弱酸电离平衡正移,不断电离H+,
使c(H+)浓度降低的更慢,PH变化更缓
