3.2.2 pH计算 课件(共23张PPT)高中化学 人教版(2019)选择性必修1
文档属性
| 名称 | 3.2.2 pH计算 课件(共23张PPT)高中化学 人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 18:42:29 | ||
图片预览








文档简介
(共23张PPT)
第二节 水的电离
第2课时 PH的计算
第三章 水溶液中的离子反应与平衡
PH的计算
基本概念
PH= -lg c(H+)
POH= -lg c(OH-)
2、对数计算规律:内乘外加,内除外减
3、常见对数:
1、基本公式:
4、判断溶液酸碱性:
①、溶液的酸碱性由溶液中H+和OH-离子的相对浓度决定,
②、PH=7的溶液并不一定是中性,PH只代表了此时溶液中的c(H+)
③、中性溶液的PH值取决于温度,任何中性溶液中,c(H+)=
模块一
简单PH的计算
(单一的强酸/碱、弱酸/碱问题)
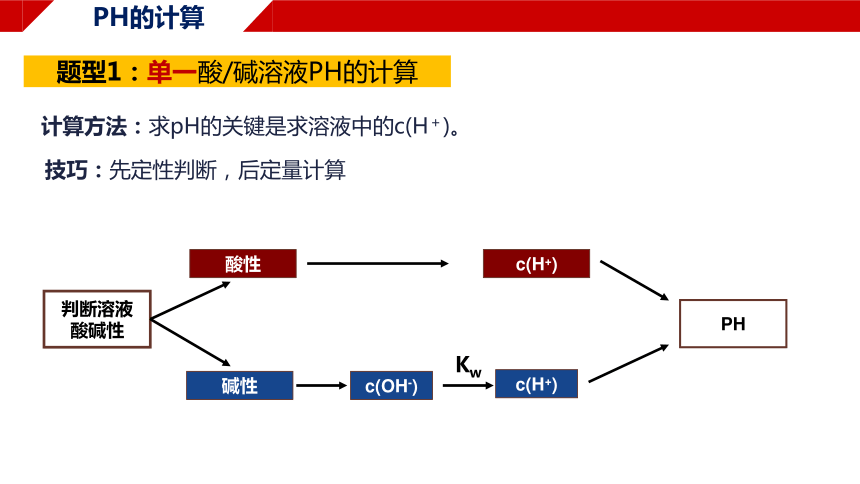
题型1:单一酸/碱溶液PH的计算
PH的计算
计算方法:求pH的关键是求溶液中的c(H+)。
技巧:先定性判断,后定量计算
判断溶液
酸碱性
酸性
碱性
c(H+)
c(OH-)
c(H+)
PH
Kw
解:c(H+)=2c(H2SO4)=0.05×2=10-1mol/L
pH =-lg c(H+)=1
【例1】常温下,计算浓度为0.05mol/L的硫酸溶液的pH。
解:c(OH-)=0.005×2=10-2mol/L
c(H+)=
KW
c(OH-)
=10-12mol/L
pH =-lg c(H+)=12
【例2】常温时,计算浓度为0.005mol/L的氢氧化钡溶液的pH。
题型1:单一、强酸/强碱溶液PH的计算
PH的计算
题型2:单一、弱酸/弱碱溶液PH的计算
PH的计算
【例1】已知CH3COOH的电离常数Ka=2×10-5, 计算浓度为0.5 mol/L的醋酸溶液的pH。
解:
Ka=
c(H+) · c(CH3COO-)
c(CH3COOH)
CH3COOH CH3COO - + H+
c(H+)=
mol·L-1
c(H+)=
c(CH3COO-)
题型2:单一、弱酸/弱碱溶液PH的计算
PH的计算
【例2】已知某弱酸BOH溶液(浓度为c mol·L-1,电离常数为Kb),求该弱碱的PH(用含c、Kb的式子表示)
BOH B+ + OH-
Kb=
c(B+)·c(OH-)
c(BOH)
c(H+)=
Kw
c(OH-)
=_________mol·L-1
c(OH-)=
mol·L-1
(Kb·c)
Kw
【练习1】
(1)常温下,0.05 mol·L-1的硫酸溶液的pH=____________。
(2)常温下,0.001 mol·L-1的氢氧化钾溶液的pH=_________。
(3)常温下,pH=12的Ba(OH)2的浓度是________ mol·L-1。
(4)已知CH3COOH的电离常数Ka=2×10-5,0.1 mol/L的CH3COOH溶液,pH=________。(已知:lg2=0.3)
1
11
0.005
2.85
PH的计算
模块二
混合溶液的PH
(强酸+强酸/强碱+强碱/强酸+强碱)
题型3:两种强酸混合
PH的计算
计算方法:先求出c混(H+),再求PH。
(忽略两溶液混合后的体积变化)
(V混=V1+V2)
n1(H+)+n2(H+)
V混
C混(H+) =
=
c1(H+)×V1+c2(H+)×V2
V1+V2
题型3:两种强酸混合
PH的计算
【例3】pH=5和pH=3的两种盐酸,以等体积混合后,计算溶液的pH。
解:
c(H+)=
=
10-5 V+ 10-3 V
2 V
≈
10-3 V
2 V
=
10-3
2
mol/L
pH =-lg c(H+)=3.3
n1(H+)+n2(H+)
V总
题型4:两种强碱混合
PH的计算
计算方法:先求出c混(OH-),再据KW求出c混(H+),最后求pH
n1(OH-)+n2(OH-)
V混
C混(OH-) =
=
c1 (OH-) ·V1+ c2 (OH-) ·V2
V1+V2
C混(H+)=
KW
C混(OH-)
题型4:两种强碱混合
PH的计算
【例4】常温时,将pH=10的NaOH溶液与pH=12的NaOH溶液以1:1体积比混合,混合后的pH为多少?
解:
c(OH-)=
=
10-4 V+ 10-2 V
2V
=
10-2
2
mol/L
pH =-lg c(H+)=11.7
n1(OH-)+n2(OH-)
V总
=2×10-12 mol/L
c(H+)=
KW
c(OH-)
题型5:强酸和强碱混合
PH的计算
计算方法:强酸强碱中和反应,求反应后剩余的c余(H+),再求PH
技巧:先初步判断中和后溶液的酸碱性,强减弱
【例4】常温时,0.1mol/L的NaOH和0.06mol/L 的H2SO4溶液等体积混合,求混合溶液的pH。
n(H+)=2c(H2SO4)·V = 0.12V
解:
设两溶液的体积都为V
n(OH-) =c(NaOH)·V=0.1V
0.12V > 0.1V 所以酸过量
c(H+)=
n(H+)- n(OH-)
V(混)
c(H+) =
0.12V-0.1V
2V
=10-2mol/L
pH =2
题型5:强酸和强碱混合
PH的计算
【练习2】常温时,0.1mol/L的盐酸和0.06mol/L的Ba(OH)2溶液等体积混合,求混合溶液的pH。
题型5:强酸和强碱混合
PH的计算
【练习3】某温度时,水的离子积常数Kw=1×10-12。
(1)将此温度下pH=11的NaOH溶液与pH=1的盐酸等体积混合(设混合后溶液体积的变化忽略不计,下同),混合后溶液的pH=________。
(2)将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得的混合溶液呈中性,则a∶b=__________。
6
1∶1
题型6:强弱混合问题(定性判断)
PH的计算
技巧:谁弱谁过量,谁过量显谁性。
原因:酸和碱已电离出的H+与OH-恰好中和,谁弱谁过量,中和后还能继续电离。
总结:若酸与碱的pH之和为14,等体积混合
常温时
若强酸与强碱等体积,则pH=7
若强酸与弱碱等体积,则pH>7
若弱酸与强碱等体积,则pH<7
模块三
稀释后溶液的PH
(强酸碱/弱酸碱/图像问题)
题型7:强酸、强碱稀释问题
PH的计算
技巧:
(1)对于强酸溶液(pH=a)每稀释10n倍,pH增大n个单位,
(2)对于强碱溶液(pH=b)每稀释10n倍,pH减小n个单位,
【例】:
①、某PH=3的盐酸,加水稀释1000倍,求稀释后溶液的PH
②、某PH=3的盐酸,加水稀释105倍,求稀释后溶液的PH
酸的PH随着稀释无限接近于7,但永远小于7
③、某PH=10的NaOH溶液,加水稀释100倍,求稀释后溶液的PH
④、某PH=10的NaOH溶液,加水稀释100倍,稀释后溶液的PH=9,请解释原因
题型8:弱酸、弱碱稀释问题
PH的计算
技巧:
(1)对于弱酸溶液(pH=a)每稀释10n倍,pH的范围是:a< pH< a+n
(即对于pH相同的强酸与弱酸稀释相同倍数,强酸pH变化的程度大)。
(2)对于弱碱溶液(pH=b)每稀释10n倍,pH的范围是:b-n(即对于pH相同的强碱与弱碱稀释相同倍数,强碱pH变化的程度大)
原理:弱酸、弱碱加水稀释时,并不是单纯的稀释,还伴随着“越稀越电离”
【练习】、室温下,有关pH计算结果一定正确的是
①强酸pH=a,加水稀释到10n倍,则pH=a+n
②弱酸pH=a,加水稀释到10n倍,则pH③强碱pH=b,加水稀释到10n倍,则pH=b n
④弱碱pH=b,加水稀释到10n倍,则pH>b n(b n>7)
A.①② B.②③ C.③④ D.②④
【答案】D
PH的计算
题型9:稀释图像
PH的计算
弱电解质“抗稀释”
强电解质“变化大”
【练习】pH=2的两种弱酸HA、HB加水稀释后,
溶液pH随加水量变化的曲线如下图所示。
则下列叙述正确的是( )
A.电离常数HA>HB
B.等体积的HA和HB与等浓度的NaOH反应,HA消耗的NaOH多
C.等体积的HA和HB与足量的Zn反应,HA生成的氢气多
D.两种酸的物质的量浓度相同
A
PH的计算
第二节 水的电离
第2课时 PH的计算
第三章 水溶液中的离子反应与平衡
PH的计算
基本概念
PH= -lg c(H+)
POH= -lg c(OH-)
2、对数计算规律:内乘外加,内除外减
3、常见对数:
1、基本公式:
4、判断溶液酸碱性:
①、溶液的酸碱性由溶液中H+和OH-离子的相对浓度决定,
②、PH=7的溶液并不一定是中性,PH只代表了此时溶液中的c(H+)
③、中性溶液的PH值取决于温度,任何中性溶液中,c(H+)=
模块一
简单PH的计算
(单一的强酸/碱、弱酸/碱问题)
题型1:单一酸/碱溶液PH的计算
PH的计算
计算方法:求pH的关键是求溶液中的c(H+)。
技巧:先定性判断,后定量计算
判断溶液
酸碱性
酸性
碱性
c(H+)
c(OH-)
c(H+)
PH
Kw
解:c(H+)=2c(H2SO4)=0.05×2=10-1mol/L
pH =-lg c(H+)=1
【例1】常温下,计算浓度为0.05mol/L的硫酸溶液的pH。
解:c(OH-)=0.005×2=10-2mol/L
c(H+)=
KW
c(OH-)
=10-12mol/L
pH =-lg c(H+)=12
【例2】常温时,计算浓度为0.005mol/L的氢氧化钡溶液的pH。
题型1:单一、强酸/强碱溶液PH的计算
PH的计算
题型2:单一、弱酸/弱碱溶液PH的计算
PH的计算
【例1】已知CH3COOH的电离常数Ka=2×10-5, 计算浓度为0.5 mol/L的醋酸溶液的pH。
解:
Ka=
c(H+) · c(CH3COO-)
c(CH3COOH)
CH3COOH CH3COO - + H+
c(H+)=
mol·L-1
c(H+)=
c(CH3COO-)
题型2:单一、弱酸/弱碱溶液PH的计算
PH的计算
【例2】已知某弱酸BOH溶液(浓度为c mol·L-1,电离常数为Kb),求该弱碱的PH(用含c、Kb的式子表示)
BOH B+ + OH-
Kb=
c(B+)·c(OH-)
c(BOH)
c(H+)=
Kw
c(OH-)
=_________mol·L-1
c(OH-)=
mol·L-1
(Kb·c)
Kw
【练习1】
(1)常温下,0.05 mol·L-1的硫酸溶液的pH=____________。
(2)常温下,0.001 mol·L-1的氢氧化钾溶液的pH=_________。
(3)常温下,pH=12的Ba(OH)2的浓度是________ mol·L-1。
(4)已知CH3COOH的电离常数Ka=2×10-5,0.1 mol/L的CH3COOH溶液,pH=________。(已知:lg2=0.3)
1
11
0.005
2.85
PH的计算
模块二
混合溶液的PH
(强酸+强酸/强碱+强碱/强酸+强碱)
题型3:两种强酸混合
PH的计算
计算方法:先求出c混(H+),再求PH。
(忽略两溶液混合后的体积变化)
(V混=V1+V2)
n1(H+)+n2(H+)
V混
C混(H+) =
=
c1(H+)×V1+c2(H+)×V2
V1+V2
题型3:两种强酸混合
PH的计算
【例3】pH=5和pH=3的两种盐酸,以等体积混合后,计算溶液的pH。
解:
c(H+)=
=
10-5 V+ 10-3 V
2 V
≈
10-3 V
2 V
=
10-3
2
mol/L
pH =-lg c(H+)=3.3
n1(H+)+n2(H+)
V总
题型4:两种强碱混合
PH的计算
计算方法:先求出c混(OH-),再据KW求出c混(H+),最后求pH
n1(OH-)+n2(OH-)
V混
C混(OH-) =
=
c1 (OH-) ·V1+ c2 (OH-) ·V2
V1+V2
C混(H+)=
KW
C混(OH-)
题型4:两种强碱混合
PH的计算
【例4】常温时,将pH=10的NaOH溶液与pH=12的NaOH溶液以1:1体积比混合,混合后的pH为多少?
解:
c(OH-)=
=
10-4 V+ 10-2 V
2V
=
10-2
2
mol/L
pH =-lg c(H+)=11.7
n1(OH-)+n2(OH-)
V总
=2×10-12 mol/L
c(H+)=
KW
c(OH-)
题型5:强酸和强碱混合
PH的计算
计算方法:强酸强碱中和反应,求反应后剩余的c余(H+),再求PH
技巧:先初步判断中和后溶液的酸碱性,强减弱
【例4】常温时,0.1mol/L的NaOH和0.06mol/L 的H2SO4溶液等体积混合,求混合溶液的pH。
n(H+)=2c(H2SO4)·V = 0.12V
解:
设两溶液的体积都为V
n(OH-) =c(NaOH)·V=0.1V
0.12V > 0.1V 所以酸过量
c(H+)=
n(H+)- n(OH-)
V(混)
c(H+) =
0.12V-0.1V
2V
=10-2mol/L
pH =2
题型5:强酸和强碱混合
PH的计算
【练习2】常温时,0.1mol/L的盐酸和0.06mol/L的Ba(OH)2溶液等体积混合,求混合溶液的pH。
题型5:强酸和强碱混合
PH的计算
【练习3】某温度时,水的离子积常数Kw=1×10-12。
(1)将此温度下pH=11的NaOH溶液与pH=1的盐酸等体积混合(设混合后溶液体积的变化忽略不计,下同),混合后溶液的pH=________。
(2)将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得的混合溶液呈中性,则a∶b=__________。
6
1∶1
题型6:强弱混合问题(定性判断)
PH的计算
技巧:谁弱谁过量,谁过量显谁性。
原因:酸和碱已电离出的H+与OH-恰好中和,谁弱谁过量,中和后还能继续电离。
总结:若酸与碱的pH之和为14,等体积混合
常温时
若强酸与强碱等体积,则pH=7
若强酸与弱碱等体积,则pH>7
若弱酸与强碱等体积,则pH<7
模块三
稀释后溶液的PH
(强酸碱/弱酸碱/图像问题)
题型7:强酸、强碱稀释问题
PH的计算
技巧:
(1)对于强酸溶液(pH=a)每稀释10n倍,pH增大n个单位,
(2)对于强碱溶液(pH=b)每稀释10n倍,pH减小n个单位,
【例】:
①、某PH=3的盐酸,加水稀释1000倍,求稀释后溶液的PH
②、某PH=3的盐酸,加水稀释105倍,求稀释后溶液的PH
酸的PH随着稀释无限接近于7,但永远小于7
③、某PH=10的NaOH溶液,加水稀释100倍,求稀释后溶液的PH
④、某PH=10的NaOH溶液,加水稀释100倍,稀释后溶液的PH=9,请解释原因
题型8:弱酸、弱碱稀释问题
PH的计算
技巧:
(1)对于弱酸溶液(pH=a)每稀释10n倍,pH的范围是:a< pH< a+n
(即对于pH相同的强酸与弱酸稀释相同倍数,强酸pH变化的程度大)。
(2)对于弱碱溶液(pH=b)每稀释10n倍,pH的范围是:b-n
原理:弱酸、弱碱加水稀释时,并不是单纯的稀释,还伴随着“越稀越电离”
【练习】、室温下,有关pH计算结果一定正确的是
①强酸pH=a,加水稀释到10n倍,则pH=a+n
②弱酸pH=a,加水稀释到10n倍,则pH
④弱碱pH=b,加水稀释到10n倍,则pH>b n(b n>7)
A.①② B.②③ C.③④ D.②④
【答案】D
PH的计算
题型9:稀释图像
PH的计算
弱电解质“抗稀释”
强电解质“变化大”
【练习】pH=2的两种弱酸HA、HB加水稀释后,
溶液pH随加水量变化的曲线如下图所示。
则下列叙述正确的是( )
A.电离常数HA>HB
B.等体积的HA和HB与等浓度的NaOH反应,HA消耗的NaOH多
C.等体积的HA和HB与足量的Zn反应,HA生成的氢气多
D.两种酸的物质的量浓度相同
A
PH的计算
